Tetrasulfuro de sodio
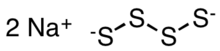 | |
| Nombres | |
|---|---|
| Nombre IUPAC Tetrasulfuro de sodio | |
| Otros nombres tetrasulfuro de disodio, sulfuro de sodio | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Araña química | |
| Tarjeta informativa de la ECHA | 100.031.628 |
| Número CE |
|
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| Na2S4 | |
| Masa molar | 174,24 g/mol |
| Apariencia | Líquido rojo oscuro, ligeramente viscoso o polvo cristalino amarillo. |
| Densidad | 1,268 g/cm3 a 15,5 °C |
| Punto de fusión | 275 °C (527 °F; 548 K) |
| Soluble en agua | |
| Peligros | |
| Seguridad y salud en el trabajo (SST/OHS): | |
Principales peligros | Estable a temperatura ambiente, pero puede ser explosivo si se calienta. Las reacciones con ácidos o agentes oxidantes generarán subproductos gaseosos que podrían ser peligrosos si se inhalan. |
| Etiquetado SGA : | |
    | |
| Peligro | |
| H228 , H301 , H311 , H314 , H400 | |
| P210 , P240 , P241 , P260 , P264 , P270 , P273 , P280 , P301+P310 , P301+P330+P331 , P302+P352 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P312 , P321 , P322 , P330 , P361 , P363 , P370+P378 , P391 , P405 , P501 | |
| NFPA 704 (rombo cortafuegos) | |
| No aplicable | |
| Ficha de datos de seguridad (FDS) | [1] [1] |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El tetrasulfuro de sodio es un compuesto inorgánico con la fórmula Na2S4 . Es un sólido de color amarillo anaranjado que se disuelve mediante hidrólisis en agua. [ 2] Es un precursor de algunos polímeros especiales e intermedios en prototipos de la batería de sodio-azufre .
Síntesis y estructura
Se produce a través de la reacción entre el azufre elemental y el hidrosulfuro de sodio en solución alcohólica: [3]
- 2NaSH + 4S → Na2S4 + H2S
Los aniones polisulfuro adoptan cadenas en zigzag de átomos de azufre. Las distancias SS son de aproximadamente 2,05 Å y los ángulos diedros SSSS son de alrededor de 90°. [4]
Reacciones y aplicaciones
Al tratarlo con ácido, se convierte en sulfuro de hidrógeno y azufre elemental. El tratamiento con agentes alquilantes produce polisulfuros orgánicos. En una aplicación comercial, se utiliza para producir el agente de reticulación bis(trietoxisililpropil)tetrasulfuro : [5]
- Na 2 S 4 + 2 ClC 3 H 6 Si (OEt) 3 → S 4 [C 3 H 6 Si (OEt) 3 ] 2 + 2 NaCl
A veces, el tetrasulfuro de sodio se mezcla con otros polisulfuros para producir el polímero llamado tiokol. La reacción implica la alquilación con cloruro de etileno :
- Na 2 S 4 + C 2 H 4 Cl 2 → 1/n (C 2 H 4 )S x ] n + 2 NaCl
Estos materiales, que tienen la fórmula aproximada (C 2 H 4 )S x ] n (x ~ 4), son altamente resistentes a la degradación por solventes y ácidos. [6]
Referencias
- ^ "Ficha de datos de seguridad, tetrasulfuro de sodio" (PDF) . Pfaltz & Bauer. Archivado desde el original (PDF) el 2016-03-03 . Consultado el 2013-11-17 .
- ^ Manual de química inorgánica preparativa, 2.ª edición, editado por G. Brauer, Academic Press, 1963, NY. Vol. 1, pág. 365.
- ^ DR Brush (2000). "Sulfuros de sodio". Enciclopedia Kirk-Othmer de tecnología química . doi :10.1002/0471238961.1915040902211908.a01. ISBN 0471238961.
- ^ R. Tegman "La estructura cristalina del tetrasulfuro de sodio, Na 2 S 4 " Acta Crystallogr. (1973). B29, 1463-1469 doi :10.1107/S0567740873004735
- ^ Thun, Friedrich; Meyer-Simon, Eugen; Michel, Rudolf "Verfahren zur Herstellung von Organosiliziumverbindungen (Fabricación continua de bis[3-(trietoxisilil)propil] tetrasulfuro)" Ger. Ofendida. (1973), DE 2212239 A1 19731004.
- ^ Sulfuros, polisulfuros y sulfanos" en la Enciclopedia de química industrial de Ullmann Ludwig Lange y Wolfgang Triebel, 2000, Wiley-VCH, Weinheim. doi :10.1002/14356007.a25_443

