Terapia con células madre
La terapia con células madre utiliza células madre para tratar o prevenir una enfermedad o afección. [1] A partir de 2024 [actualizar], la única terapia aprobada por la FDA que utiliza células madre es el trasplante de células madre hematopoyéticas . [2] [3] Esto generalmente toma la forma de un trasplante de células madre de médula ósea o sangre periférica , pero las células también pueden derivarse de la sangre del cordón umbilical . Se están realizando investigaciones para desarrollar varias fuentes de células madre, así como para aplicar tratamientos con células madre para enfermedades neurodegenerativas [4] y afecciones como la diabetes y las enfermedades cardíacas .
La terapia con células madre ha generado controversia a raíz de avances como la capacidad de los científicos para aislar y cultivar células madre embrionarias , crear células madre mediante transferencia nuclear de células somáticas y el uso de técnicas para crear células madre pluripotentes inducidas . Esta controversia suele estar relacionada con las políticas abortistas y la clonación humana . Además, los esfuerzos por comercializar tratamientos basados en el trasplante de sangre de cordón umbilical almacenada han sido controvertidos.
Usos médicos
Durante más de 90 años, el trasplante de células madre hematopoyéticas (TCMH) se ha utilizado para tratar a personas con enfermedades como la leucemia y el linfoma ; esta es la única forma ampliamente practicada de terapia con células madre. [5] [6] [7] Durante la quimioterapia , la mayoría de las células en crecimiento son destruidas por los agentes citotóxicos . Estos agentes, sin embargo, no pueden discriminar entre las células leucémicas o neoplásicas y las células madre hematopoyéticas dentro de la médula ósea. Este es el efecto secundario de las estrategias de quimioterapia convencionales que el trasplante de células madre intenta revertir; la médula ósea sana de un donante reintroduce células madre funcionales para reemplazar las células perdidas en el cuerpo del huésped durante el tratamiento. Las células trasplantadas también generan una respuesta inmune que ayuda a matar las células cancerosas; este proceso puede ir demasiado lejos, sin embargo, dando lugar a la enfermedad de injerto contra huésped , el efecto secundario más grave de este tratamiento. [8]
En 2012, Canadá aprobó condicionalmente otra terapia con células madre, denominada Prococvhymal, para el tratamiento de la enfermedad injerto contra huésped aguda en niños que no responden a los esteroides. [9] Se trata de una terapia alogénica basada en células madre mesenquimales (MSC) derivadas de la médula ósea de donantes adultos. Las MSC se purifican a partir de la médula ósea, se cultivan y se envasan, y se obtienen hasta 10 000 dosis de un solo donante. Las dosis se almacenan congeladas hasta que se necesitan. [10]
La FDA ha aprobado cinco productos de células madre hematopoyéticas derivadas de la sangre del cordón umbilical para el tratamiento de enfermedades sanguíneas e inmunológicas. [11]
En 2014, la Agencia Europea de Medicamentos recomendó la aprobación del uso de células madre limbares para personas con deficiencia grave de células madre limbares debido a quemaduras en el ojo. [12]
Solo investigación
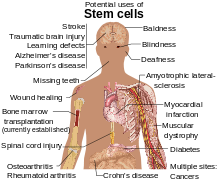
Las células madre se están estudiando por varias razones. Las moléculas y los exosomas liberados por las células madre también se están estudiando en un esfuerzo por fabricar medicamentos. [13] Además de las funciones de las propias células, se ha descubierto que los factores solubles paracrinos producidos por las células madre, conocidos como secretoma de células madre , son otro mecanismo por el cual las terapias basadas en células madre median sus efectos en enfermedades degenerativas , autoinmunes e inflamatorias . [14]
Fuentes de células madre humanas
La mayoría de las células madre destinadas a la terapia regenerativa generalmente se aíslan de la médula ósea del paciente o del tejido adiposo . [15] [16] Las células madre mesenquimales pueden diferenciarse en las células que forman el hueso, el cartílago, los tendones y los ligamentos, así como los músculos, los nervios y otros tejidos progenitores. Han sido el principal tipo de células madre estudiado en el tratamiento de enfermedades que afectan a estos tejidos. [17] [18] La cantidad de células madre trasplantadas en el tejido dañado puede alterar la eficacia del tratamiento. En consecuencia, las células madre derivadas de aspirados de médula ósea, por ejemplo, se cultivan en laboratorios especializados para su expansión a millones de células. [15] [16] Aunque el tejido derivado de tejido adiposo también requiere procesamiento antes de su uso, la metodología de cultivo para células madre derivadas de tejido adiposo no es tan extensa como la de las células derivadas de médula ósea. [19] Si bien se cree que las células madre derivadas de la médula ósea son las preferidas para la reparación de huesos, cartílagos, ligamentos y tendones, otros creen que las técnicas de recolección menos desafiantes y el microambiente multicelular ya presente en las fracciones de células madre derivadas de tejido adiposo hacen que estas últimas sean la fuente preferida para el trasplante autólogo. [20]
Se están investigando nuevas fuentes de células madre mesenquimales , incluidas las células madre presentes en la piel y la dermis, que son de interés debido a la facilidad con la que se pueden recolectar con un riesgo mínimo para el animal. [21] También se ha descubierto que las células madre hematopoyéticas viajan en el torrente sanguíneo y poseen la misma capacidad de diferenciación que otras células madre mesenquimales , nuevamente con una técnica de recolección muy no invasiva. [22]
Recientemente, se ha despertado un interés más amplio en el uso de células madre mesenquimales extraembrionarias . Se están realizando investigaciones para examinar las capacidades de diferenciación de las células madre que se encuentran en el cordón umbilical, el saco vitelino y la placenta de diferentes animales. Se cree que estas células madre tienen una mayor capacidad de diferenciación que sus contrapartes adultas, incluida la capacidad de formar más fácilmente tejidos de origen endodérmico y ectodérmico. [23]
Líneas de células madre embrionarias
A partir de 2010, hubo una controversia generalizada sobre el uso de células madre embrionarias humanas . Esta controversia se dirige principalmente a las técnicas utilizadas para derivar nuevas líneas de células madre embrionarias , que a menudo requieren la destrucción del blastocisto . La oposición al uso de células madre embrionarias humanas en la investigación a menudo se basa en objeciones filosóficas, morales o religiosas. [24] Existe otra investigación con células madre que no implica la destrucción de un embrión humano, y dicha investigación involucra células madre adultas, células madre amnióticas y células madre pluripotentes inducidas.
En enero de 2009, la Administración de Alimentos y Medicamentos de Estados Unidos autorizó a Geron Corporation a realizar el primer ensayo clínico de una terapia basada en células madre embrionarias en seres humanos. El ensayo tenía como objetivo evaluar el fármaco GRNOPC1, células progenitoras de oligodendrocitos derivadas de células madre embrionarias , en personas con lesión aguda de la médula espinal . El ensayo se interrumpió en noviembre de 2011 para que la empresa pudiera centrarse en terapias en el "entorno actual de escasez de capital y condiciones económicas inciertas". [25] En 2013, la empresa de biotecnología y medicina regenerativa BioTime ( AMEX : BTX) adquirió los activos de células madre de Geron en una transacción de acciones, con el objetivo de reiniciar el ensayo clínico. [26]
Células estromales mesenquimales (MSC)
Los científicos informaron en 2012 que las MSC, cuando se transfunden inmediatamente en las pocas horas posteriores a la descongelación, pueden mostrar una función reducida o una eficacia reducida en el tratamiento de enfermedades en comparación con las MSC que están en la fase logarítmica de crecimiento celular (frescas), por lo que las MSC criopreservadas deben volver a la fase logarítmica de crecimiento celular en un cultivo in vitro antes de la administración. El recultivo de las MSC ayudará a recuperarse del shock que sufren las células durante la congelación y la descongelación. Varios ensayos clínicos de MSC que utilizaron productos criopreservados inmediatamente después de la descongelación han fracasado en comparación con los ensayos clínicos que utilizaron MSC frescas. [27]
En el descubrimiento de fármacos y la investigación biomédica
La capacidad de cultivar tejidos adultos funcionales de forma indefinida mediante la diferenciación dirigida crea nuevas oportunidades para la investigación de fármacos. Los investigadores pueden cultivar líneas celulares diferenciadas y luego probar nuevos fármacos en cada tipo de célula para examinar posibles interacciones in vitro antes de realizar estudios in vivo . Esto es fundamental en el desarrollo de fármacos para su uso en la investigación veterinaria debido a las posibilidades de interacciones específicas entre especies. La esperanza es que tener estas líneas celulares disponibles para su uso en investigación reducirá la necesidad de utilizar animales de investigación porque los efectos sobre el tejido humano in vitro proporcionarán información que normalmente no se conoce antes de la fase de prueba con animales. [28]
- Con la llegada de las células madre pluripotentes inducidas (iPSC), se están explorando y creando tratamientos para su uso en animales en peligro de extinción de baja producción. En lugar de tener que extraer embriones u óvulos, que son limitados, los investigadores pueden extraer células madre mesenquimales con mayor facilidad y reduciendo en gran medida el peligro para el animal debido a las técnicas no invasivas. Esto permite que los óvulos limitados se utilicen solo con fines reproductivos. [28]
Expansión de células madre
Para su uso en aplicaciones de investigación o tratamiento, se necesitan grandes cantidades de células madre de alta calidad. Por lo tanto, es necesario desarrollar sistemas de cultivo que produzcan poblaciones puras de células madre específicas de tejido in vitro sin pérdida del potencial de las células madre. Para este fin se utilizan dos enfoques principales: cultivo celular bidimensional y tridimensional. [29]
El cultivo de células en dos dimensiones se ha llevado a cabo de forma rutinaria en miles de laboratorios de todo el mundo durante las últimas cuatro décadas. En plataformas bidimensionales, las células suelen estar expuestas a una superficie plana, sólida y rígida en el lado basal y a un líquido en la superficie apical. Habitar en un sustrato tan rígido y bidimensional requiere una adaptación drástica para las células supervivientes, ya que carecen de la matriz extracelular que es exclusiva de cada tipo de célula, lo que puede alterar el metabolismo celular y reducir su funcionalidad. [29]
Los sistemas de cultivo celular tridimensionales pueden crear un microambiente biomimético para las células madre, similar a su matriz extracelular (ECM) tridimensional nativa. Los biomateriales avanzados han contribuido significativamente a los sistemas de cultivo celular tridimensional en las últimas décadas, y se han propuesto biomateriales más únicos y complejos para mejorar la proliferación y la diferenciación controlada de las células madre. Entre ellos, los biomateriales nanoestructurados son de particular interés porque tienen la ventaja de una alta relación superficie-volumen, e imitan las características físicas y biológicas de la ECM natural a escala nanométrica. [29]
Modelos regenerativos asumidos
Se cree que las células madre median la reparación a través de cinco mecanismos principales: 1) proporcionar un efecto antiinflamatorio, 2) dirigirse a los tejidos dañados y reclutar otras células, como las células progenitoras endoteliales , que son necesarias para el crecimiento del tejido, 3) apoyar la remodelación del tejido en lugar de la formación de cicatrices, 4) inhibir la apoptosis y 5) diferenciarse en tejido óseo, cartilaginoso, tendinoso y ligamentoso. [30] [31]
Para enriquecer aún más el suministro de sangre a las áreas dañadas y, en consecuencia, promover la regeneración tisular, se podría utilizar plasma rico en plaquetas junto con el trasplante de células madre. [20] [15] La eficacia de algunas poblaciones de células madre también puede verse afectada por el método de administración; por ejemplo, para regenerar el hueso, las células madre a menudo se introducen en un andamio donde producen los minerales necesarios para la generación de hueso funcional. [20] [15] [32] [16]
Se ha demostrado que las células madre tienen una baja inmunogenicidad debido al número relativamente bajo de moléculas MHC que se encuentran en su superficie. Además, se ha descubierto que secretan quimiocinas que alteran la respuesta inmunitaria y promueven la tolerancia del nuevo tejido. Esto permite que los tratamientos alogénicos se realicen sin un alto riesgo de rechazo. [23]
Aplicaciones potenciales
Neurodegeneración
Se han realizado investigaciones sobre los efectos de las células madre en modelos animales de degeneración cerebral , como en la enfermedad de Parkinson , la esclerosis lateral amiotrófica y la enfermedad de Alzheimer . [33] [34] [35] Se han realizado estudios preliminares relacionados con la esclerosis múltiple , [36] [37] [38] y un ensayo de fase 2 de 2020 encontró resultados significativamente mejorados para los pacientes tratados con células madre mesenquimales en comparación con los que recibieron un tratamiento simulado. [39] En enero de 2021, la FDA aprobó el primer ensayo clínico para una terapia de células madre en investigación para restaurar las células cerebrales perdidas en personas con enfermedad de Parkinson avanzada. [40]
Los cerebros adultos sanos contienen células madre neuronales , que se dividen para mantener el número general de células madre o se convierten en células progenitoras . En animales de laboratorio adultos sanos, las células progenitoras migran dentro del cerebro y funcionan principalmente para mantener las poblaciones de neuronas para el olfato (el sentido del olfato). Se ha informado que la activación farmacológica de células madre neuronales endógenas induce neuroprotección y recuperación conductual en modelos de ratas adultas con trastornos neurológicos. [41] [42] [43]
Lesión cerebral y de la médula espinal
Los accidentes cerebrovasculares y las lesiones cerebrales traumáticas provocan la muerte celular , caracterizada por la pérdida de neuronas y oligodendrocitos en el cerebro. Se han realizado estudios clínicos y en animales sobre el uso experimental de células madre en casos de lesión de la médula espinal . [44] [45] [46] [38]
Síndrome de fragilidad
En 2017, un estudio a pequeña escala sobre personas de 60 años o más con fragilidad asociada al envejecimiento mostró, después del tratamiento intravenoso con células madre mesenquimales (MSC) de donantes jóvenes sanos, mejoras significativas en las medidas de rendimiento físico. Las MSC ayudan a bloquear la inflamación al disminuirla, lo que hace que se reviertan los efectos de la fragilidad. [47]
Corazón
En 2012, se estudiaron células madre en personas con enfermedades cardíacas graves . [48] El trabajo de Bodo-Eckehard Strauer [49] fue desacreditado al identificar cientos de contradicciones fácticas. [50] Entre varios ensayos clínicos que informaron que la terapia con células madre adultas es segura y efectiva, solo se han reportado evidencias reales de beneficios de unos pocos estudios. [51] Algunos ensayos clínicos preliminares lograron solo mejoras modestas en la función cardíaca luego del uso de la terapia con células madre de la médula ósea . [52] [53]
La terapia con células madre para el tratamiento del infarto de miocardio generalmente utiliza células madre autólogas de médula ósea, pero se pueden utilizar otros tipos de células madre adultas, como las células madre derivadas de tejido adiposo. [54]
Los posibles mecanismos de recuperación incluyen: [33] Generación de células musculares cardíacas, estimulación del crecimiento de nuevos vasos sanguíneos para repoblar el tejido cardíaco dañado y secreción de factores de crecimiento .
Formación de células sanguíneas
La especificidad del repertorio de células inmunitarias humanas es lo que permite al cuerpo humano defenderse de los antígenos que se adaptan rápidamente. Sin embargo, el sistema inmunitario es vulnerable a la degradación en la patogénesis de la enfermedad y, debido al papel crítico que desempeña en la defensa general, su degradación a menudo es fatal para el organismo en su conjunto. Las enfermedades de las células hematopoyéticas se diagnostican y clasifican a través de una subespecialidad de patología conocida como hematopatología . La especificidad de las células inmunitarias es lo que permite el reconocimiento de antígenos extraños, lo que provoca más desafíos en el tratamiento de la enfermedad inmunitaria. Ya no se requieren coincidencias idénticas entre el donante y el receptor para un trasplante exitoso. En cambio, las coincidencias haploidénticas han facilitado numerosos trasplantes, dadas las mejoras en los regímenes inmunosupresores posteriores al trasplante. [55] La investigación que utiliza células madre adultas hematopoyéticas y células madre embrionarias ha proporcionado información sobre los posibles mecanismos y métodos de tratamiento para muchas de estas dolencias. [56]
Los glóbulos rojos humanos completamente maduros pueden generarse ex vivo a partir de células madre hematopoyéticas (CMH), que son precursoras de los glóbulos rojos. En este proceso, las CMH se cultivan junto con células del estroma , creando un entorno que imita las condiciones de la médula ósea, el sitio natural de crecimiento de los glóbulos rojos. Se añade eritropoyetina , un factor de crecimiento , que induce a las células madre a completar la diferenciación terminal en glóbulos rojos. [57] La investigación futura sobre esta técnica debería tener beneficios potenciales para la terapia génica, la transfusión de sangre y la medicina tópica.
Recrecimiento de los dientes
En 2004, los científicos del King's College de Londres descubrieron una forma de cultivar un diente completo en ratones [58] y lograron hacer crecer dientes biodiseñados de manera independiente en el laboratorio. Los investigadores confían en que la tecnología de regeneración dental se pueda utilizar para hacer crecer dientes vivos en personas.
En teoría, las células madre extraídas del paciente podrían ser inducidas en el laboratorio a convertirse en un brote dental que, al implantarse en las encías, dará lugar a un nuevo diente, y se espera que crezca en un período de más de tres semanas. [59] Se fusionará con el hueso maxilar y liberará sustancias químicas que estimulan a los nervios y vasos sanguíneos a conectarse con él. El proceso es similar a lo que sucede cuando los seres humanos desarrollan sus dientes adultos originales. Sin embargo, aún quedan muchos desafíos antes de que las células madre puedan ser una opción para el reemplazo de dientes faltantes en el futuro. [60] [61]
Recrecimiento de células ciliadas cocleares
Heller ha informado que ha tenido éxito en el recrecimiento de células ciliadas de la cóclea con el uso de células madre embrionarias . [62]
En una revisión de 2019 que analizó la regeneración auditiva y la medicina regenerativa, los progenitores óticos derivados de células madre tienen el potencial de mejorar enormemente la audición. [63]
Ceguera y discapacidad visual
Desde 2003, los investigadores han trasplantado con éxito células madre de la córnea en ojos dañados para restaurar la visión. "Las láminas de células de la retina utilizadas por el equipo se extraen de fetos abortados, lo que algunas personas consideran inaceptable". Cuando estas láminas se trasplantan sobre la córnea dañada , las células madre estimulan una nueva reparación, restaurando finalmente la visión. [64] El último desarrollo de este tipo se produjo en junio de 2005, cuando los investigadores del Hospital Queen Victoria de Sussex , Inglaterra, pudieron restaurar la vista de cuarenta personas utilizando la misma técnica. El grupo, dirigido por Sheraz Daya , pudo utilizar con éxito células madre adultas obtenidas del paciente, un familiar o incluso un cadáver . Se están llevando a cabo más rondas de ensayos. [65]
Células beta pancreáticas
Las personas con diabetes tipo 1 pierden la función de las células beta productoras de insulina dentro del páncreas. En una publicación de experimentos de 2007, los científicos han podido convencer a las células madre embrionarias para que se conviertan en células beta en el laboratorio. En teoría, si la célula beta se trasplanta con éxito, podrá reemplazar a las que funcionan mal en un paciente diabético. [66] Sin embargo, las altas concentraciones de glucosa tienen efectos adversos en la terapia con células madre. [67]

Ortopedía
A partir de 2017, el uso de células madre mesenquimales (MSC) derivadas de células madre adultas estaba bajo investigación preliminar para posibles aplicaciones ortopédicas en traumatismos óseos y musculares, reparación de cartílago , osteoartritis , cirugía de disco intervertebral , cirugía del manguito rotador y trastornos musculoesqueléticos , entre otros. [68] Otras áreas de investigación ortopédica para usos de MSC incluyen ingeniería de tejidos y medicina regenerativa . [68]
Cicatrización de heridas
Las células madre también se pueden utilizar para estimular el crecimiento de tejidos humanos. En un adulto, el tejido herido se reemplaza con mayor frecuencia por tejido cicatricial , que se caracteriza en la piel por una estructura de colágeno desorganizada, pérdida de folículos pilosos y estructura vascular irregular. Sin embargo, en el caso del tejido fetal herido, el tejido herido se reemplaza por tejido normal a través de la actividad de las células madre. [69] Un posible método para la regeneración de tejidos en adultos es colocar "semillas" de células madre adultas dentro de un "suelo" de lecho de tejido en un lecho de herida y permitir que las células madre estimulen la diferenciación en las células del lecho de tejido. Este método provoca una respuesta regenerativa más similar a la curación de heridas fetales que a la formación de tejido cicatricial adulto. [69] A partir de 2018, los investigadores todavía estaban investigando diferentes aspectos del tejido "suelo" que conducen a la regeneración. [69] Debido a las capacidades generales de curación de las células madre, han ganado interés para el tratamiento de heridas cutáneas, como en el cáncer de piel . [70]
VIH/SIDA
En 2013, los científicos han estado investigando un enfoque alternativo para tratar el VIH-1/SIDA, basado en la creación de un sistema inmunológico resistente a la enfermedad mediante el trasplante de células madre y progenitoras hematopoyéticas autólogas modificadas genéticamente (resistentes al VIH-1) (GM-HSPC). [71]
Críticas
En 2013, se encontró que los estudios de células madre autólogas de médula ósea sobre la función ventricular contenían "cientos" de discrepancias. [50] Los críticos informan que de 48 informes, solo cinco ensayos subyacentes parecían haber sido utilizados, y que en muchos casos, ya fueran aleatorizados o meramente observacionales, la diferencia entre los informes del mismo ensayo era contradictoria. Un par de informes con características iniciales y resultados finales idénticos se presentó en dos publicaciones como, respectivamente, un ensayo aleatorizado de 578 pacientes y como un estudio observacional de 391 sujetos. Otros informes exigían desviaciones estándar negativas (imposibles) en subconjuntos de personas o contenían sujetos fraccionarios, clases negativas de la NYHA. En general, se informó que muchas más personas habían recibido células madre en los ensayos que el número de células madre procesadas en el laboratorio del hospital durante ese tiempo. Una investigación universitaria, cerrada en 2012 sin informe, se reabrió en julio de 2013. [72]
En 2014, un metanálisis sobre la terapia con células madre utilizando células madre de la médula ósea para enfermedades cardíacas reveló discrepancias en los informes de ensayos clínicos publicados, por lo que los estudios con un mayor número de discrepancias mostraron un aumento en los tamaños del efecto. [73] Otro metanálisis basado en los datos intra-sujeto de 12 ensayos aleatorios no pudo encontrar ningún beneficio significativo de la terapia con células madre en los puntos finales primarios, como eventos adversos importantes o aumento en las medidas de la función cardíaca, y concluyó que no hubo ningún beneficio. [74]
Los resultados de 2018 del ensayo TIME, que utilizó un diseño de ensayo aleatorizado, doble ciego y controlado con placebo, concluyeron que "la administración de células mononucleares de médula ósea no mejoró la recuperación de la función del VI durante 2 años" en personas que habían tenido un infarto de miocardio. [75] En consecuencia, el ensayo BOOST-2 realizado en 10 centros médicos en Alemania y Noruega informó que el resultado del ensayo "no respalda el uso de células madre mononucleares en pacientes con STEMI y FEVI moderadamente reducida". [76] Además, el ensayo tampoco cumplió con ningún otro criterio de valoración secundario de resonancia magnética, [77] lo que lleva a la conclusión de que la terapia intracoronaria con células madre de médula ósea no ofrece un beneficio funcional o clínico. [78]
En 2021, las inyecciones de células madre en los EE. UU. han causado infecciones graves en al menos 20 pacientes que recibieron productos derivados de la sangre del cordón umbilical comercializados como "tratamiento con células madre". [79] En 2023, se publicó el caso de una mujer que se infectó con Mycobacterium abscessus y sufrió meningitis después del tratamiento con células madre para la esclerosis múltiple en una clínica comercial en Baja California, México. [80]
Medicina veterinaria
Las investigaciones realizadas en caballos, perros y gatos han llevado al desarrollo de tratamientos con células madre en medicina veterinaria que pueden dirigirse a una amplia gama de lesiones y enfermedades, como infarto de miocardio , accidente cerebrovascular, daño en tendones y ligamentos , osteoartritis , osteocondrosis y distrofia muscular , tanto en animales grandes como en humanos. [81] [82] [83] [84] Si bien la investigación de terapias basadas en células generalmente refleja las necesidades médicas humanas, el alto grado de frecuencia y gravedad de ciertas lesiones en caballos de carreras ha colocado a la medicina veterinaria a la vanguardia de este novedoso enfoque regenerativo. [85] Los animales de compañía pueden servir como modelos clínicamente relevantes que imitan de cerca la enfermedad humana. [86] [87]
Fuentes de células madre veterinarias
Las aplicaciones veterinarias de la terapia con células madre como un medio de regeneración tisular han sido en gran medida determinadas por la investigación que comenzó con el uso de células madre mesenquimales derivadas de adultos para tratar animales con lesiones o defectos que afectan a los huesos, cartílagos, ligamentos y/o tendones. [88] [17] [89] Hay dos categorías principales de células madre utilizadas para tratamientos: células madre alogénicas derivadas de un donante genéticamente diferente dentro de la misma especie, [16] [90] y células madre mesenquimales autólogas , derivadas del paciente antes de su uso en varios tratamientos. [20] Una tercera categoría, las células madre xenogénicas , o células madre derivadas de diferentes especies, se utilizan principalmente con fines de investigación, especialmente para tratamientos humanos. [28]
Reparación ósea
El hueso tiene un proceso de curación natural único y bien documentado que normalmente es suficiente para reparar fracturas y otras lesiones comunes. Las fracturas desalineadas debido a traumatismos graves, así como los tratamientos como las resecciones tumorales del cáncer de hueso, son propensos a una curación inadecuada si se dejan al proceso natural por sí solo. Los andamios compuestos de componentes naturales y artificiales se siembran con células madre mesenquimales y se colocan en el defecto. Dentro de las cuatro semanas posteriores a la colocación del andamio, el hueso recién formado comienza a integrarse con el hueso viejo y dentro de las 32 semanas, se logra la unión completa. [91] Se necesitan más estudios para caracterizar completamente el uso de terapias basadas en células para el tratamiento de fracturas óseas.
Las células madre se han utilizado para tratar enfermedades óseas degenerativas en perros. El tratamiento que normalmente se recomienda para los perros que padecen la enfermedad de Legg-Calvé-Perthes es extirpar la cabeza del fémur una vez que la degeneración ha avanzado. Recientemente, se han inyectado células madre mesenquimales directamente en la cabeza del fémur, con éxito no solo en la regeneración ósea, sino también en la reducción del dolor. [91]
Reparación de ligamentos y tendones
Los tratamientos basados en células madre autólogas para lesiones de ligamentos , lesiones de tendones , osteoartritis , osteocondrosis y quistes óseos subcondrales han estado disponibles comercialmente para veterinarios en ejercicio para tratar caballos desde 2003 en los Estados Unidos y desde 2006 en el Reino Unido. Los tratamientos basados en células madre autólogas para lesiones de tendones, lesiones de ligamentos y osteoartritis en perros han estado disponibles para veterinarios en los Estados Unidos desde 2005. Más de 3000 caballos y perros de propiedad privada han sido tratados con células madre autólogas derivadas de tejido adiposo. La eficacia de estos tratamientos se ha demostrado en ensayos clínicos doble ciego para perros con osteoartritis de cadera y codo y caballos con daño en los tendones. [92] [93]
Los caballos de carreras son especialmente propensos a sufrir lesiones en tendones y ligamentos. Las terapias convencionales no consiguen que el caballo recupere su pleno potencial funcional. La curación natural, guiada por los tratamientos convencionales, conduce a la formación de tejido cicatricial fibroso que reduce la flexibilidad y el movimiento completo de las articulaciones. Los tratamientos tradicionales han impedido que un gran número de caballos vuelvan a la actividad completa y también tienen una alta incidencia de nuevas lesiones debido a la naturaleza rígida del tendón cicatrizado. La introducción de células madre derivadas de la médula ósea y del tejido adiposo, junto con un estímulo mecánico natural, promovió la regeneración del tejido del tendón. El movimiento natural promovió la alineación de las nuevas fibras y tendocitos con la alineación natural que se encuentra en los tendones no lesionados. El tratamiento con células madre no sólo permitió que más caballos volvieran a la actividad completa, sino que también redujo en gran medida la tasa de nuevas lesiones durante un período de tres años. [23]
El uso de células madre embrionarias también se ha aplicado a la reparación de tendones. Se ha demostrado que las células madre embrionarias tienen una mejor tasa de supervivencia en el tendón, así como una mejor capacidad de migración para alcanzar todas las áreas del tendón dañado. La calidad general de la reparación también fue mayor, con una mejor arquitectura del tendón y una mejor formación de colágeno. Tampoco se observó formación de tumores durante el período experimental de tres meses. Es necesario realizar estudios a largo plazo para examinar la eficacia a largo plazo y los riesgos asociados con el uso de células madre embrionarias. [23] Se han encontrado resultados similares en animales pequeños. [23]
Reparación de articulaciones
La osteoartritis es la principal causa de dolor articular tanto en animales como en humanos. Los caballos y los perros son los más frecuentemente afectados por la artritis. La regeneración natural del cartílago es muy limitada. Todavía se están investigando diferentes tipos de células madre mesenquimales y otros aditivos para encontrar el mejor tipo de célula y método para el tratamiento a largo plazo. [23]
Las células mesenquimales derivadas de tejido adiposo son las más utilizadas actualmente para el tratamiento de la osteoartritis con células madre debido a que su obtención no es invasiva. Se trata de una técnica no invasiva desarrollada recientemente para facilitar su uso clínico. Los perros que recibieron este tratamiento mostraron una mayor flexibilidad en sus articulaciones y menos dolor. [94]
Reparación muscular
Las células madre se han utilizado con éxito para mejorar la cicatrización del corazón después de un infarto de miocardio en perros. Se extrajeron células madre derivadas de tejido adiposo y médula ósea y se las indujo a convertirse en células cardíacas antes de inyectarlas en el corazón. Se observó que el corazón presentaba una mejor contractilidad y una reducción de la zona dañada cuatro semanas después de la aplicación de las células madre. [95]
En 2007 se estaba llevando a cabo un ensayo con un parche hecho de una sustancia porosa sobre la que se "siembran" células madre para inducir la regeneración tisular en defectos cardíacos. El tejido se regeneró y el parche se incorporó bien al tejido cardíaco. Se cree que esto se debe, en parte, a una mejor angiogénesis y a una reducción de la inflamación. Aunque los cardiomiocitos se produjeron a partir de células madre mesenquimales , no parecían ser contráctiles. Otros tratamientos que inducían un destino cardíaco en las células antes del trasplante tuvieron mayor éxito en la creación de tejido cardíaco contráctil. [96]
Las investigaciones de 2018, como el proyecto de investigación europeo nTRACK, tienen como objetivo demostrar que las nanopartículas multimodales pueden rastrear estructural y funcionalmente las células madre en la terapia de regeneración muscular. La idea es etiquetar las células madre con nanopartículas de oro que estén completamente caracterizadas en cuanto a absorción, funcionalidad y seguridad. Las células madre etiquetadas se inyectarán en un músculo lesionado y se rastrearán mediante sistemas de imágenes. [97] Sin embargo, el sistema aún necesita demostrarse a escala de laboratorio.
Reparación del sistema nervioso
Las lesiones de la médula espinal son uno de los traumatismos más comunes que se llevan a los hospitales veterinarios. [91] Las lesiones de la médula espinal se producen de dos maneras después del traumatismo: el daño mecánico primario y en procesos secundarios, como la inflamación y la formación de cicatrices, en los días posteriores al traumatismo. Estas células involucradas en la respuesta al daño secundario secretan factores que promueven la formación de cicatrices e inhiben la regeneración celular. Las células madre mesenquimales que son inducidas a un destino de célula neuronal se cargan en un andamio poroso y luego se implantan en el sitio de la lesión. Las células y el andamio secretan factores que contrarrestan los secretados por las células formadoras de cicatrices y promueven la regeneración neuronal. Ocho semanas después, los perros tratados con células madre mostraron una inmensa mejoría en comparación con los tratados con terapias convencionales. Los perros tratados con células madre pudieron ocasionalmente soportar su propio peso, lo que no se ha visto en perros sometidos a terapias convencionales. [98] [99] [100]
En un estudio para evaluar el tratamiento de la EM inducida experimentalmente en perros utilizando células madre derivadas de tejido adiposo no expandidas activadas por láser, los resultados mostraron una mejoría de los signos clínicos con el tiempo, confirmada por la resolución de las lesiones previas en la resonancia magnética. La migración positiva de las células inyectadas al sitio de la lesión, el aumento de la remielinización detectado por las proteínas básicas de mielina, la diferenciación positiva en oligodendrocitos positivos para Olig2, evitaron la formación de cicatrices gliales y restauraron la arquitectura axonal. [38]
También se están realizando ensayos clínicos con tratamientos para reparar y regenerar los nervios periféricos. Los nervios periféricos tienen más probabilidades de sufrir daños, pero los efectos del daño no son tan generalizados como los que se observan en las lesiones de la médula espinal. Actualmente se están realizando ensayos clínicos con tratamientos para reparar nervios dañados, con un éxito temprano. Se inyectaron células madre inducidas a un destino neuronal en un nervio dañado. En cuatro semanas, se observó la regeneración de las células madre previamente dañadas y haces nerviosos completamente formados. [21]
Las células madre también se encuentran en fase clínica para su uso en oftalmología. Las células madre hematopoyéticas se han utilizado para tratar úlceras corneales de diferente origen en varios caballos. Estas úlceras eran resistentes a los tratamientos convencionales disponibles, pero respondieron rápidamente de forma positiva al tratamiento con células madre. Las células madre también fueron capaces de restaurar la visión en un ojo de un caballo con desprendimiento de retina, lo que permitió al caballo volver a sus actividades diarias. [22]
Conservación
Se están estudiando las células madre para su uso en iniciativas de conservación. Se han extraído células madre espermatogoniales de una rata y se han colocado en un ratón huésped, con lo que se han producido espermatozoides completamente maduros capaces de producir crías viables. Actualmente se están realizando investigaciones para encontrar huéspedes adecuados para la introducción de células madre espermatogoniales de donantes. Si esta se convierte en una opción viable para los conservacionistas, se pueden producir espermatozoides a partir de individuos de alta calidad genética que mueren antes de alcanzar la madurez sexual, preservando así una línea que de otro modo se perdería. [101]
Sociedad y cultura
Marketing y costos
A finales de los años 1990 y principios de los años 2000, hubo una ola inicial de empresas y clínicas que ofrecían terapias con células madre, aunque no fundamentaban sus afirmaciones sobre sus propiedades saludables ni contaban con la aprobación regulatoria. [102] En 2012, había surgido una segunda ola de empresas y clínicas, generalmente ubicadas en países en desarrollo donde la medicina está menos regulada y que ofrecían terapias con células madre en un modelo de turismo médico . [103] [104] Al igual que las empresas y clínicas de la primera ola, hicieron afirmaciones similares, fuertes, pero sin fundamento, principalmente por parte de clínicas en los Estados Unidos, México, Tailandia, India y Sudáfrica . [103] [104] En 2016, las investigaciones indicaron que solo en los EE. UU. había más de 550 clínicas de células madre que vendían terapias generalmente no probadas para una amplia gama de condiciones médicas en casi todos los estados del país, [105] alterando la dinámica del turismo de células madre . En 2018, la FDA envió una carta de advertencia a StemGenex Biologic Laboratories en San Diego, que comercializaba un servicio en el que tomaba grasa corporal de personas, la procesaba en mezclas que decían que contenían varias formas de células madre y se la administraba a la persona por inhalación, vía intravenosa o infusión en la médula espinal; la compañía dijo que el tratamiento era útil para muchas afecciones crónicas y potencialmente mortales. [106]
Una táctica de marketing habitual es el registro en ClinicalTrials.gov , la base de datos del gobierno estadounidense sobre ensayos clínicos. El registro de un estudio notifica a la agencia, pero no prueba que se haya realizado una revisión. El registro en la FDA tampoco prueba que se haya concedido la aprobación. [107]
Los costos de las terapias con células madre varían ampliamente según la clínica, la condición y el tipo de célula, pero lo más común es que oscile entre $10,000 y $20,000. [108] El seguro no cubre las inyecciones de células madre en las clínicas, por lo que los pacientes a menudo usan la recaudación de fondos en línea. [109] En 2018, la Comisión Federal de Comercio de los EE. UU. encontró centros de salud y un médico individual haciendo afirmaciones sin fundamento sobre terapias con células madre y obligó a reembolsos de unos $500,000. [110] La FDA presentó una demanda contra dos empresas de clínicas de células madre casi al mismo tiempo, buscando medidas cautelares permanentes contra su comercialización y uso de productos de células madre adiposas no aprobados. [111]
Respuestas de agencias gubernamentales y marketing relacionadas con el COVID-19
Aunque según el NIH no se han aprobado tratamientos con células madre para la COVID-19 , y la agencia recomienda no utilizar células madre madre para la enfermedad, [112] algunas clínicas de células madre comenzaron a comercializar células madre y exosomas no probados y no aprobados por la FDA para la COVID-19 en 2020. [113] La FDA tomó medidas rápidas enviando cartas a las empresas en cuestión. [114] [115] La FTC también advirtió a una empresa de células madre por marketing engañoso relacionado con la COVID-19. [116] [117]
Véase también
Referencias
[118]
- ^ Mahla RS (2016). "Aplicación de células madre en medicina regenerativa y terapias de enfermedades". Revista internacional de biología celular . 2016 (7): 1–24. doi : 10.1155/2016/6940283 . PMC 4969512 . PMID 27516776.
- ^ Müller, Albrecht M.; Huppertz, Sascha; Henschler, Reinhard (julio de 2016). "Células madre hematopoyéticas en medicina regenerativa: ¿por mal camino o en el camino correcto?". Medicina transfusional y hemoterapia . 43 (4): 247–254. doi :10.1159/000447748. ISSN 1660-3796. PMC 5040947. PMID 27721700 .
- ^ "Alerta al consumidor sobre productos de medicina regenerativa que incluyen células madre y exosomas". FDA.gov . Consultado el 5 de agosto de 2024 .
- ^ Lyon, Louisa (1 de octubre de 2018). «Terapias con células madre en neurología: lo bueno, lo malo y lo desconocido». Brain . 141 (10): e77. doi : 10.1093/brain/awy221 . ISSN 0006-8950. PMID 30202947.
- ^ Ian Murnaghan para Explore Stem Cells. Actualizado: 16 de diciembre de 2013 ¿Por qué realizar un trasplante de células madre?
- ^ Trasplante de médula ósea y trasplante de células madre de sangre periférica En el sitio web de la hoja informativa del Instituto Nacional del Cáncer. Bethesda, MD: Institutos Nacionales de Salud, Departamento de Salud y Servicios Humanos de los EE. UU., 2010. Citado el 24 de agosto de 2010
- ^ Karanes C, Nelson GO, Chitphakdithai P, Agura E, Ballen KK, Bolan CD, Porter DL, Uberti JP, King RJ, Confer DL (2008). "Veinte años de trasplante de células hematopoyéticas de donantes no emparentados para receptores adultos facilitados por el Programa Nacional de Donantes de Médula Ósea". Biología del Trasplante de Sangre y Médula Ósea . 14 (9 Suppl): 8–15. doi : 10.1016/j.bbmt.2008.06.006 . PMID 18721775.
- ^ Malard F, Mohty M (2014). "Nuevos conocimientos para el diagnóstico de la enfermedad de injerto contra huésped aguda gastrointestinal". Mediators Inflamm . 2014 : 701013. doi : 10.1155/2014/701013 . PMC 3964897 . PMID 24733964.
- ^ "Prochymal: primer fármaco basado en células madre aprobado". 22 de mayo de 2012.
- ^ Pollack, Andrew (17 de mayo de 2012). "Un fármaco basado en células madre obtiene aprobación en Canadá". The New York Times .
- ^ Rosemann A (diciembre de 2014). "Por qué la medicina regenerativa con células madre progresa más lentamente de lo esperado" (PDF) . J Cell Biochem . 115 (12): 2073–6. doi : 10.1002/jcb.24894 . PMID 25079695.
- ^ Agencia Europea de Medicamentos. «Primera terapia con células madre recomendada para aprobación en la UE» . Consultado el 11 de febrero de 2024 .
- ^ Maguire, G (12 de mayo de 2016). "Terapéutica a partir de células madre adultas y la curva de popularidad". ACS Medicinal Chemistry Letters . 7 (5): 441–3. doi :10.1021/acsmedchemlett.6b00125. PMC 4867479 . PMID 27190588.
- ^ Teixeira, Fábio G.; Carvalho, Miguel M.; Sousa, Nuño; Salgado, António J. (1 de octubre de 2013). "Secrema de células madre mesenquimales: ¿un nuevo paradigma para la regeneración del sistema nervioso central?" (PDF) . Ciencias de la vida celulares y moleculares . 70 (20): 3871–82. doi :10.1007/s00018-013-1290-8. hdl : 1822/25128 . ISSN 1420-682X. PMC 11113366 . PMID 23456256. S2CID 18640402.
- ^ abcd Yamada Y, Ueda M, Naiki T, Takahashi M, Hata K, Nagasaka T (2004). "Hueso autógeno inyectable para regeneración con células madre mesenquimales y plasma rico en plaquetas: regeneración ósea mediante ingeniería tisular". Tissue Eng . 10 (5–6): 955–964. doi :10.1089/1076327041348284. PMID 15265313.
- ^ abcd Zachos TA, Smith TJ (septiembre de 2008). Uso de células madre adultas en ortopedia clínica. DVM Newsmagazine. 36–39.
- ^ ab Awad HA, Butler DL, Boivin GP, et al. (junio de 1999). "Reparación de tendón mediada por células madre mesenquimales autólogas". Tissue Eng . 5 (3): 267–277. doi :10.1089/ten.1999.5.267. PMID 10434073.
- ^ Nathan S, Das De S, Thambyah A, Fen C, Goh J, Lee EH (agosto de 2003). "Terapia basada en células para la reparación de defectos osteocondrales: un nuevo uso del tejido adiposo". Tissue Eng . 9 (4): 733–744. doi :10.1089/107632703768247412. PMID 13678450.
- ^ Fraser JK, Wulur I, Alfonso Z, Hedrick MH (abril de 2006). "Tejido graso: una fuente subestimada de células madre para la biotecnología". Trends Biotechnol . 24 (4): 150–4. doi :10.1016/j.tibtech.2006.01.010. PMID 16488036.
- ^ abcd Kane, Ed (mayo de 2008). La terapia con células madre es prometedora para las lesiones y enfermedades de los tejidos blandos. DVM Newsmagazine. 6E-10E.
- ^ ab Park BW, Kang DH, Kang EJ, Byun JH, Lee JS, Maeng GH, Rho GJ (2012). "Regeneración de nervios periféricos utilizando células madre mesenquimales autólogas derivadas de piel porcina". J Tissue Eng Regen Med . 6 (2): 113–124. doi : 10.1002/term.404. PMID 21337707. S2CID 27650070.
- ^ ab Marfe G, Massaro-Giordano M, Ranalli M, Cozzoli E, Di Stefano C, Malafoglia V, Polettini M, Gambacurta A (2012). "Células madre derivadas de la sangre: una terapia de mejora en oftalmología veterinaria". J. Celda. Fisiol . 227 (3): 1250–6. doi :10.1002/jcp.22953. PMID 21792938. S2CID 5279649.
- ^ abcdef Brehm W, Burk J, Delling U, Gittel C, Ribitsch I (2012). "Ingeniería tisular basada en células madre en ortopedia veterinaria". Cell Tissue Res . 347 (3): 677–688. doi :10.1007/s00441-011-1316-1. PMID 22287044. S2CID 14977815.
- ^ Mlsna, Lucas J. (2010). "Tratamientos basados en células madre y nuevas consideraciones para la legislación sobre cláusulas de conciencia". Indiana Health Law Review . 8 (2). Estados Unidos: 471–496. ISSN 1549-3199. OCLC 54703225..
- ^ O'Connell, Claire (27 de enero de 2012). "Células madre: ¿dónde estamos ahora?". The Irish Times .
- ^ "BioTime adquiere activos de células madre de Geron y recauda 10 millones de dólares". San Francisco Business Times . 7 de enero de 2013.
- ^ François M, Copland IB, Yuan S, Romieu-Mourez R, Waller EK, Galipeau J (febrero de 2012). "Las células estromales mesenquimales criopreservadas muestran propiedades inmunosupresoras deterioradas como resultado de la respuesta al choque térmico y la autorización de interferón-γ deteriorada". Citoterapia . 14 (2): 147–152. doi :10.3109/14653249.2011.623691. PMC 3279133 . PMID 22029655.
- ^ abc Gattegno-Ho D, Argyle SA, Argyle DJ (2012). "Células madre y medicina veterinaria: herramientas para comprender enfermedades y permitir la regeneración de tejidos y el descubrimiento de fármacos". Vet. J. 191 ( 1): 19–27. doi :10.1016/j.tvjl.2011.08.007. PMID 21958722.
- ^ abc Mellati, Amir; Zhang, Hu (2015). "Expansión de células madre mediante ingeniería de nanotejidos". Stem-Cell Nanoengineering . Wiley. págs. 243–263. doi :10.1002/9781118540640.ch14. ISBN 978-1-118-54064-0.
- ^ Richardson LE, Dudhia J, Clegg PD, Smith R (septiembre de 2007). "Células madre en medicina veterinaria: intentos de regenerar el tendón equino después de una lesión". Trends Biotechnol . 25 (9): 409–416. doi :10.1016/j.tibtech.2007.07.009. PMID 17692415.
- ^ Csaki C, Matis U, Mobasheri A, Ye H, Shakibaei M (diciembre de 2007). "Condrogénesis, osteogénesis y adipogénesis de células madre mesenquimales caninas: un estudio bioquímico, morfológico y ultraestructural". Histochem. Cell Biol . 128 (6): 507–520. doi :10.1007/s00418-007-0337-z. PMID 17922135. S2CID 6440042.
- ^ Singec I, Jandial R, Crain A, Nikkhah G, Snyder EY (2007). "La vanguardia de la terapia con células madre". Annu. Rev. Med . 58 (1): 313–328. doi :10.1146/annurev.med.58.070605.115252. PMID 17100553.
- ^ Fundamentos de las células madre: ¿Cuáles son los usos potenciales de las células madre humanas y los obstáculos que deben superarse antes de que estos usos potenciales se hagan realidad? Archivado el 24 de febrero de 2017 en Wayback Machine . En el sitio web Stem Cell Information World Wide Web. Bethesda, MD: Institutos Nacionales de Salud, Departamento de Salud y Servicios Humanos de los EE. UU., 2009. citado el domingo 26 de abril de 2009
- ^ "Las células madre neuronales podrían salvar la memoria en pacientes con Alzheimer avanzado, según sugiere un estudio en ratones". ScienceDaily .
- ^ Vastag B (abril de 2001). "Las células madre se acercan a la clínica: parálisis parcialmente revertida en ratas con enfermedad similar a la ELA". JAMA . 285 (13): 1691–3. doi :10.1001/jama.285.13.1691. PMID 11277806.
- ^ Rebeiro P, Moore J (2016). "El papel del trasplante autólogo de células madre hematopoyéticas en el tratamiento de trastornos autoinmunes". Intern Med J . 46 (1): 17–28. doi :10.1111/imj.12944. PMID 26524106. S2CID 23127508.
- ^ "Resultados informados a partir de estudios de casos de trasplante de células madre en personas con EM recurrente y progresiva". Sociedad Nacional de Esclerosis Múltiple. Enero de 2015.
- ^ abc Abdallah, Ahmed N.; Shamaa, Ashraf A.; El-Tookhy, Omar S. (agosto de 2019). "Evaluación del tratamiento de un modelo canino inducido experimentalmente de esclerosis múltiple utilizando células madre derivadas de tejido adiposo no expandidas activadas por láser". Investigación en Ciencias Veterinarias . 125 : 71–81. doi :10.1016/j.rvsc.2019.05.016. ISSN 1532-2661. PMID 31152923. S2CID 173188033.
- ^ Petrou, Panayiota; Kassis, Ibrahim; Levin, Netta; Paul, Friedemann; Backner, Yael; Benoliel, Tal; Oertel, Frederike Cosima; Scheel, Michael; Hallimi, Michelle; Yaghmour, Nour; Hur, Tamir Ben (1 de diciembre de 2020). "Efectos beneficiosos del trasplante autólogo de células madre mesenquimales en la esclerosis múltiple progresiva activa". Cerebro . 143 (12): 3574–88. doi : 10.1093/brain/awaa333 . ISSN 0006-8950. PMID 33253391.
- ^ "El próximo ensayo clínico probará una nueva terapia celular para la enfermedad de Parkinson en humanos | Memorial Sloan Kettering Cancer Center". www.mskcc.org . 15 de enero de 2021 . Consultado el 14 de septiembre de 2021 .
- ^ Androutsellis-Theotokis A, Leker RR, Soldner F, et al. (agosto de 2006). "La señalización Notch regula el número de células madre in vitro e in vivo". Nature . 442 (7104): 823–6. Bibcode :2006Natur.442..823A. doi :10.1038/nature04940. PMID 16799564. S2CID 4372065.
- ^ Androutsellis-Theotokis A, Rueger MA, Park DM, et al. (agosto de 2009). "La focalización de los precursores neuronales en el cerebro adulto rescata las neuronas dopaminérgicas lesionadas". Proc. Natl. Sci. USA . 106 (32): 13570–75. Bibcode :2009PNAS..10613570A. doi : 10.1073/pnas.0905125106 . PMC 2714762 . PMID 19628689.
- ^ Androutsellis-Theotokis A, Rueger MA, Mkhikian H, Korb E, McKay RD (2008). "Las vías de señalización que controlan las células madre neuronales ralentizan la progresión de la enfermedad cerebral". Cold Spring Harb. Symp. Quant. Biol . 73 : 403–410. doi : 10.1101/sqb.2008.73.018 . PMID 19022746.
- ^ Kang KS, Kim SW, Oh YH, et al. (2005). "Una paciente de 37 años con lesión de la médula espinal, trasplantada de células madre multipotentes de sangre de colitis ulcerosa humana, con mejor percepción sensorial y movilidad, tanto funcional como morfológicamente: un estudio de caso". Citoterapia . 7 (4): 368–373. doi :10.1080/14653240500238160. PMID 16162459.
- ^ Equipo codirigido por investigadores de la Universidad Chosun , la Universidad Nacional de Seúl y el Banco de Sangre del Cordón Umbilical de Seúl Archivado el 1 de mayo de 2007 en Wayback Machine (SCB) Las células del cordón umbilical "permiten a una mujer paralizada caminar" Por Roger Highfield, editor científico. Última actualización: 1:28 AM GMT 30 de noviembre de 2004
- ^ Cummings BJ, Uchida N, Tamaki SJ, et al. (septiembre de 2005). "Las células madre neurales humanas se diferencian y promueven la recuperación locomotora en ratones con lesión de la médula espinal". Proc. Natl. Sci. USA . 102 (39): 14069–74. Bibcode :2005PNAS..10214069C. doi : 10.1073/pnas.0507063102 . PMC 1216836 . PMID 16172374.
- ^ Tompkins, Bryon A; DiFede, Darcy L; Khan, Aisha; Landín, Ana María; Schulman, Ivonne Hernández; Pujol, Marietsy V; Heldman, Alan W; Miki, Roberto; Goldschmidt-Clermont, Pascal J; Goldstein, Bradley J; Mushtaq, Muzammil; Levis-Dusseau, Silvina; Byrnes, John J; Lowery, Maureen; Natsumeda, Makoto; Delgado, Cindy; Saltzman, Russell; Vidro-Casiano, Mayra; Da Fonseca, Moisaniel; Golpanian, Samuel; Premer, Courtney; Medina, Audrey; Valasaki, Krystalenia; Florea, Victoria; Anderson, Erica; El-Khorazaty, Jill; Mendizábal, Adán; Verde, Geoff; Oliva, Antonio A; Hare, Joshua M (noviembre de 2017). "Las células madre mesenquimales alogénicas mejoran la fragilidad asociada al envejecimiento: un ensayo clínico de fase II, aleatorizado, doble ciego y controlado con placebo". The Journals of Gerontology: Series A . 72 (11): 1513–22. doi :10.1093/gerona/glx137. Número de modelo : PMID 28977399 .
- ^ Ptaszek LM, Mansour M, Ruskin JN, Chien KR (2012). "Hacia una terapia regenerativa para la enfermedad cardíaca". The Lancet . 379 (9819): 933–942. doi :10.1016/s0140-6736(12)60075-0. PMID 22405796. S2CID 37798329.
- ^ Strauer, Bodo; Steinhoff G (septiembre de 2011). "10 años de terapia intracoronaria e intramiocárdica con células madre de la médula ósea del corazón: desde el origen metodológico hasta la práctica clínica". J Am Coll Cardiol . 58 (11): 1095–1104. doi : 10.1016/j.jacc.2011.06.016 . PMID 21884944.
- ^ ab Francis, DP; Mielewczik, M; Zargaran, D; Cole, GD (26 de junio de 2013). "Terapia con células madre autólogas derivadas de la médula ósea en enfermedades cardíacas: discrepancias y contradicciones". Revista Internacional de Cardiología . 168 (4): 3381–3403. doi :10.1016/j.ijcard.2013.04.152. PMID 23830344.
- ^ Schannwell CM, Kostering M, Zeus T, Brehm M, Erdmann G, Fleissner T, Yosef M, Kogler G, Wernet P, Strauer BE (2008). "Humane autologe Stammzelltransplantation zur Myokardregeneration bei dilatativer Kardiomyopathie (NYHA Stadium II bis III)" (PDF) . Revista Austriaca de Cardiología . 15 (1): 23–30.
- ^ Kuswardhani RA; Soejitno A. (2011). "Células madre derivadas de la médula ósea como tratamiento complementario para el infarto agudo de miocardio: una revisión sistemática y un metanálisis". Acta Medica Indonesiana . 43 (3): 168–177. PMID 21979282.
- ^ Malliaras K.; Kreke M.; Marban E. (2011). "El progreso vacilante de la terapia celular para la enfermedad cardíaca". Farmacología clínica y terapéutica . 90 (4): 532–541. doi :10.1038/clpt.2011.175. PMID 21900888. S2CID 28298536.
- ^ Paul A.; Srivastava S.; Chen G.; Shum-Tim D.; Prakash S. (2011). "Evaluación funcional de células madre adiposas para xenotrasplante utilizando modelos inmunocompetentes de infarto de miocardio: comparación con células madre de médula ósea". Bioquímica y biofísica celular . 67 (2): 263–273. doi :10.1007/s12013-011-9323-0. PMID 22205499. S2CID 15826985.
- ^ Vittayawacharin P, Kongtim P, Ciurea SO (diciembre de 2024). "Direcciones futuras en el trasplante de células madre hematopoyéticas haploidénticas". Hematología . 29 (1): 2366718. doi : 10.1080/16078454.2024.2366718 . PMID 38889342.
- ^ D'Souza A, Lee S, Zhu X, Pasquini M (septiembre de 2017). "Uso actual y tendencias en el trasplante de células hematopoyéticas en los Estados Unidos". Biología del trasplante de sangre y médula ósea . 23 (9): 1417–21. doi : 10.1016/j.bbmt.2017.05.035 . PMC 5565685 . PMID 28606646.
- ^ Giarratana MC, Kobari L, Lapillonne H, et al. (enero de 2005). "Generación ex vivo de glóbulos rojos humanos completamente maduros a partir de células madre hematopoyéticas". Nat. Biotechnol . 23 (1): 69–74. doi :10.1038/nbt1047. PMID 15619619. S2CID 21237517.
- ^ Archer, Graeme. «Tecnología». The Daily Telegraph . Londres. Archivado desde el original el 29 de marzo de 2004. Consultado el 24 de mayo de 2010 .
- ^ Anglin, Ian (26 de agosto de 2013). "Los científicos hacen crecer los dientes utilizando células madre". SingularityHUB . Consultado el 31 de julio de 2014 .
- ^ Yen AH, Sharpe PT (enero de 2008). "Células madre e ingeniería de tejidos dentales". Cell Tissue Res . 331 (1): 359–372. doi :10.1007/s00441-007-0467-6. PMID 17938970. S2CID 23765276.
- ^ Volponi AA, Pang Y, Sharpe PT (diciembre de 2010). "Reparación y regeneración biológica de dientes basada en células madre". Tendencias en biología celular . 20 (12): 715–722. doi :10.1016/j.tcb.2010.09.012. PMC 3000521. PMID 21035344 .
- ^ "La terapia genética es la primera 'cura' de la sordera - salud - 14 de febrero de 2005 - New Scientist".
- ^ Nacher-Soler, German; Garrido, Jose; Rodriguez-Serrano, Fernando (2019). "Regeneración auditiva y medicina regenerativa: enfoques presentes y futuros". Archivos de la Ciencia Médica . 15 (4): 957–967. doi :10.5114/aoms.2019.86062. PMC 6657260 . PMID 31360190.
- ^ Tejido fetal recupera la visión perdida MedicalNewsToday. 28 de octubre de 2004
- ^ "Se utilizan células madre para recuperar la visión". 28 de abril de 2005, vía news.bbc.co.uk.
- ^ Goldstein, Ron (2007). La investigación con células madre embrionarias es necesaria para encontrar una cura para la diabetes . Greenhaven Press. pág. 44.
- ^ Saki N, Jalalifar MA, Soleimani M, Hajizamani S, Rahim F (2013). "Efecto adverso de la alta concentración de glucosa en la terapia con células madre". Int J Hematol Oncol Stem Cell Res . 7 (3): 34–40. PMC 3913149 . PMID 24505533.
- ^ ab Berebichez-Fridman, R.; Gómez-García, R.; Granados-Montiel, J.; Berebichez-Fastlicht, E.; Olivos-Meza, A.; Granados, J.; Velasquillo, C.; Ibarra, C. (2017). "El Santo Grial de la cirugía ortopédica: células madre mesenquimales: sus usos actuales y aplicaciones potenciales". Células Madre Internacional . 2017 : 1-14. doi : 10.1155/2017/2638305 . PMC 5494105 . PMID 28698718.
- ^ abc Gurtner GC, Callaghan MJ, Longaker MT (2007). "Progreso y potencial para la medicina regenerativa". Annu. Rev. Med . 58 (1): 299–312. doi :10.1146/annurev.med.58.082405.095329. PMID 17076602.
- ^ Rognoni, Emanuel; Watt, Fiona M. (2018). "Heterogeneidad de las células de la piel en el desarrollo, la cicatrización de heridas y el cáncer". Tendencias en biología celular . 28 (9): 709–722. doi :10.1016/j.tcb.2018.05.002. ISSN 0962-8924. PMC 6098245 . PMID 29807713.
- ^ DiGiusto, David; Stan, Rodica; Krishnan, Amrita; Li, Haitang; Rossi, John; Zaia, John (22 de noviembre de 2013). "Desarrollo de terapia génica basada en células madre hematopoyéticas para la infección por VIH-1: consideraciones para estudios de prueba de concepto y traducción a la práctica médica estándar". Viruses . 2013 (5): 2898–2919. doi : 10.3390/v5112898 . PMC 3856421 . PMID 24284880.
- ^ Berndt, Christina (4 de julio de 2013). «Un campo minado de contradicciones». Sueddeutsche.de . Suddeutsche Zeitung . Consultado el 6 de julio de 2013 .
- ^ Nowbar, Alexandra N.; Mielewczik, Michael; Karavassilis, Maria; Dehbi, Hakim-Moulay; Shun-Shin, Matthew J.; Jones, Siana; Howard, James P.; Cole, Graham D.; Francis, Darrel P. (28 de abril de 2014). "Discrepancias en ensayos con células madre de médula ósea autóloga y mejora de la fracción de eyección (DAMASCENE): regresión ponderada y metanálisis". BMJ . 348 : g2688. doi :10.1136/bmj.g2688. ISSN 1756-1833. PMC 4002982 . PMID 24778175.
- ^ Gyöngyösi, Mariann; Wojakowski, Wojciech; Lemarchand, Patricia; Lunde, Ketil; Tendera, Michal; Bartunek, Józef; Marbán, Eduardo; Assmus, Birgit; Henry, Timoteo D.; Traverse, Jay H.; Moyé, Lemuel A.; Surder, Daniel; Corti, Roberto; Huikuri, Heikki; Miettinen, Johanna; Wöhrle, Jochen; Obradovic, Slobodan; Roncalli, Jérome; Malliaras, Konstantinos; Pokushalov, Evgeny; Romanov, Alejandro; Kastrup, Jens; Bergmann, Martín W.; Atsma, Douwe E.; Diederichsen, Axel; Edes, István; Benedek, Imre; Benedek, Teodora; Pejkov, Hristo; Nyolczas, Noemí; Pavo, Noemí; Bergler-Klein, Jutta; Pavo, Imre J.; Sylven, Christer; Berti, Sergio; Navarese, Eliano P.; Maurer, Gerald (10 de abril de 2015). "Metaanálisis de estudios cardíacos basados en células (ACCRUE) en pacientes Con infarto agudo de miocardio basado en datos de pacientes individuales: novedad y significación". Circulation Research . 116 (8): 1346–60. doi :10.1161/CIRCRESAHA.116.304346. ISSN 0009-7330. PMC 4509791 . PMID 25700037.
- ^ Traverse, Jay H.; Henry, Timothy D.; Pepine, Carl J.; Willerson, James T.; Chugh, Atul; Yang, Phillip C.; Zhao, David XM; Ellis, Stephen G.; Forder, John R.; Perin, Emerson C.; Penn, Marc S.; Hatzopoulos, Antonis K.; Chambers, Jeffrey C.; Baran, Kenneth W.; Raveendran, Ganesh; Gee, Adrian P.; Taylor, Doris A.; Moyé, Lem; Ebert, Ray F.; Simari, Robert D. (2 de febrero de 2018). "Ensayo TIME: efecto del momento de administración de células madre después de un infarto de miocardio con elevación del segmento ST en la recuperación de la función ventricular izquierda global y regional: novedad y significado". Circulation Research . 122 (3): 479–488. doi :10.1161/CIRCRESAHA.117.311466. PMC 5805626. PMID 29208679 .
- ^ Wollert, Kai C; Meyer, Gerd P; Müller-Ehmsen, Jochen; Tschöpe, Carsten; Bonarjee, Vernon; Larsen, Alf Inge; mayo, Andreas E; Empen, Klaus; Chorianopoulos, Emmanuel; Tebbe, Ulrico; Waltenberger, Johannes; Mahrholdt, Heiko; Ritter, Benedicta; Pirr, Jens; Fischer, Dieter; Korf-Klingebiel, Mortimer; Arseniev, Lubomir; Heuft, Hans-Gert; Brinchmann, Jan E; Messinger, Diethelm; Hertenstein, Bernd; Ganser, Arnold; Katus, Hugo A; Félix, Stephan B; Gawaz, Meinrad P; Dickstein, Kenneth; Schultheiss, Heinz-Peter; Ladage, Dennis; Greulich, Simón; Bauersachs, Johann (14 de octubre de 2017). "Transferencia intracoronaria de células de médula ósea autólogas después de un infarto de miocardio: ensayo clínico aleatorizado y controlado con placebo BOOST-2". Revista Europea del Corazón . 38 (39): 2936–43. doi : 10.1093/eurheartj/ehx188 . PMID 28431003.
- ^ Bartunek, Jozef; Wojakowski, Wojtek (14 de octubre de 2017). "Transferencia intracoronaria de células de médula ósea autólogas después de un infarto agudo de miocardio: interrupción y reorientación". European Heart Journal . 38 (39): 2944–7. doi : 10.1093/eurheartj/ehx300 . PMID 28637251.
- ^ Gyöngyösi, Mariann; Lukovic, Dominika; Zlabinger, Katrin; Mandic, Ljubica; Winkler, Johannes; Gugerell, Alfred (1 de enero de 2017). "Terapia regenerativa basada en células madre cardíacas para el corazón con lesión isquémica: una breve actualización de 2017". Revista de emergencias cardiovasculares . 3 (2): 81–83. doi : 10.1515/jce-2017-0009 . ISSN 2457-5518.
- ^ Hartnett, Kathleen P.; Powell, Krista M.; Rankin, Danielle; Gable, Paige; Kim, Janice J.; Spoto, Samantha; Breaker, Erin; Hunter, Robert; Dotson, Nychie; McAllister, Gillian; Stevens, Valerie; Halpin, Alison Laufer; Houston, Hollis; Epson, Erin; Malarkey, Mary (1 de octubre de 2021). "Investigación de infecciones bacterianas entre pacientes tratados con productos derivados de la sangre del cordón umbilical comercializados como terapias con células madre". JAMA Network Open . 4 (10): e2128615. doi :10.1001/jamanetworkopen.2021.28615. ISSN 2574-3805. PMC 8498849 . PMID 34618037.
- ^ Wolf, Andrew B.; Money, Kelli M.; Chandnani, Arun; Daley, Charles L.; Griffith, David E.; Chauhan, Lakshmi; Coffman, Nathan; Piquet, Amanda L.; Tyler, Kenneth L.; Zimmer, Shanta M.; Montague, Brian T.; Mann, Sarah; Pastula, Daniel M. (2023). "Meningitis por Mycobacterium abscessus asociada al tratamiento con células madre durante el turismo médico". Enfermedades infecciosas emergentes . 29 (8): 1655–8. doi :10.3201/eid2908.230317. PMC 10370854 . PMID 37486227.
- ^ Chen J, Li Y, Wang L, et al. (abril de 2001). "Beneficio terapéutico de la administración intravenosa de células estromales de la médula ósea después de la isquemia cerebral en ratas". Stroke . 32 (4): 1005–11. doi : 10.1161/01.STR.32.4.1005 . PMID 11283404.
- ^ Assmus B, Schächinger V, Teupe C, et al. (diciembre de 2002). "Trasplante de células progenitoras y mejora de la regeneración en el infarto agudo de miocardio (TOPCARE-AMI)". Circulation . 106 (24): 3009–17. doi : 10.1161/01.CIR.0000043246.74879.CD . PMID 12473544.
- ^ Murphy JM, Fink DJ, Hunziker EB, Barry FP (diciembre de 2003). "Terapia con células madre en un modelo caprino de osteoartritis". Arthritis Rheum . 48 (12): 3464–74. doi :10.1002/art.11365. PMID 14673997.
- ^ Sampaolesi M, Blot S, D'Antona G, et al. (noviembre de 2006). "Las células madre mesoangioblastos mejoran la función muscular en perros distróficos". Nature . 444 (7119): 574–9. Bibcode :2006Natur.444..574S. doi :10.1038/nature05282. PMID 17108972. S2CID 62808421.
- ^ Taylor SE, Smith RK, Clegg PD (marzo de 2007). "Terapia con células madre mesenquimales en enfermedades musculoesqueléticas equinas: ¿hecho científico o ficción clínica?". Equine Vet. J. 39 ( 2): 172–180. doi :10.2746/042516407X180868. PMID 17378447.
- ^ Tecirlioglu RT, Trounson AO (2007). "Células madre embrionarias en animales de compañía (caballos, perros y gatos): estado actual y perspectivas futuras". Reprod. Fertil. Dev . 19 (6): 740–7. doi :10.1071/RD07039. PMID 17714628.
- ^ Koch TG, Betts DH (noviembre de 2007). "Terapia con células madre para problemas articulares utilizando al caballo como modelo animal clínicamente relevante". Expert Opin Biol Ther . 7 (11): 1621–26. doi :10.1517/14712598.7.11.1621. PMID 17961087. S2CID 1659087.
- ^ Young RG, Butler DL, Weber W, Caplan AI, Gordon SL, Fink DJ (julio de 1998). "Uso de células madre mesenquimales en una matriz de colágeno para la reparación del tendón de Aquiles". J. Orthop. Res . 16 (4): 406–413. doi : 10.1002/jor.1100160403 . PMID 9747780.
- ^ Bruder SP, Kraus KH, Goldberg VM, Kadiyala S (julio de 1998). "El efecto de los implantes cargados con células madre mesenquimales autólogas en la curación de defectos óseos segmentarios caninos". J Bone Joint Surg Am . 80 (7): 985–996. doi :10.2106/00004623-199807000-00007. PMID 9698003. S2CID 13375368. Archivado desde el original el 28 de julio de 2012.
- ^ Kraus KH, Kirker-Head C (abril de 2006). "Células madre mesenquimales y regeneración ósea". Vet Surg . 35 (3): 232–242. doi :10.1111/j.1532-950X.2006.00142.x. PMID 16635002.
- ^ abc Ribitsch I, Burk J, Delling U, Geißler C, Gittel C, Jülke H, Brehm W (2010). "Ciencia básica y aplicación clínica de células madre en medicina veterinaria". Sistemas de biorreactores para ingeniería de tejidos II . Avances en ingeniería bioquímica/biotecnología. Vol. 123. págs. 219–263. Bibcode :2010bste.book..219R. doi :10.1007/10_2010_66. ISBN 978-3-642-16050-9. Número de identificación personal 20309674.
- ^ Black LL, Gaynor J, Adams C, et al. (2008). "Efecto de la inyección intraarticular de células madre y regenerativas mesenquimales derivadas de tejido adiposo autólogo sobre los signos clínicos de la osteoartritis crónica de la articulación del codo en perros". Vet. Ther . 9 (3): 192–200. PMID 19003780.
- ^ Nixon AJ, Dahlgren LA, Haupt JL, Yeager AE, Ward DL (julio de 2008). "Efecto de las fracciones de células nucleadas derivadas del tejido adiposo en la reparación de tendones en caballos con tendinitis inducida por colagenasa". Am. J. Vet. Res . 69 (7): 928–937. doi : 10.2460/ajvr.69.7.928 . PMID 18593247. S2CID 21525473.
- ^ Guercio A, Di Marco P, Casella S, Cannella V, Russotto L, Purpari G, Di Bella S, Piccione G (2012). "Producción de células madre mesenquimales caninas a partir de tejido adiposo y su aplicación en perros con osteoartritis crónica de las articulaciones humeroradiales". Cell Biol. Int . 36 (2): 189–194. doi :10.1042/CBI20110304. PMID 21936851. S2CID 45596678.
- ^ Kim U, Shin DG, Park JS, Kim YJ, Park SI, Moon YM, Jeong KS (2011). "Alojamiento de células madre derivadas de tejido adiposo en aurículas caninas extirpadas con catéter de radiofrecuencia y diferenciación en células similares a cardiomiocitos". Int. J. Cardiol . 146 (3): 371–8. doi :10.1016/j.ijcard.2009.07.016. PMID 19683815.
- ^ Chang Y, Lai PH, Wei HJ, Lin WW, Chen CH, Hwang SM, Chen SC, Sung HW (2007). "Regeneración tisular observada en un pericardio bovino acelular poroso cargado con factor de crecimiento de fibroblastos básico poblado con células madre mesenquimales". Revista de Cirugía Torácica y Cardiovascular . 134 (1): 65–73.e4. doi : 10.1016/j.jtcvs.2007.02.019 . ISSN 0022-5223. PMID 17599488.
- ^ Masa, Marc. "Nanopartículas multimodales para el seguimiento estructural y funcional de la terapia con células madre en la regeneración muscular". n-Track . Consultado el 22 de agosto de 2018 .
- ^ Sung Su Park; et al. (2012). "Recuperación funcional después de una lesión de la médula espinal en perros tratados con una combinación de Matrigel y células madre mesenquimales derivadas de tejido adiposo inducidas neuralmente". Citoterapia . 14 (5): 584–597. doi :10.3109/14653249.2012.658913. PMID 22348702.
- ^ Ryu HH, Lim JH, Byeon YE, Park JR, Seo MS, Lee YW, Kim WH, Kang KS, Kweon OK (2009). "Recuperación funcional y diferenciación neuronal después del trasplante de células madre alogénicas derivadas de tejido adiposo en un modelo canino de lesión aguda de la médula espinal". J. Vet. Sci . 10 (4): 273–284. doi :10.4142/jvs.2009.10.4.273. PMC 2807262. PMID 19934591 .
- ^ Nishida H, Nakayama M, Tanaka H, Kitamura M, Hatoya S, Sugiura K, Harada Y, Suzuki Y, Ide C, Inaba T (2012). "Seguridad del trasplante autólogo de células estromales de médula ósea en perros con lesión aguda de la médula espinal". Cirugía veterinaria . 41 (4): 437–442. doi :10.1111/j.1532-950X.2011.00959.x. ISSN 0161-3499. PMID 22548465.
- ^ I. Dobrinski; AJ Travis (2007). "Trasplante de células germinales para la propagación de animales de compañía, especies no domésticas y en peligro de extinción". Reproducción, fertilidad y desarrollo . 19 (6): 732–9. doi :10.1071/RD07036. PMID 17714627.
- ^ Enserink, M (14 de julio de 2006). "Biomedicina. Vendiendo el sueño de las células madre". Science . 313 (5784): 160–3. doi :10.1126/science.313.5784.160. PMID 16840673. S2CID 56728772.

- ^ ab Sipp, D (2017). "El nicho maligno: espacios seguros para el marketing de células madre tóxicas". npj Regenerative Medicine . 2 : 33. doi :10.1038/s41536-017-0036-x. PMC 5736713 . PMID 29302366.
- ^ ab Slabbert, Melodie (21 de agosto de 2015). "La lucha de Sudáfrica por controlar los tratamientos simulados con células madre". The Conversation .
- ^ Turner, Leigh; Knoepfler, Paul (agosto de 2016). "Venta de células madre en los EE. UU.: evaluación de la industria de venta directa al consumidor". Cell Stem Cell . 19 (2): 154–7. doi : 10.1016/j.stem.2016.06.007 . ISSN 1934-5909. PMID 27374789.
- ^ "La FDA presiona con su campaña contra los actores deshonestos de la medicina regenerativa y cita a StemGenex por ventas ilegales". Endpoints News . 14 de noviembre de 2018.
- ^ Rodeo SA (2024). "Comercialización de terapias de medicina regenerativa no probadas ni aprobadas". Salud deportiva . 16 (3): 312–4. doi : 10.1177/19417381241243380 . PMID 38629755.
- ^ Knoepfler, Paul (16 de junio de 2020). "¿Cuánto cuesta la terapia con células madre en 2021?". The Niche . Consultado el 23 de febrero de 2021 .
- ^ Snyder, Jeremy; Turner, Leigh; Crooks, Valorie A. (8 de mayo de 2018). "Financiación colectiva para intervenciones basadas en células madre no probadas". JAMA . 319 (18): 1935–6. doi : 10.1001/jama.2018.3057 . ISSN 0098-7484. PMC 6583473 . PMID 29801003.
- ^ Colleen Tressler (18 de octubre de 2018). «FTC ataca las afirmaciones engañosas sobre terapias con células madre». Comisión Federal de Comercio de Estados Unidos . Consultado el 7 de marzo de 2019 .
- ^ Comisionado, Oficina del (24 de marzo de 2020). "La FDA busca medidas cautelares permanentes contra dos clínicas de células madre". FDA . Consultado el 9 de febrero de 2021 .
- ^ "Células madre mesenquimales". Pautas para el tratamiento de la COVID-19 . Consultado el 10 de febrero de 2021 .
- ^ Comisionado, Oficina del (9 de septiembre de 2020). "Potential Risks of Treatment with No Approved Regenerative Medicine Products" (Riesgos potenciales del tratamiento con productos de medicina regenerativa no aprobados). FDA .
- ^ "Clínica promueve tratamiento con células madre inhaladas, entregado a domicilio". www.medpagetoday.com . 14 de mayo de 2020 . Consultado el 10 de febrero de 2021 .
- ^ Knoepfler, Paul (17 de mayo de 2020). "Histórica tormenta primaveral de cartas de la FDA a la industria de las clínicas de células madre". The Niche . Consultado el 10 de febrero de 2021 .
- ^ Schrotenboer, Brent. "Las empresas de células madre venden esperanza con medicamentos no probados para la COVID-19". USA Today . Consultado el 10 de febrero de 2021 .
- ^ Comisión Federal de Comercio (FTC). "Advertencia de la FTC" (PDF) .
- ^ Terapia global con células madre en el extranjero. «Terapia global con células madre en el extranjero» . Consultado el 6 de agosto de 2024 .

