Atrofia muscular
| Atrofia muscular | |
|---|---|
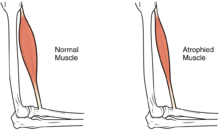 | |
| El tamaño del músculo se reduce, como consecuencia hay una pérdida de fuerza y movilidad. | |
| Especialidad | Medicina física y rehabilitación |
La atrofia muscular es la pérdida de masa muscular esquelética . Puede ser causada por inmovilidad , envejecimiento, desnutrición , medicamentos o una amplia gama de lesiones o enfermedades que afectan el sistema musculoesquelético o nervioso . La atrofia muscular conduce a debilidad muscular y causa discapacidad.
El desuso causa una rápida atrofia muscular y a menudo ocurre durante una lesión o enfermedad que requiere la inmovilización de una extremidad o reposo en cama. Dependiendo de la duración del desuso y de la salud del individuo, esto puede revertirse completamente con la actividad. La desnutrición primero causa pérdida de grasa, pero puede progresar a atrofia muscular en la inanición prolongada y puede revertirse con terapia nutricional. Por el contrario, la caquexia es un síndrome de desgaste causado por una enfermedad subyacente como el cáncer que causa una atrofia muscular dramática y no puede revertirse por completo con terapia nutricional. La sarcopenia es una atrofia muscular relacionada con la edad y puede ralentizarse con el ejercicio. Finalmente, las enfermedades de los músculos como la distrofia muscular o las miopatías pueden causar atrofia, así como daño al sistema nervioso como en la lesión de la médula espinal o el accidente cerebrovascular . Por lo tanto, la atrofia muscular suele ser un hallazgo ( signo o síntoma ) en una enfermedad en lugar de ser una enfermedad en sí misma. Sin embargo, algunos síndromes de atrofia muscular se clasifican como espectros de enfermedades o entidades patológicas en lugar de como síndromes clínicos solos, como las diversas atrofias musculares espinales .
La atrofia muscular es el resultado de un desequilibrio entre la síntesis y la degradación de proteínas, aunque los mecanismos no se comprenden del todo y varían según la causa. La pérdida muscular se puede cuantificar con estudios de imagen avanzados, pero no se suele intentar. El tratamiento depende de la causa subyacente, pero suele incluir ejercicio y una nutrición adecuada. Los agentes anabólicos pueden tener cierta eficacia, pero no se suelen utilizar debido a sus efectos secundarios. Hay múltiples tratamientos y suplementos en investigación, pero actualmente hay opciones de tratamiento limitadas en la práctica clínica. Dadas las implicaciones de la atrofia muscular y las limitadas opciones de tratamiento, minimizar la inmovilidad es fundamental en caso de lesión o enfermedad.
Signos y síntomas
El signo distintivo de la atrofia muscular es la pérdida de masa muscular magra. Este cambio puede ser difícil de detectar debido a la obesidad, los cambios en la masa grasa o el edema. Los cambios en el peso, la circunferencia de las extremidades o la cintura no son indicadores fiables de los cambios en la masa muscular. [1]
El síntoma predominante es una mayor debilidad que puede provocar dificultad o incapacidad para realizar tareas físicas según los músculos afectados. La atrofia de los músculos centrales o de las piernas puede provocar dificultad para ponerse de pie desde una posición sentada, caminar o subir escaleras y puede provocar un aumento de las caídas. La atrofia de los músculos de la garganta puede provocar dificultad para tragar y la atrofia del diafragma puede provocar dificultad para respirar. La atrofia muscular puede ser asintomática y puede pasar desapercibida hasta que se pierda una cantidad significativa de músculo. [2]
Causas

El músculo esquelético sirve como un sitio de almacenamiento de aminoácidos , creatina , mioglobina y trifosfato de adenosina , que se pueden utilizar para la producción de energía cuando las demandas son altas o los suministros son bajos. Si las demandas metabólicas siguen siendo mayores que la síntesis de proteínas, se pierde masa muscular. [3] Muchas enfermedades y afecciones pueden conducir a este desequilibrio, ya sea a través de la enfermedad en sí o cambios en el apetito asociados a la enfermedad, como la pérdida del gusto debido a Covid-19 . Las causas de la atrofia muscular incluyen inmovilidad, envejecimiento, desnutrición , ciertas enfermedades sistémicas ( cáncer , insuficiencia cardíaca congestiva ; enfermedad pulmonar obstructiva crónica ; SIDA , enfermedad hepática , etc.), desinervación, enfermedad muscular intrínseca o medicamentos (como glucocorticoides ). [4]
Inmovilidad
El desuso es una causa común de atrofia muscular y puede ser local (debido a una lesión o a un yeso) o general (reposo en cama). La tasa de atrofia muscular por desuso (10 a 42 días) es de aproximadamente el 0,5 al 0,6 % de la masa muscular total por día, aunque existe una variación considerable entre las personas. [5] Los ancianos son los más vulnerables a la pérdida muscular dramática con la inmovilidad. Gran parte de la investigación establecida ha investigado el desuso prolongado (>10 días), en el que el músculo se ve comprometido principalmente por disminuciones en las tasas de síntesis de proteínas musculares en lugar de cambios en la degradación de proteínas musculares. Hay evidencia que sugiere que puede haber una degradación de proteínas más activa durante la inmovilidad de corto plazo (<10 días). [5]
Caquexia
Ciertas enfermedades pueden causar un síndrome complejo de desgaste muscular conocido como caquexia . Se observa comúnmente en el cáncer, la insuficiencia cardíaca congestiva , la enfermedad pulmonar obstructiva crónica , la enfermedad renal crónica y el SIDA , aunque se asocia con muchos procesos patológicos, generalmente con un componente inflamatorio significativo. La caquexia causa una pérdida muscular continua que no se revierte por completo con terapia nutricional. [6] La fisiopatología no se entiende completamente, pero se considera que las citocinas inflamatorias desempeñan un papel central. A diferencia de la pérdida de peso por ingesta calórica inadecuada, la caquexia causa predominantemente pérdida muscular en lugar de pérdida de grasa y no responde tanto a la intervención nutricional. La caquexia puede comprometer significativamente la calidad de vida y el estado funcional y se asocia con malos resultados. [7] [8]
Sarcopenia
La sarcopenia es la pérdida degenerativa de masa, calidad y fuerza del músculo esquelético asociada con el envejecimiento. Esto implica atrofia muscular, reducción en el número de fibras musculares y un cambio hacia fibras musculares esqueléticas de "contracción lenta" o tipo I en lugar de fibras de "contracción rápida" o tipo II . [3] La tasa de pérdida muscular depende del nivel de ejercicio, las comorbilidades, la nutrición y otros factores. Hay muchos mecanismos propuestos de sarcopenia, como una capacidad reducida para la fosforilación oxidativa, senescencia celular o una señalización alterada de las vías que regulan la síntesis de proteínas, [9] y se considera que es el resultado de cambios en las vías de señalización de la síntesis muscular y un fallo gradual en las células satélite que ayudan a regenerar las fibras musculares esqueléticas, específicamente en las miofibras de "contracción rápida". [10]
La sarcopenia puede provocar una reducción del estado funcional y causar una discapacidad significativa, pero es una afección distinta de la caquexia , aunque pueden coexistir. [8] [11] En 2016, se publicó un código CIE para la sarcopenia, lo que contribuyó a su aceptación como entidad patológica. [12]
Enfermedades musculares intrínsecas


Las enfermedades musculares, como la distrofia muscular , la esclerosis lateral amiotrófica (ELA) o la miositis , como la miositis por cuerpos de inclusión, pueden causar atrofia muscular. [13]
Daños al sistema nervioso central
El daño a las neuronas del cerebro o la médula espinal puede causar una atrofia muscular importante. Puede tratarse de una atrofia muscular localizada y debilidad o parálisis, como en el caso de un accidente cerebrovascular o una lesión de la médula espinal . [14] Un daño más generalizado, como en el caso de una lesión cerebral traumática o una parálisis cerebral, puede causar una atrofia muscular generalizada. [15]
Daños al sistema nervioso periférico
Las lesiones o enfermedades de los nervios periféricos que irrigan músculos específicos también pueden causar atrofia muscular. Esto se observa en lesiones nerviosas debidas a traumatismos o complicaciones quirúrgicas, atrapamiento de nervios o enfermedades hereditarias como la enfermedad de Charcot-Marie-Tooth . [16]
Medicamentos
Se sabe que algunos medicamentos causan atrofia muscular, generalmente debido a un efecto directo sobre los músculos. Esto incluye los glucocorticoides que causan miopatía por glucocorticoides [4] o medicamentos tóxicos para los músculos como la doxorrubicina [17] .
Endocrinopatías
Se sabe que los trastornos del sistema endocrino, como la enfermedad de Cushing o el hipotiroidismo , causan atrofia muscular. [18]
Fisiopatología
La atrofia muscular se produce debido a un desequilibrio entre el equilibrio normal entre la síntesis y la degradación de proteínas. Esto implica una señalización celular compleja que no se comprende del todo y es probable que la atrofia muscular sea el resultado de múltiples mecanismos contribuyentes. [19]
La función mitocondrial es crucial para la salud del músculo esquelético y los cambios perjudiciales a nivel de las mitocondrias pueden contribuir a la atrofia muscular. [20] Una disminución en la densidad y calidad mitocondrial se observa constantemente en la atrofia muscular debido al desuso. [20]
La vía ubiquitina / proteasoma dependiente de ATP es un mecanismo por el cual las proteínas se degradan en el músculo. Esto implica que proteínas específicas sean marcadas para su destrucción por un pequeño péptido llamado ubiquitina , que permite que el proteasoma las reconozca para degradar la proteína. [21]
Diagnóstico
La detección de la atrofia muscular está limitada por la falta de criterios diagnósticos establecidos, aunque se han propuesto muchos. Se pueden utilizar criterios diagnósticos para otras afecciones, como la sarcopenia o la caquexia . [3] Estos síndromes también se pueden identificar con cuestionarios de detección. [ cita requerida ]
La masa muscular y sus cambios se pueden cuantificar mediante estudios de imagen como tomografías computarizadas o resonancias magnéticas . Se pueden utilizar biomarcadores como la urea en orina para estimar aproximadamente la pérdida muscular en circunstancias de pérdida muscular rápida. [22] Actualmente se están investigando otros biomarcadores, pero no se utilizan en la práctica clínica. [3]
Tratamiento
La atrofia muscular se puede retrasar, prevenir y, en ocasiones, revertir con tratamiento. Los enfoques terapéuticos incluyen influir en las vías de señalización que inducen la hipertrofia muscular o ralentizan la degradación muscular, así como optimizar el estado nutricional. [ cita requerida ]
La actividad física proporciona un estímulo muscular anabólico significativo y es un componente crucial para frenar o revertir la atrofia muscular. [3] Aún se desconoce cuál es la "dosis" ideal de ejercicio. Se ha demostrado que el ejercicio de resistencia es beneficioso para reducir la atrofia muscular en adultos mayores. [23] [24] En pacientes que no pueden hacer ejercicio debido a limitaciones físicas como la paraplejia, se puede utilizar la estimulación eléctrica funcional para estimular externamente los músculos. [25]
Las calorías y proteínas adecuadas son cruciales para prevenir la atrofia muscular. Las necesidades de proteínas pueden variar drásticamente dependiendo de los factores metabólicos y el estado de la enfermedad, por lo que la suplementación alta en proteínas puede ser beneficiosa. [3] La suplementación de proteínas o aminoácidos de cadena ramificada , especialmente leucina, puede proporcionar un estímulo para la síntesis muscular e inhibir la degradación de proteínas y se ha estudiado para la atrofia muscular por sarcopenia y caquexia. [3] [26] El β-hidroxi β-metilbutirato (HMB), un metabolito de la leucina que se vende como suplemento dietético , ha demostrado eficacia para prevenir la pérdida de masa muscular en varias condiciones de desgaste muscular en humanos, particularmente sarcopenia . [26] [27] [28] Con base en un metaanálisis de siete ensayos controlados aleatorios que se publicó en 2015, la suplementación con HMB tiene eficacia como tratamiento para preservar la masa muscular magra en adultos mayores. [29] Se necesita más investigación para determinar los efectos precisos del HMB sobre la fuerza y la función muscular en diversas poblaciones. [29]
En casos graves de atrofia muscular, se puede administrar a los pacientes un esteroide anabólico como la metandrostenolona como posible tratamiento, aunque su uso está limitado por los efectos secundarios. Se está investigando una nueva clase de fármacos, llamados moduladores selectivos del receptor de andrógenos , con resultados prometedores. Tendrían menos efectos secundarios , al tiempo que seguirían promoviendo el crecimiento y la regeneración del tejido muscular y óseo. Estos efectos aún deben confirmarse en ensayos clínicos más amplios. [30]
Resultados
Los resultados de la atrofia muscular dependen de la causa subyacente y de la salud del paciente. La inmovilidad o el reposo en cama en poblaciones predispuestas a la atrofia muscular, como los ancianos o aquellos con enfermedades que comúnmente causan caquexia , pueden causar una atrofia muscular dramática e impactar en los resultados funcionales. En los ancianos, esto a menudo conduce a una disminución de la reserva biológica y una mayor vulnerabilidad a los factores estresantes conocidos como el " síndrome de fragilidad ". [3] La pérdida de masa corporal magra también se asocia con un mayor riesgo de infección, disminución de la inmunidad y mala cicatrización de las heridas. La debilidad que acompaña a la atrofia muscular conduce a un mayor riesgo de caídas, fracturas, discapacidad física, necesidad de atención institucional, reducción de la calidad de vida, aumento de la mortalidad y aumento de los costos de atención médica. [3]
Otros animales
La inactividad y la inanición en los mamíferos provocan atrofia del músculo esquelético, acompañada de una menor cantidad y tamaño de las células musculares, así como de un menor contenido proteico. [31] En los seres humanos, se sabe que los períodos prolongados de inmovilización, como en los casos de reposo en cama o de astronautas que vuelan en el espacio, provocan debilitamiento y atrofia muscular. Estas consecuencias también se observan en pequeños mamíferos que hibernan, como las ardillas terrestres de manto dorado y los murciélagos pardos. [32]
Los osos son una excepción a esta regla; las especies de la familia Ursidae son famosas por su capacidad de sobrevivir a condiciones ambientales desfavorables de bajas temperaturas y disponibilidad limitada de nutrición durante el invierno mediante la hibernación . Durante ese tiempo, los osos pasan por una serie de cambios fisiológicos, morfológicos y de comportamiento. [33] Su capacidad para mantener la cantidad y el tamaño de los músculos esqueléticos durante el desuso es de gran importancia. [ cita requerida ]
Durante la hibernación, los osos pasan de 4 a 7 meses de inactividad y anorexia sin sufrir atrofia muscular ni pérdida de proteínas. [32] Algunos factores conocidos contribuyen al mantenimiento del tejido muscular. Durante el verano, los osos aprovechan la disponibilidad de nutrientes y acumulan proteínas musculares. El equilibrio proteico en el momento de la latencia también se mantiene gracias a los niveles más bajos de degradación de proteínas durante el invierno. [32] En épocas de inmovilidad, el desgaste muscular en los osos también se suprime mediante un inhibidor proteolítico que se libera en la circulación. [31] Otro factor que contribuye al mantenimiento de la fuerza muscular en los osos que hibernan es la aparición de contracciones voluntarias periódicas y contracciones involuntarias por temblores durante el letargo . [34] Los tres o cuatro episodios diarios de actividad muscular son responsables del mantenimiento de la fuerza muscular y la capacidad de respuesta en los osos durante la hibernación. [34]
Modelos preclínicos
La atrofia muscular puede inducirse en modelos preclínicos (por ejemplo, ratones) para estudiar los efectos de intervenciones terapéuticas contra la atrofia muscular. La restricción de la dieta, es decir, la restricción calórica, conduce a una pérdida significativa de masa muscular en dos semanas, y la pérdida de masa muscular puede ser rescatada por una intervención nutricional. [35] La inmovilización de una de las patas traseras de los ratones también conduce a la atrofia muscular, y se caracteriza por la pérdida tanto de masa muscular como de fuerza. La restricción de alimentos y la inmovilización pueden usarse en modelos de ratones y se ha demostrado que se superponen con los mecanismos asociados a la sarcopenia en humanos. [36]
Véase también
Referencias
- ^ Dev R (enero de 2019). "Medición de los criterios diagnósticos de la caquexia". Annals of Palliative Medicine . 8 (1): 24–32. doi : 10.21037/apm.2018.08.07 . PMID 30525765.
- ^ Cretoiu SM, Zugravu CA (2018). "Consideraciones nutricionales para prevenir la atrofia muscular". En Xiao J (ed.). Atrofia muscular . Avances en medicina experimental y biología. Vol. 1088. Springer Singapur. págs. 497–528. doi :10.1007/978-981-13-1435-3_23. ISBN . 9789811314346. Número de identificación personal 30390267.
- ^ abcdefghi Argilés JM, Campos N, López-Pedrosa JM, Rueda R, Rodríguez-Mañas L (septiembre de 2016). "El músculo esquelético regula el metabolismo a través de la interferencia entre órganos: funciones en la salud y la enfermedad". Revista de la Asociación Estadounidense de Directores Médicos . 17 (9): 789–96. doi : 10.1016/j.jamda.2016.04.019 . PMID 27324808.
- ^ ab Seene T (julio de 1994). "Recambio de proteínas contráctiles del músculo esquelético en la miopatía por glucocorticoides". The Journal of Steroid Biochemistry and Molecular Biology . 50 (1–2): 1–4. doi :10.1016/0960-0760(94)90165-1. PMID 8049126. S2CID 27814895.
- ^ ab Wall BT, Dirks ML, van Loon LJ (septiembre de 2013). "Atrofia del músculo esquelético durante el desuso a corto plazo: implicaciones para la sarcopenia relacionada con la edad". Ageing Research Reviews . 12 (4): 898–906. doi :10.1016/j.arr.2013.07.003. PMID 23948422. S2CID 30149063.
- ^ Evans WJ, Morley JE, Argilés J, Bales C, Baracos V, Guttridge D, et al. (Diciembre de 2008). "Cachexia: una nueva definición". Nutrición Clínica . 27 (6): 793–9. doi :10.1016/j.clnu.2008.06.013. PMID 18718696. S2CID 206821612.
- ^ Morley JE, Thomas DR, Wilson MM (abril de 2006). "Caquexia: fisiopatología y relevancia clínica". The American Journal of Clinical Nutrition . 83 (4): 735–43. doi : 10.1093/ajcn/83.4.735 . PMID 16600922.
- ^ ab Peterson SJ, Mozer M (febrero de 2017). "Diferenciación entre sarcopenia y caquexia en pacientes con cáncer". Nutrición en la práctica clínica . 32 (1): 30–39. doi :10.1177/0884533616680354. PMID 28124947. S2CID 206555460.
- ^ de Jong J (febrero de 2023). «Diferencias de sexo en la trayectoria del envejecimiento del músculo esquelético: mismos procesos, pero con una clasificación diferente». GeroScience (Investigación original). 45 (4): 2367–2386. doi : 10.1007/s11357-023-00750-4 . PMC: 10651666. PMID: 36820956 .
- ^ Verdijk L (enero de 2007). "El contenido de células satélite se reduce específicamente en las fibras musculares esqueléticas de tipo II en los ancianos". American Journal of Physiology. Endocrinology and Metabolism (Investigación original). 292 (1): E151–E157. doi :10.1152/ajpendo.00278.2006. PMID 16926381.
- ^ Marcell TJ (octubre de 2003). "Sarcopenia: causas, consecuencias y prevención". Revistas de gerontología. Serie A, Ciencias biológicas y ciencias médicas . 58 (10): M911-6. doi : 10.1093/gerona/58.10.m911 . PMID: 14570858.
- ^ Anker SD, Morley JE, von Haehling S (diciembre de 2016). "Bienvenido al código ICD-10 para sarcopenia". Journal of Cachexia, Sarcopenia and Muscle . 7 (5): 512–514. doi :10.1002/jcsm.12147. PMC 5114626 . PMID 27891296.
- ^ Powers SK, Lynch GS, Murphy KT, Reid MB, Zijdewind I (noviembre de 2016). "Atrofia y fatiga del músculo esquelético inducida por enfermedad". Medicina y ciencia en deportes y ejercicio . 48 (11): 2307–2319. doi :10.1249/MSS.0000000000000975. PMC 5069191 . PMID 27128663.
- ^ O'Brien LC, Gorgey AS (octubre de 2016). "Salud mitocondrial del músculo esquelético y lesión de la médula espinal". Revista Mundial de Ortopedia . 7 (10): 628–637. doi : 10.5312/wjo.v7.i10.628 . PMC 5065669 . PMID 27795944.
- ^ Verschuren O, Smorenburg AR, Luiking Y, Bell K, Barber L, Peterson MD (junio de 2018). "Determinantes de la preservación muscular en individuos con parálisis cerebral a lo largo de la vida: una revisión narrativa de la literatura". Journal of Cachexia, Sarcopenia and Muscle . 9 (3): 453–464. doi :10.1002/jcsm.12287. PMC 5989853 . PMID 29392922.
- ^ Wong A, Pomerantz JH (marzo de 2019). "El papel de las células madre musculares en la regeneración y recuperación después de la denervación: una revisión". Cirugía plástica y reconstructiva . 143 (3): 779–788. doi :10.1097/PRS.0000000000005370. PMID 30817650. S2CID 73495244.
- ^ Hiensch AE, Bolam KA, Mijwel S, Jeneson JA, Huitema AD, Kranenburg O, et al. (octubre de 2019). "Atrofia del músculo esquelético inducida por doxorrubicina: dilucidar las vías moleculares subyacentes". Acta Fisiológica . 229 (2): e13400. doi : 10.1111/apha.13400 . PMC 7317437 . PMID 31600860.
- ^ Martín AI, Priego T, López-Calderón A (2018). "Hormonas y atrofia muscular". En Xiao J (ed.). Atrofia muscular . Avances en medicina experimental y biología. Vol. 1088. Springer Singapur. pp. 207–233. doi :10.1007/978-981-13-1435-3_9. ISBN 9789811314346. PMID 30390253.
- ^ Egerman MA, Glass DJ (enero-febrero de 2014). "Vías de señalización que controlan la masa muscular esquelética". Crit Rev Biochem Mol Biol . 49 (1): 59–68. doi :10.3109/10409238.2013.857291. PMC 3913083 . PMID 24237131.
- ^ ab Abrigo J, Simon F, Cabrera D, Vilos C, Cabello-Verrugio C (2019-05-20). "Disfunción mitocondrial en patologías del músculo esquelético". Current Protein & Peptide Science . 20 (6): 536–546. doi :10.2174/1389203720666190402100902. PMID 30947668. S2CID 96434115.
- ^ Sandri M (junio de 2008). "Señalización en la atrofia y la hipertrofia muscular". Fisiología . 23 (3). Bethesda, Maryland: 160–70. doi :10.1152/physiol.00041.2007. PMID 18556469.
- ^ Bishop J, Briony T (2007). "Sección 1.9.2". Manual de práctica dietética . Wiley-Blackwell. pág. 76. ISBN 978-1-4051-3525-2.
- ^ Sayer AA (noviembre de 2014). "Sarcopenia, el nuevo gigante geriátrico: es hora de traducir los hallazgos de la investigación a la práctica clínica". Age and Ageing . 43 (6): 736–7. doi : 10.1093/ageing/afu118 . PMID 25227204.
- ^ Liu CJ, Latham NK (julio de 2009). "Entrenamiento progresivo de fuerza y resistencia para mejorar la función física en adultos mayores". Base de datos Cochrane de revisiones sistemáticas . 2009 (3): CD002759. doi :10.1002/14651858.CD002759.pub2. PMC 4324332. PMID 19588334 .
- ^ Zhang D, Guan TH, Widjaja F, Ang WT (23 de abril de 2007). Estimulación eléctrica funcional en la ingeniería de rehabilitación: una encuesta . Actas de la 1.ª convención internacional sobre ingeniería de rehabilitación y tecnología de asistencia: en conjunción con la 1.ª reunión sobre neurorrehabilitación del Hospital Tan Tock Seng. Association for Computing Machinery. págs. 221–226. doi :10.1145/1328491.1328546. ISBN 978-1-59593-852-7.
- ^ ab Phillips SM (julio de 2015). "Suplementos nutricionales en apoyo del ejercicio de resistencia para contrarrestar la sarcopenia relacionada con la edad". Advances in Nutrition . 6 (4): 452–60. doi :10.3945/an.115.008367. PMC 4496741 . PMID 26178029.
- ^ Brioche T, Pagano AF, Py G, Chopard A (agosto de 2016). "Desgaste muscular y envejecimiento: modelos experimentales, infiltraciones grasas y prevención" (PDF) . Aspectos moleculares de la medicina . 50 : 56–87. doi :10.1016/j.mam.2016.04.006. PMID 27106402. S2CID 29717535.
- ^ Holeček M (agosto de 2017). "Suplementación con beta-hidroxi-beta-metilbutirato y músculo esquelético en condiciones saludables y de desgaste muscular". Journal of Cachexia, Sarcopenia and Muscle . 8 (4): 529–541. doi :10.1002/jcsm.12208. PMC 5566641 . PMID 28493406.
- ^ ab Wu H, Xia Y, Jiang J, Du H, Guo X, Liu X, et al. (2015). "Efecto de la suplementación con beta-hidroxi-beta-metilbutirato en la pérdida muscular en adultos mayores: una revisión sistemática y un metanálisis". Archivos de Gerontología y Geriatría . 61 (2): 168–75. doi :10.1016/j.archger.2015.06.020. PMID 26169182.
- ^ Srinath R, Dobs A (febrero de 2014). "Enobosarm (GTx-024, S-22): un posible tratamiento para la caquexia". Future Oncology . 10 (2): 187–94. doi :10.2217/fon.13.273. PMID 24490605.
- ^ ab Fuster G, Busquets S, Almendro V, López-Soriano FJ, Argilés JM (octubre de 2007). "Efectos antiproteolíticos del plasma de osos hibernantes: ¿un nuevo enfoque para la terapia del desgaste muscular?". Nutrición clínica . 26 (5): 658–61. doi :10.1016/j.clnu.2007.07.003. PMID 17904252.
- ^ abc Lohuis TD, Harlow HJ, Beck TD (mayo de 2007). "Los osos negros (Ursus americanus) que hibernan experimentan un equilibrio proteico en el músculo esquelético durante la anorexia invernal". Comparative Biochemistry and Physiology. Parte B, Biochemistry & Molecular Biology . 147 (1): 20–8. doi :10.1016/j.cbpb.2006.12.020. PMID 17307375.
- ^ Carey HV, Andrews MT, Martin SL (octubre de 2003). "Hibernación en mamíferos: respuestas celulares y moleculares al metabolismo deprimido y a las bajas temperaturas". Physiological Reviews . 83 (4): 1153–81. doi :10.1152/physrev.00008.2003. PMID 14506303.
- ^ ab Harlow HJ, Lohuis T, Anderson-Sprecher RC, Beck TD (2004). "La temperatura de la superficie corporal de los osos negros que hibernan puede estar relacionada con la actividad muscular periódica". Journal of Mammalogy . 85 (3): 414–419. doi :10.1644/1545-1542(2004)085<0414:BSTOHB>2.0.CO;2. S2CID 86315375.
- ^ van den Hoek A (agosto de 2019). "Un nuevo suplemento nutricional previene la pérdida muscular y acelera la recuperación de masa muscular en ratones con restricción calórica". Metabolism (Investigación original). 97 : 57–67. doi : 10.1016/j.metabol.2019.05.012 . PMID 31153978.
- ^ de Jong J (junio de 2023). "Restricción calórica combinada con inmovilización como modelo traslacional para la sarcopenia que expresa vías clave de la patología humana". Envejecimiento y enfermedad (investigación original). 14 (3): 937–957. doi : 10.14336/AD.2022.1201 . PMC 10187708. PMID 37191430 .
Enlaces externos
 Medios relacionados con Atrofia muscular en Wikimedia Commons
Medios relacionados con Atrofia muscular en Wikimedia Commons- Atrofia muscular en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
