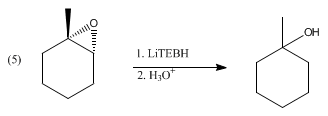Trietilborohidruro de litio
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Boranuuro de trietilo y litio | |
| Otros nombres Superhidruro LiTEBH | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Araña química | |
| Tarjeta informativa de la ECHA | 100.040.963 |
| Número CE |
|
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| Propiedades | |
| Li ( C2H5 ) 3BH | |
| Masa molar | 105,95 g/mol |
| Apariencia | Líquido incoloro a amarillo. |
| Densidad | 0,890 g/cm3 , líquido |
| Punto de ebullición | 66 °C (151 °F; 339 K) para THF |
| reactivo | |
| Peligros | |
| Seguridad y salud en el trabajo (SST/OHS): | |
Principales peligros | Altamente inflamable, corrosivo. Provoca quemaduras. Probable carcinógeno. |
| Etiquetado SGA : [1] | |
   | |
| Peligro | |
| H250 , H260 , H314 , H335 | |
| P210 , P222 , P223 , P231+P232 , P260 , P261 , P264 , P271 , P280 , P301+P330+P331 , P302+P334 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P312 , P321 , P335+P334 , P363 , P370+P378 , P402+P404 , P403+P233 , P405 , P422 , P501 | |
| NFPA 704 (rombo cortafuegos) | |
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad externa |
| Compuestos relacionados | |
Hidruro relacionado | Borohidruro de litio Borohidruro de sodio Hidruro de sodio Hidruro de litio y aluminio |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El trietilborohidruro de litio es un compuesto de organoboro con la fórmula Li Et 3 BH . Comúnmente conocido como LiTEBH o superhidruro , es un potente agente reductor utilizado en química orgánica y organometálica . Es un líquido incoloro o blanco, pero generalmente se comercializa y se utiliza como una solución de THF. [2] El agente reductor relacionado, el trietilborohidruro de sodio, está disponible comercialmente como soluciones de tolueno .
LiBHEt3 es un agente reductor más fuerte que el borohidruro de litio y el hidruro de litio y aluminio .
Preparación
El LiBHEt3 se prepara mediante la reacción de hidruro de litio (LiH) y trietilborano (Et3B ) en tetrahidrofurano (THF):
- LiH + Et3B → LiEt3BH
El complejo de THF resultante es estable indefinidamente en ausencia de humedad y aire.
Reacciones
Los haluros de alquilo se reducen a alcanos mediante LiBHEt 3 . [3] [4] [2]
El LiBHEt3 reduce una amplia gama de grupos funcionales, pero también lo hacen muchos otros reactivos hidruro. En cambio, el LiBHEt3 se reserva para sustratos difíciles, como los carbonilos estéricamente impedidos, como se ilustra con la reducción de 2,2,4,4-tetrametil-3-pentanona. De lo contrario, reduce los anhídridos de ácido a alcoholes y al ácido carboxílico, no al diol . De manera similar, las lactonas se reducen a dioles. Las α,β-enonas experimentan una adición 1,4 para dar enolatos de litio . Los disulfuros se reducen a tioles (a través de tiolatos). El LiBHEt3 desprotona los ácidos carboxílicos, pero no reduce los carboxilatos de litio resultantes. Por razones similares, los epóxidos experimentan una apertura de anillo tras el tratamiento con LiBHEt3 para dar el alcohol. Con epóxidos asimétricos, la reacción puede proceder con alta regio- y estereo- selectividad, favoreciendo el ataque en la posición menos impedida:
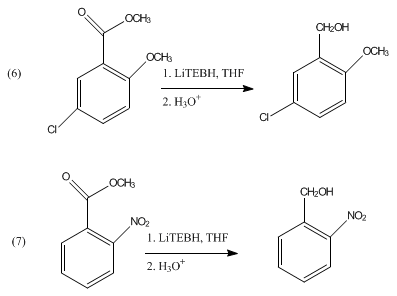
Los acetales y cetales no se reducen con LiBHEt3 . Se puede utilizar en la escisión reductora de mesilatos y tosilatos . [5] LiBHEt3 puede desproteger selectivamente los grupos N-acilo terciarios sin afectar la funcionalidad amida secundaria. [6] También se ha demostrado que reduce los ésteres aromáticos a los alcoholes correspondientes como se muestra en las ecuaciones 6 y 7.
El LiBHEt3 también reduce la piridina y las isoquinolinas a piperidinas y tetrahidroisoquinolinas respectivamente. [7]
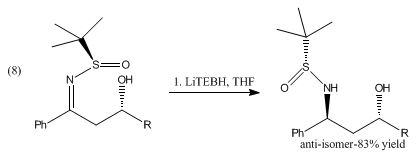
La reducción de β-hidroxisulfiniliminas con catecolborano y LiBHEt3 produce anti - 1,3-aminoalcoholes que se muestran en (8). [8]
Precauciones
El LiBHEt3 reacciona exotérmicamente, potencialmente de forma violenta, con agua, alcoholes y ácidos, liberando hidrógeno y el trietilborano pirofórico . [2]
Referencias
- ^ "Trietilohidroborato de litio". pubchem.ncbi.nlm.nih.gov . Consultado el 19 de diciembre de 2021 .
- ^ abc Zaidlewicz, M.; Brown, HC (2001). "Trietiloborohidruro de litio". Enciclopedia de reactivos para síntesis orgánica. John Wiley & Sons. doi :10.1002/047084289X.rl148. ISBN 0471936235. Consultado el 18 de febrero de 2022 .
- ^ Marek Zaidlewicz; Herbert C. Brown (2001). "Trietiloborohidruro de litio". Enciclopedia de reactivos para síntesis orgánica . doi :10.1002/047084289X.rl148. ISBN 0471936235.
- ^ Brown, HC; Kim, SC; Krishnamurthy, S. (1980-02-01). "Reducciones selectivas. 27. Reacción de haluros de alquilo con hidruros metálicos complejos representativos e hidruros metálicos. Comparación de varios agentes reductores de hidruros". J. Org. Chem . 45 (5): 849–856. doi :10.1021/jo01293a018 . Consultado el 18 de febrero de 2022 .
- ^ Baer, HH; Mekarska-Falicki, M. (noviembre de 1985). "Dependencia estereoquímica del mecanismo de desoxigenación, con trietilborohidruro de litio, en p-toluenosulfonatos de 4,6-O-bencilidenohexopiranósido". Revista canadiense de química . 63 (11): 3043. doi : 10.1139/v85-505 . Consultado el 18 de febrero de 2022 .
- ^ Tanaka, H.; Ogasawara, K. (17 de junio de 2002). "Utilización de trietilborohidruro de litio como agente desprotector selectivo de N-acilo". Tetrahedron Lett . 43 (25): 4417. doi :10.1016/S0040-4039(02)00844-4 . Consultado el 18 de febrero de 2022 .
- ^ Blough, BE; Carroll, FI (5 de noviembre de 1993). "Reducción de heterociclos que contienen isoquinolina y piridina con trietilborohidruro de litio (Super-Hydride®)". Tetrahedron Lett . 34 (45): 7239. doi :10.1016/S0040-4039(00)79297-5 . Consultado el 18 de febrero de 2022 .
- ^ Kochi, T.; Tang, TP; Ellman, JA (14 de mayo de 2002). "Síntesis asimétrica de alcoholes sin- y anti-1,3-amino". J. Am. Chem. Soc . 124 (23): 6518–6519. doi :10.1021/ja026292g. PMID 12047156. Consultado el 18 de febrero de 2022 .