Sulfoleno
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido 2,5-Dihidro-1 H -1λ 6 -tiofeno-1,1-diona | |||
| Otros nombres 2,5-Dihidrotiofeno 1,1-dióxido Butadieno sulfona 3-Sulfoleno | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh |
| ||
| Química biológica |
| ||
| Araña química |
| ||
| Tarjeta informativa de la ECHA | 100.000.964 | ||
| Número CE |
| ||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C4H6O2S | |||
| Masa molar | 118,15 g·mol −1 | ||
| Punto de fusión | 65 a 66 °C (149 a 151 °F; 338 a 339 K) | ||
| Peligros | |||
| Etiquetado SGA : [2] | |||
  | |||
| Peligro | |||
| H318 | |||
| P264+P265 , P280 , P305+P351+P338 , P305+P354+P338 , P317 , P337+P317 | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El sulfoleno o butadieno sulfona es un compuesto químico orgánico cíclico con un grupo funcional sulfona . Es un sólido blanco, inodoro, cristalino, almacenable indefinidamente, que se disuelve en agua y en muchos solventes orgánicos. [3] El compuesto se utiliza como fuente de butadieno . [4]
Producción

El sulfoleno se forma mediante la reacción quelotrópica entre el butadieno y el dióxido de azufre. La reacción se lleva a cabo normalmente en un autoclave. Se añaden pequeñas cantidades de hidroquinona o pirogalol para inhibir la polimerización del dieno. La reacción se lleva a cabo a temperatura ambiente durante el transcurso de días. A 130 °C, solo se requieren 30 minutos. [5] Un procedimiento análogo proporciona la sulfona derivada del isopreno . [6]
Reacciones
Reactividad ácido-base
El compuesto no se ve afectado por los ácidos. Incluso puede recristalizarse a partir de HNO 3 concentrado . [7] [8]
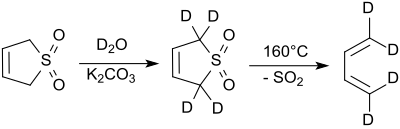
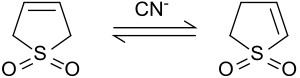
Los protones en las posiciones 2 y 5 se intercambian rápidamente con óxido de deuterio en condiciones alcalinas. [9] El cianuro de sodio cataliza esta reacción. [10]
Isomerización a 2-sulfoleno
En presencia de base o cianuro, el 3-sulfoleno se isomeriza a una mezcla de 2-sulfoleno y 3-sulfoleno. [10]
A 50 °C se obtiene una mezcla de equilibrio que contiene 42% de 3-sulfoleno y 58% de 2-sulfoleno. [11] El 2-sulfoleno, termodinámicamente más estable, se puede aislar de la mezcla de isómeros como sustancia pura en forma de placas blancas (pf 48-49 °C) calentando durante varios días a 100 °C, debido a la descomposición térmica del 3-sulfoleno a temperaturas superiores a 80 °C. [12]
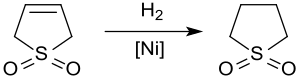
Hidrogenación
La hidrogenación catalítica produce sulfolano , un disolvente utilizado en la industria petroquímica para la extracción de aromáticos de corrientes de hidrocarburos . La hidrogenación de 3-sulfoleno sobre níquel Raney a aproximadamente 20 bar y 60 °C produce sulfolano con rendimientos de hasta el 65% solo debido al envenenamiento del catalizador por compuestos de azufre. [13]
Halogenación
El 3-sulfoleno reacciona en solución acuosa con bromo para dar 3,4-dibromotetrohidrotiofeno-1,1-dióxido, que puede deshidrobromarse a tiofeno-1,1-dióxido con carbonato de plata . [7] El tiofeno-1,1-dióxido, una especie altamente reactiva, también es accesible a través de la formación de 3,4-bis(dimetilamino)tetrahidrotiofeno-1,1-dióxido y la cuaternización doble sucesiva con yoduro de metilo y la eliminación de Hofmann con hidróxido de plata . [12]
Una síntesis de dos pasos menos engorrosa es la deshidrobromación doble de 3,4-dibromotetrohidrotiofeno-1,1-dióxido con hidróxido de sodio en polvo en tetrahidrofurano (THF) [14] o con potasio metálico disperso ultrasónicamente . [15]
Reacciones de Diels-Alder
El 3-sulfoleno se valora principalmente como sustituto del butadieno. [3] [4] La producción in situ y el consumo inmediato de 1,3-butadieno evitan en gran medida el contacto con el dieno, que es un gas a temperatura ambiente. Un posible inconveniente, además del coste, es que el dióxido de azufre que se desprende puede provocar reacciones secundarias con sustratos sensibles a los ácidos.
La reacción de Diels-Alder entre el 1,3-butadieno y los dienófilos de baja reactividad requiere normalmente un calentamiento prolongado por encima de los 100 °C. Estos procedimientos son bastante peligrosos. Si se utiliza butadieno puro, se requiere un equipo especial para trabajar a presión elevada. Con el sulfoleno no se puede esperar que aumente la presión del butadieno, ya que el dieno liberado se consume en la cicloadición y, por lo tanto, el equilibrio de la reacción de extrusión reversible actúa como una "válvula de seguridad" interna. [16]
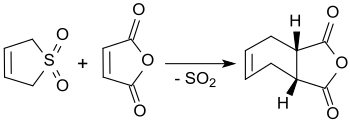
El 3-sulfoleno reacciona con anhídrido maleico en xileno hirviendo para formar anhídrido cis-4-ciclohexeno-1,2-dicarboxílico, obteniendo rendimientos de hasta el 90%. [4]
El 3-sulfoleno reacciona también con dienófilos en configuración trans (como el fumarato de dietilo) a 110 °C con eliminación de SO 2 con un rendimiento del 66-73 % al éster dietílico trans-4-ciclohexeno-1,2-dicarboxílico. [17]
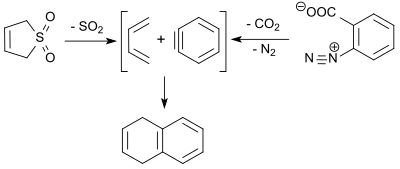
El 6,7-dibromo-1,4-epoxi-1,4-dihidronaftaleno (6,7-dibromonaftaleno-1,4-endóxido, accesible después de la desbromación a partir de 1,2,4,5-tetrabromobenceno utilizando un equivalente de n-butillitio y la reacción de Diels-Alder en furano con un rendimiento del 70 % [18] ) reacciona con 3-sulfoleno en xileno hirviendo para dar un aducto tricíclico. Este precursor produce, después del tratamiento con ácido perclórico, un dibromodihidroantraceno que se deshidrogena en el último paso con 2,3-dicloro-5,6-diciano-1,4-benzoquinona (DDQ) a 2,3-dibromoantraceno. [19]
El 1,3-butadieno (formado en la reacción retroquelótrofa del 3-sulfoleno) reacciona con el deshidrobenceno ( bencina , obtenida por descomposición térmica del bencenodiazonio-2-carboxilato) en una reacción de Diels-Alder con un rendimiento del 9 % para dar 1,4-dihidronaftaleno. [20]
2- y 3-sulfolenos como dienófilos
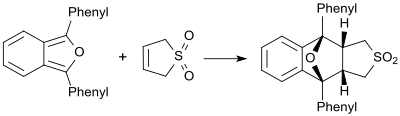
En presencia de dienos muy reactivos (por ejemplo 1,3-difenilisobenzofurano), la butadiensulfona se comporta como un dienófilo y forma el aducto de Diels-Alder correspondiente. [21]
Ya en 1938, Kurt Alder y sus colaboradores informaron sobre los aductos de Diels-Alder del isomérico 2-sulfoleno con 1,3-butadieno y del 2-sulfoleno con ciclopentadieno . [22]
Otras cicloadiciones
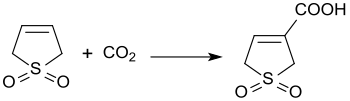
La reacción catalizada por base del 3-sulfoleno con dióxido de carbono a una presión de 3 bar produce ácido 3-sulfoleno-3-carboxílico con un rendimiento del 45%. [23]
Con diazometano , el 3-sulfoleno se forma en un cicloaducto 1,3-dipolar: [24]
Polimerización
En 1935, H. Staudinger y sus colaboradores descubrieron que la reacción de butadieno y SO2 a temperatura ambiente da un segundo producto además del 3-sulfoleno. Este segundo producto es un polímero sólido amorfo. Mediante la polimerización por radicales libres del 3-sulfoleno en éter dietílico que contiene peróxido, se obtuvo hasta un 50% de polisulfoleno de alto peso molecular insoluble. El polímero resiste la degradación por ácidos sulfúrico y nítrico. [8]
En investigaciones posteriores, la polimerización de 3-sulfoleno se inició por encima de 100 °C con el iniciador radical azobis(isobutironitrilo) (AIBN). [25] Sin embargo, el 3-sulfoleno no copolimeriza con compuestos de vinilo . Por otro lado, el 2-sulfoleno no homopolimeriza , sino que forma copolímeros con compuestos de vinilo, por ejemplo, acrilonitrilo y acetato de vinilo .
3-Sulfoleno como disolvente reciclable
La reversibilidad de la interconversión de 3-sulfoleno con buta-1,3-dieno y dióxido de azufre sugiere el uso de sulfoleno como un solvente dipolar aprótico reciclable, en reemplazo de dimetilsulfóxido (DMSO), que se usa a menudo pero es difícil de separar y poco reutilizable. [26] Como reacción modelo, se investigó la reacción de azida de bencilo con cianuro de ácido 4-toluenosulfónico formando 1-bencil-5-(4-toluenosulfonil)tetrazol. La formación del tetrazol también se puede llevar a cabo como una reacción de un solo recipiente sin el aislamiento de la azida de bencilo con un rendimiento general del 72%.
Después de la reacción, el disolvente 3-sulfoleno se descompone a 135 °C y el butadieno volátil (punto de ebullición -4,4 °C) y el dióxido de azufre (punto de ebullición -10,1 °C) se depositan en una trampa de enfriamiento a -76 °C cargada con un exceso de dióxido de azufre. Después de la adición de hidroquinona como inhibidor de la polimerización, se forman de nuevo 3-sulfoles cuantitativamente al calentar a temperatura ambiente. Sin embargo, parece cuestionable si el 3-sulfoleno con un rango útil de fase líquida de solo 64 a un máximo de aproximadamente 100 °C puede usarse como sustituto del DMSO (fácil manejo, bajo costo, compatibilidad ambiental) en la práctica industrial.
Usos
Además de su versatilidad sintética (ver arriba), el sulfoleno se utiliza como aditivo en la fluoración electroquímica . Puede aumentar el rendimiento de fluoruro de perfluorooctanosulfonilo en aproximadamente un 70%. [27] Es "muy soluble en HF anhidro y aumenta la conductividad de la solución electrolítica". [27] En esta aplicación, sufre una apertura de anillo y se fluora para formar fluoruro de perfluorobutanosulfonilo .
Lectura adicional
- DE 506839, H. Staudinger, "Verfahren zur Darstellung von monomolekularen Reaktionsprodukten von ungesättigten Kohlenwasserstoffen der Butadienreihe mit Schwefeldioxyd", publicado el 28 de agosto de 1930, asignado a H. Staudinger
Referencias
- ^ Sulfoleno en Sigma-Aldrich
- ^ "3-Sulfoleno". pubchem.ncbi.nlm.nih.gov .
- ^ por JM McIntosh (2001). "3-Sulfoleno". Enciclopedia E-EROS de reactivos para síntesis orgánica . doi :10.1002/047084289X.rs130. ISBN 0471936235.
- ^ abc Sample, Thomas E.; Hatch, Lewis F. (enero de 1968). "3-Sulfoleno: una fuente de butadieno para una síntesis de Diels-Alder". Revista de educación química . 45 (1): 55. doi :10.1021/ed045p55.
- ^ Houben-Weyl (1955). Volumen IX: Compuestos de azufre, selenio y telurio . Métodos de química orgánica (4.ª ed.). Stuttgart: Georg Thieme Verlag. pág. 237. ISBN 978-3-13-208104-8.
- ^ Robert L. Frank, Raymond P. Seven (1949). "Sulfona cíclica de isopreno". Organic Syntheses . 29 : 59. doi :10.15227/orgsyn.029.0059.
- ^ ab DE 506839, H. Staudinger, "Verfahren zur Darstellung von monomolekularen Reaktionsprodukten von ungesättigten Kohlenwasserstoffen der Butadienreihe mit Schwefeldioxyd", publicado el 28 de agosto de 1930, asignado a H. Staudinger
- ^ ab H. Staudinger; B. Ritzenthaler (1935). "Über hochmolekulare Verbindungen, 104. Mitteil.: Über die Anlagerung von Schwefeldioxyd an Äthylen-Derivate". Chemische Berichte (en alemán). 68 (3): 455–471. doi :10.1002/cber.19350680317.
- ^ J. Leonard; AB Hague; JA Knight (1998). "6. Preparación de 3-sulfolenos sustituidos y su uso como precursores de dienos de Diels-Alder". Química de los organosulfurados . Vol. 2 (4.ª ed.). San Diego: Academic Press, Inc. pág. 241. ISBN. 0-12-543562-2.
- ^ ab US 4187231, RL Cobb, "Isomerización catalizada por cianuro e intercambio de deuterio con alfa- y beta-sulfolenos", publicado el 5 de febrero de 1980, asignado a Phillips Petroleum Co.
- ^ CD Broaddus (1968). "Equilibrios e intercambio catalizado por bases de olefinas sustituidas". Accounts of Chemical Research . 1 (8): 231–238. doi :10.1021/ar50008a002.
- ^ ab WJ Bailey; EW Cummins (1954). "Diene cíclico. III. La síntesis de tiofeno-1,1-dióxido". Revista de la Sociedad Química Americana . 76 (7): 1932–1936. doi :10.1021/ja01636a058.
- ^ US 4286099, ME Nash, EE Huxley, "Hidrogenación de sulfoleno", publicada el 25 de agosto de 1981, asignada a Phillips Petroleum Co.
- ^ DM Lemal; GD Goldman (1988). "Síntesis de azuleno, un hidrocarburo azul". Revista de Educación Química . 65 (10): 923. Bibcode :1988JChEd..65..923L. doi :10.1021/ed065p923.
- ^ T.-S. Chou; M.-M. Chen (1987). "Reacciones quimioselectivas de potasio dispersado ultrasónicamente con algunos S,S-dióxidos de hidrotiofeno bromados". Heterocycles . 26 (11): 2829–2834. doi : 10.3987/R-1987-11-2829 .
- ^ MA Filatov; S. Baluschev; IZ Ilieva; V. Enkelmann; T. Miteva; K. Landfester; SE Aleshchenkov; AV Cheprakov (2012). "Tetraariltetraantra[2,3]porfirinas: síntesis, estructura y propiedades ópticas". Revista de química orgánica . 77 (24): 11119–11131. doi :10.1021/jo302135q. PMID 23205621.
- ^ "Trans-Δ 4 -tetrahidroftalato de dietilo". Síntesis orgánicas . 50 . doi :10.15227/orgsyn.050.0043.
- ^ H. Hart, A. Bashir-Hashemi, J. Luo, MA Meador (1986). "Iptycenes: Triptycenes extendidos". Tetrahedron . 42 : 1641–1654. doi :10.1016/S0040-4020(01)87581-5.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ C.-T. Lin, T.-C. Chou (1988). "Síntesis de 2,3-dibromoantraceno". Síntesis . 1988 (8): 628–630. doi :10.1055/s-1988-27659. S2CID 93109532.
- ^ LF Hatch, D. Peter (1968). "Reacción de bencina con butadieno". Chemical Communications . 23 (23): 1499. doi :10.1039/C19680001499.
- ^ MP Cava, JP VanMeter (1969). "Compuestos aromáticos de ciclobutano condensados. XXX. Síntesis de algunos heterociclos 2,3-naftoquinonoides inusuales. Una ruta sintética para derivados de nafto[2,3-b]bifenileno y antra[b]ciclobuteno". The Journal of Organic Chemistry . 34 (3): 538–545. doi :10.1021/jo01255a012.
- ^ K. Aliso; HF Rickert; E. Windemuth (1938). "Zur Kenntnis der Dien-Synthese, X. Mitteil.: Über die Dien-Synthese mit α, β-ungesättigten Nitrokörpern, Sulfonen und Thio-Äthern". Chemische Berichte . 71 (12): 2451–2461. doi :10.1002/cber.19380711206.
- ^ GS Andrade; et al. (2003). "La síntesis en un solo recipiente y la reactividad de Diels-Alder del ácido 2,5-dihidrotiofeno-1,1-dióxido-3-carboxílico". Synthetic Communications . 33 (20): 3643–3650. doi :10.1081/SCC-120024845. S2CID 98504228.
- ^ ME Brant; JE Wulff (2016). "3-Sulfolenos y sus derivados: Síntesis y aplicaciones". Síntesis . 48 (1): 1–17. doi :10.1055/s-0035-1560351. S2CID 196826278.
- ^ EJ Goethals (1967). "Sobre la polimerización y copolimerización de sulfolenos". Química y física macromolecular . 109 (1): 132–142. doi :10.1002/macp.1967.021090113.
- ^ Y. Huang; et al. (2015). "Butadieno sulfona como disolvente dipolar, aprótico, 'volátil' y reciclable para realizar reacciones de sustitución y cicloadición". Procesos químicos sostenibles . 3 (13). doi : 10.1186/s40508-015-0040-7 .
- ^ ab Lehmler HJ (marzo de 2005). "Síntesis de surfactantes fluorados ambientalmente relevantes: una revisión". Chemosphere . 58 (11): 1471–96. Bibcode :2005Chmsp..58.1471L. doi :10.1016/j.chemosphere.2004.11.078. PMID 15694468.