Sulfato de plomo (II)
_sulfate.jpg/440px-Lead(II)_sulfate.jpg) | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC sulfato de plomo (II) | |
| Otros nombres Anglesita , blanco rápido, blanco lechoso, sulfato plumoso | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Araña química | |
| Tarjeta informativa de la ECHA | 100.028.362 |
| Número CE |
|
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
| Número de la ONU | 1759 1794 |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| PbSO4 | |
| Masa molar | 303,26 g/mol [1] [2] |
| Apariencia | sólido blanco |
| Densidad | 6,29 g/cm3 [ 3] |
| Punto de fusión | 1.087 °C (1.989 °F; 1.360 K) se descompone |
| 0,0032 g/100 ml (15 °C) 0,0404 g/100 ml (25 °C) [4] | |
Producto de solubilidad ( K sp ) | 2,13 x 10 −8 (20 °C) |
| Solubilidad | insoluble en alcohol soluble en acetato de amonio (≥ 6 mol/L) soluble en tartrato de amonio en presencia de cloruro de amonio y amoniaco |
| −69,7·10 −6 cm3 / mol | |
Índice de refracción ( n D ) | 1.877 |
| Estructura | |
| ortorrómbico , barita | |
| Termoquímica | |
Capacidad calorífica ( C ) | 103 J/grado mol |
Entropía molar estándar ( S ⦵ 298 ) | 149 J·mol −1 ·K −1 [5] |
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −920 kJ·mol −1 [5] |
| Peligros | |
| Etiquetado SGA : | |
   | |
| Peligro | |
| H302 , H332 , H360DF , H410 | |
| P201 , P202 , P260 , P261 , P264 , P270 , P271 , P273 , P281 , P301+P312 , P304+P312 , P304+P340 , P308+P313 , P312 , P314 , P330 , P391 , P405 , P501 | |
| NFPA 704 (rombo cortafuegos) | |
| punto de inflamabilidad | Ininflamable |
Valor límite umbral (TLV) | 0,15 mg/ m3 |
| Compuestos relacionados | |
Otros aniones | Cloruro de plomo (II) , Bromuro de plomo (II) , Yoduro de plomo (II) , Fluoruro de plomo (II) |
Otros cationes | Sulfato de estaño (II) , Sulfato de sodio , Sulfato de cobre (II) |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El sulfato de plomo (II) (PbSO 4 ) es un sólido blanco, que aparece blanco en forma microcristalina. También se lo conoce como blanco sólido , blanco lechoso , sal de plomo del ácido sulfúrico o anglesita .
Se observa a menudo en las placas/electrodos de las baterías de los automóviles , ya que se forma cuando la batería se descarga (cuando la batería se recarga, el sulfato de plomo se transforma nuevamente en plomo metálico y ácido sulfúrico en el terminal negativo o dióxido de plomo y ácido sulfúrico en el terminal positivo). El sulfato de plomo es poco soluble en agua.
Estructura
La anglesita (sulfato de plomo (II), PbSO 4 ) adopta la misma estructura cristalina ortorrómbica que la celestita ( sulfato de estroncio , SrSO 4 ) y la barita ( sulfato de bario , BaSO 4 ). Las estructuras de los tres minerales están en el grupo espacial Pbnm (número 62) . [6] Cada ion de plomo (II) está rodeado por 12 átomos de oxígeno de 7 iones de sulfato, formando un poliedro PbO 12 . [7] Las distancias plomo-oxígeno varían de 2,612 Å a 3,267 Å y la distancia promedio es 2,865 Å. [6]
| Liderar la coordinación | Coordinación de sulfatos |
|---|---|
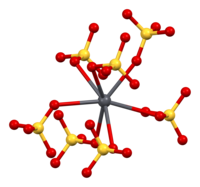 |  |
Fabricación
El sulfato de plomo (II) se prepara tratando óxido, hidróxido o carbonato de plomo con ácido sulfúrico caliente o tratando una sal de plomo soluble con ácido sulfúrico.
Alternativamente, se puede preparar mediante la interacción de soluciones de nitrato de plomo y sulfato de sodio.
Toxicología
El sulfato de plomo es tóxico por inhalación, ingestión y contacto con la piel. Es un veneno acumulativo y la exposición repetida puede provocar anemia, daño renal, daño a la vista o daño al sistema nervioso central (especialmente en niños). También es corrosivo: el contacto con los ojos puede provocar irritación grave o quemaduras. El valor límite umbral típico es de 0,15 mg/ m3 .
Mineral
El mineral natural anglesita , PbSO 4 , se presenta como un producto de oxidación del mineral de sulfuro de plomo primario.
Sulfatos de plomo básicos e hidrogenados
Se conocen varios sulfatos básicos de plomo: PbSO 4 ·PbO; PbSO 4 ·2PbO; PbSO 4 ·3PbO; PbSO 4 ·4PbO. Se utilizan en la fabricación de pasta activa para baterías de plomo-ácido. Un mineral relacionado es la leadhillita , 2PbCO 3 ·PbSO 4 ·Pb(OH) 2 .
En altas concentraciones de ácido sulfúrico (>80%), se forma hidrogenosulfato de plomo, Pb(HSO 4 ) 2 . [8]
Propiedades químicas
El sulfato de plomo (II) se puede disolver en HNO 3 concentrado , HCl, H 2 SO 4 produciendo sales ácidas o compuestos complejos, y en álcali concentrado dando complejos solubles de tetrahidroxiplumbato (II) [Pb(OH) 4 ] 2− .
- PbSO4 (s) + H2SO4 ( l) ⇌ Pb ( HSO4 ) 2 ( ac )
- PbSO 4 (s) + 4 NaOH(ac) → Na 2 [Pb(OH) 4 ](ac) + Na 2 SO 4 (ac)
El sulfato de plomo (II) se descompone cuando se calienta a más de 1000 °C:
- PbSO4 ( s ) → PbO(s) + SO3 ( g)
Aplicaciones
- Baterías de almacenamiento de plomo-ácido [9]
- Pigmentos de pintura [9]
- Reactivo de laboratorio [9]
Véase también
Referencias
- ^ "Masa molar del sulfato de plomo". webbook.nist.gov . Archivado desde el original el 13 de diciembre de 2020 . Consultado el 4 de marzo de 2022 .
- ^ "Revisión de datos del NIST de 1980" (PDF) . Instituto Nacional de Estándares y Tecnología (NIST). Archivado desde el original (PDF) el 21 de diciembre de 2016. Consultado el 4 de marzo de 2022 .
- ^ Lide, David R. (14 de septiembre de 2002). "Manual de química y física del CRC. 83.ª edición". Revista de la Sociedad Química Estadounidense . 124 (47). Instituto Nacional de Normas y Tecnología (NIST); CRC Press: Boca Raton: 14280. doi :10.1021/ja025295q. ISBN . 9780849304835. ISSN 0002-7863. OCLC 956588069. Archivado desde el original el 4 de marzo de 2022 . Consultado el 4 de marzo de 2022 .
- ^ PubChem. «Sulfato de plomo». pubchem.ncbi.nlm.nih.gov . Archivado desde el original el 29 de noviembre de 2021. Consultado el 4 de marzo de 2022 .
- ^ ab Zumdahl, Steven S. (2009). Principios químicos (6.ª ed.). Houghton Mifflin Company. pág. A22. ISBN 978-0-618-94690-7.OCLC 1029017812 .
- ^ abc Antao, Sytle M. (2012). "Tendencias estructurales de celestita (SrSO 4 ), anglesita (PbSO 4 ) y barita (BaSO 4 ): Confirmación de las variaciones esperadas dentro de los grupos SO 4 ". Am. Mineral. 97 (4): 661–665. doi :10.2138/am.2012.3905. S2CID 55149411.
- ^ Wells, AF (1984). Química inorgánica estructural (5.ª ed.). Oxford University Press. pág. 1187. ISBN 978-0-19-965763-6.
- ^ "Министерство образования и науки РФ, Реферат" Свинец и его свойства"" [Resumen: El plomo y sus propiedades]. Ministerio de Educación y Ciencia de la Federación de Rusia. 2007. Archivado desde el original el 21 de diciembre de 2007.
- ^ Hoja informativa sobre sustancias peligrosas (PDF) , septiembre de 2007
Enlaces externos
- Estudios de casos en medicina ambiental (CSEM): toxicidad por plomo
- ToxFAQs: Plomo
- Inventario Nacional de Contaminantes - Hoja informativa sobre plomo y compuestos de plomo




