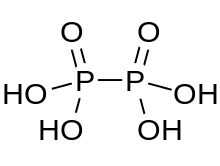
Ácido hipofosfórico
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Ácido hipodifosfórico | |
| Otros nombres Ácido difosfórico | |
| Identificadores | |
| |
Modelo 3D ( JSmol ) |
|
| EBICh |
|
| Araña química |
|
Identificador de centro de PubChem |
|
| UNIVERSIDAD |
|
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| H4P2O6 | |
| Masa molar | 161,98 g/mol |
| Apariencia | Sólido blanco (dihidrato) |
| Punto de fusión | 54 °C (129 °F; 327 K) |
| Acidez (p K a ) | 2.2, 2.8, 7.3, 10.0 [1] |
| Base conjugada | Hipofosfato |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El ácido hipofosfórico es un ácido mineral con la fórmula H 4 P 2 O 6 , con fósforo en un estado de oxidación formal de +4. En estado sólido está presente como el dihidrato, H 4 P 2 O 6 ·2H 2 O. En el ácido hipofosfórico los átomos de fósforo son idénticos y están unidos directamente con un enlace P−P. El ácido isohipofosfórico es un isómero estructural del ácido hipofosfórico en el que un fósforo tiene un hidrógeno unido directamente a él y ese átomo de fósforo está unido al otro por un puente de oxígeno para dar un anhídrido mixto de ácido fosforoso / ácido fosfórico . Los dos átomos de fósforo están en los estados de oxidación +3 y +5, respectivamente.
Preparación y reacciones
El ácido hipofosfórico se puede preparar mediante la reacción del fósforo rojo con clorito de sodio a temperatura ambiente. [2]
- 2 P + 2 NaClO 2 + 2 H 2 O → Na 2 H 2 P 2 O 6 + 2 HCl
Una mezcla de ácido hipofosfórico, ácido fosforoso (H 3 PO 3 ) y ácido fosfórico (H 3 PO 4 ) se produce cuando el fósforo blanco se oxida en el aire cuando está parcialmente sumergido en agua. [2]
La sal tetrasódica Na 4 P 2 O 6 ·10H 2 O cristaliza a pH 10 y la sal disódica, Na 2 H 2 PO 6 ·6H 2 O a pH 5,2. [1] La sal disódica se puede pasar a través de una columna de intercambio iónico para formar el ácido dihidrato, H 4 P 2 O 6 ·2H 2 O. [2]
El ácido anhidro se puede formar por deshidratación al vacío sobre P 4 O 10 o por la reacción de H 2 S sobre hipofosfato de plomo, Pb 2 P 2 O 6 . [1]
El ácido hipofosfórico es tetraprótico con constantes de disociación p K a1 = 2,2, p K a2 = 2,8, p K a3 = 7,3 y p K a4 = 10,0. [1]
Al reposar, el ácido anhidro sufre una reorganización y desproporción para formar una mezcla de ácido isohipofosfórico, HPO(OH)-O-PO 2 (OH); ácido pirofosfórico H 2 P 2 O 7 y ácido pirofosforoso. [1]
El ácido hipofosfórico es inestable en ácido clorhídrico caliente , en HCl 4 M se hidroliza para dar H 3 PO 3 + H 3 PO 4 . [1]
Estructura
El ácido hipofosforoso contiene iones oxonio y se formula mejor como [H 3 O + ] 2 [H 2 P 2 O 6 ] 2− . El ácido es isoestructural con la sal diamónica que contiene el anión [HOPO 2 PO 2 OH] 2− con una longitud de enlace P−P de 219 pm. [2]
El anión HOPO 2 PO 2 OH 2− en Na 2 H 2 P 2 O 6 ·6H 2 O tiene una estructura simétrica y escalonada similar al etano con un enlace P−P de longitud 219 pm. Cada átomo de fósforo tiene dos enlaces P−O con longitud 151 pm y una longitud de enlace P−OH de 159 pm. [3]
Sales de hipofosfato
Se conocen muchas sales de hipofosfato, por ejemplo, K 4 P 2 O 6 ·8H 2 O, Ca 2 P 2 O 6 ·2H 2 O, K 3 HP 2 O 6 ·3H 2 O, K 2 H 2 P 2 O 6 ·2H 2 O, KH 3 P 2 O 6 .
Al permanecer en el aire, los hipofosfatos tienden a oxidarse a pirofosfatos que contienen P
2Oh4−
7ion donde P tiene un estado de oxidación formal de +5. Los hipofosfatos son estables a los hidróxidos alcalinos. En hidróxido de sodio fusionado se convierten rápidamente en el ortofosfato que contiene PO3−
4. [2]
Polihipofosfatos
Se conocen polihipofosfatos que contienen aniones lineales, por ejemplo Na 5 P 3 O 8 que contiene O(PO 2 ) 3 O 5− con una cadena P−P−P y Na 6 P 4 O 10 ·2H 2 O que contiene O(PO 2 ) 4 O 6− , con una cadena P−P−P−P. El anión cíclico (PO
2)6−
6, (hipohexametafosfato [4] ) donde cada átomo de fósforo tiene un estado de oxidación de +3 se forma cuando una suspensión de fósforo rojo en KOH se oxida con bromo. [2]
Véase también
- Ácido ditiónico , el equivalente de azufre.
Referencias
- ^ abcdef Greenwood, Norman N. ; Earnshaw, Alan (1984). Química de los elementos. Oxford: Pergamon Press . págs. 515–516. ISBN 978-0-08-022057-4.
- ^ abcdef Fósforo: química, bioquímica y tecnología, sexta edición, 2013, DEC Corbridge, CRC Pres, Taylor Francis Group, ISBN 978-1-4398-4088-7
- ^ Collin, RL; Willis, M. (1971). " La estructura cristalina del hipofosfato de disodio dihidrógeno hexahidratado (Na2H2P2O6 · 6H2O ) y del pirofosfato de disodio dihidrógeno hexahidratado (Na2H2P2O7 ·6H2O)". Acta Crystallographica Sección B . 27 ( 2 ) : 291–302 . doi : 10.1107 /S0567740871002127. ISSN 0567-7408 .
- ^ Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (ed.), Química inorgánica , traducido por Eagleson, Mary; Brewer, William, San Diego/Berlín: Academic Press/De Gruyter, pág. 715, ISBN 0-12-352651-5