Sesquicarbonato de sodio
This article needs additional citations for verification. (May 2017) |
 | |
| Identificadores | |
|---|---|
Modelo 3D ( JSmol ) |
|
| Tarjeta informativa de la ECHA | 100.007.802 |
| Número CE |
|
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| Na3H ( CO3 ) 2 · 2H2O | |
| Apariencia | blanco, con forma de aguja |
| Densidad | 2,112 g/cm3 ( dihidrato) |
| dihidrato 13 g/100 ml (0 °C) 42 g/100 ml (100 °C) | |
Índice de refracción ( n D ) | 1.5073 (dihidrato) |
| Estructura | |
| monoclínico (dihidrato) | |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
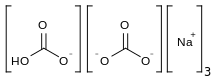
El sesquicarbonato de sodio ( nombre sistemático : bicarbonato de hidrógeno y trisodio) Na 3 H(CO 3 ) 2 es una sal doble de bicarbonato de sodio y carbonato de sodio (NaHCO 3 · Na 2 CO 3 ), y tiene una estructura cristalina en forma de aguja . Sin embargo, el término también se aplica a una mezcla equimolar de esas dos sales, con cualquier agua de hidratación que incluya el carbonato de sodio, suministrada como polvo.
El dihidrato , Na 3 H(CO 3 ) 2 · 2H 2 O, se presenta en la naturaleza como el mineral evaporítico trona . [1]
Debido a las preocupaciones sobre la toxicidad del bórax, que fue retirado como producto de limpieza y lavandería, el sesquicarbonato de sodio se vende en la Unión Europea (UE) como "sustituto del bórax". [2] También se lo conoce como uno de los aditivos alimentarios de número E E500(iii) .
Usos
El sesquicarbonato de sodio se utiliza en sales de baño , piscinas, como fuente de alcalinidad para el tratamiento del agua y como un producto libre de fosfato que reemplaza al fosfato trisódico para una limpieza intensiva. [3] [4]
El sesquicarbonato de sodio se utiliza en la conservación de objetos de cobre y aleaciones de cobre que se corroen debido al contacto con la sal (llamada " enfermedad del bronce " debido a su efecto sobre el bronce ). El cloruro de la sal forma cloruro de cobre (I) . En presencia de oxígeno y agua, incluso la pequeña cantidad de humedad en la atmósfera, el cloruro cuproso forma cloruro de cobre (II) y ácido clorhídrico , este último disuelve el metal y forma más cloruro cuproso en una reacción autosostenida que conduce a la destrucción total del objeto. El tratamiento con sesquicarbonato de sodio elimina los cloruros de cobre (II) de la capa corroída. [ cita requerida ]
También se utiliza como un ablandador de agua precipitante , que se combina con minerales de agua dura ( minerales a base de calcio y magnesio ) para formar un precipitado insoluble, eliminando estos minerales de dureza del agua. [5] Es la fracción de carbonato la que forma el precipitado, y el bicarbonato se incluye para moderar la alcalinidad del material .
En la cocina china, se le conoce como mǎyájiǎn (simplificado: 马牙碱 tradicional: 馬牙鹼) que se traduce aproximadamente como "diente de caballo alcalino" y se usa tradicionalmente como ingrediente en la marinada de huevos centenarios , un plato generalmente hecho con huevos de pato conservados enteros en una mezcla altamente alcalina [ cita requerida ] .
Referencias
- ^ "Trona".
- ^ "Sustituto de bórax: potenciador de la ropa, limpiador multiusos, baño de inmersión". Dri-Pak . 27 de abril de 2015. Archivado desde el original el 2 de julio de 2019 . Consultado el 28 de mayo de 2017 .
- ^ Sustituto de TSP sin fosfato de Savogran
- ^ Sustituto de TSP sin fosfato de Sunnyside
- ^ Según cleaning101.com Archivado el 15 de octubre de 2007 en Wayback Machine.


