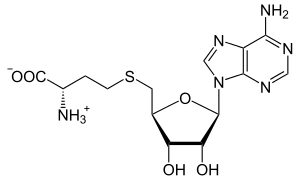
S-adenosil-L-homocisteína
 | |
| Nombres | |
|---|---|
| Nombre IUPAC S- (5′-desoxiadenos-5′-il) -L -homocisteína | |
| Nombre sistemático de la IUPAC Ácido (2 S )-2-amino-4-({[(2 S ,3 S ,4 R ,5 R )-5-(6-amino-9 H -purin-9-il)-3,4-dihidroxioxolan-2-il]metil}sulfanil)butanoico | |
| Otros nombres AdoHcy, 2- S -adenosil- L -homocisteína, 5′- S -(3-Amino-3-carboxipropil)-5′-tioadenosina S -adenosilhomocisteína, SAH | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.012.328 |
| |
| BARRIL | |
| Malla | S-adenosilhomocisteína |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C14H20N6O5S | |
| Masa molar | 384,41 g·mol −1 |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
La S -adenosil- L -homocisteína ( SAH ) es elprecursor biosintético de la homocisteína . [1] La SAH se forma por la desmetilación de la S -adenosil- L -metionina . [2] [3] La adenosilhomocisteinasa convierte la SAH en homocisteína y adenosina .
Papel biológico
Las metiltransferasas de ADN son inhibidas por SAH. [4] Dos productos del cofactor S -adenosil- L -homocisteína pueden unirse al sitio activo de la metiltransferasa de ADN 3B y evitar que el dúplex de ADN se una al sitio activo , lo que inhibe la metilación del ADN . [5]
Referencias
- ^ Finkelstein JD (2000). "Vías y regulación del metabolismo de la homocisteína en mamíferos". Seminarios sobre trombosis y hemostasia . 26 (3): 219–225. doi :10.1055/s-2000-8466. PMID 11011839.
- ^ Ribbe MW, Hu Y, Hodgson KO, Hedman B (abril de 2014). "Biosíntesis de metaloclusters de nitrogenasa". Chemical Reviews . 114 (8): 4063–4080. doi :10.1021/cr400463x. PMC 3999185 . PMID 24328215.
- ^ James SJ, Melnyk S, Pogribna M, Pogribny IP, Caudill MA (agosto de 2002). "Elevación de S-adenosilhomocisteína e hipometilación del ADN: mecanismo epigenético potencial para la patología relacionada con la homocisteína". The Journal of Nutrition . 132 (8 Suppl): 2361S–2366S. doi : 10.1093/jn/132.8.2361S . PMID 12163693.
- ^ Kumar R, Srivastava R, Singh RK, Surolia A, Rao DN (marzo de 2008). "Activación e inhibición de las metiltransferasas de ADN por análogos de S-adenosil-L-homocisteína". Química bioorgánica y medicinal . 16 (5): 2276–2285. doi :10.1016/j.bmc.2007.11.075. PMID 18083524.
- ^ Lin CC, Chen YP, Yang WZ, Shen JC, Yuan HS (abril de 2020). "Información estructural sobre la metilación del ADN específica de CpG por la metiltransferasa 3B del ADN humano". Nucleic Acids Research . 48 (7): 3949–3961. doi :10.1093/nar/gkaa111. PMC 7144912 . PMID 32083663.
Enlaces externos
- Compuesto BioCYC E.Coli K-12: S-adenosil-L-homocisteína



