Reordenamiento de Favorskii
| Reordenamiento de Favorskii | |
|---|---|
| Llamado en honor a | Alexei Yevgrafovich Favorski |
| Tipo de reacción | Reacción de reordenamiento |
| Identificadores | |
| Portal de química orgánica | reacción de favorsky |
| Identificación de ontología RSC | Número de receta: 0000385 |
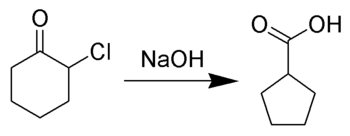
El reordenamiento de Favorskii es principalmente un reordenamiento de ciclopropanonas y α-halo cetonas que conduce a derivados de ácido carboxílico . En el caso de α-halo cetonas cíclicas, el reordenamiento de Favorskii constituye una contracción del anillo. Este reordenamiento tiene lugar en presencia de una base, a veces hidróxido , para producir un ácido carboxílico, pero normalmente una base alcóxido o una amina para producir un éster o una amida , respectivamente. Las α,α'-dihalacetonas eliminan HX en las condiciones de reacción para dar compuestos carbonílicos α,β-insaturados. [1] [2] [3] [4] [5] Nótese que los sustratos de trihalometilcetona darán lugar a la formación de haloformo y carboxilato a través de la reacción de haloformo .
Historia
La reacción debe su nombre al químico ruso Alexei Yevgrafovich Favorskii . [6] [7] [8]
Mecanismo de reacción
Se cree que el mecanismo de reacción implica la formación de un enolato en el lado de la cetona alejado del átomo de cloro . Este enolato se cicla a un intermedio de ciclopropanona que luego es atacado por el nucleófilo hidróxido . Su formación puede verse de otra manera como una electrociclación de 2 electrones de un dipolo 1,3 , que puede capturarse en reacciones de Diels Alder . El intermedio de ciclopropanona se abre para producir el carbanión más estable, que se protona rápidamente . [9]

También se ha propuesto que el segundo paso sea un proceso escalonado, en el que el anión cloruro sale primero para producir un catión oxialilo zwitteriónico antes de que se produzca un cierre de anillo electrocíclico disrotatorio para producir el intermedio de ciclopropanona. [10]
El uso de aniones alcóxido , como el metóxido de sodio, en lugar de hidróxido de sodio, produce el producto éster contraído en el anillo.
Cuando la formación de enolato es imposible, la transposición de Favorskii se lleva a cabo mediante un mecanismo alternativo, en el que se produce la adición de hidróxido a la cetona, seguida del colapso concertado del intermediario tetraédrico y la migración del carbono vecino con desplazamiento del haluro. Esto a veces se conoce como transposición pseudo-Favorskii o transposición cuazi-Favorskii, aunque antes de los estudios de etiquetado, se pensaba que todas las transposiciones de Favorskii se llevaban a cabo mediante este mecanismo.
 |
| Una animación del mecanismo de reacción. |
Degradación de Wallach
En la degradación de Wallach relacionada ( Otto Wallach , 1918), no uno sino dos átomos de halógeno flanquean la cetona, lo que da como resultado una nueva cetona contraída después de la oxidación y la descarboxilación [11] [12]
Reacción de Photo-Favorski
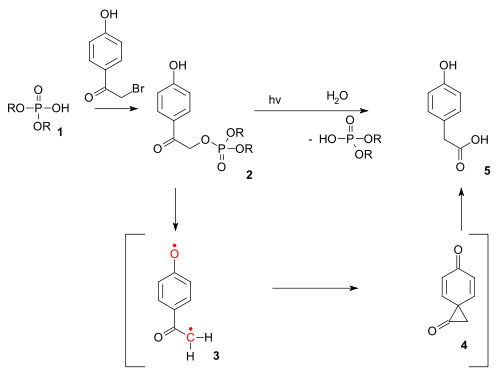
Este tipo de reacción también existe como reacción fotoquímica . La reacción foto-Favorskii se ha utilizado en el desbloqueo fotoquímico de ciertos fosfatos (por ejemplo, los de ATP ) protegidos por grupos p-hidroxifenacilo . [13] La desprotección se lleva a cabo a través de un dirradical triplete ( 3 ) y un intermedio diona espiro ( 4 ), aunque este último hasta ahora ha eludido la detección. [14]
Véase también
- Las síntesis de cubano proceden por reordenamientos de Favorskii: [15]
- Cicloadición de trimetilenmetano , que puede proceder a través de un mecanismo similar
- Reordenamiento de Homo-Favorskii , el reordenamiento de β-halocetonas y ciclobutanonas
Referencias
- ^ Cope, Arthur (1960). Reacción orgánica, volumen XI (1.ª ed.). Nueva York: Wiley-Interscience . doi :10.1002/jps.2600500225. ISBN. 9780471171270.
- ^ Wohllebe, J.; Garbisch, EW (1977). "Contracción del anillo mediante un reordenamiento de tipo Favorskii: cicloundecanona". Organic Syntheses . 56 : 107. doi :10.15227/orgsyn.056.0107; Volúmenes recopilados , vol. 6, pág. 368.
- ^ Shioiri, Takayuki; Kawai, Nobutaka (1978). "Nuevos métodos y reactivos en síntesis orgánica. 2. Una conversión fácil de alquil aril cetonas a ácidos α-arilalcanoicos utilizando fosforazidato de difenilo. Su aplicación a una nueva síntesis de ibuprofeno y naproxeno, agentes antiinflamatorios no esteroideos". J. Org. Chem. 43 (14): 2936–2938. doi :10.1021/jo00408a049.
- ^ Hamada, Yasumasa; Shioiri, Takayuki (1982). "Ácido ciclondicanocarboxílico". Síntesis orgánicas . 62 : 191. doi : 10.15227/orgsyn.062.0191; Volúmenes recopilados , vol. 7, pág. 135.
- ^ Goheen, DW; Vaughan, WR (1963). "Ácido ciclopentanocarboxílico, éster metílico". Organic Syntheses . 39 : 37. doi :10.15227/orgsyn.039.0037; Volúmenes recopilados , vol. 4, pág. 594.
- ^ Favorskii, AE (1894). J. Russ. Phys. Chem. Soc. 26 : 590.
{{cite journal}}: CS1 maint: publicación periódica sin título ( enlace ) - ^ Favorskii, AE (1905). J. Russ. Phys. Chem. Soc. 37 : 643.
{{cite journal}}: CS1 maint: publicación periódica sin título ( enlace ) - ^ Faworsky, AY (1913). "Über die Einwirkung von Phosphorhalogenverbindungen auf Ketone, Bromketone und Ketonalkohole". J. Prakt. Química. (en alemán). 88 (1): 641–698. doi :10.1002/prac.19130880148.
- ^ Kurti 1 Czako 2, Laszlo 1 Barbara 2 (15 de septiembre de 2005). Aplicaciones estratégicas de reacciones con nombre en síntesis orgánica . Elsevier . págs. 164-165. ISBN. 0-12-429785-4.
{{cite book}}: CS1 maint: nombres numéricos: lista de autores ( enlace ) - ^ Akhrem, AA; Ustynyuk, TK; Titov, Yu A (30 de septiembre de 1970). "El reordenamiento de Favorskii". Russian Chemical Reviews . 39 (9): 732–746. Código Bibliográfico :1970RuCRv..39..732A. doi :10.1070/rc1970v039n09abeh002019. ISSN 0036-021X.
- ^ Wallach, O. (1918). "Zur Kenntnis der Terpene und der ätherischen Öle. Über das Verhalten zweifach gebromter hexacyclischer Ketone in Abhängigkeit von der Stellung der Bromatome". Justus Liebigs Ann. Química. (en alemán). 414 (3): 271–296. doi :10.1002/jlac.19184140303.
- ^ Wallach, O. (1918). "Zur Kenntnis der Terpene und der ätherischen Öle". Justus Liebigs Ann. Química. (en alemán). 414 (3): 296–366. doi :10.1002/jlac.19184140304.
- ^ Park, Chan-Ho; Givens, Richard S. (1997). "Nuevos grupos protectores fotoactivados. 6. p -Hidroxifenacilo: un fotoactivador para sondas químicas y bioquímicas". J. Am. Chem. Soc. 119 (10): 2453–2463. doi :10.1021/ja9635589.
- ^ Givens, Richard S.; Heger, Dominik; Hellrung, Bruno; Kamdzhilov, Yavor; Mac, Marek; Conrad, Peter G.; Cope, Elizabeth; Lee, Jong I.; Mata-Segreda, Julio F.; Schowen, Richard L.; Wirz, Jakob (2008). "La reacción de foto-favorskii de compuestos de p-hidroxifenacilo se inicia mediante extrusión adiabática asistida por agua de un triplete birradical". J. Am. Chem. Soc. 130 (11): 3307–3309. doi :10.1021/ja7109579. PMC 3739295 . PMID 18290649.
- ^ Eaton, Philip E.; Cole, Thomas W. (1964). "Cubano". J. Am. Química. Soc. 86 (15): 3157–3158. doi:10.1021/ja01069a041.