Proceso de Stöber
El proceso Stöber es un proceso químico utilizado para preparar sílice ( SiO
2) partículas [1] de tamaño controlable y uniforme [2] para aplicaciones en ciencia de materiales . Fue pionero [3] cuando fue reportado por Werner Stöber y su equipo en 1968, [1] y sigue siendo hoy el enfoque sintético de química húmeda más utilizado para nanopartículas de sílice . [3] Es un ejemplo de un proceso sol-gel en el que un precursor molecular (típicamente tetraetilortosilicato ) primero reacciona con agua en una solución alcohólica, y las moléculas resultantes luego se unen para construir estructuras más grandes. La reacción produce partículas de sílice con diámetros que varían de 50 a 2000 nm , dependiendo de las condiciones. El proceso ha sido investigado activamente desde su descubrimiento, incluidos los esfuerzos para comprender su cinética y mecanismo : se encontró que un modelo de agregación de partículas se ajustaba mejor a los datos experimentales [4] que el modelo LaMer inicialmente hipotetizado. [5] [6] Los nuevos conocimientos adquiridos han permitido a los investigadores ejercer un alto grado de control sobre el tamaño y la distribución de las partículas y ajustar las propiedades físicas del material resultante para adaptarlo a las aplicaciones previstas.
En 1999 se informó de una modificación en dos etapas [7] que permitió la formación controlada de partículas de sílice con pequeños agujeros . [8] El proceso se lleva a cabo a un pH bajo en presencia de una molécula tensioactiva . La etapa de hidrólisis se completa con la formación de una microemulsión [9] antes de añadir fluoruro de sodio para nucleación en el proceso de condensación. El surfactante no iónico se quema para producir poros vacíos, lo que aumenta el área superficial y altera las características de la superficie de las partículas resultantes, lo que permite un control mucho mayor sobre las propiedades físicas del material. [7] También se han realizado trabajos de desarrollo para estructuras de poros más grandes, como monolitos macroporosos , [10] partículas de núcleo de cubierta basadas en poliestireno , [11] ciclenos , [12] o poliaminas , [13] y esferas de carbono. [14]
La sílice producida mediante el proceso Stöber es un material ideal para servir como modelo para estudiar los fenómenos coloidales [15] debido a la monodispersidad (uniformidad) de sus tamaños de partícula. [16] Las nanopartículas preparadas mediante el proceso Stöber han encontrado aplicaciones que incluyen la administración de medicamentos dentro de las estructuras celulares [17] y en la preparación de biosensores . [18] Los materiales Stöber de sílice porosa tienen aplicaciones en catálisis [19] y cromatografía líquida [20] debido a su gran área superficial y sus estructuras de poros uniformes, ajustables y altamente ordenadas. Los aislantes térmicos altamente efectivos conocidos como aerogeles también se pueden preparar utilizando métodos Stöber, [15] y las técnicas Stöber se han aplicado para preparar sistemas de aerogeles sin sílice. [21] Aplicando técnicas de secado supercrítico , se puede preparar un aerogel de sílice Stöber con una superficie específica de 700 m 2 ⋅g −1 y una densidad de 0,040 g⋅cm −3 . [22] La NASA ha preparado aerogeles de sílice con un enfoque de proceso Stöber para las misiones Mars Pathfinder y Stardust . [23]
Proceso de un solo paso
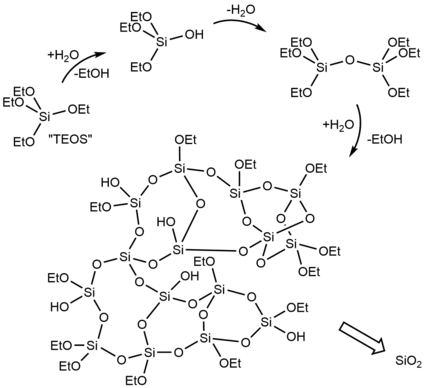
El proceso Stöber es un método sol-gel para preparar sílice esférica monodispersa (uniforme) ( SiO
2) materiales que fue desarrollado por un equipo dirigido por Werner Stöber y reportado en 1968. [1] El proceso, una evolución y extensión de la investigación descrita en la tesis doctoral de Gerhard Kolbe de 1956, [24] fue un descubrimiento innovador que todavía tiene amplias aplicaciones más de 50 años después. [3] Ortosilicato de tetraetilo precursor de sílice ( Si(O Et )
4, TEOS) se hidroliza en alcohol (normalmente metanol o etanol ) en presencia de amoníaco [ aclaración necesaria ] como catalizador : [1] [25]
La reacción produce etanol y una mezcla de etoxisilanoles ( como Si(OEt)
3OH , Si(OEt)
2(OH)
2, e incluso Si(OH)
4), que luego puede condensarse con TEOS u otro silanol con pérdida de alcohol o agua: [25]
La hidrólisis posterior de los grupos etoxi y la condensación posterior conducen a la reticulación . Es un proceso de un solo paso , ya que las reacciones de hidrólisis y condensación ocurren juntas en un solo recipiente de reacción. [1]
El proceso produce partículas microscópicas de sílice coloidal con diámetros que van desde 50 a 2000 nm ; los tamaños de partícula son bastante uniformes y la distribución está determinada por la elección de condiciones como las concentraciones de reactivos , catalizadores y temperatura. [2] Se forman partículas más grandes cuando se aumentan las concentraciones de agua y amoníaco, pero con la consiguiente ampliación de la distribución del tamaño de partícula. [26] La concentración inicial de TEOS es inversamente proporcional al tamaño de las partículas resultantes; por lo tanto, las concentraciones más altas en promedio conducen a partículas más pequeñas debido al mayor número de sitios de nucleación , pero con una mayor dispersión de tamaños. Pueden resultar partículas con formas irregulares cuando la concentración inicial del precursor es demasiado alta. [26] El proceso depende de la temperatura, y el enfriamiento (y, por lo tanto, las velocidades de reacción más lentas ) conducen a un aumento monótono del tamaño promedio de partícula, pero el control sobre la distribución del tamaño no se puede mantener a temperaturas demasiado bajas. [2]
Proceso de dos pasos
En 1999, Cédric Boissière y su equipo desarrollaron un proceso de dos pasos mediante el cual se completa la hidrólisis a un pH bajo (1 – 4) antes de que se inicie la reacción de condensación mediante la adición de fluoruro de sodio (NaF). [7] El procedimiento de dos pasos incluye la adición de una plantilla de surfactante no iónico para producir finalmente partículas de sílice mesoporosas . [8] La principal ventaja de secuenciar las reacciones de hidrólisis y condensación es la capacidad de asegurar la homogeneidad completa del surfactante y la mezcla precursora de TEOS. En consecuencia, el diámetro y la forma de las partículas del producto, así como el tamaño de los poros, están determinados únicamente por la cinética de la reacción y la cantidad de fluoruro de sodio introducido; los niveles de fluoruro relativos más altos producen un mayor número de sitios de nucleación y, por lo tanto, partículas más pequeñas. [7] La disociación del proceso de hidrólisis y condensación proporciona un nivel de control del producto que es sustancialmente superior al que ofrece el proceso Stöber de un solo paso, con un tamaño de partícula controlado casi por completo por la relación fluoruro de sodio/TEOS. [7]
El proceso Stöber de dos pasos comienza con una mezcla de TEOS, agua, alcohol y un surfactante no iónico, a la que se agrega ácido clorhídrico para producir una microemulsión . [9] Esta solución se deja reposar hasta que se complete la hidrólisis, de manera muy similar al proceso Stöber de un solo paso, pero con el ácido clorhídrico reemplazando al amoníaco como catalizador. Se agrega fluoruro de sodio a la solución homogénea resultante, iniciando la reacción de condensación al actuar como semilla de nucleación. [7] Las partículas de sílice se recolectan por filtración y se calcinan para eliminar la plantilla de surfactante no iónico por combustión, lo que da como resultado el producto de sílice mesoporosa.
La selección de las condiciones para el proceso permite controlar el tamaño de los poros, el diámetro de las partículas y sus distribuciones, como en el caso del enfoque de un solo paso. [8] La porosidad en el proceso modificado se puede controlar mediante la introducción de un agente de hinchamiento, la elección de la temperatura y la cantidad de catalizador de fluoruro de sodio añadido. Un agente de hinchamiento (como el mesitileno ) provoca aumentos en el volumen y, por lo tanto, en el tamaño de los poros, a menudo por absorción de disolvente , pero está limitado por la solubilidad del agente en el sistema. [9] El tamaño de los poros varía directamente con la temperatura, [7] limitada por el punto de enturbiamiento del surfactante y el punto de ebullición del agua. La concentración de fluoruro de sodio produce cambios directos pero no lineales en la porosidad, y el efecto disminuye a medida que la concentración de fluoruro añadido tiende a un límite superior. [27]
Cinética
El modelo LaMer para la cinética de la formación de hidrosoles [5] es ampliamente aplicable para la producción de sistemas monodispersos, [28] y originalmente se planteó la hipótesis de que el proceso Stöber seguía este modelo de adición de monómeros . [6] Este modelo incluye una rápida explosión de nucleación que forma todos los sitios de crecimiento de partículas, luego procede con la hidrólisis como el paso limitante de la velocidad para la condensación de monómeros de trietilsilanol en los sitios de nucleación. [29] La producción de tamaños de partículas monodispersos se atribuye a la adición de monómeros que ocurre a un ritmo más lento en partículas más grandes como consecuencia de la transferencia de masa limitada por difusión de TEOS. [30] Sin embargo, la evidencia experimental demuestra que la concentración de TEOS hidrolizado se mantiene por encima de la requerida para la nucleación hasta el final de la reacción, y la introducción de núcleos de crecimiento sembrados no coincide con la cinética de un proceso de adición de monómeros. En consecuencia, el modelo LaMer ha sido rechazado a favor de un modelo cinético basado en el crecimiento a través de la agregación de partículas . [4]
En un modelo basado en la agregación, los sitios de nucleación se generan y absorben continuamente, y la fusión conduce al crecimiento de partículas. [31] La generación de los sitios de nucleación y la energía de interacción entre las partículas fusionadas determinan la cinética general de la reacción. [32] La generación de los sitios de nucleación sigue la siguiente ecuación: [31]
donde J es la tasa de nucleación, k 1 y k 2 son constantes de velocidad basadas en las concentraciones de H 2 O y NH 3 y g s es el factor de normalización basado en la cantidad de precursor de sílice. El ajuste de las proporciones de concentración de estos compuestos influye directamente en la velocidad a la que se producen los sitios de nucleación. [31]
La fusión de los sitios de nucleación entre partículas está influenciada por sus energías de interacción. La energía de interacción total depende de tres fuerzas: repulsión electrostática de cargas iguales, atracción de van der Waals entre partículas y los efectos de la solvatación . [32] Estas energías de interacción (ecuaciones a continuación) describen el proceso de agregación de partículas y demuestran por qué el proceso de Stöber produce partículas de tamaño uniforme.
Las fuerzas de atracción de van der Waals están gobernadas por la siguiente ecuación: [32]
donde A H es la constante de Hamaker , R es la distancia entre los centros de las dos partículas y a 1 , a 2 son los radios de las dos partículas. Para la fuerza de repulsión electrostática la ecuación es la siguiente: [32]
- dónde
Donde ε es la constante dieléctrica del medio, k B es la constante de Boltzmann , e es la carga elemental , T es la temperatura absoluta , κ es la longitud de Debye inversa para un electrolito 1:1, x es la distancia (variable) entre las partículas y φ 0 es el potencial de superficie. El componente final de la energía de interacción total es la repulsión de solvatación que es como sigue: [32]
donde A s es el factor preexponencial (1,5 × 10 −3 J⋅m −2 ) y L es la longitud de desintegración (1 × 10 −9 m).
Este modelo de agregación controlada por crecimiento se ajusta a las observaciones experimentales realizadas con técnicas de dispersión de rayos X de ángulo pequeño [33] y predice con precisión el tamaño de las partículas en función de las condiciones iniciales. Además, los datos experimentales obtenidos con técnicas como el análisis de microgravedad [34] y el análisis de pH variable [35] coinciden con las predicciones del modelo de crecimiento de agregados.
Variaciones morfológicas
Se pueden preparar varios motivos estructurales y compositivos diferentes mediante el proceso Stöber mediante la adición de compuestos químicos a la mezcla de reacción . Estos aditivos pueden interactuar con la sílice a través de medios químicos y/o físicos durante o después de la reacción, lo que produce cambios sustanciales en la morfología de las partículas de sílice.
Sílice mesoporosa

El proceso Stöber de un solo paso se puede modificar para fabricar sílice porosa añadiendo una plantilla de surfactante a la mezcla de reacción y calcinando las partículas resultantes. [36] Los surfactantes que se han utilizado incluyen bromuro de cetrimonio , [37] cloruro de cetiltrimetilamonio , [38] y glicerol . [39] El surfactante forma micelas , pequeñas bolas casi esféricas con un interior hidrófobo y una superficie hidrófila, alrededor de las cuales crece la red de sílice, produciendo partículas con canales llenos de surfactante y solvente. [40] La calcinación del sólido conduce a la eliminación de las moléculas de surfactante y solvente por combustión y/o evaporación, dejando huecos de mesoporo en toda la estructura, como se ve en la ilustración de la derecha. [36] [40]
La variación de la concentración de surfactante permite controlar el diámetro y el volumen de los poros y, por lo tanto, el área superficial del material del producto. [37] El aumento de la cantidad de surfactante conduce a aumentos en el volumen total de poros y, por lo tanto, en el área superficial de las partículas, pero los diámetros de poro individuales permanecen sin cambios. [38] La alteración del diámetro de poro se puede lograr variando la cantidad de amoníaco utilizada en relación con la concentración de surfactante; el amoníaco adicional conduce a poros con diámetros mayores, pero con una disminución correspondiente en el volumen total de poros y el área superficial de las partículas. [37] El tiempo permitido para que se lleve a cabo la reacción también influye en la porosidad, ya que mayores tiempos de reacción conducen a aumentos en el volumen total de poros y el área superficial de las partículas. Los tiempos de reacción más largos también conducen a aumentos en el tamaño general de las partículas de sílice y disminuciones relacionadas en la uniformidad de la distribución del tamaño. [37]
Monolito macroporoso
La adición de polietilenglicol (PEG) al proceso hace que las partículas de sílice se agreguen en un bloque continuo macroporoso , lo que permite el acceso a una morfología monolítica. [10] Se requieren polímeros de PEG con grupos terminales alilo o sililo con un peso molecular de más de 2000 g⋅mol −1 . El proceso Stöber se inicia en condiciones de pH neutro, de modo que los polímeros de PEG se congreguen alrededor del exterior de las partículas en crecimiento, lo que proporciona estabilización. Una vez que los agregados son lo suficientemente grandes, las partículas estabilizadas con PEG entrarán en contacto y se fusionarán irreversiblemente entre sí mediante una "agregación pegajosa" entre las cadenas de PEG. [10] Esto continúa hasta que se ha producido la floculación completa de todas las partículas y se ha formado el monolito, momento en el que el monolito puede calcinarse y eliminarse el PEG, lo que da como resultado un monolito de sílice macroporoso. Tanto el tamaño de las partículas como la agregación pegajosa se pueden controlar variando el peso molecular y la concentración de PEG.
Partículas de núcleo-capa
Varios aditivos, incluidos el poliestireno , [11] cyclon , [12] y las poliaminas , [13] en el proceso Stöber permiten la creación de partículas de sílice con núcleo de cubierta. Se han descrito dos configuraciones de la morfología de núcleo de cubierta. Una es un núcleo de sílice con una cubierta exterior de un material alternativo como el poliestireno. La segunda es una cubierta de sílice con un núcleo morfológicamente diferente como una poliamina.
La creación de partículas compuestas de núcleo de sílice/poliestireno comienza con la creación de los núcleos de sílice mediante el proceso Stöber de un solo paso. Una vez formadas, las partículas se tratan con ácido oleico , que se propone que reaccione con los grupos silanol de la superficie. [11] El estireno se polimeriza alrededor de los núcleos de sílice modificados con ácidos grasos. En virtud de la distribución del tamaño de los núcleos de sílice, el estireno se polimeriza a su alrededor de manera uniforme, lo que da como resultado partículas compuestas de tamaño similar. [11]
Las partículas de sílice creadas con cyclen y otros ligandos de poliamina se crean de una manera muy diferente. Las poliaminas se añaden a la reacción de Stöber en los pasos iniciales junto con el precursor de TEOS. [13] Estos ligandos interactúan con el precursor de TEOS, lo que da como resultado un aumento en la velocidad de hidrólisis; sin embargo, como resultado, se incorporan a los coloides de sílice resultantes . [12] Los ligandos tienen varios sitios de nitrógeno que contienen pares solitarios de electrones que interactúan con los grupos terminales hidrolizados de TEOS. En consecuencia, la sílice se condensa alrededor de los ligandos encapsulándolos. Posteriormente, las cápsulas de sílice/ligando se pegan para crear partículas más grandes. Una vez que todo el ligando ha sido consumido por la reacción, el TEOS restante se agrega alrededor del exterior de las nanopartículas de sílice/ligando, creando una capa exterior de sílice sólida. [12] La partícula resultante tiene una capa de sílice sólida y un núcleo interno de ligandos envueltos en sílice. Los tamaños de los núcleos y capas de las partículas se pueden controlar mediante la selección de la forma de los ligandos junto con las concentraciones iniciales agregadas a la reacción. [13]
Esferas de carbono
Se ha utilizado un proceso similar al de Stöber para producir esferas de carbono monodispersas utilizando resina de resorcinol - formaldehído en lugar de un precursor de sílice. [14] El proceso modificado permite la producción de esferas de carbono con superficies lisas y un diámetro que varía de 200 a 1000 nm. [14] A diferencia del proceso de Stöber basado en sílice, esta reacción se completa a pH neutro y el amoníaco tiene un papel en la estabilización de las partículas de carbono individuales al evitar la autoadhesión y la agregación, además de actuar como catalizador. [41]
Ventajas y aplicaciones

Una ventaja importante del proceso Stöber es que puede producir partículas de sílice que son casi monodispersas, [16] y por lo tanto proporciona un modelo ideal para su uso en el estudio de fenómenos coloidales. [15] Fue un descubrimiento pionero cuando se publicó por primera vez, permitiendo la síntesis de partículas esféricas de sílice monodispersas de tamaños controlados, y en 2015 sigue siendo el enfoque de química húmeda más utilizado para las nanopartículas de sílice. [3]
El proceso proporciona un enfoque conveniente para preparar nanopartículas de sílice para aplicaciones que incluyen la administración intracelular de fármacos [17] y la biodetección . [18] Las nanopartículas de sílice mesoporosas preparadas mediante procesos Stöber modificados tienen aplicaciones en el campo de la catálisis [19] y la cromatografía líquida . [20] Además de la monodispersidad, estos materiales tienen áreas de superficie muy grandes , así como estructuras de poros uniformes, ajustables y altamente ordenadas, [20] lo que hace que la sílice mesoporosa sea excepcionalmente atractiva para estas aplicaciones.


Aerogeles
Los aerogeles son materiales ultraligeros altamente porosos en los que el componente líquido de un gel ha sido reemplazado por un gas , [44] y son notables por ser sólidos que son aislantes térmicos extremadamente efectivos [43] [45] con una densidad muy baja . [46] Los aerogeles se pueden preparar de diversas formas, y aunque la mayoría se han basado en sílice, [45] se han reportado y explorado materiales basados en zirconia , titania , celulosa , poliuretano y sistemas de resorcinol - formaldehído , entre otros. [47] La principal desventaja de un aerogel a base de sílice es su fragilidad, aunque la NASA los ha usado para aislamiento en los rovers de Marte , [48] el Mars Pathfinder y se han usado comercialmente para mantas aislantes y entre paneles de vidrio para paneles translúcidos de iluminación natural. [45] Los geles particulados preparados por el proceso Stöber se pueden deshidratar rápidamente para producir aerogeles de sílice altamente efectivos, así como xerogeles . [15] El paso clave es el uso de la extracción con fluidos supercríticos para eliminar el agua del gel mientras se mantiene la estructura del gel, lo que generalmente se hace con dióxido de carbono supercrítico , [45] como lo hace la NASA. [23] Los aerogeles resultantes son aislantes térmicos muy efectivos debido a su alta porosidad con poros muy pequeños (en el rango nanométrico ). La conducción de calor a través de la fase gaseosa es deficiente, y como la estructura inhibe en gran medida el movimiento de las moléculas de aire a través de la estructura, la transferencia de calor a través del material es deficiente, [45] como se puede ver en la imagen de la derecha donde el calor de un mechero Bunsen se transfiere tan mal que los crayones que descansan sobre el aerogel no se derriten. [43] Debido a su baja densidad, los aerogeles también se han utilizado para capturar partículas de polvo interestelar con cambios de calor mínimos al desacelerarlas (para evitar cambios inducidos por el calor en las partículas) como parte de la misión Stardust . [23]
Un método para producir un aerogel de sílice utiliza un proceso Stöber modificado y secado supercrítico . El producto aparece translúcido con un tinte azul como consecuencia de la dispersión de Rayleigh ; cuando se coloca frente a una fuente de luz, la luz transmitida se vuelve amarillenta porque la azul se ha dispersado. [22] Este aerogel tiene una superficie de 700 m 2 ⋅g −1 y una densidad de 0,040 g⋅cm −3 ; [22] en contraste, la densidad del aire es 0,0012 g⋅cm −3 (a 15 °C y 1 atm ).
Los aerogeles de sílice ocuparon 15 lugares en el Libro Guinness de los récords en 2011, entre ellos el de mejor aislante y sólido de menor densidad, aunque el aerografito se llevó este último título en 2012. [49]
El aerografeno , con una densidad de solo el 13% de la del aire a temperatura ambiente y menos denso que el gas helio , se convirtió en el sólido de menor densidad desarrollado hasta ahora en 2013. [50] [51] Se han aplicado métodos similares a los de Stöber en la preparación de aerogeles en sistemas sin sílice. [21] La NASA ha desarrollado aerogeles de sílice con un recubrimiento de polímero para reforzar la estructura, [48] produciendo un material aproximadamente dos órdenes de magnitud más fuerte para la misma densidad, y también aerogeles de polímero, que son flexibles y se pueden formar en una película delgada doblable. [45]
Sílice coloidal
La sílice coloidal se utiliza ampliamente en la fundición de metales.
Ópalos sintéticos
El proceso Stöber se puede utilizar para producir partículas esféricas para hacer crecer mineraloides de ópalo brillantes. [a] [52] [53]
Notas
- ^ Al menos dos investigaciones lo han informado.
Referencias
- ^ abcde Stöber, Werner; Fink, Arthur; Bohn, Ernst (enero de 1968). "Crecimiento controlado de esferas de sílice monodispersas en el rango de tamaño micrométrico". Journal of Colloid and Interface Science . 26 (1): 62–69. Bibcode :1968JCIS...26...62S. doi :10.1016/0021-9797(68)90272-5.
- ^ abc Bogush, GH; Tracy, MA; Zukoski, CF (agosto de 1988). "Preparación de partículas de sílice monodispersas: control del tamaño y la fracción de masa". Journal of Non-Crystalline Solids . 104 (1): 95–106. Bibcode :1988JNCS..104...95B. CiteSeerX 10.1.1.471.9863 . doi :10.1016/0022-3093(88)90187-1.
- ^ abcd Kicklebick, Guido (2015). "Nanopartículas y materiales compuestos". En Levy, David; Zayat, Marcos (eds.). El manual Sol-Gel: síntesis, caracterización y aplicaciones . Vol. 3. John Wiley & Sons . págs. 227–244. ISBN 9783527334865.
- ^ ab Bogush, GH; Zukoski, CF (marzo de 1991). "Estudios de la cinética de la precipitación de partículas de sílice uniformes a través de la hidrólisis y condensación de alcóxidos de silicio". Journal of Colloid and Interface Science . 142 (1): 1–18. Bibcode :1991JCIS..142....1B. doi :10.1016/0021-9797(91)90029-8.
- ^ ab LaMer, Victor K.; Dinegar, Robert H. (1950). "Teoría, producción y mecanismo de formación de hidrosoles monodispersos". J. Am. Chem. Soc. 72 (11): 4847–4854. doi :10.1021/ja01167a001.
- ^ ab Matsoukas, T; Gulari, Erdogan (julio de 1988). "Dinámica del crecimiento de partículas de sílice a partir de la hidrólisis catalizada por amoníaco de tetra-etil-ortosilicato". Journal of Colloid and Interface Science . 124 (1): 252–261. Bibcode :1988JCIS..124..252M. doi :10.1016/0021-9797(88)90346-3. hdl : 2027.42/27243 .
- ^ abcdefg Boissière, Cédric; van der Lee, Arie; Mansouri, Abdeslam El; Larbot, André; Prouzet, Eric (1999). "Una síntesis en doble paso de partículas de sílice MSU-X esféricas micrométricas mesoporosas". Comunicaciones químicas (20): 2047–2048. doi :10.1039/A906509A.
- ^ abc Boissière, Cédric; Larbot, André; van der Lee, Arie; Kooyman, Patricia J.; Prouzet, Eric (octubre de 2000). "Una nueva síntesis de sílice mesoporosa MSU-X controlada por una vía de dos pasos". Química de materiales . 12 (10): 2902–2913. doi :10.1021/cm991188s.
- ^ abc Prouzet, Éric; Boissière, Cédric (marzo de 2005). "Una revisión sobre la síntesis, estructura y aplicaciones en procesos de separación de sílice mesoporosa MSU-X obtenida con el proceso de dos pasos". Comptes Rendus Chimie . 8 (3–4): 579–596. doi :10.1016/j.crci.2004.09.011.
- ^ abc Cademartiri, Rebecca; Brook, Michael A.; Pelton, Robert; Brennan, John D. (2009). "Sílice macroporosa utilizando un proceso Stöber "pegajoso". Revista de química de materiales . 19 (11): 1583. doi :10.1039/B815447C. S2CID 94969948.
- ^ abcd Ding, Xuefeng; Zhao, Jingzhe; Liu, Yanhua; Zhang, Hengbin; Wang, Zichen (octubre de 2004). "Nanopartículas de sílice encapsuladas por poliestireno mediante injerto de superficie y polimerización en emulsión in situ". Materials Letters . 58 (25): 3126–3130. doi :10.1016/j.matlet.2004.06.003.
- ^ abcd Masse, Sylvie; Laurent, Guillaume; Coradin, Thibaud (2009). "Influencia de las poliaminas cíclicas en la formación de sílice durante el proceso de Stöber". Química física Química Física . 11 (43): 10204–10. Bibcode :2009PCCP...1110204M. doi :10.1039/B915428K. PMID 19865778. S2CID 37342876.
- ^ abcd Masse, Sylvie; Laurent, Guillaume; Chuburu, Françoise; Cadiou, Cyril; Déchamps, Isabelle; Coradin, Thibaud (abril de 2008). "Modificación del proceso Stöber mediante un poliazamacrociclo que conduce a nanopartículas de sílice de núcleo-capa inusuales". Langmuir . 24 (8): 4026–4031. doi :10.1021/la703828v. PMID 18303930.
- ^ abc Liu, Jian; Qiao, Shi Zhang; Liu, Hao; Chen, Jun; Orpe, Ajay; Zhao, Dongyuan; Lu, Gao Qing Max (20 de junio de 2011). "Extensión del método Stöber a la preparación de polímeros de resina de resorcinol-formaldehído monodispersos y esferas de carbono". Angewandte Chemie International Edition . 50 (26): 5947–5951. doi :10.1002/anie.201102011. PMID 21630403.
- ^ abcd Berg, John C. (2009). "Sistemas coloidales: fenomenología y caracterización". Introducción a las interfaces y los coloides: el puente hacia la nanociencia . World Scientific Publishing . pp. 367–368, 452–454. Bibcode :2009iicb.book.....B. ISBN 9789813100985.
- ^ ab Boday, Dylan J.; Wertz, Jason T.; Kuczynski, Joseph P. (2015). "Funcionalización de nanopartículas de sílice para la prevención de la corrosión del metal subyacente". En Kong, Eric SW (ed.). Nanomateriales, polímeros y dispositivos: funcionalización de materiales y fabricación de dispositivos . John Wiley & Sons . págs. 121–140. ISBN 9781118866955.
- ^ ab Quignard, Sandrine; Masse, Sylvie; Coradin, Thibaud (2011). "Nanopartículas basadas en sílice para la administración intracelular de fármacos". En Prokop, Ales (ed.). Administración intracelular . Fundamental Biomedical Technologies. Vol. 5. Springer Science & Business Media . págs. 333–361. doi :10.1007/978-94-007-1248-5_12. ISBN . 9789400712485.
- ^ ab Ju, Huangxian; Xueji, Zhang; Wang, Joseph (2011). "Biosensores basados en matrices de nanopartículas sol-gel". NanoBiosensing . Física biológica y médica, Ingeniería biomédica. Springer Science & Business Media . págs. 305–332. doi :10.1007/978-1-4419-9622-0_10. ISBN 9781441996220.
- ^ ab Giraldo, LF; López, BL; Pérez, L.; Urrego, S.; Sierra, L.; Mesa, M. (noviembre de 2007). "Aplicaciones de sílice mesoporosa". Simposios Macromoleculares . 258 (1): 129-141. doi :10.1002/masy.200751215.
- ^ ab Qiu, Bocheng; Xing, Mingyang; Zhang, Jinlong (2015). "Método similar a Stöber para sintetizar aerogeles de Fe2O3/grafeno ultraligeros, porosos y estirables para un excelente rendimiento en la reacción foto-Fenton y en condensadores electroquímicos". J. Mater . Chem. A . 3 (24): 12820–12827. doi :10.1039/C5TA02675J.
- ^ abc Steiner, Stephen. "Aerogel de sílice (TEOS, catalizado por bases)". aerogel.org . Consultado el 21 de noviembre de 2016 .
- ^ abcde "Aerogel". Misión Stardust de la NASA . Laboratorio de Propulsión a Chorro , NASA . 31 de marzo de 2005. Consultado el 11 de diciembre de 2016.
El aerogel se fabrica mediante el secado a alta temperatura y en un punto crítico de presión de un gel compuesto de unidades estructurales de sílice coloidal llenas de disolventes. El aerogel se preparó y se calificó para el vuelo en el Laboratorio de Propulsión a Chorro (JPL). El JPL también produjo aerogel para las misiones Mars Pathfinder y Stardust.
- ^ Kolbe, Gerhard (1956). Das Komplexchemische Verhalten der Kieselsäure (Ph.D.) (en alemán). Universidad Friedrich Schiller de Jena .
- ^ ab Van Blaaderen, A; Van Geest, J; Vrij, A (diciembre de 1992). "Esferas de sílice coloidal monodispersas de tetraalcoxisilanos: mecanismo de crecimiento y formación de partículas". Revista de ciencia de interfaces y coloides . 154 (2): 481–501. Código Bib : 1992JCIS..154..481V. CiteSeerX 10.1.1.531.1922 . doi :10.1016/0021-9797(92)90163-G.
- ^ ab Van Helden, AK; Jansen, JW; Vrij, A. (junio de 1981). "Preparación y caracterización de dispersiones esféricas de sílice monodispersa en disolventes no acuosos". Journal of Colloid and Interface Science . 81 (2): 354–368. Bibcode :1981JCIS...81..354V. doi :10.1016/0021-9797(81)90417-3.
- ^ Boissière, Cédric; Larbot, André; Bourgaux, Claudie; Prouzet, Eric; Bunton, Clifford A. (octubre de 2001). "Un estudio del mecanismo de ensamblaje de la síntesis en dos etapas de sílice mesoporosa MSU-X". Química de materiales . 13 (10): 3580–3586. doi :10.1021/cm011031b.
- ^ Sugimoto, Tadao (2006). "Nucleación y crecimiento de partículas monodispersas: mecanismos". En Somasundaran, P. (ed.). Enciclopedia de la ciencia de superficies y coloides . Vol. 7 (2.ª ed.). CRC Press . págs. 4257–4270. ISBN. 9780849395741.
- ^ Matsoukas, Themis; Gulari, Erdogan (octubre de 1989). "Crecimiento por adición de monómero con un paso de iniciación lento: un modelo de crecimiento para partículas de sílice a partir de alcóxidos". Journal of Colloid and Interface Science . 132 (1): 13–21. Bibcode :1989JCIS..132...13M. doi :10.1016/0021-9797(89)90210-5. hdl : 2027.42/27723 .
- ^ Matsoukas, Themis; Gulari, Erdogan (septiembre de 1991). "Revisión de las distribuciones autoafilantes: polidispersión en el crecimiento por adición de monómeros". Journal of Colloid and Interface Science . 145 (2): 557–562. Bibcode :1991JCIS..145..557M. doi :10.1016/0021-9797(91)90385-L.
- ^ abc Bogush, GH; Zukoski, CF (marzo de 1991). "Precipitación uniforme de partículas de sílice: un modelo de crecimiento agregativo". Journal of Colloid and Interface Science . 142 (1): 19–34. Bibcode :1991JCIS..142...19B. doi :10.1016/0021-9797(91)90030-C.
- ^ abcde Lee, Kangtaek; Sathyagal, Arun N.; McCormick, Alon V. (diciembre de 1998). "Una mirada más cercana a un modelo de agregación del proceso de Stöber". Coloides y superficies A: aspectos fisicoquímicos y de ingeniería . 144 (1–3): 115–125. doi :10.1016/S0927-7757(98)00566-4.
- ^ Boukari, H.; Lin, JS; Harris, MT (octubre de 1997). "Estudio de dispersión de rayos X de ángulo pequeño de la formación de partículas de sílice coloidal a partir de alcóxidos: ¿partículas primarias o no?". Journal of Colloid and Interface Science . 194 (2): 311–318. Bibcode :1997JCIS..194..311B. doi :10.1006/jcis.1997.5112. PMID 9398411.
- ^ Smith, David D.; Sibille, Laurent; Cronise, Raymond J.; Hunt, Arlon J.; Oldenburg, Steven J.; Wolfe, Daniel; Halas, Naomi J. (diciembre de 2000). "Efecto de la microgravedad en el crecimiento de nanoestructuras de sílice". Langmuir . 16 (26): 10055–10060. doi :10.1021/la000643s. hdl : 2060/20010057257 . S2CID 97817904.
- ^ Vogelsberger, Wolfram; Seidel, Andreas; Breyer, Tilo (abril de 2002). "Cinética de la formación de partículas de sol en función del pH estudiada mediante mediciones de viscosidad en soluciones de sílice". Langmuir . 18 (8): 3027–3033. doi :10.1021/la0114878.
- ^ ab Grün, Michael; Lauer, Iris; Unger, Klaus K. (marzo de 1997). "La síntesis de esferas de tamaño micrométrico y submicrométrico de óxido mesoporoso ordenado MCM-41". Materiales avanzados . 9 (3): 254–257. doi : 10.1002/adma.19970090317 . S2CID 135537204.
- ^ abcd Liu, Shiquan; Lu, Lingchao; Yang, Zhongxi; Cool, Pegie; Vansant, Etienne F. (junio de 2006). "Investigaciones adicionales sobre el método Stöber modificado para MCM-41 esférico". Química y física de materiales . 97 (2–3): 203–206. doi :10.1016/j.matchemphys.2005.09.003.
- ^ ab Kambara, Kumiko; Shimura, Naoki; Ogawa, Makoto (2007). "Síntesis a mayor escala de partículas esféricas de sílice nanoporosa templadas con tensioactivos mediante el método Stöber". Revista de la Sociedad de Cerámica de Japón . 115 (1341): 315–318. doi : 10.2109/jcersj.115.315 .
- ^ Vacassy, R.; Flatt, RJ; Hofmann, H.; Choi, KS; Singh, RK (julio de 2000). "Síntesis de esferas de sílice microporosas". Journal of Colloid and Interface Science . 227 (2): 302–315. Bibcode :2000JCIS..227..302V. doi :10.1006/jcis.2000.6860. PMID 10873314.
- ^ ab Herd, Heather; Ghandehari, Hamidreza (2016). "Características sintéticas y toxicológicas de los nanomateriales de sílice para aplicaciones de obtención de imágenes y administración de fármacos". En Sitharaman, Balaji (ed.). Nanobiomaterials Handbook . CRC Press . pág. 6-4. ISBN 9781420094671.
- ^ Lu, An-Hui; Hao, Guang-Ping; Sun, Qiang (19 de septiembre de 2011). "¿Se pueden crear esferas de carbono mediante el método Stöber?". Angewandte Chemie International Edition . 50 (39): 9023–9025. doi :10.1002/anie.201103514. PMID 21919134.
- ^ "Aerogel: humo azul misterioso" (PDF) . Laboratorio de Propulsión a Chorro , NASA . Consultado el 23 de noviembre de 2016 .
- ^ abc "Los aerogeles aíslan contra temperaturas extremas". Programa de transferencia de tecnología derivada de la NASA . 2010. Consultado el 11 de diciembre de 2016 .
- ^ Definiciones de términos relacionados con la estructura y el procesamiento de soles, geles, redes y materiales híbridos inorgánicos-orgánicos (Recomendaciones IUPAC 2007). Vol. 79. 2007. pp. 1801–1829. doi :10.1351/goldbook.A00173. ISBN 978-0-9678550-9-7.
{{cite book}}:|journal=ignorado ( ayuda ) - ^ abcdef Woods, Tori (28 de julio de 2011). «Aerogeles: más finos, más ligeros, más resistentes». Centro de Investigación Glenn , NASA . Consultado el 22 de noviembre de 2016 .
- ^ NASA (7 de mayo de 2002). «Guinness Records nombra al aerogel del JPL como el sólido más ligero del mundo». Laboratorio de Propulsión a Chorro . Archivado desde el original el 25 de mayo de 2009. Consultado el 25 de mayo de 2009 .
- ^ Aegerter, Michel A.; Leventis, Nicholas; Koebel, Matthias M., eds. (2011). Manual de aerogeles . Avances en materiales y tecnologías derivados de sol-gel. Springer Science & Business Media . ISBN. 9781441975898.
- ^ ab Meador, Mary Ann B. (2011). "Mejora de las propiedades elásticas de los aerogeles reforzados con polímeros". En Aegerter, Michel A.; Leventis, Nicholas; Koebel, Matthias M. (eds.). Manual de aerogeles . Avances en materiales y tecnologías derivados de sol-gel. Springer Science & Business Media . págs. 315–334. doi :10.1007/978-1-4419-75898-8_15 (inactivo el 1 de noviembre de 2024). ISBN 9781441975898.
{{cite book}}: CS1 maint: DOI inactivo a partir de noviembre de 2024 ( enlace ) - ^ Mecklenburg, Matthias (2012). "Aerographite: material de microtubos de carbono, de nanopared ultraligero y flexible con un rendimiento mecánico excepcional". Materiales avanzados . 24 (26): 3486–3490. doi :10.1002/adma.201200491. PMID 22688858. S2CID 2787227.
- ^ "Aerogel ultraligero producido en un laboratorio de la Universidad de Zhejiang". Universidad de Zhejiang . 19 de marzo de 2013. Archivado desde el original el 23 de mayo de 2013. Consultado el 21 de noviembre de 2016 .
- ^ Whitwam, Ryan (26 de marzo de 2013). «El aerogel de grafeno es el material más ligero del mundo». geek.com . Archivado desde el original el 27 de marzo de 2013. Consultado el 21 de noviembre de 2016 .
- ^ Gao, Weihong; Rigout, Muriel; Owens, Huw (diciembre de 2016). "Control sencillo de nanopartículas de sílice utilizando un nuevo método de variación de disolventes para la fabricación de cristales fotónicos de ópalo artificiales". Journal of Nanoparticle Research . 18 (12): 387. doi :10.1007/s11051-016-3691-8. ISSN 1388-0764. PMC 5161756 . PMID 28042282.
- ^ E. Anachkov, Svetoslav; Vasileva Tsanova, Penka (octubre de 2009), Preparación de ópalos directos bidimensionales mediante ensamblaje controlado de esferas de sílice







![{\displaystyle V_{\text{vdw}}=-{\frac {A_{\text{H}}}{6}}\left[{\frac {2a_{1}a_{2}}{R^{2}-(a_{1}+a_{2})^{2}}}+{\frac {2a_{1}a_{2}}{R^{2}-(a_{1}-a_{2})^{2}}}+\ln {\frac {R^{2}-(a_{1}+a_{2})^{2}}{R^{2}-(a_{1}-a_{2})^{2}}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f9844323e866e7025dce652ac04a90ef1c1015be)


![{\displaystyle V_{\text{solv}}=\pi A_{\text{s}}L\left[{\frac {2a_{1}a_{2}}{a_{1}+a_{2}}}\right]e^{\frac {-(R-a_{1}-a_{2})}{L}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c9d8ff949525431c03499bd0821a9d3b4b8e91bc)