Planctomicetos
| Planctomicetos | |
|---|---|
 | |
| Brocadia anammoxidans | |
| Clasificación científica | |
| Dominio: | Bacteria |
| Superfilo: | Superfilo PVC |
| Filo: | Planctomycetota Garrity y Holt 2021 [1] |
| Clases y órdenes [2] [3] | |
| |
| Sinónimos | |
| |
Los Planctomycetota son un filo de bacterias ampliamente distribuidas , que se encuentran tanto en hábitats acuáticos como terrestres. [5] Desempeñan un papel considerable en los ciclos globales del carbono y el nitrógeno, y muchas especies de este filo son capaces de realizar la oxidación anaeróbica del amonio, también conocida como anammox . [5] [6] Muchos Planctomycetota se encuentran en abundancia relativamente alta como biopelículas , [7] a menudo asociándose con otros organismos como macroalgas y esponjas marinas . [8]
Planctomycetota se incluye en el superfilo PVC junto con Verrucomicrobiota , Chlamydiota , Lentisphaerota , Kiritimatiellaeota y Candidatus Omnitrophica . [9] [10] El filo Planctomycetota está compuesto por las clases Planctomycetia y Phycisphaerae. Descritos por primera vez en 1924, los miembros de Planctomycetota se identificaron como eucariotas y solo se describieron como bacterias en 1972. [5] El examen temprano de los miembros de Planctomycetota sugirió un plan celular que difiere considerablemente de otras bacterias, aunque ahora se confirma que son bacterias Gram-negativas , pero con muchas características únicas.
Las bacterias de Planctomycetota son a menudo células pequeñas y esféricas, pero se observa una gran cantidad de variación morfológica. [11] Los miembros de Planctomycetota también muestran hábitos reproductivos distintos, y muchas especies se dividen por gemación , en contraste con todas las demás bacterias de vida libre, que se dividen por fisión binaria . [5] [12] [13]
Existe un creciente interés en los Planctomycetota con respecto a la biotecnología y las aplicaciones humanas, principalmente como fuente de moléculas bioactivas. [14] Además, algunos Planctomycetota fueron descritos recientemente como patógenos humanos. [8]
La especie Gemmata obscuriglobus ha sido identificada específicamente como una bacteria que comprende características únicas entre los Planctomycetota, [15] [16] como su capacidad para sintetizar esteroles . [5] [17] [15]
Estructura y morfología
Forma celular y apéndices
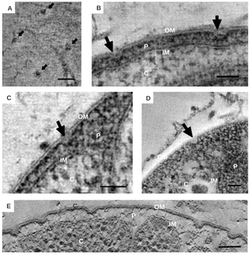
Las características morfológicas distintivas de las bacterias en Planctomycetota se han discutido extensamente. [6] La morfología común es a menudo células esféricas de aproximadamente 2 μm de diámetro, como se observa en la especie Aquisphaera giovannonii . Sin embargo, la diversidad en la forma de las células a menudo varía mucho en ellas. Se han descrito células ovoides y en forma de pera en algunas especies, y a menudo se presentan en rosetas de tres a 10 células. [11] Gemmata obscuriglobus es una especie bien estudiada en Planctomycetota con células esféricas. En contraste, las bacterias en la especie Planctopirus limnophila tienen células ovoides. [15]
Muchas especies de Planctomycetota presentan estructuras y apéndices en la superficie externa de la célula. También se han observado flagelos , comunes en la mayoría de las bacterias, en la especie P. limnophila. [5] [11] [18] Muchas Planctomycetota también tienen un soporte o tallo que une la célula a una superficie o sustrato. [5] [18] Sin embargo, los miembros de algunas especies, como Isosphaera pallida, carecen de un soporte. [5]
Se han observado apéndices únicos conocidos como estructuras crateriformes [5] [11] [18] en especies de Planctomycetota pertenecientes a la clase Planctomycetia. [13] La superficie exterior de las células en la especie P. limnophila muestra estructuras crateriformes grandes y pequeñas. Las estructuras crateriformes grandes a menudo cubren la superficie celular, mientras que las estructuras crateriformes pequeñas a menudo solo están al final de la célula. La microscopía óptica demostró fibras tanto de tipo tallo como de pili en P. limnophila y G. obscuriglobus . Las fibras de pili en ambas especies a menudo se asociaron con grandes estructuras crateriformes; en contraste, las fibras de tallo se asociaron con pequeñas estructuras crateriformes. [18]
Composición de la pared celular
Un estudio temprano de Planctomycetota sugirió que su plan celular difería considerablemente de las bacterias Gram-positivas y Gram-negativas . [5] Hasta hace poco, se pensaba que las bacterias de Planctomycetota carecían de peptidoglicanos en sus paredes celulares, y en su lugar se sugirió que tenían paredes celulares proteínicas. El peptidoglicano es un polímero esencial de glicanos, presente en todas las bacterias de vida libre, y su rigidez ayuda a mantener la integridad de la célula. La síntesis de peptidoglicano también es esencial durante la división celular . Recientemente, se descubrió que las de la especie G. obscuriglobus tenían peptidoglicano en sus paredes celulares. [5] [18]
Composición celular interna
Se pensaba que Planctomycetota mostraba una compartimentación distinta dentro del citosol . [5] [18] La reconstrucción por tomografía electrónica tridimensional de G. obscuriglobus mostró diversas interpretaciones de esta compartimentación sugerida. [16] Se sugirió que el citosol estaba separado en compartimentos, tanto el parifoplasma como el pirelulosoma, por una membrana intracitoplasmática. Desde entonces se ha demostrado que esta interpretación es incorrecta. De hecho, es bien sabido que la membrana intracitoplasmática es la membrana citoplasmática que muestra invaginaciones únicas , lo que da la apariencia de compartimentación dentro del citosol. [5] [16] [18] Por lo tanto, Planctomycetota muestra los dos compartimentos típicos de las bacterias Gram-negativas, el citoplasma y el periplasma .
El exceso de membrana observado en G. obscuriglobus triplica el área de superficie de la célula en relación con su volumen , lo que se sugiere que está asociado con la síntesis de esteroles. [16]
Pigmentos
Muchas especies de Planctomycetota presentan una coloración rosada o anaranjada, que se cree que es resultado de la producción de pigmentos carotenoides. Los carotenoides son producidos por plantas y hongos , y por algunas bacterias heterotróficas para proteger contra el estrés oxidativo . Se han identificado tres pigmentos carotenoides diferentes en dos cepas diferentes de Planctomycetota. [19]
En ambientes marinos, los Planctomycetota suelen estar suspendidos en la columna de agua o presentes como biopelículas en la superficie de las macroalgas, y suelen estar expuestos a la dañina radiación ultravioleta. Las especies más pigmentadas de Planctomycetota son más resistentes a la radiación ultravioleta, aunque esto aún no se comprende bien. [20] Desde entonces se ha demostrado que Planctomycetota sintetiza carotenoides C30 a partir de escualeno y que esta ruta del escualeno a los carotenoides C30 es la más extendida en procariotas. [21]
Características únicas de las células anammox
Las bacterias de Planctomycetota que son capaces de realizar anammox forman el orden Brocadiales. [22] Las células de las bacterias anammox suelen ser cocoides con un diámetro de aproximadamente 0,8 μm, [7] y se sugiere que contienen tres compartimentos, cada uno rodeado por una membrana. La membrana externa encierra la célula y el protoplasma y la membrana más interna rodea el anammoxosoma, la estructura central de las bacterias anammox. [18] [23] La membrana del anammoxosoma está compuesta en gran parte de lípidos inusuales basados en ladderanos . [23]
Historia de vida y reproducción
Crecimiento
Las especies de Planctomycetota crecen lentamente, en comparación con otras bacterias, [5] [10] [7] [24] a menudo forman estructuras en roseta de 3 a 5 células. [5] [24] Se sugiere que la especie P. limnophila tiene un crecimiento relativamente rápido, [5] [25] con un tiempo de duplicación de aproximadamente 6 a 14 días. En contraste, algunas otras Planctomycetota tienen tiempos de duplicación de alrededor de 30 días. [25] Su alta abundancia en muchos ecosistemas es sorprendente, dadas sus lentas tasas de crecimiento. [7] [10]
_and_in_current_PVC_species_(Right).jpg/440px-Representation_of_division_modes_in_the_last_PVC_common_ancestor_(Left)_and_in_current_PVC_species_(Right).jpg)
Ciclo vital
Los Planctomycetota a menudo realizan un cambio de estilo de vida entre una etapa de pedúnculo sésil y una etapa de nado libre. [24] Los miembros de la especie P. limnophila realizan un cambio de estilo de vida que a menudo está asociado con la división celular. La célula madre sésil produce una célula hija de nado libre. La célula hija debe luego adherirse a una superficie antes de comenzar el ciclo nuevamente. Sin embargo, no todos los Planctomycetota tienen una etapa móvil, y el cambio de estilo de vida observado en muchas especies puede no ser común entre todos los Planctomycetota. [5]
.jpg/440px-Fmicb-07-01964-g002_(1).jpg)
Reproducción
La comprensión actual de la división celular bacteriana se basa en organismos modelo como Escherichia coli . [15] La forma dominante de reproducción observada en casi todas las bacterias es la división celular por fisión binaria , que implica la síntesis tanto de peptidoglicanos como de proteínas conocidas como FtsZ . [15] [26] Por el contrario, muchas bacterias de Planctomycetota se dividen por gemación . [5] [12] [13]
Se sugiere que las proteínas FtsZ tienen una estructura similar a la de la tubulina , la proteína presente en los eucariotas, [27] y es esencial para la formación del tabique durante la división celular. [5] [6] La falta de proteínas FtsZ suele ser letal. [5] El peptidoglicano también juega un papel importante en la división celular por fisión binaria. [26]
Planctomycetota es uno de los únicos filos conocidos cuyos miembros carecen de proteínas FtsZ. [5] [26] [27] Las bacterias de Chlamydiales, también miembro del superfilo PVC, también carecen de FtsZ. [27] Aunque las bacterias de Planctomycetota carecen de FtsZ, se han observado dos modos distintos de división celular. [5] La mayoría de las especies de Planctomycetota se dividen por fisión binaria, principalmente las especies de la clase Phycisphaerae. En contraste, las especies de la clase Planctomycetia se dividen por gemación. [5] [12] [13]
Los mecanismos implicados en la gemación se han descrito ampliamente en el caso de las células de levadura . Sin embargo, la gemación bacteriana observada en Planctomycetota aún no se comprende bien. [15] La gemación se ha observado tanto en células radialmente simétricas, como en las bacterias de la especie P. limnophila , como en células axialmente simétricas. [13] Durante la división celular en los miembros de P. limnophila , las células hijas se originan en la región opuesta al polo con el pedúnculo.
Se ha observado una considerable diversidad en la división celular entre las bacterias de Planctomycetota. [12] [13] Durante la división celular en Fuerstia marisgermanicae , una estructura tubular está conectada desde la yema a la célula madre. [5] [22] La especie Kolteria novifilia forma un clado distinto de Planctomycetota, y es la única especie conocida que se divide por gemación lateral en el medio de la célula. Por último, los miembros del clado Saltatorellus son capaces de cambiar entre fisión binaria y gemación. [12] [13]
Caracteristicas genéticas
Firmas moleculares
Los Planctomycetota son conocidos por sus características celulares inusuales, y su distinción con respecto a todas las demás bacterias se ve respaldada además por la presencia compartida de dos indeles de firma conservados (CSI). [28] Estos CSI demarcan al grupo de los filos vecinos dentro del grupo PVC. [29] Se ha encontrado un CSI adicional que comparten todas las especies de Planctomycetota, con la excepción de Kuenenia stuttgartiensis. Esto respalda la idea de que K. stuttgartiensis forma una rama profunda dentro del filo Planctomycetota.
También se ha descubierto que un CSI es compartido por todo el superfilo PVC, incluido Planctomycetota. [28] [29] Planctomycetota también contiene una proteína característica conservada importante que se ha caracterizado por desempeñar una importante función de mantenimiento que es exclusiva de los miembros que pertenecen al superfilo PVC. [30]
Características generales
Se ha estimado que el tamaño del genoma de Rhodopirellula baltica es de más de 7 millones de bases, lo que lo convierte en uno de los genomas procariotas más grandes secuenciados. La duplicación extensa del genoma ocupa aproximadamente el 25% de la secuencia del genoma. [6] Esta puede ser una forma en que el organismo se adapta a las mutaciones , lo que permite la redundancia si una parte del genoma está dañada. El cebador de reacción en cadena de la polimerasa utilizado a menudo no coincide con los genes, lo que crea dificultades al secuenciar el genoma. [9]
Al compararlos bajo un microscopio, una característica definitoria de algunos Planctomycetota es que se puede identificar un único operón de ARNr no ligado cerca del origen. Los cambios de material genético se producen a través de una inversión cromosómica interna y no a través de una transferencia lateral de genes. Esto crea una forma de diversificación en las variantes de Planctomycetota, ya que múltiples genes de transposón en estas regiones tienen una orientación inversa que se transfiere a reordenamientos.
Algunas Planctomycetota prosperan en regiones que contienen nitrato altamente concentrado , [6] y tienen genes que son necesarios para la fermentación ácida heterotáctica. La enzima lactato deshidrogenasa juega un papel clave en este proceso. El proceso genético también tiene respuesta de protección contra la radiación ultravioleta , y está asociado con los genes recA, lexA, uvrA, uvrB y uvrC , además de un gen de fotoliasa que se expresa cuando el entorno ofrece un estrés excesivo por radiación ultravioleta. Otras respuestas al estrés incluyen la descomposición del peróxido de hidrógeno y la oxidación .
Muchos Planctomycetota también expresan genes de sulfatasa . El genoma de la cepa 1 de Pirellula sp. incorpora 110 genes que contribuyen a codificar proteínas que producen enzimas sulfatasas. En comparación con una especie diferente de procariota, Pseudomonas aeruginosa, solo existen 6 sulfatasas y los genes que expresan estas proteínas están contenidos en dos a cinco pares, generalmente agrupados en 22 grupos. [6]
Evolución molecular
Los Planctomycetota se originan dentro de las bacterias y estas similitudes entre las proteínas de Planctomycetales y eucariotas reflejan una evolución convergente . Las familias de proteínas adquiridas en Gemmataceae , un subgrupo dentro de Planctomycetota, tienen una baja similitud de secuencia con las proteínas eucariotas; sin embargo, muestran una similitud de secuencia más alta con otras familias de proteínas de Gemmataceae. [31]
Hay una aparición masiva de nuevas familias de proteínas dentro de las Gemmataceae . Más de mil familias de proteínas fueron adquiridas por duplicaciones y reordenamientos de dominios. Los nuevos parálogos funcionan en la transducción de señales , sistemas reguladores y vías de interacción de proteínas. Están relacionados con la organización funcional de la célula, lo que puede interpretarse como una adaptación a un estilo de vida más complejo. [31] La longitud de la proteína es mayor en las Gemmataceae que en la mayoría de las otras bacterias y los genes tienen enlaces. Existe una superposición entre las proteínas más largas en Planctomycetales y las proteínas más cortas en eucariotas. En términos de paralogía genética, longitud de proteína y estructuras de dominios proteicos, procariotas y eucariotas no tienen límites definidos. [31]
Filogenia
Originalmente clasificado como eucariota debido a su morfología, el advenimiento de la secuenciación genética permitió a los investigadores estar de acuerdo en que Planctomycetota pertenece al dominio Bacteria. [5] Dentro de ese dominio, Planctomycetota se clasifica como su propio filo, sin embargo, otros investigadores han argumentado que también podrían categorizarse como parte de un superfilo más grande llamado PVC, que abarcaría los filos Verrucomicrobia, Chlamydiae y Lentisphaerae, y el filo candidato " Candidatus Omnitrophica". [9] Dentro de este superfilo, se ha descubierto que sus miembros están estrechamente relacionados a través de la creación de árboles de ARNr 16S. Tanto Planctomycetota como Chlamydiota codifican proteínas para transportadores de nucleótidos , y también se ha descubierto que Verrucomicrobiota tiene características comunes entre las células eucariotas. Por lo tanto, un ancestro común de este superfilo puede haber sido el inicio del linaje eucariota. [9] Si bien esta es una explicación posible, debido a que el PVC no es el comienzo del árbol bacteriano, [32] la existencia de rasgos y genes eucariotas se explica más probablemente a través de la transferencia lateral de genes, y no de un ancestro eucariota más reciente. [9]
| LTP basada en ARNr 16S _12_2021 [33] [34] [35] | 120 proteínas marcadoras de copia única basadas en GTDB 08-RS214 [36] [37] [38] | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Ecología
Distribución y abundancia
Los miembros de Planctomycetota se encuentran en una amplia gama de entornos, tanto geográficos como ecológicos, [39] y se encuentran tanto en hábitats acuáticos como terrestres. [5] En entornos acuáticos, se encuentran tanto en sistemas de agua dulce como marinos. [39] Originalmente se creía que Planctomycetota existía exclusivamente en entornos acuáticos, pero ahora se sabe que también abunda en suelos [40] y entornos hipersalinos. [41] Están ampliamente distribuidos en cinco continentes, incluida la Antártida y Australia . [40] [39]
Se utilizó la hibridación in situ con fluorescencia para detectar Planctomycetota en diversos entornos, y Planctomycetota se encuentra en abundancia en los pantanos de esfagno. Algunos Planctomycetota se encontraron en los sistemas digestivos de formas de vida marinas, mientras que otros tienden a vivir entre eucariotas. [9]
Influencias ambientales en la distribución
Planctomycetota representa aproximadamente el 11% de las comunidades procariotas en sistemas marinos, y su amplia distribución demuestra su capacidad para habitar en muchos entornos diferentes. También pueden adaptarse tanto a condiciones aeróbicas como anaeróbicas. Muchos factores pueden afectar su distribución, como la humedad, los niveles de oxígeno y los niveles de pH. La diversidad y abundancia de Planctomycetota están fuertemente asociadas con la humedad relativa. Los efectos de los niveles de oxígeno demuestran las necesidades energéticas del individuo. Muchas especies de Planctomycetota son quimioheterotróficas, incluida G. obscuriglobus . Thermostilla marina , una especie anaeróbica termófila que ocupa regiones de respiraderos hidrotermales , puede usar azufre elemental para generar sulfuro y respirar con nitrato . Planctomycetota también puede habitar regiones con rangos de niveles de pH de 4,2 a 11,6. [8]
Impactos ecológicos y ciclo global del carbono
Los planctomicetos tienen un impacto significativo en la biogeoquímica y el clima global, con su capacidad de mineralizar y descomponer partículas de detritos en la columna de agua. [6] [20]
Los planctomycetota desempeñan un papel importante en el ciclo global del carbono . [5] [6] [13] [42] Como quimioheterótrofos aeróbicos tanto obligados como facultativos , la fuente principal de carbono utilizada por los planctomycetota son los carbohidratos . Muchos planctomycetota tienen la capacidad de descomponer carbohidratos extremadamente complejos, lo que hace que estos nutrientes estén disponibles para otros organismos. Esta capacidad de reciclar el carbono se ha relacionado con genes específicos del metabolismo C1 observados en muchos planctomycetota y se sugiere que desempeñan un papel importante, pero esta área de investigación aún se comprende poco.
Los Planctomycetota también presentan muchas enzimas sulfatasas , que son capaces de descomponer los heteropolisacáridos sulfatados, que son producidos por muchos grupos de macroalgas. La descomposición de estos heteropolisacáridos sulfatados por los Planctomycetota se utiliza luego como fuente de energía. Se sugiere que algunos Planctomycetota son capaces de descomponer la carragenina . [42]

Asociación con otros organismos
Los planctomicetos se han observado a menudo en asociación con muchos organismos, entre ellos, macroalgas, microalgas, esponjas marinas y plantas como líquenes y briofitas . [8] También se los ha observado habitando en filtraciones frías de aguas profundas , donde son organismos dominantes que viven en gusanos tubícolas . [5]
Macroalgas

Los planctomycetota suelen estar asociados a superficies marinas ricas en nutrientes. Se presentan como biopelículas en superficies de algas en abundancia relativamente alta. [7] Se sugiere que las macroalgas como las algas Laminaria hyperborea y Ecklonia radiata son un hábitat importante para los planctomycetota. [5] [43] Aproximadamente el 70% de la comunidad bacteriana en Ecklonia radiata eran planctomycetota. [5] [10] Se han aislado casi 150 especies de planctomycetota de las biopelículas de macroalgas, y estas comunidades asociadas con las macroalgas son principalmente independientes de los cambios en la distribución geográfica. Esto sugeriría una relación simbiótica . [8]
Los bosques de algas marinas dominan las costas rocosas de las regiones de temperatura y proporcionan hábitat, refugio y alimento para muchos organismos, incluido el Planctomycetota. [5] Dado el papel considerable de los bosques de algas marinas en la productividad primaria costera , la asociación del Planctomycetota con las algas marinas podría indicar su papel significativo en los hábitats costeros. [44] El Planctomycetota también juega un papel importante como componente de los detritos en la columna de agua, también conocido como nieve marina , [5] [44] dada su capacidad para adherirse a las superficies. [45]
A medida que el clima continúa calentándose, la abundancia de Planctomycetota asociada con las macroalgas podría aumentar. El alga Caulerpa taxifolia fue incubada en condiciones de mayor CO2 y la abundancia de Planctomycetota aumentó sustancialmente, hasta 10 veces en algunas especies. [5]
Floraciones de microalgas y diatomeas
Si bien las macroalgas son sustratos bien conocidos para las comunidades de Planctomycetota, también se sabe que su abundancia se correlaciona con las floraciones de microalgas como las diatomeas. [44] [5] Las floraciones de cianobacterias , diatomeas y dinoflagelados proporcionan nutrientes a Planctomycetota, lo que podría explicar la asociación. [8]
Esponjas marinas
Las especies de Planctomycetota suelen estar asociadas a las superficies de las esponjas marinas. [8] [45] Interactúan con las esponjas ya sea mediante la unión con un soporte o mediante una relación simbiótica. Existe una gran diversidad de Planctomycetota en forma de biopelículas en las esponjas. La relación simbiótica entre las esponjas y Planctomycetota contribuye a la salud de la esponja, y la esponja a menudo proporciona un hábitat adecuado y nutrientes a Planctomycetota. [8]
Comunidades de líquenes y turberas de esfagno
Se ha descubierto que los planctomicetos son muy abundantes en las comunidades de líquenes del noroeste de Siberia y muestran una diversidad extremadamente alta. Los planctomicetos también se han asociado con las comunidades de líquenes y los humedales de esfagno . Los humedales de esfagno almacenan grandes cantidades de carbono, lo que contribuye al ciclo global del carbono. Los planctomicetos desempeñan un papel considerable en la degradación del esfagno, ya que representan aproximadamente el 15 % de la comunidad bacteriana. [8]
Otras comunidades bacterianas
Los Planctomycetota muestran asociaciones con otras comunidades bacterianas, principalmente Alphaproteobacteria , Bacteroidota , Gemmatimonadota y Verrucomicrobiota . El crecimiento de muchos Planctomycetota suele estar respaldado por los nutrientes esenciales proporcionados por otras bacterias dentro de la comunidad, y algunos Planctomycetota dependen en gran medida de relaciones simbióticas con otras bacterias. [8]
Fisiología
Endocitosis
La existencia de proteínas de la capa de membrana cerca de la membrana intracitoplasmática podría utilizarse para un sistema de captación similar a la endocitosis , lo que sería la primera instancia en la que se ha encontrado esta función fuera del dominio eucariota. Sin embargo, ahora que se ha confirmado la existencia de una pared celular rígida de peptidoglicano, parece poco probable que estas vesículas puedan atravesar esta pared celular. Además, la eliminación de una de estas proteínas de la capa de membrana dentro de P. limnophila no encontró una disminución en la captación de macromoléculas . [18] Además, con el uso de la reconstrucción tridimensional basada en tomografía crioelectrónica de Planctomycetota se ha descubierto que lo que originalmente se pensaba que eran vesículas retenidas en el periplasma son en realidad solo pliegues en la membrana citoplasmática. [5] Sin embargo, se ha demostrado que Planctomycetota puede sobrevivir con polisacáridos de alto peso molecular como su única fuente de carbono, lo que significa que deben tener la capacidad de incorporar sustratos de carbono complejos en su citoplasma. Se han planteado tres hipótesis: en primer lugar, los Planctomycetota excretan una enzima que, fuera de la pared celular, degrada los sustratos complejos en monosacáridos más pequeños, que pueden transportarse más fácilmente a través de las diferentes membranas. En segundo lugar, los sustratos complejos se anclan al exterior de los Planctomycetota, que luego pueden descomponer lentamente estos sustratos en oligosacáridos, que pueden ser transportados al periplasma de los Planctomycetota por proteínas especializadas. La tercera hipótesis involucra las estructuras crateriformes que se encuentran en el exterior de las paredes celulares de los Planctomycetota. Estas estructuras tienen fibras que recubren sus fosas que pueden ser capaces de absorber polisacáridos completos en el periplasma, donde luego serían digeridos. [18]
Regulación osmótica

Casi todas las bacterias tienen un citosol que sigue la forma exterior de su pared celular de peptidoglicano. Los eucariotas son diferentes en que tienen su citosol dividido en múltiples compartimentos para crear orgánulos como un núcleo . Los planctomicetos son únicos en que tienen grandes invaginaciones de su membrana citoplasmática, separándose de la pared celular de peptidoglicano y dejando espacio para el periplasma. Tradicionalmente, se ha pensado que la membrana citoplasmática era responsable de controlar la presión osmótica de las células bacterianas. Sin embargo, debido a los pliegues en la membrana citoplasmática y la existencia de grandes espacios de periplasma dentro de los planctomicetos, su peptidoglicano actúa como una barrera osmótica y el periplasma es isotónico al citosol. [5]
Oxidación anaeróbica de amonio (anammox)
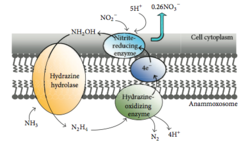
Anammox es el proceso de oxidación del amonio donde el nitrito actúa como aceptor de electrones. Este proceso crea energía para el organismo que realiza la reacción de la misma manera que los humanos obtienen energía al oxidar la glucosa. [46] En un entorno marino, esto finalmente elimina el nitrógeno del agua, ya que el fitoplancton no puede utilizar el gas N 2 y se libera a la atmósfera . Hasta el 67% de la producción de gas dinitrógeno en el océano se puede atribuir a anammox [47] y se cree que aproximadamente el 50% del gas nitrógeno en la atmósfera se produce a partir de anammox. [48] Planctomycetota es el filo más dominante de bacterias capaces de realizar anammox, por lo que Planctomycetota capaz de realizar anammox juega un papel importante en el ciclo global del nitrógeno. [49]
Síntesis de esteroles
La síntesis de esteroles, observada a menudo en eucariotas y poco común entre bacterias, se ha observado muy raramente en Planctomycetota. [5] [15] La síntesis de esteroles como el lanosterol se ha observado en G. obscuriglobus . El lanosterol es común en eucariotas y otros dos grupos de bacterias, tanto Pseudomonadota metilotrófica como mixobacteria . La síntesis de esteroles observada en G. obscuriglobus es única dentro de Planctomycetota. Se sugiere que la síntesis de esteroles está asociada con la regulación de la fluidez de la membrana en Planctomycetota, [15] y se ha descrito como esencial para el crecimiento y la reproducción adecuados de G. obscuriglobus . [17]
Biotecnología y aplicaciones humanas
Recientemente, ha surgido interés en examinar a Planctomycetota con respecto a sus posibles funciones en biotecnología, principalmente como fuente de moléculas bioactivas, [8] [14] de interés principalmente para la industria farmacéutica. Los compuestos bioactivos están presentes principalmente como metabolitos secundarios, [14] aunque se sabe poco sobre los metabolitos secundarios de Planctomycetota. [50] Esto es inesperado, ya que Planctomycetota tiene varias características clave como otros productores conocidos de moléculas bioactivas, como Myxobacteria. [50] Sin embargo, una serie de estudios en curso sirven como varios primeros pasos en la inclusión de Planctomycetota en el desarrollo de fármacos de moléculas pequeñas para humanos.
Las especies de Planctomycetota son consideraciones que vale la pena considerar para desafiar los modelos actuales sobre el origen del núcleo, junto con otros aspectos del origen y la evolución del sistema endomembranoso eucariota. [41]
Cambio climático
Los impactos de la investigación sobre Planctomycetota y sus usos podrían ser de importancia global en lo que respecta a los procesos de ciclado de nutrientes y ayudar a mejorar la comprensión de la biogeoquímica marina global. Sin embargo, con la creciente influencia de Planctomycetota en los procesos metabólicos que involucran agua y aire, también puede tener un papel en los intercambios entre océanos y atmósfera, lo que podría afectar el cambio climático. [41]
Planctomycetota como patógenos
Las especies de Planctomycetota fueron identificadas recientemente como un patógeno humano oportunista, [ cita requerida ] pero la falta de medios de cultivo limita los estudios sobre las bacterias de Planctomycetota como patógenos de humanos. [8]
Referencias
- ^ Oren A, Garrity GM (2021). "Publicación válida de los nombres de cuarenta y dos filos de procariotas". Int J Syst Evol Microbiol . 71 (10): 5056. doi : 10.1099/ijsem.0.005056 . PMID 34694987. S2CID 239887308.
- ^ Euzéby JP, Parte AC. ""Planctomycetes"". Lista de nombres procariotas con posición en la nomenclatura (LPSN) . Consultado el 26 de agosto de 2021 .
- ^ Sayers; et al. "Planctomycetes". Base de datos de taxonomía del Centro Nacional de Información Biotecnológica (NCBI) . Consultado el 20 de marzo de 2016 .
- ^ Garrity GM, Holt JG. (2001). "La hoja de ruta hacia el manual". En Boone DR, Castenholz RW, Garrity GM. (eds.). Bergey's Manual of Systematic Bacteriology . Vol. 1 (Las arqueas y las bacterias fototróficas y de ramificación profunda ) (2.ª ed.). Nueva York, NY: Springer-Verlag. págs. 119-166.
- ^ abcdefghijklmnopqrstu vwxyz aa ab ac ad ae af ag ah ai aj ak Wiegand S, Jogler M, Jogler C (noviembre de 2018). "Sobre los Planctomycetes inconformistas". FEMS Microbiology Reviews . 42 (6): 739–760. doi : 10.1093/femsre/fuy029 . PMID 30052954.
- ^ abcdefgh Glöckner FO, Kube M, Bauer M, Teeling H, Lombardot T, Ludwig W, et al. (julio de 2003). "Secuencia completa del genoma del planctomiceto marino Pirellula sp. cepa 1". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 100 (14): 8298–303. Bibcode :2003PNAS..100.8298G. doi : 10.1073/pnas.1431443100 . PMC 166223 . PMID 12835416.
- ^ abcde Boersma AS, Kallscheuer N, Wiegand S, Rast P, Peeters SH, Mesman RJ, et al. (diciembre de 2020). "Alienimonas californiensis gen. nov. sp. nov., un nuevo Planctomycete aislado del bosque de algas marinas en la Bahía de Monterey". Antonie van Leeuwenhoek . 113 (12): 1751-1766. doi :10.1007/s10482-019-01367-4. hdl : 10033/623182 . PMID 31802338. S2CID 208641991.
- ^ abcdefghijkl Kaboré OD, Godreuil S, Drancourt M (2020). "Planctomicetos como bacterias asociadas al huésped: una perspectiva prometedora para sus aislamientos futuros, imitando sus nichos ambientales nativos en laboratorios de microbiología clínica". Frontiers in Cellular and Infection Microbiology . 10 : 519301. doi : 10.3389/fcimb.2020.519301 . PMC 7734314 . PMID 33330115.
- ^ abcdef Wagner, Michael; Horn, Matthias (1 de junio de 2006). "Los filos Planctomycetes, Verrucomicrobia, Chlamydiae y otros filos hermanos forman un superfilo con relevancia biotecnológica y médica". Current Opinion in Biotechnology . Biotecnología ambiental/Biotecnología energética. 17 (3): 241–249. doi :10.1016/j.copbio.2006.05.005. ISSN 0958-1669. PMID 16704931.
- ^ abcd Kohn, Timo; Rast, Patrick; Kallscheuer, Nicolai; Wiegand, Sandra; Boedeker, Christian; Jetten, Mike SM; Jeske, Olga; Vollmers, John; Kaster, Anne-Kristin; Rohde, Manfred; Jogler, Mareike (2020). "El microbioma de las hojas de las praderas marinas de Posidonia oceanica puede estar dominado por planctomicetos". Frontiers in Microbiology . 11 : 1458. doi : 10.3389/fmicb.2020.01458 . ISSN 1664-302X. PMC 7366357 . PMID 32754127.
- ^ abcd Lage OM, Bondoso J, Lobo-da-Cunha A (octubre de 2013). "Conocimientos sobre la morfología ultraestructural de nuevos Planctomycetes". Antonie van Leeuwenhoek . 104 (4): 467–76. doi :10.1007/s10482-013-9969-2. PMID 23857394. S2CID 17003623.
- ^ abcde Kumar D, Kumar G, Jagadeeshwari U, Sasikala C, Ramana CV (abril de 2021). "" Candidatus Laterigemmans baculatus" gen. nov. sp. nov., el primer representante de planctomicetos en forma de bastón con gemación lateral en la familia Pirellulaceae". Microbiología Sistemática y Aplicada . 44 (2): 126188. doi : 10.1016/j.syapm.2021.126188. PMID 33647766. S2CID 232091472.
- ^ abcdefgh Wiegand S, Jogler M, Boedeker C, Pinto D, Vollmers J, Rivas-Marín E, et al. (enero de 2020). "El cultivo y la caracterización funcional de 79 planctomicetos revelan su biología única". Nature Microbiology . 5 (1): 126–140. doi :10.1038/s41564-019-0588-1. PMC 7286433 . PMID 31740763.
- ^ abc Graça AP, Calisto R, Lage OM (2016). "Planctomicetos como nueva fuente de moléculas bioactivas". Frontiers in Microbiology . 7 : 1241. doi : 10.3389/fmicb.2016.01241 . PMC 4982196 . PMID 27570520.
- ^ abcdefgh Rivas-Marin E, Peeters SH, Claret Fernández L, Jogler C, van Niftrik L, Wiegand S, Devos DP (enero de 2020). "No esencialidad de los genes de división celular canónica en el planctomiceto Planctopirus limnophila". Informes científicos . 10 (1): 66. Código bibliográfico : 2020NatSR..10...66R. doi :10.1038/s41598-019-56978-8. PMC 6952346 . PMID 31919386.
- ^ abcde Santarella-Mellwig R, Pruggnaller S, Roos N, Mattaj IW, Devos DP (21 de mayo de 2013). "Reconstrucción tridimensional de bacterias con un sistema de endomembrana complejo". PLOS Biology . 11 (5): e1001565. doi : 10.1371/journal.pbio.1001565 . PMC 3660258 . PMID 23700385.
- ^ ab Rivas-Marín, Elena; Stettner, Sean; Gottshall, Ekaterina Y.; Santana-Molina, Carlos; Diablos, Mitch; Basile, Franco; Ward, Naomi L.; Devos, Damien P. (2 de julio de 2019). "Esencialidad de los genes de síntesis de esteroles en la bacteria planctomiceto Gemmata obscuriglobus". Comunicaciones de la naturaleza . 10 (1): 2916. Código bibliográfico : 2019NatCo..10.2916R. doi : 10.1038/s41467-019-10983-7 . ISSN 2041-1723. PMC 6606645 . PMID 31266954.
- ^ abcdefghij Boedeker C, Schüler M, Reintjes G, Jeske O, van Teeseling MC, Jogler M, et al. (Abril de 2017). "Determinación de la biología celular bacteriana de Planctomycetes". Comunicaciones de la naturaleza . 8 (1): 14853. Código bibliográfico : 2017NatCo...814853B. doi : 10.1038/ncomms14853. PMC 5394234 . PMID 28393831.
- ^ Kallscheuer N, Moreira C, Airs R, Llewellyn CA, Wiegand S, Jogler C, Lage OM (diciembre de 2019). "Los planctomicetos pigmentados de rosa y naranja producen carotenoides de tipo saproxantina, incluido un carotenoide C45 poco común" (PDF) . Informes de microbiología ambiental . 11 (6): 741–748. doi :10.1111/1758-2229.12796. PMID 31600855. S2CID 204244301.
- ^ ab Viana F, Lage OM, Oliveira R (octubre de 2013). "Alta resistencia a la radiación ultravioleta C de los planctomicetos marinos". Antonie van Leeuwenhoek . 104 (4): 585–95. doi :10.1007/s10482-013-0027-x. hdl : 1822/50752 . PMID 24052365. S2CID 13153498.
- ^ Santana-Molina C, Henriques V, Hornero-Méndez D, Devos DP, Rivas-Marin E (diciembre de 2022). "La ruta del escualeno a la biosíntesis de carotenoides C30 y los orígenes de las vías biosintéticas de carotenoides". Proc Natl Acad Sci USA . 119 (52): e2210081119. doi : 10.1073/pnas.2210081119 . PMC 9907078 . PMID 36534808. S2CID 254909480.
- ^ ab Kohn T, Heuer A, Jogler M, Vollmers J, Boedeker C, Bunk B, et al. (2016). "Fuerstia marisgermanicae gen. nov., sp. nov., un miembro inusual del filo Planctomycetes del mar de Wadden alemán". Fronteras en Microbiología . 7 : 2079. doi : 10.3389/fmicb.2016.02079 . PMC 5177795 . PMID 28066393.
- ^ ab Kartal, Boran; de Almeida, Noemí M.; Maalcke, Wouter J.; Op den Camp, Huub JM; Jetten, Mike SM; Keltjens, Jan T. (1 de mayo de 2013). "Cómo ganarse la vida con la oxidación anaeróbica de amonio". Reseñas de microbiología FEMS . 37 (3): 428–461. doi : 10.1111/1574-6976.12014 . hdl : 2066/103425 . ISSN 0168-6445. PMID 23210799.
- ^ abc Peeters SH, Wiegand S, Kallscheuer N, Jogler M, Heuer A, Jetten MS y col. (diciembre de 2020). "Tres cepas marinas constituyen el nuevo género y especie Crateriforma conspicua en el filo Planctomycetes". Antonie van Leeuwenhoek . 113 (12): 1797–1809. doi :10.1007/s10482-019-01375-4. hdl : 10033/623180 . PMID 31894495. S2CID 209516837.
- ^ ab Jogler C, Glöckner FO, Kolter R (agosto de 2011). "Caracterización de Planctomyces limnophilus y desarrollo de herramientas genéticas para su manipulación que lo establecen como una especie modelo para el filo Planctomycetes". Applied and Environmental Microbiology . 77 (16): 5826–9. Bibcode :2011ApEnM..77.5826J. doi :10.1128/AEM.05132-11. PMC 3165242 . PMID 21724885.
- ^ abcde Rivas-Marín E, Canosa I, Devos DP (2016). "Biología celular evolutiva del modo de división en el superfilo bacteriano Planctomycetes-Verrucomicrobia-Chlamydiae". Frontiers in Microbiology . 7 : 1964. doi : 10.3389/fmicb.2016.01964 . PMC 5147048 . PMID 28018303.
- ^ abc Bernander R, Ettema TJ (diciembre de 2010). "División celular sin FtsZ en arqueas y bacterias". Opinión actual en microbiología . Crecimiento y desarrollo: eucariotas/procariotas. 13 (6): 747–52. doi :10.1016/j.mib.2010.10.005. PMID 21050804.
- ^ ab Gupta RS, Bhandari V, Naushad HS (2012). "Las firmas moleculares del clado PVC (Planctomycetes, Verrucomicrobia, Chlamydiae y Lentisphaerae) de bacterias proporcionan información sobre sus relaciones evolutivas". Frontiers in Microbiology . 3 : 327. doi : 10.3389/fmicb.2012.00327 . PMC 3444138 . PMID 23060863.
- ^ ab Gupta RS (julio de 2016). "Impacto de la genómica en la comprensión de la evolución y la clasificación microbiana: la importancia de las opiniones de Darwin sobre la clasificación". FEMS Microbiology Reviews . 40 (4): 520–53. doi : 10.1093/femsre/fuw011 . PMID 27279642.
- ^ Lagkouvardos I, Jehl MA, Rattei T, Horn M (enero de 2014). "Proteína distintiva del superfilo PVC". Microbiología aplicada y ambiental . 80 (2): 440–5. Código Bibliográfico :2014ApEnM..80..440L. doi :10.1128/AEM.02655-13. PMC 3911108 . PMID 24185849.
- ^ abc Mahajan, Mayank; Yee, Benjamin; Hägglund, Emil; Guy, Lionel; Fuerst, John A; Andersson, Siv GE (11 de diciembre de 2019). "Paralogización y nuevas arquitecturas proteicas en bacterias planctomicetos con estructuras celulares complejas". Biología molecular y evolución . 37 (4): 1020–1040. doi : 10.1093/molbev/msz287 . ISSN 0737-4038. PMID 31808939.
- ^ Strous M, Pelletier E, Mangenot S (6 de abril de 2006). "Descifrando la evolución y el metabolismo de una bacteria anammox a partir de un genoma comunitario". Nature . 440 (7085): 790–794. Bibcode :2006Natur.440..790S. doi :10.1038/nature04647. hdl : 2066/35981 . PMID 16598256. S2CID 4402553.
- ^ "El LTP" . Consultado el 23 de febrero de 2021 .
- ^ "Árbol LTP_all en formato newick" . Consultado el 23 de febrero de 2021 .
- ^ "Notas de la versión LTP_12_2021" (PDF) . Consultado el 23 de febrero de 2021 .
- ^ "GTDB release 08-RS214". Base de datos de taxonomía del genoma . Consultado el 10 de mayo de 2023 .
- ^ "bac120_r214.sp_label". Base de datos de taxonomía del genoma . Consultado el 10 de mayo de 2023 .
- ^ "Historia del taxón". Base de datos de taxonomía del genoma . Consultado el 10 de mayo de 2023 .
- ^ abc Fuerst, John (2004). "Planctomycetes: un filo de interés emergente para la evolución y la ecología microbiana". Boletín de Colecciones de la Federación Mundial de Cultivos . 38 . CiteSeerX 10.1.1.538.2883 .
- ^ ab Buckley, Daniel H.; Huangyutitham, Varisa; Nelson, Tyrrell A.; Rumberger, Angelika; Thies, Janice E. (1 de julio de 2006). "Diversidad de planctomicetos en el suelo en relación con la historia del suelo y la heterogeneidad ambiental". Microbiología aplicada y ambiental . 72 (7): 4522–4531. Bibcode :2006ApEnM..72.4522B. doi :10.1128/AEM.00149-06. ISSN 0099-2240. PMC 1489350 . PMID 16820439.
- ^ abc Fuerst, JA (1 de julio de 1995). "Los planctomicetos: modelos emergentes para la ecología microbiana, la evolución y la biología celular". Microbiología . 141 (7): 1493–1506. doi :10.1099/13500872-141-7-1493. ISSN 1350-0872. PMID 7551018.
- ^ ab Woebken D, Teeling H, Wecker P, Dumitriu A, Kostadinov I, Delong EF, et al. (septiembre de 2007). "Fósmidos de nuevos planctomicetos marinos de los sistemas de surgencia de la costa de Namibia y Oregón y su comparación cruzada con genomas de planctomicetos". The ISME Journal . 1 (5): 419–35. doi : 10.1038/ismej.2007.63 . PMID 18043661. S2CID 23859244.
- ^ Bondoso J, Balagué V, Gasol JM, Lage OM (junio de 2014). "Composición de la comunidad de Planctomycetota asociada a diferentes macroalgas". FEMS Microbiology Ecology . 88 (3): 445–56. doi : 10.1111/1574-6941.12258 . PMID 24266389.
- ^ abc Fuerst JA (octubre de 2005). "Compartimentación intracelular en planctomicetos". Revisión anual de microbiología . 59 (1): 299–328. doi :10.1146/annurev.micro.59.030804.121258. PMID 15910279.
- ^ ab Izumi H, Sagulenko E, Webb RI, Fuerst JA (octubre de 2013). "Aislamiento y diversidad de planctomicetos de la esponja Niphates sp., agua de mar y sedimentos de la Bahía Moreton, Australia". Antonie van Leeuwenhoek . 104 (4): 533–46. doi :10.1007/s10482-013-0003-5. PMID 23959164. S2CID 12315225.
- ^ Kartal, Boran (2011). Cultivo, detección y ecofisiología de bacterias anaeróbicas oxidantes de amonio . San Diego, CA: Academic Press. Págs. 89-108. ISBN. 978-0-12-381294-0.
- ^ Qian; et al. (2018). "Diversidad y distribución de bacterias anammox en la columna de agua y sedimentos del Océano Índico Oriental". International Biodeterioration & Biodegradation . 133 : 52–62. doi :10.1016/j.ibiod.2018.05.015. S2CID 90491277.
- ^ Teeseling; et al. (2015). "Los planctomicetos Anammox tienen una pared celular de peptidoglicano". Nature Communications . 6 : 6878. Bibcode :2015NatCo...6.6878V. doi : 10.1038/ncomms7878 . PMC 4432595 . PMID 25962786.
- ^ Jing; et al. (2015). "Una instantánea sobre la distribución espacial y vertical de las comunidades bacterianas en el Océano Índico oriental". Acta Oceanologica Sinica . 35 (6): 85–93. doi :10.1007/s13131-016-0871-4. S2CID 89295982.
- ^ ab Jeske, Olga; Jogler, Mareike; Petersen, Jörn; Sikorski, Johannes; Jogler, Christian (1 de octubre de 2013). "De la minería de genomas a los microarreglos fenotípicos: Planctomicetos como fuente de nuevas moléculas bioactivas". Antonie van Leeuwenhoek . 104 (4): 551–567. doi :10.1007/s10482-013-0007-1. ISSN 1572-9699. PMID 23982431. S2CID 18752686.
Enlaces externos
 Datos relacionados con Planctomycetota en Wikispecies
Datos relacionados con Planctomycetota en Wikispecies- Más allá de procariotas y eucariotas: planctomicetos y organización celular.
- Gemmata en Microbewiki
