Pericito
| Pericito | |
|---|---|
 Micrografía electrónica de transmisión de un microvaso que muestra pericitos que recubren la superficie externa de las células endoteliales que rodean un eritrocito (E). | |
| Detalles | |
| Identificadores | |
| latín | pericito |
| Malla | D020286 |
| EL | H3.09.02.0.02006 |
| FMA | 63174 |
| Términos anatómicos de microanatomía [editar en Wikidata] | |
Los pericitos (antes llamados células de Rouget ) [1] son células murales multifuncionales de la microcirculación que envuelven las células endoteliales que recubren los capilares de todo el cuerpo. [2] Los pericitos están incrustados en la membrana basal de los capilares sanguíneos, donde se comunican con las células endoteliales mediante contacto físico directo y señalización paracrina . [3] La morfología, distribución, densidad y huellas moleculares de los pericitos varían entre órganos y lechos vasculares. [4] [5] Los pericitos ayudan en el mantenimiento de las funciones homeostáticas y hemostáticas en el cerebro , donde uno de los órganos se caracteriza por una mayor cobertura de pericitos, y también sostienen la barrera hematoencefálica . [6] Estas células también son un componente clave de la unidad neurovascular , que incluye células endoteliales, astrocitos y neuronas . [7] [8] Se ha postulado que los pericitos regulan el flujo sanguíneo capilar [9] [10] [11] [12] y la eliminación y fagocitosis de los restos celulares in vitro. [13] Los pericitos estabilizan y controlan la maduración de las células endoteliales mediante la comunicación directa entre la membrana celular, así como a través de la señalización paracrina. [14] Una deficiencia de pericitos en el sistema nervioso central puede provocar un aumento de la permeabilidad de la barrera hematoencefálica. [6]
Estructura
En el sistema nervioso central (SNC), los pericitos envuelven las células endoteliales que recubren el interior del capilar. Estos dos tipos de células se pueden distinguir fácilmente entre sí en función de la presencia del núcleo redondo prominente del pericito en comparación con el núcleo alargado y plano de las células endoteliales. [7] Los pericitos también proyectan extensiones en forma de dedos que envuelven la pared capilar, lo que permite que las células regulen el flujo sanguíneo capilar. [6]
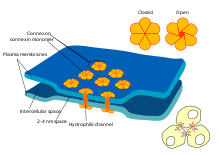
Tanto los pericitos como las células endoteliales comparten una membrana basal donde se realizan una variedad de conexiones intercelulares. Muchos tipos de moléculas de integrina facilitan la comunicación entre los pericitos y las células endoteliales separadas por la membrana basal. [6] Los pericitos también pueden formar conexiones directas con células vecinas mediante la formación de disposiciones de clavija y zócalo en las que partes de las células se entrelazan, de manera similar a los engranajes de un reloj. En estos sitios de entrelazado, se pueden formar uniones en hendidura , que permiten que los pericitos y las células vecinas intercambien iones y otras moléculas pequeñas. [6] Las moléculas importantes en estas conexiones intercelulares incluyen N-cadherina , fibronectina , conexina y varias integrinas. [7]
En algunas regiones de la membrana basal se pueden encontrar placas de adhesión compuestas por fibronectina, las cuales facilitan la conexión de la membrana basal con la estructura citoesquelética compuesta por actina y la membrana plasmática de los pericitos y las células endoteliales. [6]
Función
Regeneración del músculo esquelético y formación de grasa.
Los pericitos del músculo estriado esquelético pertenecen a dos poblaciones distintas, cada una con su propia función. El primer subtipo de pericito (tipo 1) puede diferenciarse en células grasas , mientras que el otro (tipo 2) en células musculares. El tipo 1 se caracteriza por la expresión negativa de nestina (PDGFRβ+CD146+Nes-) y el tipo 2 se caracteriza por la expresión positiva de nestina (PDGFRβ+CD146+Nes+). Si bien ambos tipos pueden proliferar en respuesta a una lesión inducida por glicerol o BaCl 2 , los pericitos de tipo 1 dan lugar a células adipogénicas solo en respuesta a la inyección de glicerol y los de tipo 2 se vuelven miogénicos en respuesta a ambos tipos de lesión . Se desconoce en qué medida los pericitos de tipo 1 participan en la acumulación de grasa.
Angiogénesis y supervivencia de las células endoteliales
Los pericitos también están asociados con la diferenciación y multiplicación de células endoteliales, la angiogénesis , la supervivencia de señales apoptóticas y el viaje. Ciertos pericitos, conocidos como pericitos microvasculares, se desarrollan alrededor de las paredes de los capilares y ayudan a cumplir esta función. Los pericitos microvasculares pueden no ser células contráctiles, ya que carecen de isoformas de alfa- actina , estructuras que son comunes entre otras células contráctiles. Estas células se comunican con las células endoteliales a través de uniones en hendidura y, a su vez, hacen que las células endoteliales proliferen o se inhiban selectivamente. Si este proceso no ocurriera, podría producirse hiperplasia y morfogénesis vascular anormal . Estos tipos de pericitos también pueden fagocitar proteínas exógenas. Esto sugiere que el tipo de célula podría haberse derivado de la microglia . [15]
Se ha propuesto una relación de linaje con otros tipos de células, incluidas las células musculares lisas , [16] células neuronales, [16] glía NG2 , [17] fibras musculares , adipocitos , así como fibroblastos [18] y otras células madre mesenquimales . Sin embargo, si estas células se diferencian entre sí es una pregunta pendiente en el campo. La capacidad regenerativa de los pericitos se ve afectada por el envejecimiento. [18] Tal versatilidad es útil, ya que remodelan activamente los vasos sanguíneos en todo el cuerpo y, por lo tanto, pueden mezclarse homogéneamente con el entorno tisular local. [19]
Además de crear y remodelar los vasos sanguíneos, se ha descubierto que los pericitos protegen a las células endoteliales de la muerte por apoptosis o elementos citotóxicos . Se ha demostrado in vivo que los pericitos liberan una hormona conocida como aminopeptidasa pericítica N/pAPN que puede ayudar a promover la angiogénesis. Cuando esta hormona se mezcló con células endoteliales cerebrales , así como con astrocitos, los pericitos se agruparon en estructuras que se parecían a los capilares. Además, cuando el grupo experimental contenía todo lo siguiente con la excepción de los pericitos, las células endoteliales sufrirían apoptosis. [ más explicación necesaria ] Por lo tanto, se concluyó que los pericitos deben estar presentes para garantizar el funcionamiento adecuado de las células endoteliales, y los astrocitos deben estar presentes para garantizar que ambos permanezcan en contacto. Si no, entonces no puede ocurrir una angiogénesis adecuada. [20] También se ha descubierto que los pericitos contribuyen a la supervivencia de las células endoteliales, ya que secretan la proteína Bcl-w durante la comunicación celular. Bcl-w es una proteína instrumental en la vía que refuerza la expresión de VEGF-A y desalienta la apoptosis. [21] Aunque hay cierta especulación sobre por qué VEGF es directamente responsable de prevenir la apoptosis, se cree que es responsable de modular las vías de transducción de señales apoptóticas e inhibir la activación de las enzimas inductoras de apoptosis . Dos mecanismos bioquímicos utilizados por VEGF para lograr esto serían la fosforilación de la quinasa reguladora extracelular 1 (ERK-1, también conocida como MAPK3), que sostiene la supervivencia celular a lo largo del tiempo, y la inhibición de la proteína quinasa activada por estrés/quinasa c-jun-NH2, que también promueve la apoptosis. [22]
Barrera hematoencefálica
Los pericitos desempeñan un papel crucial en la formación y funcionalidad de la barrera hematoencefálica . Esta barrera está compuesta por células endoteliales y asegura la protección y funcionalidad del cerebro y del sistema nervioso central. Se ha descubierto que los pericitos son cruciales para la formación postnatal de esta barrera. Los pericitos son responsables de la formación de uniones estrechas y el tráfico de vesículas entre las células endoteliales. Además, permiten la formación de la barrera hematoencefálica al inhibir los efectos de las células inmunes del SNC (que pueden dañar la formación de la barrera) y al reducir la expresión de moléculas que aumentan la permeabilidad vascular. [23]
Además de la formación de la barrera hematoencefálica, los pericitos también desempeñan un papel activo en su funcionalidad. Los modelos animales de pérdida de desarrollo de pericitos muestran un aumento de la transcitosis endotelial, así como una zonificación arteriovenosa sesgada, un aumento de la expresión de moléculas de adhesión leucocítica y microaneurismas. [24] [25] También se ha teorizado que la pérdida o disfunción de los pericitos contribuye a enfermedades neurodegenerativas como el Alzheimer , [26] [27] [28] el Parkinson y la ELA [29] a través de la ruptura de la barrera hematoencefálica.
Circulación sanguínea
Cada vez hay más pruebas que sugieren que los pericitos pueden regular el flujo sanguíneo a nivel capilar. En el caso de la retina, se han publicado películas [12] que muestran que los pericitos contraen los capilares cuando se altera su potencial de membrana para provocar la entrada de calcio, y en el cerebro se ha informado de que la actividad neuronal aumenta el flujo sanguíneo local al inducir a los pericitos a dilatar los capilares antes de que se produzca la dilatación de las arteriolas aguas arriba. [11] Esta área es controvertida, ya que un estudio de 2015 afirma que los pericitos no expresan proteínas contráctiles y no son capaces de contraerse in vivo, [10] aunque este último artículo ha sido criticado por utilizar una definición muy poco convencional de pericito que excluye explícitamente a los pericitos contráctiles. [30] Parece que diferentes vías de señalización regulan la constricción de los capilares por parte de los pericitos y de las arteriolas por parte de las células musculares lisas. [31] Estudios recientes en ratas han encontrado una vía de señalización en la que después de una lesión de la médula espinal y una hipoxia inducida por debajo de la lesión, hay un exceso de actividad de los receptores de monoamina en los pericitos que contrae localmente los capilares y reduce el flujo sanguíneo a niveles isquémicos. [32]
Los pericitos son importantes para mantener la circulación. En un estudio en ratones adultos con deficiencia de pericitos, el flujo sanguíneo cerebral disminuyó con una regresión vascular simultánea debido a la pérdida de endotelios y pericitos. Se informó de una hipoxia significativamente mayor en el hipocampo de los ratones con deficiencia de pericitos, así como de inflamación y deterioro del aprendizaje y la memoria . [33]
Importancia clínica
Debido a su papel crucial en el mantenimiento y la regulación de la estructura de las células endoteliales y el flujo sanguíneo, se observan anomalías en la función de los pericitos en muchas patologías. Pueden estar presentes en exceso, lo que conduce a enfermedades como la hipertensión y la formación de tumores, o en deficiencia, lo que conduce a enfermedades neurodegenerativas.
Hemangioma
Las fases clínicas del hemangioma presentan diferencias fisiológicas, correlacionadas con perfiles inmunofenotípicos por Takahashi et al. Durante la fase proliferativa temprana (0-12 meses) los tumores expresan antígeno nuclear de células proliferantes (pericitosna), factor de crecimiento endotelial vascular (VEGF) y colagenasa tipo IV, los dos primeros localizados tanto en el endotelio como en los pericitos, y el último en el endotelio. Los marcadores vasculares CD31, factor de von Willebrand (vWF) y actina de músculo liso (marcador de pericitos) están presentes durante las fases de proliferación e involución, pero se pierden después de que la lesión está completamente involucionada. [34]
Hemangiopericitoma

El hemangiopericitoma es una neoplasia vascular rara, o crecimiento anormal, que puede ser benigna o maligna. En su forma maligna, puede producir metástasis en los pulmones, el hígado, el cerebro y las extremidades. Se manifiesta con mayor frecuencia en el fémur y la tibia proximal como un sarcoma óseo, y suele encontrarse en personas mayores, aunque se han encontrado casos en niños. El hemangiopericitoma es causado por la superposición excesiva de láminas de pericitos alrededor de vasos sanguíneos mal formados. El diagnóstico de este tumor es difícil debido a la incapacidad de distinguir los pericitos de otros tipos de células mediante microscopía óptica. El tratamiento puede implicar la extirpación quirúrgica y la radioterapia, según el nivel de penetración ósea y la etapa de desarrollo del tumor. [35]
Retinopatía diabética
La retina de los individuos diabéticos a menudo presenta pérdida de pericitos, y esta pérdida es un factor característico de las primeras etapas de la retinopatía diabética . Los estudios han encontrado que los pericitos son esenciales en los individuos diabéticos para proteger las células endoteliales de los capilares retinianos. Con la pérdida de pericitos, se forman microaneurismas en los capilares. En respuesta, la retina aumenta su permeabilidad vascular, lo que lleva a la hinchazón del ojo a través de un edema macular , o forma nuevos vasos que permean la membrana vítrea del ojo. El resultado final es la reducción o pérdida de la visión. [36] Si bien no está claro por qué se pierden pericitos en pacientes diabéticos, una hipótesis es que el sorbitol tóxico y los productos finales de la glicación avanzada (AGE) se acumulan en los pericitos. Debido a la acumulación de glucosa, la vía del poliol aumenta su flujo y el sorbitol y la fructosa intracelulares se acumulan. Esto conduce a un desequilibrio osmótico, que resulta en daño celular. La presencia de niveles elevados de glucosa también conduce a la acumulación de AGE, que también dañan las células. [37]
Enfermedades neurodegenerativas
Los estudios han encontrado que la pérdida de pericitos en el cerebro adulto y envejecido conduce a la interrupción de la perfusión cerebral adecuada y el mantenimiento de la barrera hematoencefálica, lo que causa neurodegeneración y neuroinflamación. [ cita requerida ] La apoptosis de los pericitos en el cerebro envejecido puede ser el resultado de una falla en la comunicación entre los factores de crecimiento y los receptores en los pericitos. El factor de crecimiento derivado de plaquetas B ( PDGFB ) se libera de las células endoteliales en la vasculatura cerebral y se une al receptor PDGFRB en los pericitos, iniciando su proliferación e inversión en la vasculatura.
Los estudios inmunohistoquímicos de tejido humano de la enfermedad de Alzheimer y la esclerosis lateral amiotrófica muestran pérdida de pericitos y deterioro de la barrera hematoencefálica. Los modelos de ratón deficientes en pericitos (que carecen de genes que codifican pasos en la cascada de señalización PDGFB:PDGFRB) y que tienen una mutación que causa Alzheimer han exacerbado la patología similar a la enfermedad de Alzheimer en comparación con los ratones con una cobertura de pericitos normal y una mutación que causa Alzheimer.
Ataque
En caso de accidente cerebrovascular , los pericitos contraen los capilares cerebrales y luego mueren, lo que puede provocar una disminución duradera del flujo sanguíneo y la pérdida de la función de la barrera hematoencefálica, aumentando la muerte de células nerviosas. [11]
Investigación
Interacciones endoteliales y pericíticas
Las células endoteliales y los pericitos son interdependientes y la falla de la comunicación adecuada entre los dos tipos de células puede conducir a numerosas patologías humanas. [38]
Existen varias vías de comunicación entre las células endoteliales y los pericitos. La primera es la señalización del factor de crecimiento transformante (TGF), que está mediada por las células endoteliales. Esto es importante para la diferenciación de los pericitos. [39] [40] La señalización de angiopoyetina 1 y Tie-2 es esencial para la maduración y estabilización de las células endoteliales. [41] La señalización de la vía del factor de crecimiento derivado de plaquetas (PDGF) de las células endoteliales recluta pericitos, de modo que estos puedan migrar a los vasos sanguíneos en desarrollo. Si esta vía está bloqueada, conduce a una deficiencia de pericitos. [42] La señalización de esfingosina-1-fosfato (S1P) también ayuda al reclutamiento de pericitos mediante la comunicación a través de receptores acoplados a proteína G. S1P envía señales a través de GTPasas que promueven el tráfico de N-cadherina a las membranas endoteliales. Este tráfico fortalece los contactos endoteliales con los pericitos. [43]
La comunicación entre las células endoteliales y los pericitos es vital. La inhibición de la vía del PDGF conduce a una deficiencia de pericitos. Esto causa hiperplasia endotelial, uniones anormales y retinopatía diabética. [36] La falta de pericitos también causa una regulación positiva del factor de crecimiento endotelial vascular (VEGF), lo que conduce a fugas vasculares y hemorragias . [44] La angiopoyetina 2 puede actuar como antagonista de Tie-2, [45] desestabilizando las células endoteliales, lo que resulta en una menor interacción entre las células endoteliales y los pericitos. Esto ocasionalmente conduce a la formación de tumores. [46] De manera similar a la inhibición de la vía del PDGF, la angiopoyetina 2 reduce los niveles de pericitos, lo que conduce a la retinopatía diabética. [47]
Cicatrización
Por lo general, los astrocitos se asocian con el proceso de cicatrización en el sistema nervioso central , formando cicatrices gliales . Se ha propuesto que un subtipo de pericitos participa en esta cicatrización de una manera independiente de la glía. A través de estudios de seguimiento de linaje, se hizo un seguimiento de este subtipo de pericitos después del accidente cerebrovascular, lo que reveló que contribuyen a la cicatriz glial al diferenciarse en miofibroblastos y depositar matriz extracelular. [48] Sin embargo, esto sigue siendo controvertido, ya que estudios más recientes sugieren que es probable que el tipo de célula seguido en estos estudios de cicatrices no sean pericitos, sino fibroblastos. [49] [50]
Contribución a la neurogénesis adulta
La evidencia emergente (a partir de 2019) sugiere que los pericitos microvasculares neuronales, bajo la instrucción de las células gliales residentes, se reprograman en interneuronas y enriquecen los microcircuitos neuronales locales. [51] Esta respuesta se amplifica por la angiogénesis concomitante.
Véase también
- Hemangiopericitoma
- Mesoangioblast
- Retinopatía diabética causada por muerte de pericitos
- Lista de tipos de células humanas derivadas de las capas germinales
Referencias
- ^ Dore-Duffy, P. (2008). "Pericitos: células pluripotentes de la barrera hematoencefálica". Current Pharmaceutical Design . 14 (16): 1581–93. doi :10.2174/138161208784705469. PMID 18673199.
- ^ Birbrair A, Zhang T, Wang ZM, Messi ML, Mintz A, Delbono O (enero de 2015). "Pericitos en la intersección entre la regeneración tisular y la patología". Clinical Science . 128 (2): 81–93. doi :10.1042/CS20140278. PMC 4200531 . PMID 25236972.
- ^ Bergers G, Song S (octubre de 2005). "El papel de los pericitos en la formación y el mantenimiento de los vasos sanguíneos". Neuro-Oncology . 7 (4): 452–64. doi :10.1215/S1152851705000232. PMC 1871727 . PMID 16212810.
- ^ Sims, David E. (enero de 1986). "El pericito: una revisión". Tejido y célula . 18 (2): 153–174. doi :10.1016/0040-8166(86)90026-1. PMID 3085281.
- ^ Muhl, Lars; Genové, Guillem; Leptidis, Stefanos; Liu, Jianping; He, Liqun; Mocci, Giuseppe; Sun, Ying; Gustafsson, Sonja; Buyandelger, Byambajav; Chivukula, Indira V.; Segerstolpe, Åsa (diciembre de 2020). "El análisis de células individuales descubre la heterogeneidad de los fibroblastos y los criterios para la identificación y discriminación de fibroblastos y células murales". Nature Communications . 11 (1): 3953. Bibcode :2020NatCo..11.3953M. doi :10.1038/s41467-020-17740-1. ISSN 2041-1723. PMC 7414220 . PMID 32769974.
- ^ abcdef Winkler EA, Bell RD, Zlokovic BV (octubre de 2011). "Pericitos del sistema nervioso central en la salud y la enfermedad". Nature Neuroscience . 14 (11): 1398–1405. doi :10.1038/nn.2946. PMC 4020628 . PMID 22030551.
- ^ abc Dore-Duffy P, Cleary K (2011). "Morfología y propiedades de los pericitos". La barrera hematoencefálica y otras barreras neuronales . Métodos en biología molecular. Vol. 686. págs. 49–68. doi :10.1007/978-1-60761-938-3_2. ISBN 978-1-60761-937-6. Número de identificación personal 21082366.
- ^ Liebner S, Czupalla CJ, Wolburg H (2011). "Conceptos actuales del desarrollo de la barrera hematoencefálica". Revista internacional de biología del desarrollo . 55 (4–5): 467–76. doi : 10.1387/ijdb.103224sl . PMID 21769778.
- ^ Hartmann, David A.; Berthiaume, Andrée-Anne; Grant, Roger I.; Harrill, Sarah A.; Koski, Tegan; Tieu, Taryn; McDowell, Konnor P.; Faino, Anna V.; Kelly, Abigail L.; Shih, Andy Y. (mayo de 2021). "Los pericitos capilares cerebrales ejercen una influencia sustancial pero lenta en el flujo sanguíneo". Nature Neuroscience . 24 (5): 633–645. doi :10.1038/s41593-020-00793-2. ISSN 1097-6256. PMC 8102366 . PMID 33603231.
- ^ ab Hill RA, Tong L, Yuan P, Murikinati S, Gupta S, Grutzendler J (julio de 2015). "El flujo sanguíneo regional en el cerebro normal e isquémico está controlado por la contractilidad de las células musculares lisas arteriolares y no por los pericitos capilares". Neuron . 87 (1): 95–110. doi :10.1016/j.neuron.2015.06.001. PMC 4487786 . PMID 26119027.
- ^ abc Hall CN, Reynell C, Gesslein B, Hamilton NB, Mishra A, Sutherland BA, O'Farrell FM, Buchan AM, Lauritzen M, Attwell D (abril de 2014). "Los pericitos capilares regulan el flujo sanguíneo cerebral en la salud y la enfermedad". Nature . 508 (7494): 55–60. Bibcode :2014Natur.508...55H. doi :10.1038/nature13165. PMC 3976267 . PMID 24670647.
- ^ ab Peppiatt CM, Howarth C, Mobbs P, Attwell D (octubre de 2006). "Control bidireccional del diámetro capilar del SNC por los pericitos". Nature . 443 (7112): 700–4. Bibcode :2006Natur.443..700P. doi :10.1038/nature05193. PMC 1761848 . PMID 17036005.
- ^ Rustenhoven, Justin; Smyth, Leon C.; Jansson, Deidre; Schweder, Patrick; Aalderink, Miranda; Scotter, Emma L .; Mee, Edward W.; Faull, Richard LM; Park, Thomas I.-H.; Dragunow, Mike (diciembre de 2018). "Modelado de condiciones fisiológicas y patológicas para estudiar la biología de los pericitos en la función y disfunción cerebral". BMC Neuroscience . 19 (1): 6. doi : 10.1186/s12868-018-0405-4 . ISSN 1471-2202. PMC 5824614 . PMID 29471788.
- ^ Fakhrejahani E, Toi M (2012). "Angiogénesis tumoral: los pericitos y la maduración no deben ignorarse". Journal of Oncology . 2012 : 1–10. doi : 10.1155/2012/261750 . PMC 3191787 . PMID 22007214.
- ^ "Asociación de pericitos, astrocitos y lámina basal con la barrera hematoencefálica (BHE)". Ciencias de la Salud de la Universidad de Arizona. Archivado desde el original el 16 de febrero de 2017.
- ^ ab Birbrair A, Zhang T, Wang ZM, Messi ML, Enikolopov GN, Mintz A, Delbono O (enero de 2013). "Los subtipos de pericitos del músculo esquelético difieren en su potencial de diferenciación". Investigación de células madre . 10 (1): 67–84. doi :10.1016/j.scr.2012.09.003. PMC 3781014 . PMID 23128780.
- ^ Birbrair A, Zhang T, Wang ZM, Messi ML, Enikolopov GN, Mintz A, Delbono O (enero de 2013). "Las células progenitoras neurales del músculo esquelético exhiben propiedades de NG2-glia". Experimental Cell Research . 319 (1): 45–63. doi :10.1016/j.yexcr.2012.09.008. PMC 3597239 . PMID 22999866.
- ^ ab Birbrair A, Zhang T, Wang ZM, Messi ML, Mintz A, Delbono O (diciembre de 2013). "Los pericitos de tipo 1 participan en la deposición de tejido fibroso en el músculo esquelético envejecido". Revista estadounidense de fisiología. Fisiología celular . 305 (11): C1098–113. doi :10.1152/ajpcell.00171.2013. PMC 3882385. PMID 24067916 .
- ^ Gerhardt H, Betsholtz C (octubre de 2003). "Interacciones endoteliales-pericíticas en la angiogénesis". Cell and Tissue Research . 314 (1): 15–23. doi :10.1007/s00441-003-0745-x. PMID 12883993. S2CID 24258796.
- ^ Ramsauer M, Krause D, Dermietzel R (agosto de 2002). "Angiogénesis de la barrera hematoencefálica in vitro y la función de los pericitos cerebrales". FASEB Journal . 16 (10): 1274–6. doi : 10.1096/fj.01-0814fje . PMID 12153997. S2CID 37606009.
- ^ Franco M, Roswall P, Cortez E, Hanahan D, Pietras K (septiembre de 2011). "Los pericitos promueven la supervivencia de las células endoteliales mediante la inducción de la señalización autocrina de VEGF-A y la expresión de Bcl-w". Blood . 118 (10): 2906–17. doi :10.1182/blood-2011-01-331694. PMC 3172806 . PMID 21778339.
- ^ Gupta K, Kshirsagar S, Li W, Gui L, Ramakrishnan S, Gupta P, Law PY, Hebbel RP (marzo de 1999). "VEGF previene la apoptosis de las células endoteliales microvasculares humanas a través de efectos opuestos en la señalización MAPK/ERK y SAPK/JNK". Experimental Cell Research . 247 (2): 495–504. doi :10.1006/excr.1998.4359. PMID 10066377.
- ^ Daneman R, Zhou L, Kebede AA, Barres BA (noviembre de 2010). "Los pericitos son necesarios para la integridad de la barrera hematoencefálica durante la embriogénesis". Nature . 468 (7323): 562–6. Bibcode :2010Natur.468..562D. doi :10.1038/nature09513. PMC 3241506 . PMID 20944625.
- ^ Armulik A, Genové G, Mäe M, Nisancioglu MH, Wallgard E, Niaudet C, He L, Norlin J, Lindblom P, Strittmatter K, Johansson BR, Betsholtz C (noviembre de 2010). "Los pericitos regulan la barrera hematoencefálica". Naturaleza . 468 (7323): 557–61. Código Bib :2010Natur.468..557A. doi : 10.1038/naturaleza09522. hdl : 10616/40288 . PMID 20944627. S2CID 4429989.
- "La clave para la barrera hematoencefálica abre el camino al tratamiento del Alzheimer y el ictus". Instituto Karolinska . 14 de octubre de 2010. Archivado desde el original el 1 de febrero de 2014.
- ^ Mäe, Maarja A.; Él, Liquín; Nordling, Sofía; Vázquez-Liébanas, Elisa; Nahar, Khayrun; Jung, Bonnam; Li, Xidan; Bronceado, Bryan C.; Chin Foo, Juat; Cazenave-Gassiot, Amaury; Wenk, Markus R. (19 de febrero de 2021). "Análisis unicelular de la respuesta de la barrera hematoencefálica a la pérdida de pericitos". Investigación de circulación . 128 (4): e46-e62. doi : 10.1161/CIRCRESAHA.120.317473 . ISSN 0009-7330. PMC 10858745 . PMID 33375813. S2CID 229721934.
- ^ Halliday, Matthew R; Rege, Sanket V; Ma, Qingyi; Zhao, Zhen; Miller, Carol A; Winkler, Ethan A; Zlokovic, Berislav V (enero de 2016). "Degeneración acelerada de los pericitos y degradación de la barrera hematoencefálica en portadores de apolipoproteína E4 con enfermedad de Alzheimer". Journal of Cerebral Blood Flow & Metabolism . 36 (1): 216–227. doi :10.1038/jcbfm.2015.44. ISSN 0271-678X. PMC 4758554 . PMID 25757756.
- ^ Miners, J Scott; Schulz, Isabel; Love, Seth (enero de 2018). "Diferentes asociaciones entre la acumulación de Aβ, la hipoperfusión, la disfunción de la barrera hematoencefálica y la pérdida del marcador pericítico PDGFRB en el precúneo y la sustancia blanca parietal en la enfermedad de Alzheimer". Journal of Cerebral Blood Flow & Metabolism . 38 (1): 103–115. doi :10.1177/0271678X17690761. ISSN 0271-678X. PMC 5757436 . PMID 28151041.
- ^ Sengillo, Jesse D.; Winkler, Ethan A.; Walker, Corey T.; Sullivan, John S.; Johnson, Mahlon; Zlokovic, Berislav V. (mayo de 2013). "La deficiencia en células vasculares murales coincide con la alteración de la barrera hematoencefálica en la enfermedad de Alzheimer: pericitos en la enfermedad de Alzheimer". Patología cerebral . 23 (3): 303–310. doi :10.1111/bpa.12004. PMC 3628957 . PMID 23126372.
- ^ Winkler, Ethan A.; Sengillo, Jesse D.; Sullivan, John S.; Henkel, Jenny S.; Appel, Stanley H.; Zlokovic, Berislav V. (enero de 2013). "Descomposición de la barrera hematoencefálica y reducción de pericitos en la esclerosis lateral amiotrófica". Acta Neuropathologica . 125 (1): 111–120. doi :10.1007/s00401-012-1039-8. ISSN 0001-6322. PMC 3535352 . PMID 22941226.
- ^ Attwell D, Mishra A, Hall CN, O'Farrell FM, Dalkara T (febrero de 2016). "¿Qué es un pericito?". Revista de flujo sanguíneo cerebral y metabolismo . 36 (2): 451–5. doi :10.1177/0271678x15610340. PMC 4759679. PMID 26661200 .
- ^ Mishra A, Reynolds JP, Chen Y, Gourine AV, Rusakov DA, Attwell D (diciembre de 2016). "Los astrocitos median la señalización neurovascular a los pericitos capilares pero no a las arteriolas". Nature Neuroscience . 19 (12): 1619–1627. doi :10.1038/nn.4428. PMC 5131849 . PMID 27775719.
- ^ Li, Yaqing; Lucas-Osma, Ana M.; Black, Sophie; Bandet, Mischa V.; Stephens, Marilee J.; Vavrek, Romana; Sanelli, Leo; Fenrich, Keith K.; Di Narzo, Antonio F.; Dracheva, Stella; Winship, Ian R.; Fouad, Karim; Bennett, David J. (junio de 2017). "Los pericitos perjudican el flujo sanguíneo capilar y la función motora después de una lesión crónica de la médula espinal". Nature Medicine . 23 (6): 733–741. doi :10.1038/nm.4331. ISSN 1546-170X. PMC 5716958 . PMID 28459438.
- ^ Bell RD, Winkler EA, Sagare AP, Singh I, LaRue B, Deane R, Zlokovic BV (noviembre de 2010). "Los pericitos controlan funciones neurovasculares clave y el fenotipo neuronal en el cerebro adulto y durante el envejecimiento cerebral". Neuron . 68 (3): 409–27. doi :10.1016/j.neuron.2010.09.043. PMC 3056408 . PMID 21040844.
- ^ Munde P. "Pericitos en la salud y la enfermedad". Celesta Software Pvt Ltd. Consultado el 22 de noviembre de 2014 .
- ^ Gellman H. "Solitary Fibrous Tumor". Medscape . Consultado el 2 de noviembre de 2011 .
- ^ ab Hammes HP, Lin J, Renner O, Shani M, Lundqvist A, Betsholtz C, Brownlee M, Deutsch U (octubre de 2002). "Pericitos y patogénesis de la retinopatía diabética". Diabetes . 51 (10): 3107–12. doi : 10.2337/diabetes.51.10.3107 . PMID 12351455.
- ^ Ciulla TA, Amador AG, Zinman B (septiembre de 2003). "Retinopatía diabética y edema macular diabético: fisiopatología, detección y nuevas terapias". Diabetes Care . 26 (9): 2653–64. doi : 10.2337/diacare.26.9.2653 . PMID 12941734.
- ^ Armulik A, Abramsson A, Betsholtz C (septiembre de 2005). "Interacciones endoteliales/pericíticas". Circulation Research . 97 (6): 512–23. doi : 10.1161/01.RES.0000182903.16652.d7 . PMID 16166562.
- ^ Carvalho RL, Jonker L, Goumans MJ, Larsson J, Bouwman P, Karlsson S, Dijke PT, Arthur HM, Mummery CL (diciembre de 2004). "Señalización paracrina defectuosa por TGFbeta en la vasculatura del saco vitelino de ratones mutantes de endoglina: un paradigma para la telangiectasia hemorrágica hereditaria". Desarrollo . 131 (24): 6237–47. doi : 10.1242/dev.01529 . PMID 15548578.
- ^ Hirschi KK, Rohovsky SA, D'Amore PA (mayo de 1998). "PDGF, TGF-beta y las interacciones célula-célula heterotípicas median el reclutamiento inducido por células endoteliales de células 10T1/2 y su diferenciación hacia un destino de músculo liso". The Journal of Cell Biology . 141 (3): 805–14. doi :10.1083/jcb.141.3.805. PMC 2132737 . PMID 9566978.
- ^ Thurston G, Suri C, Smith K, McClain J, Sato TN, Yancopoulos GD, McDonald DM (diciembre de 1999). "Vasos sanguíneos resistentes a fugas en ratones que sobreexpresan angiopoyetina-1 de forma transgénica". Science . 286 (5449): 2511–4. doi :10.1126/science.286.5449.2511. PMID 10617467.
- ^ Bjarnegård M, Enge M, Norlin J, Gustafsdottir S, Fredriksson S, Abramsson A, Takemoto M, Gustafsson E, Fässler R, Betsholtz C (abril de 2004). "La ablación específica del endotelio de PDGFB conduce a la pérdida de pericitos y a anomalías glomerulares, cardíacas y placentarias". Desarrollo . 131 (8): 1847–57. doi : 10.1242/dev.01080 . PMID 15084468.
- ^ Paik JH, Skoura A, Chae SS, Cowan AE, Han DK, Proia RL, Hla T (octubre de 2004). "La regulación del receptor de esfingosina 1-fosfato de la N-cadherina media la estabilización vascular". Genes & Development . 18 (19): 2392–403. doi :10.1101/gad.1227804. PMC 522989 . PMID 15371328.
- ^ Hellström M, Gerhardt H, Kalén M, Li X, Eriksson U, Wolburg H, Betsholtz C (abril de 2001). "La falta de pericitos conduce a hiperplasia endotelial y morfogénesis vascular anormal". The Journal of Cell Biology . 153 (3): 543–53. doi :10.1083/jcb.153.3.543. PMC 2190573 . PMID 11331305.
- ^ Maisonpierre PC, Suri C, Jones PF, Bartunkova S, Wiegand SJ, Radziejewski C, Compton D, McClain J, Aldrich TH, Papadopoulos N, Daly TJ, Davis S, Sato TN, Yancopoulos GD (julio de 1997). "Angiopoietina-2, un antagonista natural de Tie2 que altera la angiogénesis in vivo". Science . 277 (5322): 55–60. doi :10.1126/science.277.5322.55. PMID 9204896.
- ^ Zhang L, Yang N, Park JW, Katsaros D, Fracchioli S, Cao G, O'Brien-Jenkins A, Randall TC, Rubin SC, Coukos G (junio de 2003). "El factor de crecimiento endotelial vascular derivado de tumores regula positivamente la angiopoyetina-2 en el endotelio del huésped y desestabiliza la vasculatura del huésped, lo que favorece la angiogénesis en el cáncer de ovario". Cancer Research . 63 (12): 3403–12. PMID 12810677.
- ^ Hammes HP, Lin J, Wagner P, Feng Y, Vom Hagen F, Krzizok T, Renner O, Breier G, Brownlee M, Deutsch U (abril de 2004). "La angiopoyetina-2 provoca la pérdida de pericitos en la retina normal: evidencia de participación en la retinopatía diabética". Diabetes . 53 (4): 1104–10. doi : 10.2337/diabetes.53.4.1104 . PMID 15047628.
- ^ Göritz C, Dias DO, Tomilin N, Barbacid M, Shupliakov O, Frisén J (julio de 2011). "Origen pericítico del tejido cicatricial de la médula espinal". Science . 333 (6039): 238–42. Bibcode :2011Sci...333..238G. doi :10.1126/science.1203165. PMID 21737741. S2CID 206532774.
- ^ Soderblom C, Luo X, Blumenthal E, Bray E, Lyapichev K, Ramos J, Krishnan V, Lai-Hsu C, Park KK, Tsoulfas P, Lee JK (agosto de 2013). "Los fibroblastos perivasculares forman la cicatriz fibrótica después de una lesión contusa de la médula espinal". The Journal of Neuroscience . 33 (34): 13882–7. doi :10.1523/JNEUROSCI.2524-13.2013. PMC 3755723 . PMID 23966707.
- ^ Vanlandewijck M, He L, Mäe MA, Andrae J, Ando K, Del Gaudio F, Nahar K, Lebouvier T, Laviña B, Gouveia L, Sun Y, Raschperger E, Räsänen M, Zarb Y, Mochizuki N, Keller A, Lendahl U, Betsholtz C (febrero de 2018). "Un atlas molecular de tipos de células y zonificación en la vasculatura cerebral". Naturaleza . 554 (7693): 475–480. Código Bib :2018Natur.554..475V. doi : 10.1038/naturaleza25739. hdl : 10138/301079 . PMID 29443965. S2CID 205264161.
- ^ Farahani, Ramin M.; Rezaei-Lotfi, Saba; Simonian, Mary; Xaymardan, Munira; Hunter, Neil (2019). "Los pericitos microvasculares neuronales contribuyen a la neurogénesis adulta humana". Revista de neurología comparada . 527 (4): 780–796. doi :10.1002/cne.24565. ISSN 1096-9861. PMID 30471080. S2CID 53711787.
Enlaces externos
- www.stemcellsfreak.com — Los pericitos pueden utilizarse para la regeneración muscular
- Diagrama en udel.edu

