Perclorato de zinc
 | |
 | |
| Nombres | |
|---|---|
| Otros nombres Diperclorato de zinc, perclorato de zinc (II) | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Araña química |
|
| Tarjeta informativa de la ECHA | 100.033.733 |
| Número CE |
|
Identificador de centro de PubChem |
|
| UNIVERSIDAD |
|
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| Cl 2Oh 8Zinc | |
| Masa molar | 261.826 |
| Apariencia | sólido incoloro |
| Densidad | 2,252 g/ cm3 |
| Punto de fusión | 106 °C (223 °F; 379 K) |
| Punto de ebullición | 210 °C (410 °F; 483 K) |
| soluble | |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
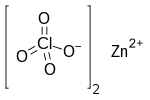
El perclorato de zinc es el compuesto inorgánico con la fórmula química Zn(ClO 4 ) 2 que forma el hexahidrato. [1] [2]
Síntesis
El perclorato de zinc se puede preparar disolviendo óxido de zinc o carbonato de zinc en ácido perclórico : [3]
Propiedades químicas
El compuesto se descompone cuando se calienta a altas temperaturas y puede explotar si se calienta demasiado.
Como la mayoría de los demás percloratos, como el perclorato de cobre y el perclorato de plomo , el perclorato de zinc es propenso a la deliquescencia .
El perclorato de zinc puede formar complejos con ligandos como 8-aminoquinolina , tricarbohidrazida y tetrafeniletilen tetratriazol. [4]
Propiedades físicas
El compuesto forma un hexahidrato Zn(ClO
4)
2·6 horas
2O . [5] [6]
El perclorato de zinc forma un sólido higroscópico incoloro, inodoro, soluble en agua y alcoholes de bajo peso.
Usos
El perclorato de zinc se utiliza como agente oxidante y catalizador.
Referencias
- ^ Kumar, Raj; Thilagavathi, Ramasamy; Gulhane, Rajesh; Chakraborti, Asit K. (2 de mayo de 2006). "Perclorato de zinc (II) como un catalizador nuevo y altamente eficiente para la formación de aldehído 1,1-diacetato a temperatura ambiente y en condiciones libres de solventes". Journal of Molecular Catalysis A: Chemical . 250 (1): 226–231. doi :10.1016/j.molcata.2006.01.063. ISSN 1381-1169 . Consultado el 14 de marzo de 2023 .
- ^ Avances en química inorgánica. Academic Press. 5 de diciembre de 1984. pág. 283. ISBN 978-0-08-057877-4. Recuperado el 14 de marzo de 2023 .
- ^ Lin, Lili; Liu, Xiaohua; Feng, Xiaoming (27 de mayo de 2014). "Perclorato de cinc (II) hexahidratado". Enciclopedia de reactivos para síntesis orgánica : 1–5. doi :10.1002/047084289X.rn01657. ISBN 9780470842898. Recuperado el 14 de marzo de 2023 .
- ^ "Complejo metálico de perclorato de zinc y 8-aminoquinolina, y método de preparación y aplicación del mismo". 30 de abril de 2014. Consultado el 14 de marzo de 2023 .
- ^ "Perclorato de cinc hexahidratado". American Elements . Consultado el 14 de marzo de 2023 .
- ^ "Perclorato de cinc hexahidratado". Sigma Aldrich . Consultado el 14 de marzo de 2023 .


