Peróxido de acetona
 Ejemplos de dímeros y trímeros cíclicos | |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombres IUPAC 3,3-Dimetil-1,2-dioxaciclopropano (monómero) 3,3,6,6-Tetrametil-1,2,4,5-tetraoxano (dímero) 3,3,6,6,9,9-Hexametil- 3,3,6,6,9,9,12,12-Octametil- | |||
| Otros nombres Triperóxido de triacetona Peroxiacetona Madre de Satanás | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| Araña química | |||
| Número E | E929 (agentes de recubrimiento, ...) | ||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C 6 H 12 O 4 (dímero) C 9 H 18 O 6 (trímero) C 12 H 24 O 8 (tetrámero) | |||
| Masa molar | 148,157 g/mol (dímero) 222,24 g/mol (trímero) 296,296 g/mol (tetrámero) [1] | ||
| Apariencia | Sólido cristalino blanco | ||
| Punto de fusión | 131,5 a 133 °C (dímero) [2] 91 °C (trímero) | ||
| Punto de ebullición | 97 a 160 °C (207 a 320 °F; 370 a 433 K) | ||
| Insoluble | |||
| Peligros | |||
| Etiquetado SGA : | |||
  | |||
| NFPA 704 (rombo cortafuegos) | |||
| Datos explosivos | |||
| Sensibilidad a los golpes | Alto/Alto cuando está mojado | ||
| Sensibilidad a la fricción | Alto/moderado cuando está húmedo | ||
| Velocidad de detonación | 5300 m/s a densidad máxima (1,18 g/cm 3 ), alrededor de 2500–3000 m/s cerca de 0,5 g/cm 3 17 384 pies/s 3,29 millas por segundo | ||
| Factor RE | 0,80 | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
Peróxido de acetona ( / æ s ə ˈ t ə ʊ n p ɛr ˈ ɒ k s aɪ d / también llamadoAPEXymadre de Satanás[3][4]) es unperóxido orgánicoy unexplosivo primario. Se produce por la reacción deacetonayperóxido de hidrógenopara producir una mezcla demonómeroycíclicas de dímero,trímeroytetrámero. El monómero esdimetildioxirano. El dímero se conoce como diperóxido de diacetona(DADP). El trímero se conoce comotriperóxido de triacetona(TATP) operóxido de acetona tricíclico(TCAP). El peróxido de acetona toma la forma de un polvo cristalino blanco con un olor distintivode la lejía(cuando es impuro) o un olor similar al de la fruta cuando es puro, y puede explotar poderosamente si se somete a calor, fricción, electricidad estática, ácido sulfúrico concentrado, fuerte radiación ultravioleta ochoque. Hasta aproximadamente 2015, los detectores de explosivos no estaban configurados para detectar explosivos no nitrogenados, ya que la mayoría de los explosivos utilizados antes de 2015 estaban basados en nitrógeno. El TATP, al no contener nitrógeno, se ha utilizado como explosivo de elección en variosterroristascon bombas desde 2001.
Historia
El peróxido de acetona (específicamente, triperóxido de triacetona) fue descubierto en 1895 por el químico alemán Richard Wolffenstein . [5] [6] [7] Wolffenstein combinó acetona y peróxido de hidrógeno , y luego dejó reposar la mezcla durante una semana a temperatura ambiente, tiempo durante el cual precipitó una pequeña cantidad de cristales, que tenían un punto de fusión de 97 °C (207 °F). [8]
En 1899, Adolf von Baeyer y Victor Villiger describieron la primera síntesis del dímero y describieron el uso de ácidos para la síntesis de ambos peróxidos. [9] [10] [11] [12] [13] Baeyer y Villiger prepararon el dímero combinando persulfato de potasio en éter dietílico con acetona, bajo enfriamiento. Después de separar la capa de éter, el producto se purificó y se descubrió que se fundía a 132-133 °C (270-271 °F). [14] Descubrieron que el trímero se podía preparar añadiendo ácido clorhídrico a una mezcla fría de acetona y peróxido de hidrógeno. [15] Al utilizar la depresión de los puntos de congelación para determinar los pesos moleculares de los compuestos, también determinaron que la forma de peróxido de acetona que habían preparado a través del persulfato de potasio era un dímero, mientras que el peróxido de acetona que se había preparado a través del ácido clorhídrico era un trímero, como el compuesto de Wolffenstein. [16]
Los trabajos sobre esta metodología y sobre los diversos productos obtenidos fueron investigados más a fondo a mediados del siglo XX por Milas y Golubović. [17]
Química
El nombre químico peróxido de acetona se utiliza con mayor frecuencia para referirse al trímero cíclico, el producto de una reacción entre dos precursores , peróxido de hidrógeno y acetona, en una adición nucleofílica catalizada por ácido , aunque también son posibles las formas monoméricas y diméricas. [18] [19]
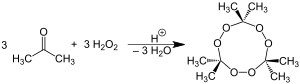
En concreto, también se pueden formar dos dímeros, uno cíclico (C 6 H 12 O 4 ) y otro de cadena abierta (C 6 H 14 O 4 ), así como un monómero de dihidroperóxido abierto (C 3 H 8 O 4 ), [20] ; en un conjunto particular de condiciones de concentración de reactivo y catalizador ácido, el trímero cíclico es el producto primario. [17] En condiciones neutras, se informa que la reacción produce el peróxido orgánico monomérico . [17]
También se ha descrito una forma tetramérica, en diferentes condiciones catalíticas, [21] aunque no sin disputas y controversias. [22] [23]
La ruta más común para obtener TATP casi puro es H2O2 / acetona / HCl en proporciones molares de 1:1:0,25, utilizando peróxido de hidrógeno al 30%. Este producto contiene muy poco o nada de DADP con algunos rastros muy pequeños de compuestos clorados. El producto que contiene una gran fracción de DADP se puede obtener a partir de H2O2 al 50% utilizando grandes cantidades de ácido sulfúrico concentrado como catalizador o, alternativamente, con H2O2 al 30% y cantidades masivas de HCl como catalizador. [23]
El producto elaborado con ácido clorhídrico se considera más estable que el elaborado con ácido sulfúrico. Se sabe que las trazas de ácido sulfúrico atrapadas dentro de los cristales de peróxido de acetona formados provocan inestabilidad. De hecho, el ácido sulfúrico atrapado puede inducir la detonación a temperaturas tan bajas como 50 °C (122 °F). Este es el mecanismo más probable detrás de las explosiones accidentales de peróxido de acetona que ocurren durante el secado sobre superficies calientes. [24]
Los peróxidos orgánicos en general son explosivos sensibles y peligrosos, y todas las formas de peróxido de acetona son sensibles a la iniciación . [ cita requerida ] El TATP se descompone explosivamente; el examen de la descomposición explosiva del TATP en el borde mismo del frente de detonación predice "la formación de acetona y ozono como los principales productos de descomposición y no los productos de oxidación esperados intuitivamente". [25] La descomposición explosiva del TATP en el borde mismo del frente de detonación crea muy poco calor; el análisis computacional anterior sugiere que la descomposición del TATP es una explosión entrópica . [25] Sin embargo, esta hipótesis ha sido cuestionada por no ajustarse a las mediciones reales. [26] La afirmación de explosión entrópica se ha vinculado a los eventos justo detrás del frente de detonación. Los autores del artículo de 2004 de Dubnikova et al. Un estudio confirma que una reacción redox final (combustión) de ozono, oxígeno y especies reactivas en agua, varios óxidos e hidrocarburos tiene lugar aproximadamente 180 ps después de la reacción inicial, aproximadamente a una micra de la onda de detonación. Los cristales detonantes de TATP finalmente alcanzan una temperatura de 2300 K (2030 °C; 3680 °F) y una presión de 80 kbar. [27] La energía final de detonación es de aproximadamente 2800 kJ/kg (medida en helio), suficiente para elevar brevemente la temperatura de los productos gaseosos a 2000 °C (3630 °F). El volumen de gases en condiciones normales es de 855 L/kg para TATP y 713 L/kg para DADP (medido en helio). [26]
Se informa que la forma tetramérica del peróxido de acetona, preparada en condiciones neutras utilizando un catalizador de estaño en presencia de un quelante o inhibidor general de la química radical , es químicamente más estable, aunque sigue siendo un explosivo primario muy peligroso . [21] Su síntesis ha sido cuestionada. [23]
Tanto el TATP como el DADP son propensos a la pérdida de masa por sublimación . El DADP tiene un peso molecular más bajo y una presión de vapor más alta . Esto significa que el DADP es más propenso a la sublimación que el TATP. Esto puede provocar un crecimiento peligroso de los cristales cuando los vapores se depositan si los cristales se han almacenado en un recipiente con tapa roscada. Este proceso de sublimación y deposición repetidas también da como resultado un cambio en el tamaño de los cristales a través de la maduración de Ostwald .
Se pueden utilizar varios métodos para el análisis de trazas de TATP, [28] incluyendo cromatografía de gases/espectrometría de masas (GC/MS), [29] [30] [31] [32] [33] cromatografía líquida de alto rendimiento /espectrometría de masas (HPLC/MS), [34] [35] [36] [37] [38] y HPLC con derivatización post-columna. [39]
El peróxido de acetona es soluble en tolueno, cloroformo, acetona, diclorometano y metanol. [40] La recristalización de explosivos primarios puede producir cristales grandes que detonan espontáneamente debido a la tensión interna. [41]
- Peróxido de acetona tetramérico
- Depósitos de cristales de TATP sublimado.
Usos industriales
Los peróxidos de cetona , incluidos el peróxido de acetona y el peróxido de metiletilcetona , se utilizan como iniciadores de reacciones de polimerización , por ejemplo, resinas de silicona o poliéster , en la fabricación de compuestos reforzados con fibra de vidrio . [ cita requerida ] Para estos usos, los peróxidos se encuentran típicamente en forma de una solución diluida en un disolvente orgánico; el peróxido de metiletilcetona es más común para este propósito, ya que es estable en el almacenamiento. [ cita requerida ]
El peróxido de acetona se utiliza como agente blanqueador de harina para blanquear y "madurar" la harina. [42]
Los peróxidos de acetona son subproductos no deseados de algunas reacciones de oxidación, como las que se utilizan en las síntesis de fenol . [43] Debido a su naturaleza explosiva, su presencia en procesos químicos y muestras químicas crea situaciones potencialmente peligrosas. Por ejemplo, el peróxido de triacetona es el principal contaminante que se encuentra en el éter diisopropílico como resultado de la oxidación fotoquímica en el aire. [44] Es posible que se produzcan accidentalmente en laboratorios ilícitos de MDMA . [45]
Se utilizan numerosos métodos para reducir su aparición, incluido cambiar el pH a uno más alcalino, ajustar la temperatura de reacción o agregar inhibidores de su producción. [43] [ cita(s) adicional(es) necesaria(s) ]
Uso en dispositivos explosivos improvisados
El TATP se ha utilizado en ataques con bombas y suicidas y en dispositivos explosivos improvisados, incluidos los atentados de Londres del 7 de julio de 2005 , donde cuatro atacantes suicidas mataron a 52 personas e hirieron a más de 700. [46] [47] [48] [49] Fue uno de los explosivos utilizados por el "terrorista del zapato" Richard Reid [50] [51] [49] en su fallido intento de bomba de zapato de 2001 y fue utilizado por los atacantes suicidas en los ataques de París de noviembre de 2015 , [52] los atentados de Bruselas de 2016 , [53] el atentado del Manchester Arena , el atentado de Bruselas de junio de 2017 , [54] el atentado de Parsons Green , [55] los atentados de Surabaya , [56] y los atentados de Pascua de Sri Lanka de 2019 . [57] [58] La policía de Hong Kong afirma haber encontrado 2 kg (4,4 lb) de TATP entre armas y materiales de protesta en julio de 2019, cuando se estaban produciendo protestas masivas contra un proyecto de ley que permitía la extradición a China continental . [59]
La sobrepresión de la onda de choque TATP es el 70% de la del TNT, y el impulso de fase positiva es el 55% del equivalente del TNT . El TATP a 0,4 g/cm 3 tiene aproximadamente un tercio de la brisancia del TNT (1,2 g/cm 3 ) medida mediante la prueba de Hess. [60]
El TATP es atractivo para los terroristas porque se prepara fácilmente a partir de ingredientes que se consiguen fácilmente en las tiendas, como el blanqueador de cabello y el quitaesmalte de uñas. [52] También pudo evadir la detección porque es uno de los pocos explosivos de alta potencia que no contienen nitrógeno , [61] y, por lo tanto, podía pasar sin ser detectado por los escáneres de detección de explosivos estándar , que hasta entonces estaban diseñados para detectar explosivos nitrogenados. [62] En 2016, los detectores de explosivos se habían modificado para poder detectar el TATP y se desarrollaron nuevos tipos. [63] [64]
En la Unión Europea se han adoptado medidas legislativas para limitar la venta de peróxido de hidrógeno concentrado al 12% o más. [65]
Una desventaja clave es la alta susceptibilidad del TATP a la detonación accidental, causando lesiones y muertes entre los fabricantes ilegales de bombas, lo que ha llevado a que se lo denomine la "Madre de Satanás". [64] [61] El TATP se encontró en la explosión accidental que precedió a los ataques terroristas de 2017 en Barcelona y áreas circundantes . [66]
La síntesis a gran escala de TATP suele delatar un olor excesivo a lejía o afrutado. Este olor puede incluso penetrar en la ropa y el cabello en cantidades bastante perceptibles; esto se observó en los atentados de Bruselas de 2016. [ 67]
Referencias
- ^ "Masa molar C12H24O8".
- ^ Federoff, Basil T. et al., Enciclopedia de explosivos y artículos relacionados (Springfield, Virginia: Servicio Nacional de Información Técnica, 1960), vol. 1, pág. A41.
- ^ Berezow, Alex (14 de noviembre de 2018). "TATP: La química del explosivo 'Madre de Satán'". Consejo Americano de Ciencia y Salud.
- ^ Swartz, Anna (24 de marzo de 2016). "¿Qué es 'Madre de Satán'? Lo que debes saber sobre los explosivos utilizados en los ataques de Bruselas". Yahoo News.
- ^ Wolffenstein R (1895). "Über die Einwirkung von Wasserstoffsuperoxyd auf Aceton und Mesityloxyd" [Sobre el efecto del peróxido de hidrógeno sobre la acetona y el óxido de mesitilo]. Berichte der Deutschen Chemischen Gesellschaft (en alemán). 28 (2): 2265–2269. doi :10.1002/cber.189502802208. Wolffenstein determinó que el peróxido de acetona formaba un trímero y propuso una fórmula estructural para él. De las págs. 2266-2267: "Die physikalischen Eigenschaften des Superoxyds, der feste Aggregatzustand, die Unlöslichkeit in Wasser etc. sprachen dafür, dass das Molekulargewicht desselben ein grösseres wäre, als dem einfachen Atomverhältnisse entsprach. … Es lag also ein trimolekulares Acetonsuperoxyd vor, das aus dem monomolekularen entstehen kann, indem sich die Bindungen zwischen je zwei Sauerstoffatomen lösen und zur Verknüpfung mit den Sauerstoffatomen eines benachbarten Moleküls dienen Man gelangt so zur folgenden Constitutionsformel: [diagrama de la estructura molecular propuesta del. [Las propiedades físicas del peróxido , su estado sólido de agregación, su insolubilidad en agua, etc., sugerían que su peso molecular sería mayor [que el correspondiente a su fórmula empírica simple. … Así , [el resultado de la determinación del peso molecular mostró que] estaba presente un peróxido de acetona trimolecular, que puede surgir del monómero por los enlaces entre cada par de átomos de oxígeno [en una molécula de peróxido de acetona] rompiéndose y sirviendo como enlaces a los átomos de oxígeno de una molécula vecina. De este modo se llega a la siguiente fórmula estructural: [diagrama de la estructura molecular propuesta del trímero de peróxido de acetona] . Este extraño compuesto en forma de anillo se llamará "peróxido de tri-cicloacetona".)
- ^ Wolfenstein R (1895) Deutsches Reichspatent 84.953
- ^ Matyáš R, Pachman J (2013). Explosivos primarios. Berlín: Springer. pag. 262.ISBN 978-3-642-28436-6.
- ^ Wolffenstein 1895, pág. 2266.
- ^ Baeyer, Adolf; Villiger, Víctor (1899). "Einwirkung des Caro'schen Reagens auf Ketone" [Efecto del reactivo de Caro sobre las cetonas [parte 1]]. Berichte der Deutschen Chemischen Gesellschaft . 32 (3): 3625–3633. doi :10.1002/cber.189903203151.Véase pág. 3632.
- ^ Baeyer A, Villiger V (1900a). "Über die Einwirkung des Caro'schen Reagens auf Ketone" [Sobre el efecto del reactivo de Caro sobre las cetonas [parte 3]]. Berichte der Deutschen Chemischen Gesellschaft . 33 (1): 858–864. doi :10.1002/cber.190003301153.
- ^ Baeyer A, Villiger V (1900b). "Über die Nomenclatur der Superoxyde und die Superoxyde der Aldehyde" [Sobre la nomenclatura de los peróxidos y el peróxido de aldehídos] (PDF) . Berichte der Deutschen Chemischen Gesellschaft . 33 (2): 2479–2487. doi :10.1002/cber.190003302185.
- ^ Federoff, Basil T. et al., Enciclopedia de explosivos y artículos relacionados (Springfield, Virginia: Servicio Nacional de Información Técnica, 1960), vol. 1, pág. A41.
- ^ Matyáš, Robert y Pachman, Jirí, ed.s, Primary Explosives (Berlín, Alemania: Springer, 2013), pág. 257.
- ^ Baeyer y Villiger 1899, pag. 3632.
- ^ Baeyer y Villiger 1900a, pág. 859.
- ^ Baeyer y Villiger 1900a, pág. 859 "Das mit dem Caro'schen Reagens dargestellte, bei 132–133° schmelzende Superoxyd gab bei der Molekulargewichtsbestimmung nach der Gefrierpunktsmethode Resultate, welche zeigen, dass es dimolekular ist. Um zu sehen, ob das mit Salzsäure dargestellte Superoxyd vom Schmp. 90– 94° mit dem Wolffenstein'schen identisch ist, wurde davon ebenfalls eine Molekulargewichtsbestimmung gemacht, welche auf Zahlen führte, die für ein trimolekulares Superoxyd stimmen." [El peróxido que se preparó con el reactivo de Caro y que se fundió a 132–133 °C (270–271 °F) dio, según una determinación del peso molecular por el método del punto de congelación, resultados que muestran que es dimolecular. Para ver si el peróxido que se preparó con ácido clorhídrico y que tiene un punto de fusión de 90–94 °C (194–201 °F) es idéntico al de Wolffenstein, se determinó también su peso molecular, lo que arrojó valores correctos para un peróxido trimolecular.]
- ^ abc Milas NA, Golubović A (1959). "Estudios en peróxidos orgánicos. XXVI. Peróxidos orgánicos derivados de acetona y peróxido de hidrógeno". Revista de la Sociedad Química Americana . 81 (24): 6461–6462. doi :10.1021/ja01533a033.
- ^ Fukuzumi, Kazuo; Miyakawa, Takero; Morohira, Hidenori (1965). "Concentrados de dihidroperóxido monomérico a partir de docosahexaenoato de metilo autooxidado". Revista de la Sociedad Americana de Químicos del Petróleo . 42 (8): 717–720. doi :10.1007/BF02540046. ISSN 0003-021X.
- ^ "Informe anual de 2013 del Centro de Excelencia para la detección, mitigación y respuesta a explosivos del Departamento de Seguridad Nacional" (PDF) . 2013. Consultado el 17 de febrero de 2024 .
- ^ Este no es el monómero DMDO al que se hace referencia en Chembox, sino el monómero dihidro de cadena abierta descrito por Milas y Goluboviç, op. cit.
- ^ ab Jiang H, Chu G, Gong H, Qiao Q (1999). "Oxidación de acetona con peróxido de hidrógeno catalizada por cloruro de estaño a peróxido de acetona tetramérico". Revista de investigación química . 28 (4): 288–289. doi :10.1039/a809955c. S2CID 95733839.
- ^ Explosivos primarios , Robert Matyáš, Jiří Pachman (auth.), p. 275
- ^ abc Matyáš, R.; Pachman, J. (8 de febrero de 2010). «Estudio de TATP: influencia de las condiciones de reacción en la composición del producto» . Propulsores, explosivos, pirotecnia . 35 (1): 31–37. doi :10.1002/prep.200800044 . Consultado el 30 de agosto de 2021 .
- ^ Matyas R, Pachman J (1 de julio de 2007). "Estabilidad térmica del triperóxido de triacetona". Ciencia y tecnología de materiales energéticos . 68 : 111–116.
- ^ ab Dubnikova, Faina; Kosloff, Ronnie; Almog, José; Zeiri, Yehuda; Boese, Roland; Itzhaky, Harel; Alt, Aarón; Keinan, Ehud (2005). "La descomposición del triperóxido de triacetona es una explosión entrópica". Revista de la Sociedad Química Estadounidense . 127 (4): 1146-1159. doi :10.1021/ja0464903. PMID 15669854.
- ^ ab Sinditskii VP, Koltsov VI, Egorshev, VY, Patrikeev DI, Dorofeeva OV (2014). "Termoquímica de peróxidos de acetona cíclicos". Thermochimica Acta . 585 : 10–15. doi :10.1016/j.tca.2014.03.046.
- ^ Van Duin AC, Zeiri Y, Dubnikova F, Kosloff R, Goddard WA (2005). "Simulaciones a escala atómica de los eventos químicos iniciales en la iniciación térmica del triacetontriperóxido". Revista de la Sociedad Química Estadounidense . 127 (31): 11053–62. doi :10.1021/ja052067y. PMID 16076213.
- ^ Schulte-Ladbeck R, Vogel M, Karst U (octubre de 2006). "Métodos recientes para la determinación de explosivos a base de peróxido". Química analítica y bioanalítica . 386 (3): 559–65. doi :10.1007/s00216-006-0579-y. PMID 16862379. S2CID 38737572.
- ^ Muller D, Levy A, Shelef R, Abramovich-Bar S, Sonenfeld D, Tamiri T (septiembre de 2004). "Método mejorado para la detección de TATP después de una explosión". Revista de Ciencias Forenses . 49 (5): 935–8. doi :10.1520/JFS2003003. PMID 15461093.
- ^ Stambouli A, El Bouri A, Bouayoun T, Bellimam MA (diciembre de 2004). "Detección de trazas de TATP en escombros post-explosión mediante cromatografía de gases/espectrometría de masas en el espacio de cabeza". Forensic Science International . 146 Suppl: S191–4. doi :10.1016/j.forsciint.2004.09.060. PMID 15639574.
- ^ Oxley JC, Smith JL, Shinde K, Moran J (2005). "Determinación de la densidad de vapor de triperóxido de triacetona (TATP) utilizando una técnica de cromatografía de gases en espacio de cabeza". Propelentes, explosivos, pirotecnia . 30 (2): 127. doi :10.1002/prep.200400094.
- ^ Sigman ME, Clark CD, Fidler R, Geiger CL, Clausen CA (2006). "Análisis de triperóxido de triacetona mediante cromatografía de gases/espectrometría de masas y cromatografía de gases/espectrometría de masas en tándem mediante ionización electrónica y química". Rapid Communications in Mass Spectrometry . 20 (19): 2851–7. Bibcode :2006RCMS...20.2851S. doi :10.1002/rcm.2678. PMID 16941533.
- ^ Romolo FS, Cassioli L, Grossi S, Cinelli G, Russo MV (enero de 2013). "Muestreo de superficies y análisis de TATP mediante hisopado y cromatografía de gases/espectrometría de masas". Forensic Science International . 224 (1–3): 96–100. doi :10.1016/j.forsciint.2012.11.005. PMID 23219697.
- ^ Widmer L, Watson S, Schlatter K, Crowson A (diciembre de 2002). "Desarrollo de un método LC/MS para el análisis de trazas de triperóxido de triacetona (TATP)". The Analyst . 127 (12): 1627–32. Bibcode :2002Ana...127.1627W. doi :10.1039/B208350G. PMID 12537371.
- ^ Xu X, van de Craats AM, Kok EM, de Bruyn PC (noviembre de 2004). "Análisis de trazas de explosivos de peróxido mediante cromatografía líquida de alto rendimiento-ionización química a presión atmosférica-espectrometría de masas en tándem (HPLC-APCI-MS/MS) para aplicaciones forenses". Journal of Forensic Sciences . 49 (6): 1230–6. PMID 15568694.
- ^ Cotte-Rodríguez I, Hernandez-Soto H, Chen H, Cooks RG (marzo de 2008). "Detección de trazas in situ de explosivos de peróxido mediante ionización por electropulverización por desorción y ionización química a presión atmosférica por desorción". Química analítica . 80 (5): 1512–9. doi :10.1021/ac7020085. PMID 18247583.
- ^ Sigman ME, Clark CD, Caiano T, Mullen R (2008). "Análisis de triperóxido de triacetona (TATP) y de intermediarios sintéticos de TATP mediante espectrometría de masas de ionización por electrospray". Comunicaciones rápidas en espectrometría de masas . 22 (2): 84–90. Bibcode :2008RCMS...22...84S. doi : 10.1002/rcm.3335 . PMID 18058960.
- ^ Sigman ME, Clark CD, Painter K, Milton C, Simatos E, Frisch JL, McCormick M, Bitter JL (febrero de 2009). "Análisis de peróxidos oligoméricos en muestras de triperóxido de triacetona sintético mediante espectrometría de masas en tándem". Rapid Communications in Mass Spectrometry . 23 (3): 349–56. Bibcode :2009RCMS...23..349S. doi :10.1002/rcm.3879. PMID 19125413.
- ^ Schulte-Ladbeck R, Kolla P, Karst U (febrero de 2003). "Análisis de trazas de explosivos a base de peróxido". Química analítica . 75 (4): 731–5. doi :10.1021/ac020392n. PMID 12622359.
- ^ Kende, Anikó; Lebics, Ferenc; Eke, Zsuzsanna; Torkos, Kornél (2008). "Identificación de trazas de triacetona-triperóxido con SPME-GC-MS en sistemas modelo". Microchimica Acta . 163 (3–4): 335–338. doi :10.1007/s00604-008-0001-x. S2CID 97978057.
- ^ Explosivos primarios , pág. 278, ISBN 9783642284359 .
- ^ Ferrari CG, Higashiuchi K, Podliska JA (1963). "Maduración y blanqueo de la harina con peróxidos de acetona acíclicos" (PDF) . Cereal Chemistry . 40 : 89–100. Archivado desde el original (PDF) el 20 de febrero de 2017. Consultado el 25 de marzo de 2016 .
- ^ ab US 5003109, Costantini, Michel, "Destrucción del peróxido de acetona", publicado el 26 de marzo de 1991
- ^ Acree F, Haller HL (1943). "Peróxido de acetona trimolecular en éter isopropílico". Revista de la Sociedad Química Americana . 65 (8): 1652. doi :10.1021/ja01248a501.
- ^ Burke, Robert A. (25 de julio de 2006). Contraterrorismo para equipos de respuesta ante emergencias, segunda edición . CRC Press LLC. pág. 213. ISBN 9781138747623El peróxido de acetona
también puede producirse accidentalmente... También es un subproducto peligroso de la oxidación del isosafrol en acetona, un paso en la síntesis ilícita de MDMA, la droga callejera éxtasis.
- ^ "La verdadera historia del 7/7", The Observer , 7 de mayo de 2006
- ^ [1] Los terroristas de Londres utilizaron materiales de uso cotidiano. Policía estadounidense , Reuters, 4 de agosto de 2005
- ^ Naughton P (15 de julio de 2005). «TATP es el arma preferida de los terroristas suicidas». The Times (Reino Unido) . Archivado desde el original el 10 de febrero de 2008.
- ^ ab Vince G (15 de julio de 2005). "Se identificaron explosivos relacionados con los atentados de Londres". New Scientist .
- ^ "Juez niega libertad bajo fianza a acusado de atentado con bomba en el zapato". CNN. 28 de diciembre de 2001.
- ^ "Uso terrorista del explosivo TATP". officialconfusion.com . 25 de julio de 2005.
- ^ ab Callimachi R, Rubin AJ, Fourquet L (19 de marzo de 2016). "Una visión de la evolución de ISIS en nuevos detalles de los ataques de París". The New York Times .
- ^ "'La mère de Satan' ou TATP, l'explosif préféré de l'EI" ['Madre de Satanás' o TATP, el explosivo preferido para los artefactos explosivos improvisados]. LeVif.be Express (en francés). 23 de marzo de 2016.
- ^ Doherty B (25 de mayo de 2017). "La bomba de Manchester utilizó el mismo explosivo que los ataques de París y Bruselas, dice un legislador estadounidense". The Guardian . Consultado el 16 de septiembre de 2017 .
- ^ Dearden, Lizzie (16 de septiembre de 2017). «Ataque en Londres: los terroristas de Parsons Green «siguen ahí fuera» más de 24 horas después de la explosión en el metro, advierten las autoridades» . The Independent . Archivado desde el original el 17 de septiembre de 2017. Consultado el 5 de noviembre de 2017 .
- ^ "Explosivos 'Madre de Satán' utilizados en atentados con bombas en iglesias de Surabaya: Policía". The Jakarta Post . 14 de mayo de 2018 . Consultado el 15 de mayo de 2018 .
- ^ "Asia Times | Explosivo 'Madre de Satán' usado en atentados en Sri Lanka | Artículo". Asia Times . 24 de abril de 2019 . Consultado el 24 de abril de 2019 .
- ^ Explosivo TATP utilizado en ataques de Pascua—Ex DIG Nimal Lewke News First (Sri Lanka), consultado el 23 de abril de 2019.
- ^ "Protestas en Hong Kong: la policía investiga el vínculo entre el enorme botín de explosivos". BBC News. 20 de julio de 2019.
- ^ Pachman, J; Matyáš, R; Künzel, M (2014). "Estudio de TATP: características de explosión y equivalencia de TNT de pequeñas cargas". Shock Waves . 24 (4): 439. Bibcode :2014ShWav..24..439P. doi :10.1007/s00193-014-0497-4. S2CID 122101166.
- ^ ab Glas K (6 de noviembre de 2006). "TATP: Countering the Mother of Satan". The Future of Things . Consultado el 24 de septiembre de 2009.
La tremenda fuerza devastadora del TATP, junto con la relativa facilidad para fabricarlo, así como la dificultad para detectarlo, hicieron del TATP una de las armas preferidas por los terroristas.
- ^ "Los federales están equivocados en cuanto a la seguridad aeroportuaria". Star-Ledger . Newark, Nueva Jersey. 24 de agosto de 2006 . Consultado el 11 de septiembre de 2009 .
En este momento, dijo Watts, los dispositivos de detección están configurados para detectar explosivos a base de nitrógeno, una categoría que no incluye TATP
[ enlace muerto permanente ] - ^ Jacoby, Mitch (29 de marzo de 2016). "El explosivo utilizado en Bruselas no es difícil de detectar". Chemical & Engineering News . Consultado el 28 de enero de 2018 .
- ^ ab Genuth I, Fresco-Cohen L (6 de noviembre de 2006). "TATP: Countering the Mother of Satan". The Future of Things . Consultado el 24 de septiembre de 2009.
La tremenda fuerza devastadora del TATP, junto con la relativa facilidad para fabricarlo, así como la dificultad para detectarlo, hicieron del TATP una de las armas preferidas por los terroristas.
- ^ «Reglamento (UE) 2019/1148 del Parlamento Europeo y del Consejo, de 20 de junio de 2019, sobre la comercialización y la utilización de precursores de explosivos».
- ^ Watts J, Burgen S (21 de agosto de 2017). "La policía extiende la búsqueda del sospechoso del ataque de Barcelona por toda Europa". The Guardian . Consultado el 16 de septiembre de 2017 .
- ^ Andrew Higgins; Kimiko de Freytas-Tamura (26 de marzo de 2016). "En el complot del atentado de Bruselas, un rastro de puntos no conectados". The New York Times . Consultado el 28 de marzo de 2016 .








