Neuroimagen
| Neuroimagen | |
|---|---|
 Resonancia magnética parasagital de la cabeza en un paciente con macrocefalia familiar benigna | |
| Objetivo | Estructura de imágenes indirectas (directas), función/farmacología del sistema nervioso |
La neuroimagen es el uso de técnicas cuantitativas (computacionales) para estudiar la estructura y función del sistema nervioso central , desarrollada como una forma objetiva de estudiar científicamente el cerebro humano sano de una manera no invasiva. Cada vez se utiliza más para estudios de investigación cuantitativa de enfermedades cerebrales y enfermedades psiquiátricas. La neuroimagen es altamente multidisciplinaria e involucra neurociencia, informática, psicología y estadística, y no es una especialidad médica. La neuroimagen a veces se confunde con la neurorradiología.
La neurorradiología es una especialidad médica que utiliza imágenes cerebrales no estadísticas en un entorno clínico, practicada por radiólogos que son médicos. La neurorradiología se centra principalmente en el reconocimiento de lesiones cerebrales, como enfermedades vasculares, accidentes cerebrovasculares, tumores y enfermedades inflamatorias. A diferencia de la neuroimagen, la neurorradiología es cualitativa (se basa en impresiones subjetivas y una amplia formación clínica), pero a veces utiliza métodos cuantitativos básicos. Las técnicas de imágenes cerebrales funcionales, como la resonancia magnética funcional ( fMRI ), son comunes en la neuroimagen, pero rara vez se utilizan en la neurorradiología. La neuroimagen se divide en dos grandes categorías:
- Imágenes estructurales, que se utilizan para cuantificar la estructura del cerebro mediante, por ejemplo, morfometría basada en vóxeles .
- Imágenes funcionales , que se utilizan para estudiar la función cerebral, a menudo utilizando fMRI y otras técnicas como PET y MEG (ver más abajo).
Historia

El primer capítulo de la historia de la neuroimagen se remonta al neurocientífico italiano Angelo Mosso , quien inventó la "balanza de circulación humana", que podía medir de forma no invasiva la redistribución de la sangre durante la actividad emocional e intelectual. [1]
En 1918, el neurocirujano estadounidense Walter Dandy introdujo la técnica de la ventriculografía. Se obtenían imágenes de rayos X del sistema ventricular dentro del cerebro mediante la inyección de aire filtrado directamente en uno o ambos ventrículos laterales del cerebro. Dandy también observó que el aire introducido en el espacio subaracnoideo a través de una punción espinal lumbar podía entrar en los ventrículos cerebrales y también mostrar los compartimentos de líquido cefalorraquídeo alrededor de la base del cerebro y sobre su superficie. Esta técnica se denominó neumoencefalografía . [ cita requerida ]
En 1927, Egas Moniz introdujo la angiografía cerebral , mediante la cual se podían visualizar con gran precisión los vasos sanguíneos normales y anormales dentro y alrededor del cerebro.
A principios de la década de 1970, Allan McLeod Cormack y Godfrey Newbold Hounsfield introdujeron la tomografía axial computarizada (TAC) y se pudieron obtener imágenes anatómicas del cerebro cada vez más detalladas para fines de diagnóstico e investigación. Cormack y Hounsfield ganaron el Premio Nobel de Fisiología o Medicina en 1979 por su trabajo. Poco después de la introducción de la TAC a principios de la década de 1980, el desarrollo de radioligandos permitió la tomografía computarizada por emisión de fotón único (SPECT) y la tomografía por emisión de positrones (PET) del cerebro.
Más o menos simultáneamente, la resonancia magnética (MRI o escaneo MR) fue desarrollada por investigadores como Peter Mansfield y Paul Lauterbur , quienes fueron galardonados con el Premio Nobel de Fisiología o Medicina en 2003. A principios de la década de 1980, la MRI se introdujo clínicamente, y durante la década de 1980 tuvo lugar una verdadera explosión de refinamientos técnicos y aplicaciones diagnósticas de la RM. Los científicos pronto aprendieron que los grandes cambios en el flujo sanguíneo medidos por PET también podían ser visualizados por el tipo correcto de MRI. Nació la resonancia magnética funcional (fMRI), y desde la década de 1990, la fMRI ha llegado a dominar el campo del mapeo cerebral debido a su baja invasividad, falta de exposición a la radiación y disponibilidad relativamente amplia.
A principios de la década de 2000, el campo de la neuroimagen llegó a una etapa en la que se hicieron factibles algunas aplicaciones prácticas de la imagenología funcional del cerebro. El principal campo de aplicación son las formas rudimentarias de interfaz cerebro-computadora .
El récord mundial de resolución espacial de una imagen de resonancia magnética de cerebro completo fue un volumen (imagen) de 100 micrómetros logrado en 2019. La adquisición de la muestra tomó alrededor de 100 horas. [2] El récord mundial espacial de un cerebro humano completo con cualquier método fue una tomografía de rayos X realizada en el ESRF (instalación europea de radiación sincrotrón), que tuvo una resolución de aproximadamente 25 micras y requirió aproximadamente 22 horas. Esta exploración fue parte del atlas de órganos humanos que tiene tomografías de rayos X de otros órganos del cuerpo humano con la misma resolución. [3] [4]
Una idea fundamental para la obtención de imágenes por resonancia magnética es que el vector de magnetización neta se puede mover exponiendo el sistema de espín a una energía de una frecuencia igual a la diferencia de energía entre los estados de espín (por ejemplo, mediante un pulso de radiofrecuencia). Si se suministra suficiente energía al sistema, es posible hacer que el vector de magnetización neta sea ortogonal al del campo magnético externo.
Indicaciones
La neurorradiología a menudo sigue a un examen neurológico en el que un médico ha encontrado motivos para investigar más profundamente a un paciente que tiene o puede tener un trastorno neurológico .
Las indicaciones clínicas comunes para la neuroimagen incluyen traumatismo craneoencefálico, síntomas similares a los de un accidente cerebrovascular, por ejemplo: debilidad/entumecimiento repentino en la mitad del cuerpo, dificultad para hablar o caminar, convulsiones, dolor de cabeza intenso de aparición repentina, cambio repentino en el nivel de conciencia por razones poco claras.
Otra indicación para la neurorradiología es la cirugía estereotáctica o radiocirugía guiada por TC, RMN y PET para el tratamiento de tumores intracraneales, malformaciones arteriovenosas y otras afecciones tratables quirúrgicamente. [5] [6] [7]
Uno de los problemas neurológicos más comunes que una persona puede experimentar es el síncope simple . [8] [9] En los casos de síncope simple en los que la historia del paciente no sugiere otros síntomas neurológicos, el diagnóstico incluye un examen neurológico , pero no se indican imágenes neurológicas de rutina porque la probabilidad de encontrar una causa en el sistema nervioso central es extremadamente baja y es poco probable que el paciente se beneficie del procedimiento. [9]
La neurorradiología no está indicada para pacientes con dolores de cabeza estables que se diagnostican como migraña. [10] Los estudios indican que la presencia de migraña no aumenta el riesgo de un paciente de sufrir una enfermedad intracraneal. [10] Un diagnóstico de migraña que indique la ausencia de otros problemas, como el edema de papila , no indicaría la necesidad de investigaciones radiológicas. [10] Al realizar un diagnóstico cuidadoso, el médico debe considerar si el dolor de cabeza tiene una causa distinta a la migraña y podría requerir investigaciones radiológicas. [10] [11]
Técnicas de imágenes cerebrales
Tomografía axial computarizada
La tomografía computarizada (TC) o la tomografía axial computarizada (TAC) utilizan una serie de radiografías de la cabeza tomadas desde muchas direcciones diferentes. Generalmente se utiliza para ver rápidamente lesiones cerebrales ; la tomografía computarizada utiliza un programa informático que realiza un cálculo numérico integral (la transformada inversa de Radon ) en la serie de rayos X medida para estimar qué cantidad de un haz de rayos X se absorbe en un pequeño volumen del cerebro. Por lo general, la información se presenta como secciones transversales del cerebro. [12]
Imágenes por resonancia magnética

La resonancia magnética utiliza campos magnéticos y ondas de radio para producir imágenes bidimensionales o tridimensionales de alta calidad de las estructuras cerebrales sin el uso de radiación ionizante (rayos X) o trazadores radiactivos.
El récord de resolución espacial más alta de un cerebro intacto (post mortem) es de 100 micrones, del Hospital General de Massachusetts. Los datos se publicaron en Scientific Data el 30 de octubre de 2019. [13]
Tomografía por emisión de positrones
La tomografía por emisión de positrones (PET) y la tomografía por emisión de positrones cerebral miden las emisiones de sustancias químicas metabólicamente activas marcadas radiactivamente que se han inyectado en el torrente sanguíneo. Los datos de emisión se procesan por computadora para producir imágenes bidimensionales o tridimensionales de la distribución de las sustancias químicas en todo el cerebro. [14] : 57 Los radioisótopos emisores de positrones utilizados son producidos por un ciclotrón y las sustancias químicas se marcan con estos átomos radiactivos. El compuesto marcado, llamado radiotrazador , se inyecta en el torrente sanguíneo y finalmente llega al cerebro. Los sensores en el escáner PET detectan la radiactividad a medida que el compuesto se acumula en varias regiones del cerebro. Una computadora utiliza los datos recopilados por los sensores para crear imágenes bidimensionales o tridimensionales multicolores que muestran dónde actúa el compuesto en el cerebro. Especialmente útiles son una amplia gama de ligandos utilizados para mapear diferentes aspectos de la actividad de los neurotransmisores, siendo el trazador PET más comúnmente usado una forma marcada de glucosa (ver Fludesoxiglucosa (18F) (FDG)).
El mayor beneficio de la tomografía por emisión de positrones es que diferentes compuestos pueden mostrar el flujo sanguíneo y el metabolismo del oxígeno y la glucosa en los tejidos del cerebro en funcionamiento. Estas mediciones reflejan la cantidad de actividad cerebral en las diversas regiones del cerebro y permiten aprender más sobre cómo funciona el cerebro. Las tomografías por emisión de positrones eran superiores a todos los demás métodos de imágenes metabólicas en términos de resolución y velocidad de finalización (tan solo 30 segundos) cuando estuvieron disponibles por primera vez. La resolución mejorada permitió realizar un mejor estudio en cuanto al área del cerebro activada por una tarea particular. El mayor inconveniente de la tomografía por emisión de positrones es que debido a que la radiactividad se desintegra rápidamente, se limita a la monitorización de tareas cortas. [14] : 60 Antes de que la tecnología fMRI estuviera en línea, la tomografía por emisión de positrones era el método preferido de imágenes cerebrales funcionales (a diferencia de las estructurales), y continúa haciendo grandes contribuciones a la neurociencia .
La tomografía por emisión de positrones (PET) también se utiliza para el diagnóstico de enfermedades cerebrales, en particular tumores cerebrales, epilepsia y enfermedades que dañan las neuronas y que causan demencia (como la enfermedad de Alzheimer), todas ellas causan grandes cambios en el metabolismo cerebral, lo que a su vez provoca cambios fácilmente detectables en las tomografías por emisión de positrones. La PET es probablemente más útil en los casos iniciales de ciertas demencias (los ejemplos clásicos son la enfermedad de Alzheimer y la enfermedad de Pick ) en los que el daño inicial es demasiado difuso y hace muy poca diferencia en el volumen y la estructura general del cerebro como para cambiar las imágenes de TC y RMN estándar lo suficiente como para poder diferenciarlo de manera fiable del rango "normal" de atrofia cortical que se produce con el envejecimiento (en muchas personas, pero no en todas), y que no causa demencia clínica.
La tomografía por emisión de positrones con FDG también se utiliza a menudo para evaluar a pacientes con epilepsia que siguen teniendo convulsiones a pesar de recibir un tratamiento médico adecuado. En la epilepsia focal, en la que las convulsiones comienzan en una pequeña parte del cerebro antes de propagarse a otras partes, es una de las muchas modalidades que se utilizan para identificar la región del cerebro responsable del inicio de las convulsiones. Normalmente, la zona del cerebro en la que comienzan las convulsiones es disfuncional incluso cuando el paciente no está sufriendo una convulsión y absorbe menos glucosa, por lo tanto, menos FDG en comparación con las regiones cerebrales sanas. [15] Esta información puede ayudar a planificar la cirugía de la epilepsia como tratamiento para la epilepsia resistente a los medicamentos.
También se han utilizado otros radiotrazadores para identificar las zonas de inicio de las convulsiones, aunque no están disponibles comercialmente para uso clínico. Entre ellos se encuentran el 11 C-flumazenil, el 11 C -alfa-metil-L-triptófano, la 11 C-metionina y el 11 C-cerfentanil. [15]
Tomografía computarizada por emisión de fotón único
La tomografía computarizada por emisión monofotónica (SPECT) es similar a la PET y utiliza radioisótopos que emiten rayos gamma y una cámara gamma para registrar datos que una computadora utiliza para construir imágenes bidimensionales o tridimensionales de las regiones cerebrales activas. [16] La SPECT se basa en una inyección de un trazador radiactivo, o "agente SPECT", que es rápidamente absorbido por el cerebro pero no se redistribuye. La absorción del agente SPECT se completa casi al 100% en 30 a 60 segundos, lo que refleja el flujo sanguíneo cerebral (FSC) en el momento de la inyección. Estas propiedades de la SPECT la hacen particularmente adecuada para la obtención de imágenes de la epilepsia, que generalmente se dificulta por problemas con el movimiento del paciente y tipos variables de convulsiones. La SPECT proporciona una "instantánea" del flujo sanguíneo cerebral ya que las exploraciones se pueden adquirir después de la terminación de la convulsión (siempre que el trazador radiactivo se haya inyectado en el momento de la convulsión). Una limitación significativa de la SPECT es su mala resolución (alrededor de 1 cm) en comparación con la de la resonancia magnética. En la actualidad, se utilizan comúnmente máquinas SPECT con cabezales detectores dobles, aunque en el mercado se encuentran disponibles máquinas con cabezales detectores triples. La reconstrucción tomográfica (que se utiliza principalmente para "instantáneas" funcionales del cerebro) requiere múltiples proyecciones de cabezales detectores que giran alrededor del cráneo humano, por lo que algunos investigadores han desarrollado máquinas SPECT con 6 y 11 cabezales detectores para reducir el tiempo de obtención de imágenes y brindar una mayor resolución. [17] [18]
Al igual que la PET, la SPECT también se puede utilizar para diferenciar diferentes tipos de procesos patológicos que producen demencia, y se utiliza cada vez más para este fin. La exploración SPECT con isoflupano marcado con I-123 (también llamada exploración DaT) es útil para diferenciar la enfermedad de Parkinson de otras causas de temblor. [19]
La tomografía computarizada por emisión de fotón único (SPECT) también se utiliza para evaluar la epilepsia resistente a fármacos. Para ello, se utilizan como trazadores la oxima de hexametilpropilenamina marcada con Tc 99 ( HMPAO ) o el dímero de etil cisteinato (ECD) marcado con Tc 99. El radiotrazador se inyecta en la vena del paciente tan pronto como se detecta el inicio de una convulsión y la exploración se realiza unas horas después de que finaliza la convulsión. Esta técnica se denomina SPECT ictal y se basa en el aumento del flujo sanguíneo cerebral en las zonas de inicio de la convulsión durante la misma. La SPECT interictal es una exploración que se realiza utilizando los mismos trazadores, pero durante un momento en el que el paciente no está sufriendo una convulsión. Entre las convulsiones, se observa una reducción del flujo sanguíneo cerebral en las zonas de inicio de la convulsión y no es tan pronunciada como el aumento del flujo sanguíneo durante la convulsión. [20]
Ecografía craneal
La ecografía craneal suele emplearse únicamente en bebés, cuyas fontanelas abiertas proporcionan ventanas acústicas que permiten obtener imágenes ecográficas del cerebro. Entre las ventajas se encuentran la ausencia de radiación ionizante y la posibilidad de realizar exploraciones en la cama del paciente, pero la falta de detalles de los tejidos blandos hace que la resonancia magnética sea la opción preferida para algunas afecciones.
[21]
Resonancia magnética funcional
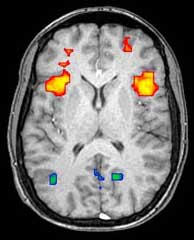
La resonancia magnética funcional (fMRI) y el etiquetado de espín arterial (ASL) se basan en las propiedades paramagnéticas de la hemoglobina oxigenada y desoxigenada para ver imágenes de cambios en el flujo sanguíneo cerebral asociados con la actividad neuronal. Esto permite generar imágenes que reflejen qué estructuras cerebrales se activan (y cómo) durante la realización de diferentes tareas o en estado de reposo. Según la hipótesis de la oxigenación, los cambios en el uso de oxígeno en el flujo sanguíneo cerebral regional durante la actividad cognitiva o conductual pueden asociarse con las neuronas regionales como si estuvieran directamente relacionadas con las tareas cognitivas o conductuales a las que se está asistiendo.
La mayoría de los escáneres fMRI permiten presentar a los sujetos diferentes imágenes visuales, sonidos y estímulos táctiles, y realizar diferentes acciones, como presionar un botón o mover un joystick. En consecuencia, la fMRI se puede utilizar para revelar estructuras cerebrales y procesos asociados con la percepción, el pensamiento y la acción. La resolución de la fMRI es de aproximadamente 2-3 milímetros en la actualidad, limitada por la dispersión espacial de la respuesta hemodinámica a la actividad neuronal. Ha reemplazado en gran medida a la PET para el estudio de los patrones de activación cerebral. Sin embargo, la PET conserva la importante ventaja de poder identificar receptores cerebrales específicos (o transportadores ) asociados con neurotransmisores particulares a través de su capacidad para obtener imágenes de "ligandos" de receptores radiomarcados (los ligandos de receptores son cualquier sustancia química que se adhiere a los receptores). También existe una preocupación significativa con respecto a la validez de algunas de las estadísticas utilizadas en los análisis fMRI; de ahí la validez de las conclusiones extraídas de muchos estudios fMRI. [22]
Con una precisión de entre el 72% y el 90%, donde el azar alcanzaría el 0,8%, [23] las técnicas de fMRI pueden decidir cuál de un conjunto de imágenes conocidas está viendo el sujeto. [24]
Estudios recientes sobre aprendizaje automático en psiquiatría han utilizado fMRI para construir modelos de aprendizaje automático que pueden discriminar entre individuos con o sin comportamiento suicida. Los estudios de imágenes en conjunto con algoritmos de aprendizaje automático pueden ayudar a identificar nuevos marcadores en neuroimagen que podrían permitir la estratificación basada en el riesgo de suicidio de los pacientes y ayudar a desarrollar las mejores terapias y tratamientos para pacientes individuales. [25]
Imágenes ópticas difusas
La tomografía óptica difusa (DOI) o tomografía óptica difusa (DOT) es una modalidad de obtención de imágenes médicas que utiliza luz infrarroja cercana para generar imágenes del cuerpo. La técnica mide la absorción óptica de la hemoglobina y se basa en el espectro de absorción de la hemoglobina que varía con su estado de oxigenación. La tomografía óptica difusa de alta densidad (HD-DOT) se ha comparado directamente con la fMRI utilizando la respuesta a la estimulación visual en sujetos estudiados con ambas técnicas, con resultados tranquilizadoramente similares. [26] La HD-DOT también se ha comparado con la fMRI en términos de tareas de lenguaje y conectividad funcional en estado de reposo. [27]
Señal óptica relacionada con eventos
La señal óptica relacionada con eventos (EROS, por sus siglas en inglés) es una técnica de escaneo cerebral que utiliza luz infrarroja a través de fibras ópticas para medir los cambios en las propiedades ópticas de las áreas activas de la corteza cerebral. Mientras que técnicas como la imagen óptica difusa (DOT, por sus siglas en inglés) y la espectroscopia de infrarrojo cercano (NIRS, por sus siglas en inglés) miden la absorción óptica de la hemoglobina y, por lo tanto, se basan en el flujo sanguíneo, EROS aprovecha las propiedades de dispersión de las propias neuronas y, por lo tanto, proporciona una medida mucho más directa de la actividad celular. EROS puede detectar la actividad en el cerebro con una precisión de milímetros (espacialmente) y de milisegundos (temporalmente). Su mayor desventaja es la incapacidad de detectar actividad a más de unos pocos centímetros de profundidad. EROS es una técnica nueva, relativamente económica y no invasiva para el sujeto de prueba. Fue desarrollada en la Universidad de Illinois en Urbana-Champaign, donde ahora se utiliza en el Laboratorio de Neuroimagen Cognitiva del Dr. Gabriele Gratton y la Dra. Monica Fabiani.
Magnetoencefalografía
La magnetoencefalografía (MEG) es una técnica de obtención de imágenes que se utiliza para medir los campos magnéticos producidos por la actividad eléctrica en el cerebro a través de dispositivos extremadamente sensibles, como los dispositivos superconductores de interferencia cuántica (SQUID) o los magnetómetros de intercambio de espín libre de relajación [28] (SERF). La MEG ofrece una medición muy directa de la actividad eléctrica neuronal (en comparación con la fMRI, por ejemplo) con una resolución temporal muy alta pero una resolución espacial relativamente baja. La ventaja de medir los campos magnéticos producidos por la actividad neuronal es que es probable que estén menos distorsionados por el tejido circundante (en particular el cráneo y el cuero cabelludo) en comparación con los campos eléctricos medidos por electroencefalografía (EEG). En concreto, se puede demostrar que los campos magnéticos producidos por la actividad eléctrica no se ven afectados por el tejido circundante de la cabeza, cuando la cabeza se modela como un conjunto de capas esféricas concéntricas, cada una de las cuales es un conductor homogéneo isótropo. Las cabezas reales no son esféricas y tienen conductividades en gran medida anisotrópicas (en particular la materia blanca y el cráneo). Si bien la anisotropía del cráneo tiene un efecto insignificante en la MEG (a diferencia del EEG), la anisotropía de la materia blanca afecta fuertemente las mediciones de MEG para fuentes radiales y profundas. [29] Sin embargo, tenga en cuenta que se asumió que el cráneo era uniformemente anisotrópico en este estudio, lo que no es cierto para una cabeza real: los espesores absolutos y relativos de las capas de diploe y tablas varían entre y dentro de los huesos del cráneo. Esto hace que sea probable que la MEG también se vea afectada por la anisotropía del cráneo, [30] aunque probablemente no en el mismo grado que el EEG.
La MEG tiene muchos usos, entre ellos, ayudar a los cirujanos a localizar una patología, ayudar a los investigadores a determinar la función de varias partes del cerebro, neurofeedback y otros.
Imágenes por ultrasonido funcional
La ecografía funcional (fUS) es una técnica de ecografía médica que permite detectar o medir cambios en las actividades neuronales o el metabolismo, por ejemplo, los lugares de actividad cerebral, generalmente midiendo el flujo sanguíneo o los cambios hemodinámicos. La ecografía funcional se basa en la ecografía Doppler ultrasensible y la ecografía ultrarrápida, que permite obtener imágenes del flujo sanguíneo con alta sensibilidad.
Magnetómetro cuántico bombeado ópticamente
En junio de 2021, los investigadores informaron sobre el desarrollo del primer escáner cerebral cuántico modular que utiliza imágenes magnéticas y podría convertirse en un nuevo enfoque de escaneo de todo el cerebro. [31] [32]
Ventajas y preocupaciones de las técnicas de neuroimagen
Imágenes por resonancia magnética funcional (fMRI)
La fMRI se clasifica comúnmente como un método de riesgo mínimo a moderado debido a su carácter no invasivo en comparación con otros métodos de diagnóstico por imágenes. La fMRI utiliza un contraste dependiente del nivel de oxigenación de la sangre (BOLD) para producir su forma de imagen. El contraste BOLD es un proceso que ocurre de forma natural en el cuerpo, por lo que la fMRI suele preferirse a los métodos de diagnóstico por imágenes que requieren marcadores radiactivos para producir imágenes similares. [33] Una preocupación en el uso de fMRI es su uso en personas con implantes o dispositivos médicos y elementos metálicos en el cuerpo. La resonancia magnética (RM) emitida por el equipo puede provocar fallas en los dispositivos médicos y atraer objetos metálicos en el cuerpo si no se examinan adecuadamente. Actualmente, la FDA clasifica los implantes y dispositivos médicos en tres categorías, según la compatibilidad con RM: seguro para RM (seguro en todos los entornos de RM), inseguro para RM (inseguro en cualquier entorno de RM) y condicional para RM (compatible con RM en ciertos entornos, lo que requiere más información). [34]
- Etiquetas de seguridad de la FDA para implantes y dispositivos de RM
- MR Seguro [35]
- Condicional MR
- MR inseguro
Tomografía computarizada (TC)
La tomografía computarizada se introdujo en la década de 1970 y rápidamente se convirtió en uno de los métodos de diagnóstico por imagen más utilizados. Una tomografía computarizada se puede realizar en menos de un segundo y produce resultados rápidos para los médicos, y su facilidad de uso llevó a un aumento de las tomografías computarizadas realizadas en los Estados Unidos de 3 millones en 1980 a 62 millones en 2007. Los médicos a menudo realizan múltiples exploraciones, y el 30% de las personas se someten a al menos 3 exploraciones en un estudio sobre el uso de la tomografía computarizada. [36] Las tomografías computarizadas pueden exponer a los pacientes a niveles de radiación entre 100 y 500 veces superiores a los de los rayos X tradicionales, y las dosis de radiación más altas producen imágenes de mejor resolución. [37] Aunque es fácil de usar, el aumento del uso de la tomografía computarizada, especialmente en pacientes asintomáticos, es un tema de preocupación, ya que los pacientes están expuestos a niveles significativamente altos de radiación. [36]
Tomografía por emisión de positrones (PET)
En las tomografías por emisión de positrones (PET), la obtención de imágenes no depende de procesos biológicos intrínsecos, sino de una sustancia extraña inyectada en el torrente sanguíneo que viaja hasta el cerebro. A los pacientes se les inyectan radioisótopos que se metabolizan en el cerebro y emiten positrones para producir una visualización de la actividad cerebral. [33] La cantidad de radiación a la que se expone un paciente en una tomografía por emisión de positrones es relativamente pequeña, comparable a la cantidad de radiación ambiental a la que se expone un individuo a lo largo de un año. Los radioisótopos de la PET tienen un tiempo de exposición limitado en el cuerpo, ya que suelen tener vidas medias muy cortas (~2 horas) y se desintegran rápidamente. [38] Actualmente, la fMRI es un método preferido para obtener imágenes de la actividad cerebral en comparación con la PET, ya que no implica radiación, tiene una resolución temporal más alta que la PET y está más disponible en la mayoría de los entornos médicos. [33]
Magnetoencefalografía (MEG) y Electroencefalografía (EEG)
La alta resolución temporal de la MEG y la EEG permite que estos métodos midan la actividad cerebral con precisión de milisegundos. Tanto la MEG como la EEG no requieren la exposición del paciente a la radiación para funcionar. Los electrodos de EEG detectan las señales eléctricas producidas por las neuronas para medir la actividad cerebral y la MEG utiliza las oscilaciones en el campo magnético producido por estas corrientes eléctricas para medir la actividad. Una barrera en el uso generalizado de la MEG se debe al precio, ya que los sistemas MEG pueden costar millones de dólares. La EEG es un método mucho más utilizado para lograr esa resolución temporal, ya que los sistemas de EEG cuestan mucho menos que los sistemas MEG. Una desventaja de la EEG y la MEG es que ambos métodos tienen una resolución espacial deficiente en comparación con la fMRI. [33]
Véase también
- Mapeo cerebral : conjunto de técnicas de neurociencia
- Esquema del mapeo cerebral : descripción general y guía temática del mapeo cerebral
- Conectograma – Representaciones gráficas de la conectómica
- Integración funcional (neurobiología) : estudio de la cooperación de las regiones cerebrales para procesar información.
- Espectroscopia funcional de infrarrojo cercano : técnica óptica para monitorizar la actividad cerebral
- Historia de la neuroimagen
- Cerebro humano – Órgano central del sistema nervioso humano
- Neurociencia cognitiva – Campo científico
- Esquema del cerebro humano : descripción general y guía temática sobre el cerebro humano
- Lista de software de neuroimagen
- Lista de bases de datos de neurociencia
- Resonancia magnética : técnica de imagen médica
- Magnetoencefalografía : mapeo de la actividad cerebral mediante el registro de los campos magnéticos producidos por las corrientes en el cerebro
- Computación de imágenes médicas : un campo interdisciplinario
- Imágenes médicas : técnica y proceso de creación de representaciones visuales del interior de un cuerpo.
- Revistas de neuroimagen
- Mapeo estadístico paramétrico – Técnica estadística
- Estimulación magnética transcraneal : estimulación cerebral mediante campos magnéticos
- Morfometría basada en vóxeles : método de neuroanatomía computacional
Referencias
- ^ Sandrone S, Bacigaluppi M, Galloni MR, Martino G (noviembre de 2012). "Ángelo Mosso (1846-1910)". Revista de Neurología . 259 (11): 2513–4. doi :10.1007/s00415-012-6632-1. hdl : 2318/140004 . PMID 23010944. S2CID 13365830.
- ^ "Una resonancia magnética del cerebro humano de 100 horas de duración produce las imágenes 3D más detalladas hasta la fecha".
- ^ "Los rayos X más brillantes del mundo revelan los daños que el COVID-19 ha causado en el organismo". National Geographic Society . 26 de enero de 2022. Archivado desde el original el 26 de enero de 2022.
- ^ "Atlas de órganos humanos".
- ^ Thomas DG, Anderson RE, du Boulay GH (enero de 1984). "Neurocirugía estereotáctica guiada por TC: experiencia en 24 casos con un nuevo sistema estereotáctico". Revista de neurología, neurocirugía y psiquiatría . 47 (1): 9–16. doi :10.1136/jnnp.47.1.9. PMC 1027634 . PMID 6363629.
- ^ Heilbrun MP, Sunderland PM, McDonald PR, Wells TH, Cosman E, Ganz E (1987). "Modificaciones del marco estereotáctico de Brown-Roberts-Wells para lograr la guía de imágenes por resonancia magnética en tres planos". Neurofisiología aplicada . 50 (1–6): 143–52. doi :10.1159/000100700. PMID 3329837.
- ^ Leksell L, Leksell D, Schwebel J (enero de 1985). "Estereotaxis y resonancia magnética nuclear". Revista de neurología, neurocirugía y psiquiatría . 48 (1): 14–8. doi :10.1136/jnnp.48.1.14. PMC 1028176 . PMID 3882889.
- ^ Miller TH, Kruse JE (octubre de 2005). "Evaluación del síncope". American Family Physician . 72 (8): 1492–500. PMID 16273816.
- ^ ab American College of Physicians (septiembre de 2013), "Cinco cosas que los médicos y los pacientes deberían cuestionar", Choosing Wisely : an initiative of the ABIM Foundation , American College of Physicians , consultado el 10 de diciembre de 2013, que cita
- American College of Radiology; American Society of Neuroradiology (2010), "ACR-ASNR practice guideline for the performance of computered tomography (CT) of the brain", Agencia para la Investigación y la Calidad de la Atención Sanitaria , Reston, VA, EE. UU.: American College of Radiology , archivado desde el original el 15 de septiembre de 2012 , consultado el 9 de septiembre de 2012
- Pérdida transitoria de la conciencia en adultos y jóvenes: guía del NICE, Instituto Nacional de Salud y Excelencia Clínica , 25 de agosto de 2010 , consultado el 9 de septiembre de 2012
- Moya A, Sutton R, Ammirati F, Blanc JJ, Brignole M, Dahm JB, Deharo JC, Gajek J, Gjesdal K, Krahn A, Massin M, Pepi M, Pezawas T, Ruiz Granell R, Sarasin F, Ungar A, van Dijk JG, Walma EP, Wieling W (noviembre de 2009). "Pautas para el diagnóstico y manejo del síncope (versión 2009)". Revista europea del corazón . 30 (21): 2631–71. doi :10.1093/eurheartj/ehp298. PMC 3295536 . PMID 19713422.
- ^ abcd American Headache Society (septiembre de 2013), "Cinco cosas que los médicos y los pacientes deberían cuestionar", Choosing Wisely : una iniciativa de la Fundación ABIM , American Headache Society , archivado desde el original el 3 de diciembre de 2013 , consultado el 10 de diciembre de 2013, que cita
- Lewis DW, Dorbad D (septiembre de 2000). "La utilidad de las técnicas de neuroimagen en la evaluación de niños con migraña o cefalea crónica diaria que presentan exámenes neurológicos normales". Cefaleas . 40 (8): 629–32. doi :10.1046/j.1526-4610.2000.040008629.x. PMID 10971658. S2CID 14443890.
- Silberstein SD (septiembre de 2000). "Parámetro de práctica: pautas basadas en evidencia para la migraña (una revisión basada en evidencia): informe del Subcomité de Normas de Calidad de la Academia Estadounidense de Neurología". Neurología . 55 (6): 754–62. doi : 10.1212/WNL.55.6.754 . PMID 10993991.
- Asesoría Médica, Secretaría (2010). “Neuroimagen para la evaluación de dolores de cabeza crónicos: un análisis basado en evidencia”. Serie de evaluación de tecnologías sanitarias de Ontario . 10 (26): 1–57. PMC 3377587. PMID 23074404 .
- ^ Levivier M, Massager N, Wikler D, Lorenzoni J, Ruiz S, Devriendt D, David P, Desmedt F, Simon S, Van Houtte P, Brotchi J, Goldman S (julio de 2004). "Uso de imágenes PET estereotácticas en la planificación dosimétrica de la radiocirugía para tumores cerebrales: experiencia clínica y clasificación propuesta". Revista de Medicina Nuclear . 45 (7): 1146–54. PMID 15235060.
- ^ Jeeves MA (1994). Campos mentales: reflexiones sobre la ciencia de la mente y el cerebro . Grand Rapids, MI: Baker Books. pág. 21.
- ^ Dockrill P. "Una resonancia magnética del cerebro humano de 100 horas de duración produce las imágenes 3D más detalladas hasta el momento". www.sciencealert.com .
- ^ ab Nilsson LG, Markowitsch HJ (1999). Neurociencia Cognitiva de la Memoria . Seattle: Editorial Hogrefe & Huber.
- ^ ab Sarikaya I (12 de octubre de 2015). "Estudios PET en epilepsia". Revista estadounidense de medicina nuclear e imágenes moleculares . 5 (5): 416–430. PMC 4620171 . PMID 26550535.
- ^ Explicación de las imágenes cerebrales de Philip Ball
- ^ "Sistemas SPECT para imágenes cerebrales" . Consultado el 24 de julio de 2014 .
- ^ "SPECT Brain Imaging" . Consultado el 12 de enero de 2016 .
- ^ Akdemir ÜÖ, Bora Tokçaer A, Atay LÖ (abril de 2021). "Imágenes SPECT del transportador de dopamina en la enfermedad de Parkinson y los trastornos parkinsonianos". Revista Turca de Ciencias Médicas . 51 (2): 400–410. doi :10.3906/sag-2008-253. PMC 8203173 . PMID 33237660.
- ^ Kim S, Mountz JM (2011). "Imágenes SPECT de la epilepsia: descripción general y comparación con la PET con F-18 FDG". Revista internacional de imágenes moleculares . 2011 : 813028. doi : 10.1155/2011/813028 . PMC 3139140. PMID 21785722 .
- ^ Hospital General de Massachusetts. "Un equipo publica un estudio de resonancia magnética cerebral de máxima resolución". medicalxpress.com .
- ^ Eklund A, Nichols TE, Knutsson H (julio de 2016). "Falla de agrupamiento: por qué las inferencias fMRI para la extensión espacial han inflado las tasas de falsos positivos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 113 (28): 7900–7905. Bibcode :2016PNAS..113.7900E. doi : 10.1073/pnas.1602413113 . PMC 4948312 . PMID 27357684.
- ^ Smith K (5 de marzo de 2008). "Lectura de la mente con un escáner cerebral". Nature News . Nature Publishing Group . Consultado el 5 de marzo de 2008 .
- ^ Keim B (5 de marzo de 2008). "El escáner cerebral puede decir lo que estás mirando". Wired News . CondéNet . Consultado el 16 de septiembre de 2015 .
- ^ Videtič Paska A, Kouter K (agosto de 2021). "El aprendizaje automático como nuevo enfoque para comprender los biomarcadores de la conducta suicida". Revista bosnia de ciencias médicas básicas . 21 (4): 398–408. doi :10.17305/bjbms.2020.5146. PMC 8292863 . PMID 33485296.
- ^ Eggebrecht AT, White BR, Ferradal SL, Chen C, Zhan Y, Snyder AZ, Dehghani H, Culver JP (julio de 2012). "Una comparación espacial cuantitativa de la tomografía difusa de alta densidad y el mapeo cortical fMRI". NeuroImage . 61 (4): 1120–8. doi :10.1016/j.neuroimage.2012.01.124. PMC 3581336 . PMID 22330315.
- ^ Eggebrecht AT, Ferradal SL, Robichaux-Viehoever A, Hassanpour MS, Dehghani H, Snyder AZ, Hershey T, Culver JP (junio de 2014). "Mapeo de funciones cerebrales distribuidas y redes con tomografía óptica difusa". Nature Photonics . 8 (6): 448–454. Bibcode :2014NaPho...8..448E. doi :10.1038/nphoton.2014.107. PMC 4114252 . PMID 25083161.
- ^ Boto E, Holmes N, Leggett J, Roberts G, Shah V, Meyer SS, et al. (marzo de 2018). "Avanzando con la magnetoencefalografía hacia aplicaciones en el mundo real con un sistema portátil". Nature . 555 (7698): 657–661. Bibcode :2018Natur.555..657B. doi :10.1038/nature26147. PMC 6063354 . PMID 29562238.
- ^ Wolters CH, Anwander A, Tricoche X, Weinstein D, Koch MA, MacLeod RS (abril de 2006). "Influencia de la anisotropía de la conductividad tisular en el campo EEG/MEG y el cálculo de la corriente de retorno en un modelo de cabeza realista: un estudio de simulación y visualización utilizando modelado de elementos finitos de alta resolución". NeuroImage . 30 (3): 813–26. doi :10.1016/j.neuroimage.2005.10.014. hdl : 11858/00-001M-0000-0019-1079-8 . PMID 16364662. S2CID 5578998.
- ^ Ramon C, Haueisen J, Schimpf PH (octubre de 2006). "Influencia de los modelos de cabeza en los campos neuromagnéticos y las localizaciones inversas de fuentes". Ingeniería Biomédica en Línea . 5 (1): 55. doi : 10.1186/1475-925X-5-55 . PMC 1629018 . PMID 17059601.
- ^ "Los investigadores construyen el primer sensor cerebral cuántico modular y registran señales". phys.org . Consultado el 11 de julio de 2021 .
- ^ Coussens T, Abel C, Gialopsou A, Bason MG, James TM, Orucevic F, Kruger P (10 de junio de 2021). "Sistema de magnetómetro modular bombeado ópticamente". arXiv : 2106.05877 [physics.atom-ph].
- ^ abcd Crosson B, Ford A, McGregor KM, Meinzer M, Cheshkov S, Li X, Walker-Batson D, Briggs RW (2010). "Imágenes funcionales y técnicas relacionadas: una introducción para investigadores en rehabilitación". Revista de investigación y desarrollo en rehabilitación . 47 (2): vii–xxxiv. doi :10.1682/jrrd.2010.02.0017. PMC 3225087 . PMID 20593321.
- ^ Tsai LL, Grant AK, Mortele KJ, Kung JW, Smith MP (octubre de 2015). "Una guía práctica para la seguridad de las imágenes por resonancia magnética: lo que los radiólogos deben saber". Radiographics . 35 (6): 1722–37. doi :10.1148/rg.2015150108. PMID 26466181.
- ^ Centro de Dispositivos y Salud Radiológica. "MRI (imágenes por resonancia magnética): carteles de seguridad de MRI". www.fda.gov . Consultado el 10 de abril de 2018 .
- ^ ab Brenner DJ, Hall EJ (noviembre de 2007). "Tomografía computarizada: una fuente cada vez mayor de exposición a la radiación" (PDF) . The New England Journal of Medicine . 357 (22): 2277–84. doi :10.1056/NEJMra072149. PMID 18046031. S2CID 2760372.
- ^ Smith-Bindman R (julio de 2010). "¿Es segura la tomografía computarizada?". The New England Journal of Medicine . 363 (1): 1–4. doi :10.1056/NEJMp1002530. PMID 20573919.
- ^¿ Qué sucede durante una exploración PET?. 2016-12-30.
Enlaces externos
- El Atlas del Cerebro Completo de Harvard
- Notas de clase sobre los aspectos matemáticos de la neuroimagen, a cargo de Will Penny, University College London
- "Estimulación magnética transcraneal". Por Michael Leventon en asociación con MIT AI Lab .
- NeuroDebian: un sistema operativo completo enfocado en la neuroimagen
![Caja fuerte para el Sr. [35]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/6e/MR_safe_sign.svg/180px-MR_safe_sign.svg.png)



