Desmetilación
La desmetilación es el proceso químico que resulta en la eliminación de un grupo metilo (CH 3 ) de una molécula. [1] [2] Una forma común de desmetilación es el reemplazo de un grupo metilo por un átomo de hidrógeno, lo que resulta en una pérdida neta de un carbono y dos átomos de hidrógeno.
La contraparte de la desmetilación es la metilación .
En bioquímica

Dicamba, un herbicida ampliamente utilizado, se biodegrada por desmetilación para dar ácido 3,6-diclorosalicílico , catalizado por una enzima dioxigenasa . [3]
La desmetilación es relevante para la epigenética . La desmetilación del ADN es catalizada por desmetilasas . Estas enzimas oxidan los grupos N-metilo, que se encuentran en las histonas , en los derivados de la lisina y en algunas formas de ADN. [4]
- R2N - CH3 + O → R2N - H + CH2O
Una familia de tales enzimas oxidativas es el citocromo P450 . [5] Las hidroxilasas dependientes de alfa-cetoglutarato también son activas para la desmetilación del ADN, operando mediante una estequiometría similar. [6] Estas reacciones, que proceden mediante hidroxilación , explotan los enlaces CH ligeramente debilitados de las metilaminas y los metiléteres .
La desmetilación de algunos esteroles es un paso en la biosíntesis de testosterona y colesterol . Los grupos metilo se pierden en forma de formato . [7]
Procesamiento de biomasa
Los grupos metoxi decoran profusamente la lignina del biopolímero . Se ha mostrado mucho interés en convertir esta abundante forma de biomasa en productos químicos útiles (aparte del combustible). Un paso en dicho procesamiento es la desmetilación. [8] [9] La desmetilación de la vainillina , un derivado de la lignina, requiere 250 °C (482 °F) y una base fuerte. [10] La industria de pulpa y papel]] digiere la lignina utilizando sulfuro de sodio acuoso , que despolimeriza parcialmente la lignina. La deslignificación está acompañada de una extensa O-desmetilación, produciendo metanotiol , que es emitido por las fábricas de papel . [11]
En química orgánica
La desmetilación a menudo se refiere a la escisión de éteres , especialmente éteres arílicos. [12]
Históricamente, los éteres de metilo de arilo, incluidos productos naturales como la codeína ( O -metilmorfina), se han desmetilado calentando la sustancia en clorhidrato de piridina fundido (punto de fusión 144 °C (291 °F)) a 180 a 220 °C (356 a 428 °F), a veces con exceso de cloruro de hidrógeno , en un proceso conocido como escisión del éter Zeisel-Prey . [13] [14] El análisis cuantitativo de los éteres de metilo aromáticos se puede realizar mediante la determinación argentométrica del cloruro de N -metilpiridinio formado. [15] El mecanismo de esta reacción comienza con la transferencia de protones del ion piridinio al éter de metilo arilo, un paso altamente desfavorable ( K < 10 −11 ) que explica las duras condiciones requeridas, dada la acidez mucho más débil del piridinio ( p K a = 5,2) en comparación con el éter de metilo arilo protonado (un ion arilmetiloxonio, p K a = –6,7 para arilo = Ph [16] ). A esto le sigue el ataque S N 2 del ion arilmetiloxonio en el grupo metilo por piridina o ion cloruro (dependiendo del sustrato) para dar el fenol libre y, en última instancia, cloruro de N -metilpiridinio, ya sea directamente o por transferencia de metilo posterior del cloruro de metilo a la piridina. [15]

Otro método clásico (pero, de nuevo, severo) para la eliminación del grupo metilo de un éter de metilo arílico es calentar el éter en una solución de bromuro de hidrógeno o yoduro de hidrógeno, a veces también con ácido acético . [17] La escisión de los éteres por ácido bromhídrico o yodhídrico se produce por protonación del éter, seguida de desplazamiento por bromuro o yoduro . Un conjunto de condiciones ligeramente más suaves utiliza yoduro de ciclohexilo (CyI, 10,0 equiv) en N , N -dimetilformamida para generar una pequeña cantidad de yoduro de hidrógeno in situ . [18]
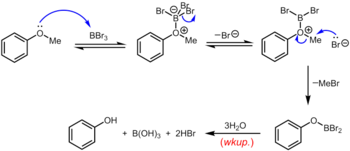
El tribromuro de boro , que se puede utilizar a temperatura ambiente o inferior, es un reactivo más especializado para la desmetilación de éteres de metilo arílicos. El mecanismo de desalquilación del éter se produce a través de la formación reversible inicial de un aducto ácido-base de Lewis entre el BBr3 fuertemente ácido de Lewis y el éter básico de Lewis. Este aducto de Lewis puede disociarse reversiblemente para dar un catión dibromoboril oxonio y Br – . La ruptura del enlace éter se produce a través del posterior ataque nucleofílico sobre la especie oxonio por Br – para producir un ariloxidibromoborano y bromuro de metilo. Una vez completada la reacción, el fenol se libera junto con el ácido bórico (H 3 BO 3 ) y el ácido bromhídrico (HBr ac.) tras la hidrólisis del derivado de dibromoborano durante el tratamiento acuoso . [19]
Los nucleófilos más fuertes , como los diorganofosfuros (LiPPh 2 ), también escinden los éteres arílicos, a veces en condiciones suaves. [20] Otros nucleófilos fuertes que se han empleado incluyen sales de tiolato como EtSNa. [21]
Los éteres metílicos aromáticos, particularmente aquellos con un grupo carbonilo adyacente, pueden desmetilarse regioselectivamente utilizando eterato de yoduro de magnesio . [22] Un ejemplo de este uso es la síntesis del producto natural Calphostin A , [23] como se ve a continuación.

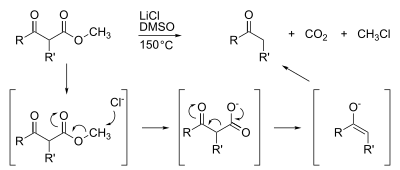
Los ésteres metílicos también son susceptibles a la desmetilación, que generalmente se logra mediante saponificación . Son abundantes las desmetilaciones altamente especializadas, como la descarboxilación de Krapcho :
Se calentó una mezcla de anetol , KOH y alcohol en un autoclave. Aunque el producto de esta reacción fue el anol esperado, Charles Dodds también descubrió un producto de dimerización altamente reactivo en las aguas madres llamado dianol .
norte-desmetilación
La N -desmetilación de las aminas 3° se realiza mediante la reacción de von Braun , que utiliza BrCN como reactivo para dar los derivados nor correspondientes . Se desarrolló una variación moderna de la reacción de von Braun, en la que el BrCN fue reemplazado por cloroformiato de etilo . La preparación de Paxil a partir de arecolina es una aplicación de esta reacción, así como la síntesis de GSK-372,475 , por ejemplo.
La N -desmetilación de la imipramina produce desipramina .
Véase también
- Metilación , la adición de un grupo metilo a un sustrato.
Referencias
- ^ Clayden, J.; Greeves, N.; Warren, S.; Wothers, P. (2001). Química orgánica . Oxford, Oxfordshire: Oxford University Press . ISBN 978-0-19-850346-0.
- ^ Smith, Michael B.; March, Jerry (2007), Química orgánica avanzada: reacciones, mecanismos y estructura (6.ª ed.), Nueva York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Dumitru, Razvan; Jiang, Wen Zhi; Weeks, Donald P.; Wilson, Mark A. (2009). "Estructura cristalina de la monooxigenasa dicamba: una oxigenasa no hemo de Rieske que cataliza la desmetilación oxidativa". Revista de biología molecular . 392 (2): 498–510. doi :10.1016/j.jmb.2009.07.021. PMC 3109874 . PMID 19616011.
- ^ Pedersen MT, Helin K (noviembre de 2010). "Histonas desmetilasas en el desarrollo y la enfermedad". Tendencias en biología celular . 20 (11): 662–71. doi :10.1016/j.tcb.2010.08.011. PMID 20863703.
- ^ Roland Sigel; Sigel, Astrid; Sigel, Helmut (2007). Los roles ubicuos de las proteínas del citocromo P450: iones metálicos en las ciencias de la vida . Nueva York: Wiley. ISBN 978-0-470-01672-5.
- ^ Kohli RM, Zhang Y (octubre de 2013). "Enzimas TET, TDG y la dinámica de la desmetilación del ADN". Nature . 502 (7472): 472–9. Bibcode :2013Natur.502..472K. doi :10.1038/nature12750. PMC 4046508 . PMID 24153300.
- ^ Pietzke, Matthias; Meiser, Johannes; Vazquez, Alexei (2020). "Metabolismo del formato en la salud y la enfermedad". Metabolismo molecular . 33 : 23–37. doi :10.1016/j.molmet.2019.05.012. PMC 7056922 . PMID 31402327.
- ^ Schmidt, Sandy (2022). "Ampliando el repertorio de oxigenasas de Rieske para O-desmetilaciones". Química Catálisis . 2 (8): 1843–1845. doi :10.1016/j.checat.2022.07.005.
- ^ W. Boerjan; J. Ralph; M. Baucher (junio de 2003). "Biosíntesis de lignina". Annu. Rev. Plant Biol. 54 (1): 519–549. doi :10.1146/annurev.arplant.54.031902.134938. PMID 14503002.
- ^ Irwin A. Pearl (1949). "Ácido protocatecúlico". Síntesis orgánicas . 29 : 85; Volúmenes recopilados , vol. 3, pág. 745.
- ^ Hansen, GA (1962). " Control de olores y contaminación en una fábrica de pulpa Kraft ". Revista de la Asociación de Control de la Contaminación del Aire . 12 (9): 409–436. doi :10.1080/00022470.1962.10468107. PMID 13904415.
- ^ Weissman, Steven A.; Zewge, Daniel (2005). "Avances recientes en la desalquilación del éter". Tetrahedron . 61 (33): 7833–7863. doi :10.1016/j.tet.2005.05.041.
- ^ Lawson, JA; DeGraw, JI (1977). "Un método mejorado para la O-desmetilación de la codeína". Revista de química medicinal . 20 (1): 165–166. doi :10.1021/jm00211a037. ISSN 0022-2623. PMID 833817.
- ^ Hassner, Alfred; Stumer, C. (2002). Síntesis orgánicas basadas en reacciones de nombres (2.ª ed.). Ámsterdam: Pergamon . ISBN 9780080513348.OCLC 190810761 .
- ^ ab Burwell, Robert L. (1 de agosto de 1954). "La escisión de los éteres". Chemical Reviews . 54 (4): 615–685. doi :10.1021/cr60170a003. ISSN 0009-2665.
- ^ Vollhardt, Peter; Schore, Neil (1 de enero de 2014). Química orgánica: estructura y función (séptima edición). Nueva York, NY. ISBN 9781464120275.OCLC 866584251 .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Streitwieser, Andrew; Heathcock, Clayton H.; Kosower, Edward M. (1992). Introducción a la química orgánica (4.ª ed.). Upper Saddle River, NJ: Prentice Hall . ISBN 978-0139738500.OCLC 52836313 .
- ^ Zuo, Li; Yao, Shanyan; Wang, Wei; Duan, Wenhu (junio de 2008). "Un método eficiente para la desmetilación de éteres de metilo de arilo". Tetrahedron Letters . 49 (25): 4054–4056. doi :10.1016/j.tetlet.2008.04.070.
- ^ JFW McOmie, DE West (1969). "3,3'-Dihidroxibifenilo". Síntesis orgánicas . 49 : 13; Volúmenes recopilados , vol. 5, pág. 412.
- ^ Robert E. Irlanda; David M. Walba (1977). Síntesis orgánicas . vol. 56. pág. 44. doi :10.1002/0471264180.os056.11. ISBN 978-0471264224.
- ^ Mirrington, RN; Feutrill, GI (1973). "Orcinol Monomethyl Ether". Síntesis orgánicas . 53 : 90. doi :10.15227/orgsyn.053.0090.
- ^ Yamaguchi, Seiji; Nedachi, Masahiro; Yokoyama, Hajime; Hirai, Yoshiro (octubre de 1999). "Desmetilación regioselectiva de 2,6-dimetoxibenzaldehídos con eterato de yoduro de magnesio". Letras de tetraedro . 40 (41): 7363–7365. doi :10.1016/S0040-4039(99)01411-2.
- ^ Merlic, Craig A.; Aldrich, Courtney C.; Albaneze-Walker, Jennifer; Saghatelian, Alan (1 de abril de 2000). "Complejos de carbeno en la síntesis de productos naturales complejos: síntesis total de las calfostinas". Revista de la Sociedad Química Americana . 122 (13): 3224–3225. doi :10.1021/ja994313+. PMC 3548573 . PMID 23335811.