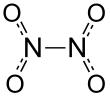
Tetróxido de dinitrógeno
| |||
 Dióxido de nitrógeno a -196 °C, 0 °C, 23 °C, 35 °C y 50 °C. ( NO 2) se convierte en tetróxido de dinitrógeno incoloro ( N 2Oh 4) a bajas temperaturas y vuelve a NO 2a temperaturas más altas. | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Tetróxido de dinitrógeno | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.031.012 | ||
| Número CE |
| ||
| 2249 | |||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 1067 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| N2O4 | |||
| Masa molar | 92,010 g·mol −1 | ||
| Apariencia | Sólido blanco, líquido incoloro, gas naranja. | ||
| Densidad | 1,44246 g/cm3 ( líquido, 21 °C) | ||
| Punto de fusión | -11,2 °C (11,8 °F; 261,9 K) y se descompone en NO 2 | ||
| Punto de ebullición | 21,69 °C (71,04 °F; 294,84 K) | ||
| Reacciona para formar ácidos nitroso y nítrico. | |||
| Presión de vapor | 96 kPa (20 °C) [1] | ||
| −23,0·10 −6 cm3 / mol | |||
Índice de refracción ( n D ) | 1.00112 | ||
| Estructura | |||
| Planar, D 2h | |||
| pequeño, distinto de cero | |||
| Termoquímica | |||
Entropía molar estándar ( S ⦵ 298 ) | 304,29 J/K⋅mol [2] | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | +9,16 kJ/mol [2] | ||
| Peligros | |||
| Etiquetado SGA : | |||
    | |||
| Peligro | |||
| H270 , H314 , H330 , H335 , H336 | |||
| P220 , P244 , P260 , P261 , P264 , P271 , P280 , P284 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P312 , P320 , P321 , P363 , P370+P376 , P403 , P403+P233 , P405 , P410+P403 , P501 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | Ininflamable | ||
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad externa | ||
| Compuestos relacionados | |||
Compuestos relacionados | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El tetróxido de dinitrógeno , comúnmente denominado tetróxido de nitrógeno ( NTO ), y ocasionalmente (generalmente entre los ingenieros de cohetes de la ex Unión Soviética/Rusia) como amilo , es el compuesto químico N 2 O 4 . Es un reactivo útil en la síntesis química. Forma una mezcla de equilibrio con dióxido de nitrógeno . Su masa molar es 92,011 g/mol.
El tetróxido de dinitrógeno es un oxidante potente que es hipergólico (reacciona espontáneamente) al entrar en contacto con diversas formas de hidracina , lo que ha convertido a este par en un bipropelente común para cohetes.
Estructura y propiedades
El tetróxido de dinitrógeno podría considerarse como dos grupos nitro (-NO 2 ) unidos entre sí. Forma una mezcla de equilibrio con el dióxido de nitrógeno . [5] La molécula es plana con una distancia de enlace NN de 1,78 Å y distancias NO de 1,19 Å. La distancia NN corresponde a un enlace débil, ya que es significativamente más larga que la longitud promedio de enlace simple NN de 1,45 Å. [6] Este enlace σ excepcionalmente débil (que equivale a la superposición de los orbitales híbridos sp 2 de las dos unidades NO 2 [7] ) resulta de la deslocalización simultánea del par de electrones de enlace a lo largo de toda la molécula de N 2 O 4 y la considerable repulsión electrostática de los orbitales moleculares doblemente ocupados de cada unidad NO 2 . [8]
A diferencia del NO 2 , el N 2 O 4 es diamagnético ya que no tiene electrones desapareados. [9] El líquido también es incoloro pero puede aparecer como un líquido amarillo parduzco debido a la presencia de NO 2 de acuerdo con el siguiente equilibrio: [10]
- N 2 O 4 ⇌ 2 NO 2 ( Δ H = +57,23 kJ/mol )
Las temperaturas más altas empujan el equilibrio hacia el dióxido de nitrógeno. Inevitablemente, parte del tetróxido de dinitrógeno es un componente del smog que contiene dióxido de nitrógeno.
El N 2 O 4 sólido es blanco y se funde a -11,2 °C. [11]
Producción
El tetróxido de nitrógeno se obtiene por oxidación catalítica del amoníaco ( proceso de Ostwald ): se utiliza vapor como diluyente para reducir la temperatura de combustión. En el primer paso, el amoníaco se oxida a óxido nítrico :
- 4NH3 + 5O2 → 4NO + 6H2O
La mayor parte del agua se condensa y los gases se enfrían aún más; el óxido nítrico que se produjo se oxida a dióxido de nitrógeno, que luego se dimeriza en tetróxido de nitrógeno:
- 2NO2 + O2 → 2NO2
- 2NO2⇌N2O4
y el resto del agua se elimina en forma de ácido nítrico . El gas es esencialmente dióxido de nitrógeno puro, que se condensa en tetróxido de dinitrógeno en un licuador enfriado con salmuera. [12]
El tetróxido de dinitrógeno también se puede producir mediante la reacción de ácido nítrico concentrado y cobre metálico. Esta síntesis es práctica en un entorno de laboratorio. El tetróxido de dinitrógeno también se puede producir calentando nitratos metálicos. [13] La oxidación del cobre por ácido nítrico es una reacción compleja que forma varios óxidos de nitrógeno de estabilidad variable que depende de la concentración del ácido nítrico, la presencia de oxígeno y otros factores. Las especies inestables reaccionan aún más para formar dióxido de nitrógeno que luego se purifica y se condensa para formar tetróxido de dinitrógeno.
Uso como propulsor de cohetes
El tetróxido de nitrógeno se utiliza como agente oxidante en uno de los sistemas de propulsión de cohetes más importantes porque se puede almacenar como líquido a temperatura ambiente. Pedro Paulet , un erudito peruano , informó en 1927 que había experimentado en la década de 1890 con un motor de cohete que utilizaba boquillas accionadas por resorte que introducían periódicamente tetróxido de nitrógeno vaporizado y bencina de petróleo en una bujía para el encendido, con el motor produciendo 300 explosiones pulsantes por minuto. [14] [15] Paulet visitaría la asociación alemana de cohetes Verein für Raumschiffahrt (VfR) y el 15 de marzo de 1928, Valier aplaudió el diseño del cohete propulsado por líquido de Paulet en la publicación de VfR Die Rakete , diciendo que el motor tenía "una potencia asombrosa". [16] Paulet pronto sería contactado por la Alemania nazi para ayudar a desarrollar la tecnología de cohetes, aunque se negó a ayudar y nunca compartió la fórmula de su propulsor. [17]
A principios de 1944, científicos alemanes llevaron a cabo investigaciones sobre la utilidad del tetróxido de dinitrógeno como agente oxidante para combustible de cohetes, aunque los alemanes solo lo usaron en una medida muy limitada como aditivo para S-Stoff (ácido nítrico fumante). Se convirtió en el oxidante almacenable de elección para muchos cohetes tanto en los Estados Unidos como en la URSS a fines de la década de 1950. Es un propulsor hipergólico en combinación con un combustible para cohetes a base de hidracina . Uno de los primeros usos de esta combinación fue en la familia de cohetes Titan utilizados originalmente como misiles balísticos intercontinentales y luego como vehículos de lanzamiento para muchas naves espaciales. Utilizado en las naves espaciales estadounidenses Gemini y Apollo y también en el transbordador espacial , continúa utilizándose como propulsor de mantenimiento de la estación en la mayoría de los satélites geoestacionarios y muchas sondas de espacio profundo. También es el oxidante principal del cohete Proton de Rusia .
Cuando se utiliza como propulsor, el tetróxido de dinitrógeno se suele denominar simplemente tetróxido de nitrógeno y la abreviatura NTO se utiliza ampliamente. Además, el NTO se utiliza a menudo con la adición de un pequeño porcentaje de óxido nítrico , que inhibe el agrietamiento por corrosión bajo tensión de las aleaciones de titanio, y en esta forma, el NTO de grado propulsor se conoce como óxidos mixtos de nitrógeno ( MON ). La mayoría de las naves espaciales utilizan ahora MON en lugar de NTO; por ejemplo, el sistema de control de reacción del transbordador espacial utilizó MON3 (NTO que contiene un 3% de NO en peso). [18]
El accidente del Apollo-Soyuz
El 24 de julio de 1975, tres astronautas estadounidenses que se encontraban en el último descenso a la Tierra tras el vuelo del proyecto de pruebas Apolo-Soyuz sufrieron un envenenamiento por NTO. Esto se debió a que un interruptor se dejó accidentalmente en la posición incorrecta, lo que permitió que los propulsores de control de actitud se activaran después de que se abriera la entrada de aire fresco de la cabina, lo que permitió que los vapores de NTO entraran en la cabina. Un miembro de la tripulación perdió el conocimiento durante el descenso. Al aterrizar, la tripulación estuvo hospitalizada durante cinco días por neumonía y edema inducidos por sustancias químicas . [19] [20]
Generación de energía utilizando N2Oh4
La tendencia del N2O4 a descomponerse reversiblemente en NO2 ha llevado a la investigación sobre su uso en sistemas avanzados de generación de energía como un gas llamado disociativo. [21] El tetróxido de dinitrógeno "frío" se comprime y se calienta, lo que hace que se disocie en dióxido de nitrógeno a la mitad del peso molecular. Este dióxido de nitrógeno caliente se expande a través de una turbina, enfriándolo y reduciendo la presión, y luego se enfría aún más en un disipador de calor, lo que hace que se recombine en tetróxido de nitrógeno con el peso molecular original. Entonces es mucho más fácil comprimirlo para comenzar todo el ciclo nuevamente. Estos ciclos Brayton de gas disociativo tienen el potencial de aumentar considerablemente la eficiencia de los equipos de conversión de energía. [22]
El alto peso molecular y la menor relación de expansión volumétrica del dióxido de nitrógeno en comparación con el vapor permiten que las turbinas sean más compactas. [23]
El N 2 O 4 fue el componente principal del fluido de trabajo "nitrina" en el reactor nuclear portátil Pamir-630D fuera de servicio que funcionó entre 1985 y 1987. [24]
Reacciones químicas
Intermedio en la fabricación de ácido nítrico
El ácido nítrico se fabrica a gran escala a partir del N 2 O 4 . Esta especie reacciona con el agua para dar ácido nitroso y ácido nítrico :
- norte 2 O 4 + H 2 O → HNO 2 + HNO 3
El coproducto HNO2 al calentarse se desproporciona y forma NO y más ácido nítrico. Cuando se expone al oxígeno, el NO se convierte nuevamente en dióxido de nitrógeno:
- 2NO2 + O2 → 2NO2
El NO2 y el N2O4 resultantes pueden devolverse al ciclo para dar nuevamente la mezcla de ácidos nitroso y nítrico .
Síntesis de nitratos metálicos
El N 2 O 4 sufre una autoionización molecular para dar [NO + ] [NO 3 − ], siendo el ion nitrosonio anterior un oxidante fuerte. Se pueden preparar diversos complejos de nitrato de metales de transición anhidros a partir de N 2 O 4 y metal base. [25]
- 2N2O4 + M → 2NO+M( NO3 ) 2
Si se preparan nitratos metálicos a partir de N 2 O 4 en condiciones completamente anhidras, se puede formar una gama de nitratos metálicos covalentes con muchos metales de transición. Esto se debe a que existe una preferencia termodinámica por el enlace covalente del ion nitrato con dichos metales en lugar de formar una estructura iónica. Dichos compuestos deben prepararse en condiciones anhidras, ya que el ion nitrato es un ligando mucho más débil que el agua, y si hay agua presente, se formará el nitrato simple del ion metálico hidratado . Los nitratos anhidros en cuestión son covalentes en sí mismos, y muchos, por ejemplo, el nitrato de cobre anhidro , son volátiles a temperatura ambiente. El nitrato de titanio anhidro sublima al vacío a solo 40 °C. Muchos de los nitratos de metales de transición anhidros tienen colores llamativos. Esta rama de la química fue desarrollada por Cliff Addison y Norman Logan en la Universidad de Nottingham en el Reino Unido durante las décadas de 1960 y 1970, cuando comenzaron a estar disponibles desecantes y cajas secas altamente eficientes.
Con compuestos orgánicos
Incluso en disolventes ligeramente básicos, el N2O4 se añade a los alquenos de forma radical, dando lugar a mezclas de compuestos nitrados y ésteres de nitrito . Puros o en disolventes totalmente no básicos, los compuestos se autoionizan como se ha indicado anteriormente, para dar lugar a compuestos nitrosos y ésteres de nitrato . [26]
Referencias
- ^ Ficha internacional de seguridad química https://www.ilo.org/dyn/icsc/showcard.display?p_lang=en&p_card_id=0930&p_version=2
- ^ ab PW Atkins y J. de Paula, Química física (8.ª ed., WH Freeman, 2006) pág. 999
- ^ "Ficha técnica química: Tetróxido de nitrógeno". CAMEO Chemicals NOAA . Consultado el 8 de septiembre de 2020 .
- ^ "Resumen del compuesto: Tetróxido de dinitrógeno". PubChem . Consultado el 8 de septiembre de 2020 .
- ^ Bent, Henry A. (1963). "Dímeros de dióxido de nitrógeno. II. Estructura y enlaces". Química inorgánica . 2 (4): 747–752. doi :10.1021/ic50008a020.
- ^ Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). Química general: principios y aplicaciones modernas (8.ª ed.). Upper Saddle River, NJ: Prentice Hall. pág. 420. ISBN 978-0-13-014329-7. OCLC 46872308 .
- ^ Rayner-canham, Geoff (2013). Química inorgánica descriptiva (6.ª ed.). pág. 400. ISBN 978-1-319-15411-0.OCLC 1026755795 .
- ^ Ahlrichs, Reinhart; Keil, Frerich (1974-12-01). "Estructura y enlace en tetróxido de dinitrógeno (N2O4)". Revista de la Sociedad Química Americana . 96 (25): 7615–7620. doi :10.1021/ja00832a002. ISSN 0002-7863.
- ^ Holleman, AF; Wiberg, E. "Química inorgánica" Academic Press: San Diego, 2001. ISBN 978-0-12-352651-9 .
- ^ Holleman, AF; Wiberg, E. (2001) Química inorgánica . Academic Press: San Diego. ISBN 0-12-352651-5 .
- ^ Holleman, AF; Wiberg, E. (2001) Química inorgánica . Academic Press: San Diego. ISBN 0-12-352651-5 .
- ^ Hebry, TH; Inskeep, GC (1954). Procesos químicos modernos: una serie de artículos que describen plantas de fabricación de productos químicos. Nueva York: Reinhold. pág. 219.
- ^ Rennie, Richard (2016). Diccionario de química. Oxford University Press. pág. 178. ISBN 978-0-19-872282-3.
- ^ Gonzales Obando, Diana (22 de julio de 2021). "Pedro Paulet: el genio peruano que se adelantó a su época y fundó la era espacial". El Comercio (en español) . Consultado el 13 de marzo de 2022 .
- ^ "Un peruano Pedro Paulet reclama la propiedad de su invento". El Comercio (en español). 25 de agosto de 1927 . Consultado el 13 de marzo de 2022 .
- ↑ Mejía, Álvaro (2017). Pedro Paulet, sabio multidisciplinario (en español). Universidad Católica San Pablo. págs. 95-122.
- ^ "El peruano que se convirtió en el padre de la astronáutica inspirado por Julio Verne y que aparece en los nuevos billetes de 100 soles". BBC News (en español) . Consultado el 11 de marzo de 2022 .
- ^ "Índice de propulsores de cohetes". Archivado desde el original el 11 de mayo de 2008. Consultado el 1 de marzo de 2005 .
- ^ "Brand asume la culpa por la fuga de gas del Apollo", Florence, AL - Times Daily , 10 de agosto de 1975
- ^ Sotos, John G., MD. "Historias médicas de astronautas y cosmonautas", 12 de mayo de 2008, consultado el 1 de abril de 2011.
- ^ Stochl, Robert J. (1979). Potencial mejora del rendimiento mediante el uso de un gas reactivo (tetróxido de nitrógeno) como fluido de trabajo en un ciclo Brayton cerrado (PDF) (Informe técnico). NASA . TM-79322.
- ^ Ragheb, R. "Conceptos de reactores nucleares y ciclos termodinámicos" (PDF) . Consultado el 1 de mayo de 2013 .
- ^ Binotti, Marco; Invernizzi, Costante M.; Iora, Paolo; Manzolini, Giampaolo (marzo de 2019). "Mezclas de tetróxido de dinitrógeno y dióxido de carbono como fluidos de trabajo en plantas solares de torre". Energía solar . 181 : 203–213. doi :10.1016/j.solener.2019.01.079. S2CID 104462066.
- ^ Paliukhovich, VM (7 de mayo de 2023). «Desmantelamiento seguro de una central nuclear móvil» (PDF) . Organismo Internacional de Energía Atómica . Minsk, Bielorrusia: Departamento de Supervisión de la Seguridad Industrial y Nuclear. Archivado (PDF) del original el 7 de mayo de 2023. Consultado el 7 de mayo de 2023 .
- ^ Addison, C. Clifford (febrero de 1980). "Tetróxido de dinitrógeno, ácido nítrico y sus mezclas como medios para reacciones inorgánicas". Chemical Reviews . 80 (1): 21–39. doi :10.1021/cr60323a002.
- ^ Williams, D. L. H. (1988). Nitrosación . Cambridge, Reino Unido: Cambridge University . Págs. 49-50. ISBN. 0-521-26796-X.
Enlaces externos
- Ficha internacional de seguridad química 0930
- Inventario Nacional de Contaminantes – Hoja informativa sobre óxidos de nitrógeno
- Guía de bolsillo del NIOSH sobre peligros químicos: tetróxido de nitrógeno
- Enciclopedia de gases de Air Liquide: NO2 / N2O4 Archivado el 10 de marzo de 2016 en Wayback Machine.
- Poliakoff, Martyn (2009). "La química del despegue lunar: nuestro especial del 40.º aniversario del Apolo 11". La tabla periódica de vídeos . Universidad de Nottingham .