Modulador selectivo del receptor de andrógenos
| Modulador selectivo del receptor de andrógenos | |
|---|---|
| Clase de droga | |
 Enobosarm (ostarina), un SARM no esteroide bajo investigación para un posible uso médico. | |
| Identificadores de clase | |
| Sinónimos | Andrógeno no esteroide (aunque no todos los SARM son no esteroides) [1] |
| Usar | En investigación |
| Objetivo biológico | Receptor de andrógenos |
| Clase química | Mayormente no esteroides |
| Estatus legal | |
| Estatus legal |
|
| En Wikidata | |
Los moduladores selectivos del receptor de andrógenos ( SARM ) son una clase de medicamentos que activan selectivamente el receptor de andrógenos en tejidos específicos , promoviendo el crecimiento muscular y óseo y teniendo menos efecto en los tejidos reproductivos masculinos como la glándula prostática .
Los esteroides no selectivos , llamados esteroides anabólicos androgénicos (EAA), se han utilizado para diversos fines médicos, pero sus efectos secundarios limitan su uso. En 1998, los investigadores descubrieron una nueva clase de compuestos no esteroides, los SARM. Estos compuestos estimulan selectivamente el receptor de andrógenos, ofreciendo efectos potentes sobre los huesos y los músculos para aumentar la densidad ósea y la masa corporal magra, mientras que tienen un impacto mínimo en los tejidos reproductivos.
Los SARM se han investigado en estudios en humanos para el tratamiento de la osteoporosis , la caquexia (síndrome de desgaste), la hiperplasia prostática benigna , la incontinencia urinaria de esfuerzo y el cáncer de mama . A partir de 2023 [actualizar], no hay SARM que hayan sido aprobados por la Administración de Alimentos y Medicamentos de los Estados Unidos o la Agencia Europea de Medicamentos . Aunque los efectos adversos en los estudios clínicos han sido poco frecuentes y leves, los SARM pueden causar enzimas hepáticas elevadas , reducción de los niveles de colesterol HDL y supresión del eje hipotálamo-hipofisario-gonadal (eje HPG), entre otros efectos secundarios.
Desde principios del siglo XXI, los SARM se han utilizado con fines dopantes ; fueron prohibidos por la Agencia Mundial Antidopaje en 2008. Los SARM están fácilmente disponibles en los mercados grises basados en Internet y se utilizan comúnmente con fines recreativos para estimular el crecimiento muscular.
Historia
Andrógenos esteroides
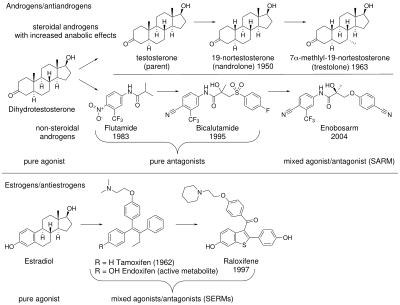

Los esteroides anabólicos androgénicos (AAS) se utilizan para tratar una variedad de condiciones médicas, pero sus efectos secundarios han impulsado la búsqueda de una nueva clase de medicamentos, con una mejor separación entre los efectos anabólicos deseables y los androgénicos indeseables. El primer AAS utilizado clínicamente fue la testosterona , que se descubrió en 1935 y se aprobó por primera vez para uso médico en 1939. [5] Los AAS, incluidos los producidos endógenamente, como la testosterona y la dihidrotestosterona (DHT), se unen y activan el receptor de andrógenos (AR) para producir sus efectos. Los efectos de los AAS se pueden separar en androgénicos (el desarrollo y mantenimiento de las características sexuales masculinas ) y anabólicos (aumento de la densidad ósea , la masa muscular y la fuerza). Los AAS también afectan la hematopoyesis , la coagulación , el metabolismo y la cognición. [6] [7] Para la mayoría de las aplicaciones médicas, un AAS con potentes efectos anabólicos y androgénicos y cardiovasculares mínimos sería una ventaja.
En la década de 1930, se descubrieron los esteroides anabólicos 17α-alquilados . Estos tienen una mayor estabilidad metabólica y son activos por vía oral, pero no son selectivos de los tejidos. [8] Estos esteroides anabólicos alquilados todavía tienen efectos androgénicos significativos y también son hepatotóxicos . [9] [10] En 1950, se sintetizó por primera vez la nandrolona (19-nortestosterona), que a veces se considera un SARM debido a una mayor selectividad tisular que la testosterona. [8] [10] [11] Además, también se ha informado que la sustitución de testosterona por 7α-alquilo (por ejemplo, trestolona ) aumenta sus efectos anabólicos. [8] Sin embargo, los esfuerzos por desarrollar un esteroide con efectos anabólicos pero androgénicos mínimos no tuvieron éxito. [12]
SERM
El interés en los agonistas/antagonistas mixtos de AR no esteroides aumentó después de que se hicieran evidentes los usos terapéuticos de los moduladores selectivos del receptor de estrógeno (SERM). [13] El primer SERM, el tamoxifeno , se desarrolló originalmente como un anticonceptivo antiestrógeno. Sin embargo, se descubrió que promovía la ovulación en humanos al actuar como un agonista en los ovarios. Luego, el fármaco se reutilizó con éxito como tratamiento para el cáncer de mama, donde se descubrió que actuaba como un antagonista completo en el tejido mamario. [14] De manera algo inesperada, también se descubrió que el tamoxifeno preserva la densidad ósea [15] al actuar como un agonista en los osteoclastos que reabsorben los huesos . [16] El éxito clínico de los SERM estimuló el interés en fármacos selectivos de tejidos análogos que se dirigen al AR. [7]
Antagonistas de AR no esteroides
El punto de partida químico de los agonistas/antagonistas mixtos de AR fueron los antiandrógenos AR no esteroides como la flutamida , la nilutamida y la bicalutamida . Estos antagonistas funcionan uniéndose al AR para prevenir la acción androgénica; esta clase de sustancias químicas data de la década de 1970. [6] [13] El descubrimiento de las arilpropionamidas, que comparten una similitud estructural con la bicalutamida y la hidroxiflutamida , sugirió una forma de fabricar compuestos que se unen al AR y producen efectos tanto anabólicos como antiandrogénicos. [6] Los moduladores selectivos del receptor de andrógenos (SARM) se desarrollaron a partir del deseo de mantener los efectos anabólicos de los andrógenos en los músculos y los huesos, al tiempo que se evitan los efectos secundarios en otros tejidos como la próstata y el sistema cardiovascular. [9]
SARM no esteroides
Los primeros SARM no esteroides fueron desarrollados en 1998 de forma independiente por dos grupos de investigación, uno en la Universidad de Tennessee que creó un SARM de arilpropionamida y Ligand Pharmaceuticals que creó un SARM con una estructura de núcleo de quinolona . El nombre fue adoptado por analogía con los SERM. [13] Otros SARM incluyen tetrahidroquinolinas , tricíclicos , tricíclicos puenteados, anilina , diaril anilina, hidantoínas bicíclicas, benzimidazol , imidazolopirazol, indol y derivados de pirazolina . [6] Los SARM pueden ser agonistas , antagonistas o agonistas parciales del AR dependiendo del tejido, lo que puede permitir dirigirse a condiciones médicas específicas mientras se minimizan los efectos secundarios. [7] Aquellos que han avanzado a ensayos en humanos muestran efectos más fuertes en el tejido óseo y muscular y efectos más débiles en la próstata. [8]
A diferencia de la mayoría de las formas actuales de reemplazo de testosterona, los SARM son biodisponibles por vía oral [7] y se eliminan en gran medida a través del metabolismo hepático y se metabolizan a través de la hidrólisis de amida en el caso de las arilpropionamidas y la nitrorreducción del anillo A de la andarina . [9]
Tratamiento propuesto para el hipogonadismo
Debido al perfil de efectos secundarios potencialmente mejor de los SARM en comparación con la testosterona, se han propuesto los SARM para su uso en el tratamiento del hipogonadismo y para la terapia de reemplazo de andrógenos. [17] [18] [19] Los ensayos de fase I y II han proporcionado evidencia preliminar de que los SARM enobosarm y GSK-2881078 (en hombres mayores y mujeres posmenopáusicas), y OPL-88004 (sobrevivientes de cáncer de próstata con niveles bajos de testosterona) aumentan la masa corporal magra y el tamaño muscular con poco efecto en la próstata, lo que respalda el potencial de los SARM para su uso en la terapia de reemplazo hormonal. [9] Sin embargo, se ha argumentado que los SARM no son ideales para su uso en la terapia de reemplazo de andrógenos y no podrían reemplazar a la testosterona en este contexto, ya que no reproducen el espectro completo de efectos de la testosterona, incluida la potenciación androgénica a través de la 5α-reducción y la aromatización en estrógeno. [20] [21] La señalización estrogénica en particular es esencial para la fisiología y la salud masculinas normales, incluido, por ejemplo, el mantenimiento de la fortaleza ósea. [22] [23]
Mecanismo
El mecanismo de acción de los efectos específicos de los SARM en los tejidos sigue siendo objeto de debate en 2020. [actualizar][ 6] [24] Se han propuesto varias hipótesis, entre ellas la no activación de los SARM por la 5α-reductasa , la expresión selectiva de los correguladores del receptor de andrógenos en los tejidos , la señalización no genómica y la captación selectiva de los SARM en los tejidos. [6] [25]
5α-reductasa
La testosterona es activa en el tejido no reproductivo sin activación. Por el contrario, la activación selectiva del tejido por la 5α-reductasa a la forma más activa DHT es necesaria para una actividad significativa en el tejido reproductivo. El resultado neto es que la testosterona y su metabolito juntos no son selectivos en el tejido. [26] Los SARM no son sustratos de la 5α-reductasa, por lo tanto, no se activan selectivamente como la testosterona en tejidos como la próstata. [10] Esta falta de activación imparte efectivamente un grado de selectividad tisular a los SARM. [27]
Correguladores del receptor de andrógenos
La expresión correguladora de transcripción selectiva de tejido es otro posible contribuyente a la selectividad de los SARM. [28] [25] Al igual que otros receptores nucleares de tipo I , el receptor de andrógenos (AR) no ligado reside en el citosol complejado con proteínas de choque térmico (HSP). Tras la unión del ligando, el AR se libera de las HSP y se transloca al núcleo donde se une a los elementos de respuesta a los andrógenos en el ADN para regular la expresión génica. [29] Los agonistas de AR como la testosterona reclutan proteínas coactivadoras para AR que facilitan la regulación positiva de la expresión génica, mientras que los antagonistas reclutan correpresores que regulan negativamente la expresión génica. Además, se sabe que la proporción de coactivadores a correpresores varía según el tipo de tejido. [28] [19] Estructuralmente, los agonistas de AR puros estabilizan la posición de la hélice-12 (H12) en el dominio de unión al ligando de AR cerca de H3 y H4 para producir una hendidura superficial que se une a un motivo FxxLF contenido en coactivadores. [29] Por el contrario, los antagonistas desestabilizan la conformación agonista de H12 bloqueando la unión del motivo coactivador FXXLF mientras facilitan la unión del motivo correpresor LXX(I/H)IXXX(I/L) encontrado en los correpresores NCOR1 y SMRT . [29]
En analogía con los SERM , los SARM son agonistas/antagonistas mixtos que muestran actividad agonista del receptor de andrógenos en el hueso y el músculo y actividad agonista o antagonista parcial en otros tejidos como la próstata. [25] [7] Los agonistas no selectivos como la testosterona pueden reclutar coactivadores cuando se unen al AR pero no a los correpresores y, por lo tanto, son agonistas en todos los tejidos. Por el contrario, los SARM pueden reclutar tanto coactivadores como correpresores al desestabilizar parcialmente la conformación agonista de H12. En los tejidos donde los coactivadores están en exceso (como en el hueso y el músculo), los SARM actúan como agonistas. Por el contrario, en los tejidos donde los correpresores están en exceso (como la próstata), los SARM actúan como agonistas o antagonistas parciales. [25]
Las pruebas in vitro de los SARM enobosarm (ostarina) y YK-11 mostraron que se unían al AR, pero a diferencia de los agonistas completos del AR, bloqueaban la interacción entre el extremo N y el extremo C del AR, lo que resultó en un modo de acción agonista/antagonista mixto. [6] [25]
Señalización no genómica
Además de la regulación de la expresión génica por el AR nuclear, se sabe que el AR asociado a la membrana tiene efectos no genómicos rápidos en las células a través de cascadas de transducción de señales . Los efectos no genómicos parecen contribuir significativamente a los efectos anabólicos de los andrógenos, mientras que los efectos genómicos son los principales responsables del desarrollo de los órganos sexuales masculinos. Además, cada andrógeno esteroide o SARM no esteroide influye de forma única en vías distintas según el tipo de célula. [25]
Distribución de tejidos
La captación selectiva de tejidos en los tejidos anabólicos presenta otro mecanismo potencial para la selectividad tisular de los SARM. Sin embargo, los estudios de autorradiografía con SARM radiomarcados no muestran una distribución preferencial en los tejidos anabólicos. [10]
Candidatos a fármacos
| Nombre | Clase | Revelador | Investigado por | Se alcanzó la etapa más alta de desarrollo | Estructura |
|---|---|---|---|---|---|
| Andarina (S-4, GTx-007) | Arilpropionamida | GTx, Terapéutica interna [31] | Caquexia [31] | Fase I (interrumpida) [31] |  |
| Arcarina (ORM-11984) [32] | Desconocido [30] | Corporación Orión [32] | Hiperplasia prostática benigna, hipogonadismo, osteoporosis [30] | Fase I (interrumpida) [32] [30] | Estructura no revelada [30] |
| BMS-564,929 (PS-178990) | Pirroloimidazol [30] | Bristol-Myers Squibb , productos farmacéuticos ligandos [33] | Andropausia, caquexia [33] [30] | Fase I (interrumpida) [33] [34] [30] |  [30] [30] |
| DT-200 (GLPG-0492) | Imidazolidina-2,4-diona | ProSkelia, Akashi Therapeutics, Galápagos NV [35] | Distrofia muscular, caquexia [35] | Fase I [30] [35] [36] |  |
| Enobosarm (ostarina, GTx-024, MK-2866, S-22) | Arilpropionamida | GTx , Veru Salud [37] | Cáncer de mama , caquexia , distrofia muscular , incontinencia urinaria de esfuerzo [37] | Fase III [37] [38] |  |
| GSK-971086 | Indol [39] | GlaxoSmithKline [40] | Sarcopenia [40] | Fase I (interrumpida) [40] [41] |  [39] [39] |
| GSK-2849466 | N-arilhidroxialquilo [42] | GlaxoSmithKline [42] | Caquexia, insuficiencia cardíaca [42] | Fase I (interrumpida) [42] [43] |  [42] [42] |
| GSK-2881078 | Indol | GlaxoSmithKline [44] | Caquexia [44] [45] | Fase II [44] [46] |  |
| GTx-027 | Arilpropionamida | GTx [47] [48] | Cáncer de mama, incontinencia urinaria de esfuerzo [47] [48] | Fase I (interrumpida) [47] [48] o preclínica [19] | |
| LGD-2941 (LGD-122941) | Quinolinona | Ligandos farmacéuticos [49] | Caquexia, disfunción sexual, hipogonadismo, menopausia, osteoporosis [49] | Fase I (interrumpida) [49] |  |
| LGD-4033 (VK5211, ligando) | Pirrolidinbenzonitrilo | Ligandos farmacéuticos [50] | Pérdida de masa muscular debido a fractura de cadera , caquexia , hipogonadismo , osteoporosis [24] [50] | Fase II [50] [51] |  |
| LY305 | N-arilhidroxialquilo | Eli Lilly [52] | Osteoporosis [52] | Fase I [52] |  |
| MK-0773 (PF-05314882) | Esteroide | GTx , Merck [53] | Sarcopenia, osteoporosis [30] [53] | Fase II (interrumpida) [30] [53] [54] [55] |  |
| MK-3984 | Bencilpropionamida | Merck | Sarcopenia [30] | Fase I [30] |  |
| OPK-88004 (LY-2452473, TT-701) | Indol | Eli Lilly , OPKO [56] | Hiperplasia prostática benigna , calidad de vida en el cáncer de próstata , disfunción eréctil [56] [57] | Fase II [56] [58] |  |
| PF-06260414 | Isoquinolina | Pfizer [59] [60] | Caquexia [59] | Fase I (interrumpida) [59] |  |
| Vosilasarm (RAD140, EP0062, testolona) | Feniloxadiazol | Puntos suspensivos [61] | Cáncer de mama, osteoporosis, sarcopenia [62] | Fase I/II [62] [63] |  |
| Año escolar 11 | Esteroide | Universidad de Toho | Pérdida de masa muscular [64] | Preclínico |  |
Ciertos esteroides anabólicos, como la trestolona , el undecanoato de dimetandrolona y el dodecilcarbonato de 11β-metil-19-nortestosterona , también se han clasificado a veces como SARM. [30]
Posibles aplicaciones terapéuticas
Debido a su selectividad tisular , los SARM tienen el potencial de tratar una amplia variedad de afecciones, incluidas las enfermedades debilitantes. Se han investigado en estudios humanos para el tratamiento de la osteoporosis , la caquexia , la hiperplasia prostática benigna , la incontinencia urinaria de esfuerzo , el cáncer de próstata y el cáncer de mama y también se han considerado para el tratamiento de la enfermedad de Alzheimer , la distrofia muscular de Duchenne , el hipogonadismo y como anticonceptivo masculino . [19] [7] A partir de 2023 [actualizar], no hay SARM que hayan sido aprobados para uso terapéutico por la Administración de Alimentos y Medicamentos de los Estados Unidos o la Agencia Europea de Medicamentos . [65]
La mayoría de los SARM se han probado in vitro o en roedores, mientras que se han llevado a cabo ensayos clínicos limitados en humanos. [6] [66] La investigación inicial se centró en el desgaste muscular. [25] Enobosarm (ostarina) es el SARM más estudiado; según su fabricante, GTx Incorporated , se han realizado 25 estudios en más de 1.700 humanos a partir de 2020 [actualizar]con dosis de 1 a 18 mg cada día. [67] [24] A partir de 2020 [actualizar], hay poca investigación que distinga diferentes SARM entre sí. [6] Gran parte de la investigación sobre SARM ha sido realizada por corporaciones y no se ha hecho pública. [8]
Hiperplasia prostática benigna
En modelos de rata con hiperplasia prostática benigna (HPB), una afección en la que la próstata se agranda en ausencia de cáncer de próstata , los SARM redujeron el peso de la próstata. [66] OPK-88004 avanzó a un ensayo de fase II en humanos, pero se interrumpió debido a la dificultad para medir el tamaño de la próstata, el objetivo principal del ensayo. [19]
Cáncer
Los SARM pueden ayudar a tratar el cáncer de mama AR y receptor de estrógeno (ER) positivo , que comprenden la mayoría de los cánceres de mama. [7] [68] Los AAS se usaron históricamente con éxito para tratar el cáncer de mama AR positivo, pero se eliminaron gradualmente después del desarrollo de terapias antiestrógenos, debido a los efectos secundarios androgénicos y las preocupaciones sobre la aromatización a estrógeno (que no ocurre con los SARM). [68] [25] Aunque un ensayo sobre el cáncer de mama triple negativo AR positivo (que es ER-) finalizó temprano debido a la falta de eficacia, el enobosarm mostró beneficios en algunos pacientes con cáncer de mama ER+, AR+ en un estudio de fase II. En pacientes con más del 40 por ciento de positividad de AR según lo determinado por inmunohistoquímica , la tasa de beneficio clínico (CBR) fue del 80 por ciento y la tasa de respuesta objetiva (ORR) fue del 48 por ciento, lo que se consideró prometedor dado que los pacientes tenían una enfermedad avanzada y habían sido intensamente tratados previamente. [69] [68] En 2022, la FDA otorgó la designación de vía rápida a enobosarm para el cáncer de mama metastásico AR+, ER+, HER2-. [ 70 ] Otros SARM como vosilasarm han llegado a ensayos clínicos en pacientes con cáncer de mama. [61]
Pérdida de masa ósea y muscular
A partir de 2020 [actualizar], no hay medicamentos aprobados para tratar el desgaste muscular en personas con enfermedades crónicas y, por lo tanto, existe una necesidad insatisfecha de medicamentos anabólicos con pocos efectos secundarios. Un aspecto que obstaculiza la aprobación de medicamentos para tratamientos para la caquexia y la sarcopenia (dos tipos de desgaste muscular) es el desacuerdo sobre qué resultados demostrarían la eficacia de un medicamento. Varios ensayos clínicos han encontrado que los SARM mejoran la masa magra en humanos, pero no está claro si la fuerza y la función física también mejoran. Después de resultados prometedores en un ensayo de fase II, se demostró que un ensayo de fase III de enobosarm aumenta la masa corporal magra , pero no mostró una mejora significativa en la función. A este y a otros medicamentos se les ha denegado la aprobación regulatoria debido a la falta de evidencia de que aumentaran el rendimiento físico; la Administración de Alimentos y Medicamentos no consideró que prevenir el deterioro de la funcionalidad fuera un punto final aceptable . No se sabe cómo interactúan los SARM con la ingesta de proteínas dietéticas y el entrenamiento de resistencia en personas con desgaste muscular. [24] [19]
Los ensayos de fase II de enobosarm para la incontinencia urinaria de esfuerzo —considerados prometedores, dado que el músculo elevador del ano en el suelo pélvico tiene una alta densidad de receptores de andrógenos— no alcanzaron su objetivo final y fueron abandonados. [19] [25]
A diferencia de otros tratamientos para la osteoporosis, que actúan disminuyendo la pérdida ósea, los SARM han demostrado tener potencial para promover el crecimiento del tejido óseo. El LY305 mostró resultados prometedores en un ensayo de fase I en humanos. [19]
Efectos secundarios
A diferencia de los AAS y la terapia de reemplazo de testosterona , que tienen muchos efectos secundarios que han limitado su uso médico, los SARM son bien tolerados y tienen eventos adversos leves e infrecuentes en ensayos controlados aleatorios . [66] A veces se afirma que los SARM no son virilizantes (no masculinizantes). [19] [71] Sin embargo, en realidad, los SARM no están caracterizados clínicamente en gran medida en términos de posibles efectos virilizantes. [6] Además, los SARM no se pueden aromatizar a estrógeno , por lo que no causan efectos secundarios estrogénicos, por ejemplo, ginecomastia . [72] [19] [7]
El uso de SARM puede provocar enzimas hepáticas elevadas y reducción del colesterol HDL . [72] [19] La administración transdérmica a través de un parche cutáneo puede reducir estos efectos. [19] [52] Varios informes de casos han asociado los SARM con lesión hepática inducida por fármacos hepatocelulares cuando se usan de forma recreativa, [73] no se sabe si el riesgo es significativo para el uso médico. [66] [7] Se desconoce si los SARM aumentan el riesgo de eventos cardiovasculares. [66] [7] Los SARM tienen menos efecto en los perfiles de lípidos en sangre que el reemplazo de testosterona; no se sabe si las reducciones de HDL inducidas por andrógenos aumentan el riesgo cardiovascular; y los SARM aumentan la sensibilidad a la insulina y reducen los triglicéridos . [7] [24]
Aunque causan menos supresión del eje hipotálamo-hipofisario-gonadal (eje HPG) que la testosterona, los estudios han encontrado que las gonadotropinas , la testosterona libre y total y la SHBG pueden reducirse de manera dependiente del compuesto y de la dosis en los hombres por el uso de SARM. [6] [24] Normalmente, la SHBG se reduce junto con la testosterona total y el colesterol total , mientras que el hematocrito aumenta. La mayoría de los estudios han encontrado que los niveles de hormona folículo estimulante (FSH), hormona luteinizante (LH), antígeno prostático específico , estradiol y DHT no se alteran. [66] De los SARM que se han investigado, el enobosarm es uno de los menos supresores de las gonadotropinas, incluso en dosis mucho más altas que las utilizadas en los ensayos clínicos. Se desconoce cómo se ve afectado el eje HPG en las mujeres que usan SARM. [6] [24] El efecto de los SARM en la supresión de las gonadotropinas FSH y LH es lo que hace que los SARM sean potencialmente útiles como anticonceptivo masculino. [74]
Uso no médico
Fuera de la investigación farmacéutica, los SARM son una sustancia del mercado gris producida por pequeños laboratorios y a menudo comercializada como una sustancia química de investigación supuestamente no para consumo humano. [6] [75] [76] La comercialización de SARM para consumo humano es ilegal en algunas jurisdicciones y ha dado lugar a condenas penales en los Estados Unidos [77] y la multa más grande jamás impuesta en virtud de la Ley de Productos Terapéuticos de Australia de 1989. [ 78] Aunque los SARM están fácilmente disponibles para su compra en Internet, un estudio encontró que la mayoría de los productos publicitados como SARM en línea estaban mal etiquetados. También se pueden encontrar anécdotas y guías sobre el uso en línea y en las redes sociales . [79] [72] [7] Algunos compuestos se comercializan comúnmente para uso recreativo como SARM a pesar de tener un mecanismo de acción diferente . Estas sustancias incluyen ibutamoren (MK-677), que aumenta la secreción de la hormona del crecimiento ; GW501516 (cardarina), un mimético del ejercicio que funciona como agonista del PPARβ/δ ; y SR9009 (Stenabolic), un agonista del Rev-Erb , que desempeña un papel en el ritmo circadiano . [6] [80]
Los SARM son utilizados por culturistas y atletas competitivos debido a sus efectos anabólicos y la falta de efectos androgénicos, [7] particularmente en los Estados Unidos, Europa y otros países occidentales. [72] Algunas personas que usan SARM de manera recreativa combinan múltiples SARM o toman un SARM junto con otros compuestos, aunque no hay investigaciones sobre la combinación de SARM. Las dosis utilizadas a menudo exceden las de los ensayos clínicos; sin embargo, la masa libre de grasa obtenida de los SARM es generalmente menor que la que se obtiene con dosis moderadas de derivados de testosterona. [6] Según un estudio de usuarios de SARM, más del 90 por ciento estaban satisfechos con su uso y el 64 por ciento tomaría SARM nuevamente a pesar de que la mayoría experimentó efectos adversos. [81]
Los SARM fueron prohibidos por la Agencia Mundial Antidopaje (AMA) en 2008. [6] Los SARM se pueden detectar en la orina y el cabello después del consumo. [82] La AMA informó su primer hallazgo analítico adverso para SARM en 2010 y el número de pruebas positivas ha aumentado desde entonces; los SARM detectados con mayor frecuencia son enobosarm (ostarina) y LGD-4033 (ligandrol). [83] [84] Los atletas que compiten en la NFL , NBA , UFC , NCAA y los Juegos Olímpicos han dado positivo. [73] Hay evidencia limitada sobre cómo los SARM afectan el rendimiento atlético. [85]
Terminología
Los SARM a veces también se denominan "andrógenos no esteroides", [1] [86] aunque no todos los SARM tienen una estructura no esteroidea y también existen SARM esteroides. [30] Los primeros SARM, descubiertos en 1998, no eran esteroides y se denominaron inicialmente andrógenos no esteroides. [87] En 1999, se introdujo el término "modulador selectivo del receptor de andrógenos" o "SARM", ya que la actividad mixta agonista-antagonista y selectiva de tejidos de estos agonistas del receptor de andrógenos no esteroides tenía similitudes con los moduladores selectivos del receptor de estrógeno (SERM). [17] A pesar de su uso generalizado, el término "modulador selectivo del receptor de andrógenos" ha sido criticado por algunos autores, como David Handelsman , que argumentan que es un término de marketing farmacéutico engañoso en lugar de una descripción farmacológica precisa. [20] También ha criticado las nociones de que los SARM aíslan los efectos anabólicos de los efectos androgénicos o virilizantes, como se ha afirmado anteriormente en el caso de los esteroides anabólicos . [20] [88] [89] [90]
Referencias
- ^ ab Tauchen J, Jurášek M, Huml L, Rimpelová S (febrero de 2021). "Uso medicinal de testosterona y esteroides relacionados revisitado". Moléculas . 26 (4): 1032. doi : 10.3390/molecules26041032 . PMC 7919692 . PMID 33672087.
Los SARM son un nuevo grupo de compuestos desarrollados para aumentar selectivamente los efectos anabólicos en los músculos y los huesos, evitando al mismo tiempo los efectos androgénicos indeseables en la piel, la laringe y los órganos reproductivos. La mayoría de estos compuestos carecen de las funcionalidades estructurales de los esteroides anabólicos originales y, a veces, se denominan andrógenos no esteroides. Se esperaba que estos agentes pudieran usarse en casos en los que los esteroides anabólicos convencionales produjeran efectos secundarios indeseables, como virilización en mujeres e hiperplasia de próstata en hombres [67]. A pesar del enorme esfuerzo que se ha invertido en el desarrollo de agentes anabólicos selectivos, el efecto androgénico es muy difícil de eliminar por completo y muchos de los SARM desarrollados actualmente todavía tienen cierta actividad androgénica.
- ^ Koh B (22 de marzo de 2013). «La agencia antidopaje advierte a los tramposos sobre los riesgos para la salud del endurobol». The Conversation . Archivado desde el original el 4 de septiembre de 2023. Consultado el 4 de septiembre de 2023 .
- ^ Mohler ML, Sikdar A, Ponnusamy S, Hwang DJ, He Y, Miller DD, et al. (febrero de 2021). "Una descripción general de las terapias dirigidas al receptor de andrógenos de próxima generación en desarrollo para el tratamiento del cáncer de próstata". Revista internacional de ciencias moleculares . 22 (4): 2124. doi : 10.3390/ijms22042124 . PMC 7924596 . PMID 33672769.
- ^ de Vera IM, Waaninayake US, Burris TP (octubre de 2018). "Información estructural sobre los receptores de estrógeno y las terapias antiestrógenas". En Zhang X (ed.). Receptor de estrógeno y cáncer de mama: celebración del 60.º aniversario del descubrimiento del receptor de estrógeno . Springer International Publishing. ISBN 978-3-319-99350-8.
- ^ Brannigan RE (2021). "Terapia con testosterona y fertilidad masculina". En Mulhall JP, Maggi M, Trost L (eds.). Controversias en la deficiencia de testosterona . Springer International Publishing. págs. 57–70 (57). doi :10.1007/978-3-030-77111-9_6. ISBN 978-3-03-077111-9. Número de identificación del sujeto 237993949.
- ^ abcdefghijklmnop Machek SB, Cardaci TD, Wilburn DT, Willoughby DS (2020). "Consideraciones, posibles contraindicaciones y mecanismos potenciales para el efecto nocivo en el uso recreativo y atlético de moduladores selectivos del receptor de andrógenos (SARM) en lugar de esteroides androgénicos anabólicos: una revisión narrativa". Esteroides . 164 : 108753. doi :10.1016/j.steroids.2020.108753. ISSN 0039-128X. PMID 33148520. S2CID 225049089. Archivado desde el original el 2023-08-30 . Consultado el 2023-08-30 .
Los efectos de los SARM específicos del sexo en los seres humanos también siguen siendo considerablemente nebulosos. Los SARM pueden representar una opción más tentadora para el uso recreativo femenino dadas las posibles tendencias previas hacia los AAS menos androgénicos (es decir, la oxandrolona) [103]. De todos modos, como este último aún impone riesgo de masculinización permanente y hepatotoxicidad, los SARM no están caracterizados en gran medida por sus impactos específicos en las mujeres.
- ^ abcdefghijklm Solomon ZJ, Mirabal JR, Mazur DJ, Kohn TP, Lipshultz LI, Pastuszak AW (2019). "Moduladores selectivos del receptor de andrógenos: conocimiento actual y aplicaciones clínicas". Sexual Medicine Reviews . 7 (1): 84–94. doi :10.1016/j.sxmr.2018.09.006. PMC 6326857 . PMID 30503797.
- ^ abcde Jasuja R, Zacharov MN, Bhasin S (2012). "El estado del arte en el desarrollo de moduladores selectivos del receptor de andrógenos". En Nieschlag E, Behre HM (eds.). Testosterona: acción, deficiencia, sustitución (4.ª ed.). Cambridge University Press. págs. 459–460. doi :10.1017/CBO9781139003353.022. ISBN 978-1-107-01290-5.
- ^ abcd Bhasin S, Krishnan V, Storer TW, Steiner M, Dobs AS (2023). "Andrógenos y moduladores selectivos del receptor de andrógenos para tratar las limitaciones funcionales asociadas con el envejecimiento y las enfermedades crónicas". The Journals of Gerontology: Serie A . 78 (Suplemento_1): 25–31. doi :10.1093/gerona/glad027. PMC 10272983 . PMID 37325955. Archivado desde el original el 1 de septiembre de 2023 . Consultado el 1 de septiembre de 2023 .
- ^ abcd Bhasin S, Jasuja R (2009). "Moduladores selectivos del receptor de andrógenos (SARM) como terapias que promueven la función". Current Opinion in Clinical Nutrition and Metabolic Care . 12 (3): 232–240. doi :10.1097/MCO.0b013e32832a3d79. ISSN 1363-1950. PMC 2907129 . PMID 19357508.
- ^ Thevis M, Schänzer W (2010). "Agentes anabólicos sintéticos: esteroides y moduladores selectivos del receptor de andrógenos no esteroides". Dopaje en el deporte . Manual de farmacología experimental. Vol. 195. págs. 99-126. doi :10.1007/978-3-540-79088-4_5. ISBN 978-3-540-79087-7. PMID 20020362.
Uno de los primeros análogos sintéticos de la testosterona preparado por el premio Nobel Ruzicka fue la 17α-metiltestosterona (Ruzicka et al. 1935).
- ^ Katzung BG (2017). Farmacología básica y clínica (14.ª ed.). McGraw Hill Professional. pág. 741. ISBN 978-1-259-64116-9.
- ^ abcd Temerdashev AZ, Dmitrieva EV (2020). "Métodos para la determinación de moduladores selectivos del receptor de andrógenos". Revista de química analítica . 75 (7): 835–850. doi :10.1134/S1061934820070187. S2CID 220398030.
- ^ Quirke VM (2017). "El tamoxifeno, de píldora anticonceptiva fallida a medicamento superventas contra el cáncer de mama: un estudio de caso sobre innovación farmacéutica". Frontiers in Pharmacology . 8 : 620. doi : 10.3389/fphar.2017.00620 . PMC 5600945 . PMID 28955226.
- ^ Jordan VC (noviembre de 2021). "Convertir la serendipia científica en descubrimientos en la investigación y el tratamiento del cáncer de mama: una historia de estudiantes de doctorado y un equipo de tamoxifeno itinerante durante 50 años". Investigación y tratamiento del cáncer de mama . 190 (1): 19–38. doi :10.1007/s10549-021-06356-8. PMC 8557169 . PMID 34398352.
- ^ Komm BS, Cheskis B, Bodine PV (noviembre de 2007). "Regulación de la función de las células óseas por los estrógenos". En Marcus R (ed.). Osteoporosis . Elsevier Science. págs. 383–412 (409). ISBN 978-0-08-055347-4Archivado desde el original el 8 de marzo de 2024. Consultado el 4 de febrero de 2024 .
- ^ ab Negro-Vilar A (octubre de 1999). "Moduladores selectivos del receptor de andrógenos (SARM): un nuevo enfoque para la terapia con andrógenos para el nuevo milenio". The Journal of Clinical Endocrinology and Metabolism . 84 (10): 3459–3462. doi :10.1210/jcem.84.10.6122. PMID 10522980.
Hemos elegido el término moduladores selectivos del receptor de andrógenos (SARM) después de la terminología que se utiliza actualmente para moléculas similares dirigidas al receptor de estrógeno. ... Perfil deseado de actividad de los nuevos SARM: aplicaciones masculinas: Las indicaciones seleccionadas pueden incluir osteoporosis inducida por glucocorticoides, reemplazo de andrógenos en hombres de edad avanzada, emaciación por VIH, caquexia por cáncer, ciertas anemias, distrofias musculares y anticoncepción masculina.
- ^ Zaveri NT, Murphy BJ (2007). "Receptores de hormonas nucleares". En Taylor JB, Triggle DJ (eds.). Química medicinal integral II . Elsevier. págs. 993–1036. doi :10.1016/B0-08-045044-X/00063-8. ISBN . 9780080450445
Un SARM para el tratamiento del hipogonadismo o la osteoporosis sería un agonista de AR en el músculo y el hueso, con efectos agonistas hipertróficos mínimos en la próstata
. - ^ abcdefghijkl Christiansen AR, Lipshultz LI, Hotaling JM, Pastuszak AW (marzo de 2020). "Moduladores selectivos del receptor de andrógenos: ¿el futuro de la terapia con andrógenos?". Andrología y Urología Traslacional . 9 (Supl. 2): S135–S148. doi : 10.21037/tau.2019.11.02 . ISSN 2223-4683. PMC 7108998. PMID 32257854 .
- ^ abc Handelsman DJ (julio de 2022). "Historia de los andrógenos y la acción de los andrógenos". Mejores prácticas e investigación. Endocrinología clínica y metabolismo . 36 (4): 101629. doi : 10.1016/j.beem.2022.101629. PMID 35277356.
La siguiente invención fue la del primer andrógeno no esteroide por Dalton et al. [111] en 1998, seis décadas después del primer estrógeno no esteroide [112]. Esto crea una nueva clase de andrógeno sintético no esteroide, a menudo denominado moduladores específicos del receptor de andrógenos (SARM), un término de marketing engañoso en lugar de una descripción farmacológica precisa [113,114], usurpando una analogía especulativa pero poco sólida con los moduladores específicos del receptor de estrógeno (SERM). [...] ninguno de los andrógenos no esteroides en desarrollo [116,117] se comercializará en 2021. Sin embargo, la esperanza es eterna para este nuevo intento de separar las propiedades anabólicas de las androgénicas de los andrógenos para facilitar la comercialización del desgaste muscular y otros efectos selectivos de la testosterona.
- ^ Feingold KR, Anawalt B, Blackman MR, Boyce A, Chrousos G, Corpas E, et al. (5 de octubre de 2020). "Fisiología, farmacología, uso y mal uso de los andrógenos". Endotext . PMID 25905231.
Estas características sugieren que los andrógenos no esteroides tienen potencial para el desarrollo en regímenes de terapia farmacológica con andrógenos como agonistas de andrógenos mixtos o parciales selectivos de tejidos ("moduladores selectivos del receptor de andrógenos", SARM) (419, 718). Por el contrario, no son ideales para la terapia de reemplazo de andrógenos donde se requiere idealmente el espectro completo de efectos de la testosterona, incluida la aromatización, especialmente para tejidos como el cerebro (148, 159) y el hueso (153) donde la aromatización es una característica destacada de la acción de la testosterona.
- ^ Russell N, Grossmann M (julio de 2019). "Mecanismos en endocrinología: el estradiol como hormona masculina". Eur J Endocrinol . 181 (1): R23–R43. doi :10.1530/EJE-18-1000. PMID 31096185.
- ^ Cooke PS, Nanjappa MK, Ko C, Prins GS, Hess RA (julio de 2017). "Estrógenos en la fisiología masculina". Physiol Rev. 97 ( 3): 995–1043. doi :10.1152/physrev.00018.2016. PMC 6151497. PMID 28539434 .
- ^ abcdefg Fonseca GW, Dworatzek E, Ebner N, Von Haehling S (2020). "Moduladores selectivos del receptor de andrógenos (SARM) como tratamiento farmacológico para el desgaste muscular en ensayos clínicos en curso". Opinión de expertos sobre fármacos en investigación . 29 (8): 881–891. doi :10.1080/13543784.2020.1777275. PMID 32476495. S2CID 219174372.
- ^ abcdefghi Narayanan R, Coss CC, Dalton JT (abril de 2018). "Desarrollo de moduladores selectivos del receptor de andrógenos (SARM)". Endocrinología molecular y celular . 465 : 134–142. doi :10.1016/j.mce.2017.06.013. PMC 5896569. PMID 28624515 .
- ^ Kicman AT (junio de 2008). "Farmacología de los esteroides anabólicos". British Journal of Pharmacology . 154 (3): 502–521. doi :10.1038/bjp.2008.165. PMC 2439524 . PMID 18500378.
- ^ Gao W, Dalton JT (febrero de 2007). "La navaja de Ockham y los moduladores selectivos del receptor de andrógenos (SARM): ¿estamos pasando por alto el papel de la 5α-reductasa?". Molecular Interventions . 7 (1): 10–3. doi :10.1124/mi.7.1.3. PMC 2040232 . PMID 17339601.
- ^ ab Smith CL, O'Malley BW (febrero de 2004). "Función correguladora: una clave para comprender la especificidad tisular de los moduladores selectivos de receptores". Endocrine Reviews . 25 (1): 45–71. doi : 10.1210/er.2003-0023 . PMID 14769827.
- ^ abc Tan MH, Li J, Xu HE, Melcher K, Yong EL (enero de 2015). "Receptor de andrógenos: estructura, función en el cáncer de próstata y descubrimiento de fármacos". Acta Pharmacologica Sinica . 36 (1): 3–23. doi :10.1038/aps.2014.18. PMC 4571323 . PMID 24909511.
- ^ abcdefghijklmnop Xie Y, Tian Y, Zhang Y, Zhang Z, Chen R, Li M, et al. (febrero de 2022). "Descripción general del desarrollo de moduladores selectivos del receptor de andrógenos (SARM) como tratamiento farmacológico para la osteoporosis (1998-2021)". Eur J Med Chem . 230 : 114119. doi : 10.1016/j.ejmech.2022.114119. PMID 35063736. S2CID 245941791.
- ^ abc "Andarine". AdisInsight . Springer Nature Switzerland AG. Archivado desde el original el 2024-01-03 . Consultado el 2024-01-03 .
- ^ abc "Arcarine". Synapse . PatSnap. Archivado desde el original el 14 de enero de 2024 . Consultado el 14 de enero de 2024 .
- ^ abc "PS 178990". AdisInsight . Springer Nature Switzerland AG. Archivado desde el original el 14 de enero de 2024 . Consultado el 14 de enero de 2024 .
- ^ "PS-178990". Sinapsis . PatSnap. Archivado desde el original el 14 de enero de 2024 . Consultado el 14 de enero de 2024 .
- ^ abc "DT 200". AdisInsight . Springer Nature Switzerland AG. Archivado desde el original el 2024-01-03 . Consultado el 2024-01-14 .
- ^ "Resultados de la búsqueda de intervención/tratamiento GLPG0492". ClinicalTrials.gov . Biblioteca Nacional de Medicina de EE. UU. Archivado desde el original el 8 de febrero de 2024 . Consultado el 8 de febrero de 2024 .
- ^ abc "Enobosarm - Veru Healthcare". AdisInsight . Springer Nature Switzerland AG. Archivado desde el original el 2023-04-05 . Consultado el 2024-01-14 .
- ^ "Resultados de la búsqueda de tratamiento/intervención con enobosarm". ClinicalTrials.gov . Biblioteca Nacional de Medicina de EE. UU. Archivado desde el original el 8 de marzo de 2024 . Consultado el 11 de febrero de 2024 .
- ^ ab "GSK-971086". Inxight Drugs . Centro Nacional para el Avance de las Ciencias Traslacionales (NCATS), Institutos Nacionales de Salud de EE. UU.
- ^ abc "GSK 971086". AdisInsight . Springer Nature Switzerland AG. Archivado desde el original el 14 de enero de 2024 . Consultado el 14 de enero de 2024 .
- ^ "Resultados de la búsqueda de intervención/tratamiento GSK971086". ClinicalTrials.gov . Biblioteca Nacional de Medicina de EE. UU. Archivado desde el original el 8 de marzo de 2024 . Consultado el 11 de febrero de 2024 .
- ^ abcde "GSK 2849466". AdisInsight . Springer Nature Switzerland AG. Archivado desde el original el 14 de enero de 2024 . Consultado el 14 de enero de 2024 .
- ^ "Resultados de la búsqueda de intervención/tratamiento GSK2849466". ClinicalTrials.gov . Biblioteca Nacional de Medicina de EE. UU. Archivado desde el original el 8 de marzo de 2024 . Consultado el 11 de febrero de 2024 .
- ^ abc "GSK 2881078". AdisInsight . Springer Nature Switzerland AG. Archivado desde el original el 2024-01-03 . Consultado el 2024-01-14 .
- ^ Mohan D, Rossiter H, Watz H, Fogarty C, Evans RA, Man W, et al. (1 de marzo de 2023). "Modulación selectiva del receptor de andrógenos para la debilidad muscular en la enfermedad pulmonar obstructiva crónica: un ensayo controlado aleatorizado". Thorax . 78 (3): 258–266. doi :10.1136/thorax-2021-218360. ISSN 0040-6376. PMC 9985744 . PMID 36283827. Archivado desde el original el 2 de septiembre de 2023 . Consultado el 11 de septiembre de 2023 .
- ^ "Resultados de la búsqueda de intervención/tratamiento GSK2881078". ClinicalTrials.gov . Biblioteca Nacional de Medicina de EE. UU. Archivado desde el original el 8 de marzo de 2024 . Consultado el 11 de febrero de 2024 .
- ^ abc "Profundizando en las últimas actualizaciones de GTx-027 con Synapse". Synapse . 13 de octubre de 2024 . Consultado el 22 de octubre de 2024 .
- ^ abc «Programa de investigación: moduladores selectivos del receptor de andrógenos». AdisInsight . 16 de abril de 2020 . Consultado el 22 de octubre de 2024 .
- ^ abc "LGD 2941". AdisInsight . Springer Nature Switzerland AG. Archivado desde el original el 14 de enero de 2024 . Consultado el 14 de enero de 2024 .
- ^ abc "VK 5211". AdisInsight . Springer Nature Switzerland AG. Archivado desde el original el 3 de enero de 2024 . Consultado el 7 de enero de 2024 .
- ^ "Resultados de la búsqueda de intervención/tratamiento VK5211". ClinicalTrials.gov . Biblioteca Nacional de Medicina de EE. UU. Archivado desde el original el 8 de marzo de 2024 . Consultado el 11 de febrero de 2024 .
- ^ abcd Krishnan V, Patel NJ, Mackrell JG, Sweetana SA, Bullock H, Ma YL, et al. (2018). "Desarrollo de un modulador selectivo del receptor de andrógenos para uso transdérmico en pacientes hipogonadales". Andrología . 6 (3): 455–464. doi : 10.1111/andr.12479 . PMID 29527831. S2CID 3858281.
- ^ abc "MK 0773". AdisInsight . Springer Nature Switzerland AG. Archivado desde el original el 9 de julio de 2023 . Consultado el 14 de enero de 2024 .
- ^ Papanicolaou DA, Ather SN, Zhu H, Zhou Y, Lutkiewicz J, Scott BB, et al. (2013). "Un ensayo clínico aleatorizado, controlado con placebo de fase IIA para estudiar la eficacia y seguridad del modulador selectivo del receptor de andrógenos (SARM), MK-0773 en participantes femeninas con sarcopenia". J Nutr Health Aging . 17 (6): 533–43. doi : 10.1007/s12603-013-0335-x . PMID 23732550. S2CID 42439768.
- ^ "Resultados de la búsqueda de intervención/tratamiento MK0773". ClinicalTrials.gov . Biblioteca Nacional de Medicina de EE. UU. Archivado desde el original el 8 de febrero de 2024 . Consultado el 8 de febrero de 2024 .
- ^ abc "OPK 88004". AdisInsight . Springer Nature Switzerland AG. Archivado desde el original el 2024-01-03 . Consultado el 2024-01-14 .
- ^ Pencina KM, Burnett AL, Storer TW, Guo W, Li Z, Kibel AS, et al. (2021). "Un modulador selectivo del receptor de andrógenos (OPK-88004) en sobrevivientes de cáncer de próstata: un ensayo aleatorizado". Revista de endocrinología clínica y metabolismo . 106 (8): 2171–2186. doi :10.1210/clinem/dgab361. PMC 8277210 . PMID 34019661.
- ^ "Resultados de la búsqueda de intervenciones y tratamientos OPK-88004". ClinicalTrials.gov . Biblioteca Nacional de Medicina de EE. UU. Archivado desde el original el 8 de marzo de 2024 . Consultado el 11 de febrero de 2024 .
- ^ abc "PF 626414". AdisInsight . Springer Nature Switzerland AG. Archivado desde el original el 14 de enero de 2024 . Consultado el 14 de enero de 2024 .
- ^ "Resultados de la búsqueda de intervención/tratamiento PF-06260414". ClinicalTrials.gov . Biblioteca Nacional de Medicina de EE. UU.
- ^ ab Lim E, Hamilton E, Palmieri C, Arkenau HT, Brook S, Fisher G, et al. (1 de marzo de 2023). "Resumen OT1-02-02: Un estudio de fase 1/2 para evaluar la seguridad y eficacia de EP0062, un modulador selectivo del receptor de andrógenos (SARM) oral, para el tratamiento del cáncer de mama avanzado AR+/HER2-/ER+". Cancer Research . 83 (5_Suplemento): OT1–02–02-OT1-02-02. doi :10.1158/1538-7445.SABCS22-OT1-02-02. S2CID 257320030.
- ^ ab "Vosilasarm - Ellipses Pharma". AdisInsight . Springer Nature Switzerland AG. Archivado desde el original el 2024-01-03 . Consultado el 2024-01-12 .
- ^ "Resultados de la búsqueda de tratamiento/intervención RAD140". ClinicalTrials.gov . Biblioteca Nacional de Medicina de EE. UU.
- ^ Lee SJ, Gharbi A, Shin JE, Jung ID, Park YM (2021). "El inhibidor de miostatina YK11 como suplemento preventivo para la salud en caso de sepsis bacteriana". Comunicaciones de investigación bioquímica y biofísica . 543 : 1–7. doi : 10.1016/j.bbrc.2021.01.030 . ISSN 0006-291X. PMID 33588136. S2CID 231938058.
- ^ Leciejewska N, Jędrejko K, Gómez-Renaud VM, Manríquez-Núñez J, Muszyńska B, Pokrywka A (febrero de 2024). "Uso de moduladores selectivos del receptor de andrógenos y eventos adversos relacionados, incluida la lesión hepática inducida por fármacos: análisis de casos sospechosos". Revista Europea de Farmacología Clínica . 80 (2): 185–202. doi :10.1007/s00228-023-03592-3. PMC 10847181 . PMID 38059982.
- ^ abcdef Sigalos JT, Walker DT, Lipschultz LI (2023). "Moduladores selectivos del receptor de andrógenos en el tratamiento del hipogonadismo y la salud masculina". Salud sexual y reproductiva masculina a lo largo de la vida: un enfoque integrado de la fertilidad, la función sexual y la vitalidad . Cambridge University Press. pág. 266. doi :10.1017/9781009197533.034. ISBN . 978-1-009-19755-7.
- ^ Zajac JD, Seeman E, Russell N, Ramchand SK, Bretherton I, Grossmann M, et al. (2020). "Testosterona". Enciclopedia de biología ósea . Academic Press. pág. 545. ISBN 978-0-12-814082-6.
- ^ abc Dai C, Ellisen LW (2023). "Revisitando la señalización del receptor de andrógenos en el cáncer de mama". The Oncologist . 28 (5): 383–391. doi :10.1093/oncolo/oyad049. PMC 10166165 . PMID 36972361. Archivado desde el original el 2023-10-12 . Consultado el 2023-09-10 .
- ^ Palmieri C, Linden HM, Birrell S, Lim E, Schwartzberg LS, Rugo HS, et al. (2021). "La eficacia de enobosarm, un agente selectivo dirigido al receptor de andrógenos (AR), se correlaciona con el grado de positividad de AR en el cáncer de mama avanzado AR+/receptor de estrógeno (ER)+ en un estudio clínico internacional de fase 2". Journal of Clinical Oncology . 39 (15_suppl): 1020. doi :10.1200/JCO.2021.39.15_suppl.1020. ISSN 0732-183X. S2CID 236407030. Archivado desde el original el 2023-10-12 . Consultado el 2023-09-10 .
- ^ "La FDA otorga la designación de vía rápida a Enobosarm en el cáncer de mama metastásico AR+, ER+ y HER2-". Cancer Network . 10 de enero de 2022. Archivado desde el original el 27 de agosto de 2023 . Consultado el 27 de agosto de 2023 .
- ^ Zhang X, Sui Z (febrero de 2013). "Descifrando el paradigma de los moduladores selectivos del receptor de andrógenos". Expert Opin Drug Discov . 8 (2): 191–218. doi :10.1517/17460441.2013.741582. PMID 23231475. S2CID 2584722.
- ^ abcd Xie Y, Tian Y, Zhang Y, Zhang Z, Chen R, Li M, et al. (15 de febrero de 2022). "Descripción general del desarrollo de moduladores selectivos del receptor de andrógenos (SARM) como tratamiento farmacológico para la osteoporosis (1998-2021)". Revista Europea de Química Medicinal . 230 : 114119. doi :10.1016/j.ejmech.2022.114119. ISSN 0223-5234. PMID 35063736. S2CID 245941791.
- ^ ab Hahamyan H, Gould H, Gregory A, Dodson C, Gausden E, Voos J, et al. (2023). "Póster 390: Revisión sistemática del abuso de SARM en atletas". Revista ortopédica de medicina deportiva . 11 (7_suppl3): 2325967123S00352. doi : 10.1177/2325967123S00352 . ISSN 2325-9671. PMC 10392554. S2CID 260375399 .
- ^ Bhasin S (2015). "Moduladores selectivos del receptor de andrógenos como terapias que promueven la función". Revista de fragilidad y envejecimiento . 4 (3): 121–122. doi :10.14283/jfa.2015.65. ISSN 2260-1341. PMC 6039107 . PMID 27030938.
- ^ Sobolevsky T, Ahrens B (2021). "Ensayo de espectrometría de masas en tándem con cromatografía líquida de alto rendimiento como procedimiento de prueba inicial para el análisis de la fracción urinaria total". Drug Testing and Analysis . 13 (2): 283–298. doi :10.1002/dta.2917. ISSN 1942-7603. PMID 32852861. S2CID 221347916. Archivado desde el original el 2023-09-01 . Consultado el 2023-09-01 .
- ^ Turnock DL, Gibbs DN (2023). "Clic, clic, compra: El mercado de nuevas hormonas peptídicas sintéticas en las principales plataformas de comercio electrónico del Reino Unido". Mejora del rendimiento y salud . 11 (2): 100251. doi : 10.1016/j.peh.2023.100251 . ISSN 2211-2669. S2CID 257706930.
- ^ Oberheiden N (26 de junio de 2023). "La FDA sigue tomando medidas enérgicas contra la fabricación y distribución de SARM". Abogado federal . Archivado desde el original el 4 de noviembre de 2023. Consultado el 13 de octubre de 2023 .
- ^ Jacobson HL, Zhang A, Forrai Z (3 de agosto de 2021). "No eliminar publicidad ilegal conlleva una multa de 12 millones de dólares". Lexology . Archivado desde el original el 4 de noviembre de 2023 . Consultado el 13 de octubre de 2023 .
- ^ Hahamyan HA, Vasireddi N, Voos JE, Calcei JG (2023). "El impacto de las redes sociales en el abuso generalizado de SARM". El médico y la medicina deportiva . 51 (4): 291–293. doi : 10.1080/00913847.2022.2078679 . ISSN 0091-3847. PMID 35574698. S2CID 248812455.
- ^ Handschin C (2016). "Restricción calórica y miméticos del ejercicio: ¿listos para el momento cumbre?". Investigación farmacológica . 103 : 158–166. doi :10.1016/j.phrs.2015.11.009. PMC 4970791. PMID 26658171 .
- ^ Efimenko IV, Valancy D, Dubin JM, Ramasamy R (2022). "Efectos adversos y posibles beneficios entre los usuarios de moduladores selectivos del receptor de andrógenos: una encuesta transversal". Revista internacional de investigación sobre la impotencia . 34 (8): 757–761. doi :10.1038/s41443-021-00465-0. ISSN 1476-5489. PMID 34471228. S2CID 237378326.
- ^ Kintz P, Ameline A, Gheddar L, Raul JS (2019). "LGD-4033, S-4 y MK-2866: pruebas de SARM en el cabello: acerca de dos casos de dopaje". Toxicologie Analytique et Clinique . 31 (1): 56–63. Código Bibliográfico : 2019ToxAC..31...56K. doi : 10.1016/j.toxac.2018.12.001. ISSN 2352-0078. Archivado desde el original el 2023-08-30 . Consultado el 2023-08-30 .
- ^ "Moduladores selectivos de andrógenos (SARM)". Institut für Biochemie, Deutsche Sporthochschule Köln (en alemán). Archivado desde el original el 1 de septiembre de 2023 . Consultado el 1 de septiembre de 2023 .
- ^ Kintz P (5 de enero de 2022). "La respuesta forense después de un hallazgo analítico adverso (dopaje) que involucra un modulador selectivo del receptor de andrógenos (SARM) en un atleta humano". Revista de análisis farmacéutico y biomédico . 207 : 114433. doi : 10.1016/j.jpba.2021.114433 . ISSN 1873-264X. PMID 34715583. S2CID 240229684.
- ^ Warrier AA, Azua EN, Kasson LB, Allahabadi S, Khan ZA, Mameri ES, et al. (2023). "Fármacos que mejoran el rendimiento en deportistas sanos: una revisión general de revisiones sistemáticas y metanálisis". Salud deportiva: un enfoque multidisciplinario . 16 (5): 695–705. doi :10.1177/19417381231197389. ISSN 1941-7381. PMC 11346223. PMID 37688400. S2CID 261620672. Archivado desde el original el 2023-11-04 . Consultado el 2023-10-12 .
- ^ Brown TR (diciembre de 2004). "Moduladores selectivos de los receptores de andrógenos no esteroides (SARM): los andrógenos de diseño con estructuras flexibles ofrecen una promesa clínica". Endocrinology . 145 (12): 5417–9. doi :10.1210/en.2004-1207. PMID 15545403.
- ^ Dalton JT, Mukherjee A, Zhu Z, Kirkovsky L, Miller DD (marzo de 1998). "Descubrimiento de los andrógenos no esteroideos". Biochem Biophys Res Commun . 244 (1): 1–4. doi :10.1006/bbrc.1998.8209. PMID 9514878.
- ^ Handelsman DJ (mayo de 2011). "Comentario: andrógenos y "esteroides anabólicos": el Janus de una cabeza". Endocrinología . 152 (5): 1752–4. doi :10.1210/en.2010-1501. PMID 21511988.
Aunque el desarrollo de los primeros andrógenos no esteroides (17, 18) como candidatos a moduladores selectivos del AR (19) genera esperanzas de resucitar este término obsoleto (20), los mecanismos de activación de prerreceptores no se pueden aplicar a los andrógenos no esteroides, y el AR singular carece de un mecanismo de accionamiento dual de los otros receptores de esteroides sexuales emparejados. En consecuencia, no es sorprendente que el conocimiento disponible (21) proporcione solo una pequeña esperanza de que esta dicotomía fallida, y probablemente falsa, ahora tenga éxito a través de una búsqueda renovada guiada por el mismo bioensayo in vivo.
- ^ Handelsman DJ (julio de 2021). "Uso indebido y abuso de andrógenos". Endocr Rev. 42 ( 4): 457–501. doi :10.1210/endrev/bnab001. PMID 33484556.
Sin embargo, una tercera gran búsqueda, para el desarrollo de un andrógeno no virilizante ("esteroide anabólico") adecuado para su uso en mujeres y niños, basada en disociar los efectos virilizantes de los anabólicos de los andrógenos, fracasó estrepitosamente (36). Ahora se entiende que este fracaso se debe al descubrimiento de un receptor de andrógenos (AR) singular junto con la interpretación errónea de bioensayos de andrógenos inespecíficos en animales completos empleados para distinguir entre efectos anabólicos y virilizantes (37). El término "andrógeno" se utiliza aquí tanto para los andrógenos endógenos como para los sintéticos, incluidas las referencias a sustancias químicas denominadas en otros lugares como "esteroides anabólicos", "esteroides anabólico-androgénicos" o "moduladores específicos de AR" (SARM), que siguen haciendo una distinción obsoleta y oxímoron entre los efectos virilizantes y anabólicos de los andrógenos cuando no hay diferencia (36).
- ^ Handelsman DJ (26 de julio de 2012). "Terapia con andrógenos en enfermedades no gonadales". Testosterona . Cambridge University Press. págs. 372–407. doi :10.1017/cbo9781139003353.018. ISBN . 978-1-139-00335-3El desarrollo de andrógenos no esteroides
, comercializados como "moduladores selectivos del receptor de andrógenos" (SARM), ofrece nuevas posibilidades para la terapia farmacológica adyuvante con andrógenos. A diferencia del espectro completo de efectos andrógenos de la testosterona, estos SARM serían andrógenos puros no sujetos a activación tisular específica por aromatización a un estrógeno correspondiente o a la amplificación de la potencia androgénica por reducción 5α. En este contexto, los andrógenos puros endógenos nandrolona y DHT pueden considerarse prototipos de SARM. Los SARM no son la encarnación moderna de los llamados "esteroides anabólicos", un término obsoleto que se refiere a andrógenos no virilizantes hipotéticos pero inexistentes dirigidos exclusivamente al músculo, un concepto fallido que carece de prueba biológica de principio (Handelsman 2011).
