Trestolona
 | |
| Datos clínicos | |
|---|---|
| Otros nombres | MENT; MENTR; RU-27333; 7α-Metilnandrolona; 7α-Metil-19-nortestosterona; 7α-Metilestr-4-en-17β-ol-3-ona |
| Vías de administración | Implante subcutáneo , inyección intramuscular (como acetato de trestolona ) |
| Clase de droga | Andrógeno ; Esteroides anabólicos ; Progestágeno ; Antigonadotropina |
| Código ATC |
|
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Banco de medicamentos | |
| Araña química | |
| UNIVERSIDAD |
|
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.184.887 |
| Datos químicos y físicos | |
| Fórmula | C19H28O2 |
| Masa molar | 288,431 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
| (verificar) | |
La trestolona , también conocida como 7α-metil-19-nortestosterona ( MENT ), es un esteroide anabólico / andrógeno (AAS) y progestágeno experimental que ha estado en desarrollo para su posible uso como una forma de control de la natalidad hormonal para hombres y en la terapia de reemplazo de andrógenos para niveles bajos de testosterona en hombres, pero nunca se ha comercializado para uso médico. [1] [2] [3] [4] [5] Se administra como un implante que se coloca en la grasa . [3] Como acetato de trestolona , un éster androgénico y profármaco de la trestolona, el medicamento también se puede administrar mediante inyección en el músculo . [1] [5]
Efectos secundarios La trestolona es un AAS y, por lo tanto, es un agonista del receptor de andrógenos , el objetivo biológico de los andrógenos como la testosterona . [3] [6] También es una progestina , o un progestágeno sintético , y por lo tanto es un agonista del receptor de progesterona , el objetivo biológico de los progestágenos como la progesterona . [3] [6] Debido a su actividad androgénica y progestágena, la trestolona tiene efectos antigonadotrópicos . [3] [6] Estos efectos dan como resultado una supresión reversible de la producción de esperma y son responsables de los efectos anticonceptivos de la trestolona en los hombres. [3]
La trestolona se describió por primera vez en 1963. [7] Posteriormente, no se volvió a estudiar hasta 1990. [8] El desarrollo de la trestolona para un posible uso clínico comenzó en 1993 y continuó a partir de entonces. [4] [9] No parece que se haya llevado a cabo ningún desarrollo adicional desde 2013. [3] El medicamento fue desarrollado por el Population Council , una organización no gubernamental sin fines de lucro dedicada a la salud reproductiva . [3] [10]
Usos médicos
La trestolona es un medicamento experimental y actualmente no está aprobado para uso médico. [2] [3] Se ha estado desarrollando para su posible uso como anticonceptivo hormonal masculino y en la terapia de reemplazo de andrógenos para niveles bajos de testosterona . [2] [3] [4] [9] [5] El medicamento ha sido estudiado y desarrollado para su uso como implante subcutáneo . [3] También se ha desarrollado un éster androgénico y profármaco de trestolona, el acetato de trestolona , para su uso mediante inyección intramuscular . [1] [5]
Efectos secundarios
La trestolona puede causar disfunción sexual (p. ej., disminución del deseo sexual , reducción de la función eréctil ) y disminución de la densidad mineral ósea debido a la deficiencia de estrógeno . [5] [3] [11]
Farmacología
Farmacodinamia
Como un AAS, la trestolona es un agonista del receptor de andrógenos (AR), de manera similar a los andrógenos como la testosterona y la dihidrotestosterona (DHT). [4] [3] La trestolona no es un sustrato para la 5α-reductasa y, por lo tanto, no se potencia ni se inactiva en los llamados tejidos "androgénicos" como la piel , los folículos pilosos y la glándula prostática . [12] Como tal, tiene una alta proporción de actividad anabólica a androgénica , de manera similar a otros derivados de la nandrolona. [4] [3] La trestolona es un sustrato para la aromatasa y, por lo tanto, produce el estrógeno 7α-metilestradiol como metabolito . [6] [13] Sin embargo, la trestolona solo tiene una actividad estrogénica débil y una cantidad que parecería ser insuficiente para fines de reemplazo, como lo demuestra la disminución de la densidad mineral ósea en hombres tratados con ella para el hipogonadismo. [5] [3] La trestolona también tiene una potente actividad progestágena . [6] [3] Se cree que tanto la actividad androgénica como la progestágena de la trestolona están implicadas en su actividad antigonadotrópica . [6] [3]
| Compuesto | Relaciones públicasInformación sobre herramientas Receptor de progesterona | ArkansasReceptor de andrógenos | ESReceptor de estrógeno | GRAMOInformación sobre herramientas Receptor de glucocorticoides | SEÑORInformación sobre herramientas Receptor de mineralocorticoides | SHBGInformación sobre herramientas Globulina transportadora de hormonas sexuales | CBGGlobulina transportadora de corticosteroides | |
|---|---|---|---|---|---|---|---|---|
| Nandrolona | 20 | 154–155 | <0,1 | 0,5 | 1.6 | 1 | ? | |
| Trestolona | 50–75 | 100–125 | ? | <1 | ? | ? | ? | |
| 7α-Metilestradiol | 1–3 | 15–25 | 101 | <1 | <1 | ? | ? | |
| Los valores son porcentajes (%). Los ligandos de referencia (100%) fueron progesterona para el PR.Información sobre herramientas sobre el receptor de progesterona, testosterona para la ARReceptor de andrógenos con información sobre herramientas, E2 para urgenciasReceptor de estrógeno con información sobre herramientas, DEXAInformación sobre herramientas sobre dexametasonaPara el GRReceptor de glucocorticoides con información sobre herramientas, aldosterona para el MRInformación sobre herramientas sobre el receptor de mineralocorticoides, DHTInformación sobre herramientas sobre dihidrotestosteronaPara SHBGInformación sobre herramientas sobre la globulina transportadora de hormonas sexuales, y cortisol para CBGGlobulina transportadora de corticosteroides. | ||||||||
Mecanismo de acción
Los espermatozoides se producen en los testículos de los hombres en un proceso llamado espermatogénesis . Para que un hombre sea infértil, un método anticonceptivo masculino basado en hormonas debe detener la espermatogénesis interrumpiendo la liberación de gonadotropinas de la glándula pituitaria . Incluso en bajas concentraciones, la trestolona es un potente inhibidor de la liberación de gonadotropinas, hormona luteinizante (LH) y hormona folículo estimulante (FSH). [4] [3] Para que se produzca la espermatogénesis en los testículos, deben estar presentes tanto la FSH como la testosterona. Al inhibir la liberación de FSH, la trestolona crea un entorno endocrino en el que las condiciones para la espermatogénesis no son ideales. [4] [3] La fabricación de espermatozoides se ve afectada aún más por la supresión de LH, que a su vez reduce drásticamente la producción de testosterona. [4] [3] Dosis regulares suficientes de trestolona causan oligozoospermia o azoospermia grave y, por lo tanto, infertilidad, en la mayoría de los hombres. [4] [3] Se ha descubierto que la infertilidad inducida por trestolona es rápidamente reversible tras la interrupción del tratamiento. [4] [3]
Cuando se inhibe la liberación de LH, la cantidad de testosterona producida en los testículos disminuye drásticamente. [4] [3] Como resultado de las cualidades supresoras de gonadotropina de la trestolona, los niveles de testosterona sérica caen bruscamente en los hombres tratados con cantidades suficientes del medicamento. [4] [3] La testosterona es la principal hormona responsable del mantenimiento de las características sexuales secundarias masculinas . Normalmente, un nivel inadecuado de testosterona causa efectos indeseables como fatiga , pérdida de masa muscular esquelética , reducción de la libido y aumento de peso. Sin embargo, las propiedades androgénicas y anabólicas de la trestolona mejoran en gran medida este problema [4] [3] — esencialmente, la trestolona reemplaza el papel de la testosterona como la principal hormona masculina en el cuerpo. [4] [3]
Farmacocinética
Las propiedades farmacocinéticas de la trestolona, como su baja biodisponibilidad oral y su corta vida media de eliminación , la hacen inadecuada para la administración oral o la inyección intramuscular a largo plazo . [19] [20] Como tal, la trestolona debe administrarse por vía parenteral a través de una vía diferente y más práctica, como un implante subcutáneo , un parche transdérmico o un gel tópico . [19] El acetato de trestolona , un profármaco de la trestolona, se puede administrar mediante inyección intramuscular . [5]
Química
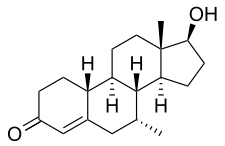
La trestolona, también conocida como 7α-metil-19-nortestosterona (MENT) o como 7α-metilestr-4-en-17β-ol-3-ona, es un esteroide estrano sintético y un derivado de la nandrolona (19-nortestosterona). [1] Es una modificación de la nandrolona con un grupo metilo en la posición C7α. [1] Entre los AAS estrechamente relacionados se encuentran la 7α-metil-19-norandrostenediona (MENT diona, trestiona) (una prohormona androgénica de la trestolona) y la dimetandrolona (7α,11β-dimetil-19-nortestosterona) (el derivado metilado C11β de la trestolona), así como la mibolerona (7α,17α-dimetil-19-nortestosterona) y la dimetiltrienolona (7α,17α-dimetil-δ 9,11 -19-nortestosterona). [1] La progestina tibolona (7α-metil-17α-etinil-δ 5(10) -19-nortestosterona) también está estrechamente relacionada con la trestolona. [1]
Historia
La trestolona se describió por primera vez en 1963. [7] Sin embargo, no se volvió a estudiar hasta 1990. [8] [21] El desarrollo de la trestolona para su posible uso en la anticoncepción hormonal masculina y la terapia de reemplazo de andrógenos se inició en 1993 y continuó a partir de entonces. [4] [9] [3] No parece que se haya realizado ningún desarrollo adicional desde 2013. [3] La trestolona fue desarrollada por el Population Council , una organización no gubernamental sin fines de lucro dedicada a la salud reproductiva . [3] [10]
Sociedad y cultura
Nombres genéricos
Trestolona es el nombre genérico del medicamento y su DCITooltip Nombre común internacional. [1] También se conoce comúnmente como 7α-metil-19-nortestosterona ( MENT ). [1] [2] [3]
Referencias
- ^ abcdefghi J. Elks (14 de noviembre de 2014). Diccionario de fármacos: datos químicos: datos químicos, estructuras y bibliografías. Springer. pp. 888–. ISBN 978-1-4757-2085-3.
- ^ abcd "7-alfa-metil-19-nortestosterona - AdisInsight".
- ^ abcdefghijklmnopqrstu vwxyz aa ab ac ad Nieschlag E, Kumar N, Sitruk-Ware R (2013). "7α-metil-19-nortestosterona (MENTR): la contribución del Population Council a la investigación sobre anticoncepción masculina y tratamiento del hipogonadismo". Anticoncepción . 87 (3): 288–95. doi :10.1016/j.contraception.2012.08.036. PMID 23063338.
- ^ abcdefghijklmno Sundaram K, Kumar N, Bardin CW (abril de 1993). "7 alfa-metil-nortestosterona (MENT): el andrógeno óptimo para la anticoncepción masculina". Ann. Med . 25 (2): 199–205. doi :10.3109/07853899309164168. PMID 8489761.
- ^ abcdefg Corona G, Rastrelli G, Vignozzi L, Maggi M (2012). "Medicamentos emergentes para el tratamiento del hipogonadismo masculino". Expert Opin Emerg Drugs . 17 (2): 239–59. doi :10.1517/14728214.2012.683411. PMID 22612692. S2CID 22068249.
- ^ abcdef García-Becerra R, Ordaz-Rosado D, Noé G, Chávez B, Cooney AJ, Larrea F (2012). "Comparación de la efectividad de la 7α-metil-19-nortestosterona sola o combinada con progestinas en la transactivación mediada por el receptor de andrógenos". Reproducción . 143 (2): 211–9. doi : 10.1530/REP-11-0171 . PMID 22065861.
- ^ ab Lyster SC, Duncan GW (julio de 1963). "Actividades anabólicas, androgénicas y miotrópicas de los derivados de la 7-alfa-metil-19-nortestosterona". Acta Endocrinol . 43 (3): 399–411. doi :10.1530/acta.0.0430399. PMID 13931986.
- ^ ab Ma JB, Li ZS (1990). "[Síntesis de 17 beta-hidroxi-7 alfa-metil-4-estren-3-ona 4-sustituida y sus 17-acetatos como compuestos antifertilidad]". Yao Xue Xue Bao (en chino). 25 (1): 18–23. PMID 2363352.
- ^ abc Sundaram K, Kumar N, Bardin CW (1994). "7 alfa-Metil-19-nortestosterona: un andrógeno ideal para la terapia de reemplazo". Recent Prog. Horm. Res . 49 : 373–6. doi :10.1016/b978-0-12-571149-4.50027-1. ISBN 9780125711494. Número de identificación personal 8146434.
- ^ ab MENT – información del proyecto del Consejo de Población
- ^ Anderson RA, Wallace AM, Sattar N, Kumar N, Sundaram K (junio de 2003). "Evidencia de selectividad tisular del andrógeno sintético 7 alfa-metil-19-nortestosterona en hombres hipogonadales". J. Clin. Endocrinol. Metab . 88 (6): 2784–93. doi : 10.1210/jc.2002-021960 . PMID: 12788888.
- ^ Attardi BJ, Hild SA, Koduri S, Pham T, Pessaint L, Engbring J, Till B, Gropp D, Semon A, Reel JR (octubre de 2010). "Los potentes andrógenos sintéticos, dimetandrolona (7α,11β-dimetil-19-nortestosterona) y 11β-metil-19-nortestosterona, no requieren 5α-reducción para ejercer sus efectos androgénicos máximos". The Journal of Steroid Biochemistry and Molecular Biology . 122 (4): 212–8. doi :10.1016/j.jsbmb.2010.06.009. PMC 2949447 . PMID 20599615.
- ^ Attardi BJ, Pham TC, Radler LC, Burgenson J, Hild SA, Reel JR (junio de 2008). "La dimetandrolona (7,11β-dimetil-19-nortestosterona) y la 11β-metil-19-nortestosterona no se convierten en productos aromáticos de anillo A en presencia de aromatasa humana recombinante". The Journal of Steroid Biochemistry and Molecular Biology . 110 (3–5): 214–22. doi :10.1016/j.jsbmb.2007.11.009. PMC 2575079 . PMID 18555683.
- ^ Ojasoo T, Delettré J, Mornon JP, Turpin-VanDycke C, Raynaud JP (1987). "Hacia el mapeo de los receptores de progesterona y andrógenos". J. Steroid Biochem . 27 (1–3): 255–69. doi :10.1016/0022-4731(87)90317-7. PMID 3695484.
- ^ Delettré J, Mornon JP, Lepicard G, Ojasoo T, Raynaud JP (enero de 1980). "Flexibilidad de esteroides y especificidad del receptor". J. Steroid Biochem . 13 (1): 45–59. doi :10.1016/0022-4731(80)90112-0. PMID 7382482.
- ^ Raynaud JP, Bouton MM, Moguilewsky M, Ojasoo T, Philibert D, Beck G, Labrie F, Mornon JP (enero de 1980). "Receptores de hormonas esteroides y farmacología". J. Steroid Biochem . 12 : 143–57. doi :10.1016/0022-4731(80)90264-2. PMID 7421203.
- ^ Ojasoo T, Raynaud JP, Doé JC (enero de 1994). "Afiliaciones entre receptores de esteroides reveladas por análisis multivariado de datos de unión de esteroides". J. Steroid Biochem. Mol. Biol . 48 (1): 31–46. doi :10.1016/0960-0760(94)90248-8. PMID 8136304. S2CID 21336380.
- ^ Raynaud J, Ojasoo T, Bouton M, Philibert D (1979). "La unión a receptores como herramienta en el desarrollo de nuevos esteroides bioactivos". Drug Design: Medicinal Chemistry: A Series of Monographs. Vol. 8. Nueva York, Academic Press. págs. 169-214. doi :10.1016/B978-0-12-060308-4.50010-X. ISBN. 9780120603084.
- ^ ab Attardi BJ, Hild SA, Reel JR (junio de 2006). "Undecanoato de dimetandrolona: un nuevo y potente andrógeno activo por vía oral con actividad progestacional". Endocrinología . 147 (6): 3016–26. doi : 10.1210/en.2005-1524 . PMID 16497801.
Las propiedades farmacocinéticas de la MENT la hacen inadecuada para el tratamiento oral una vez al día o la inyección a largo plazo; por lo tanto, se requiere la administración mediante implante subcutáneo o mediante parche o gel (27). La MENT mostró una tasa de depuración metabólica más rápida que la T en hombres y monos, probablemente debido en parte a su incapacidad para unirse a la SHBG (28). En monos, el acetato de MENT en implantes subdérmicos fue 10 veces más potente que la T en la supresión de la secreción de gonadotropina y los efectos anabólicos, pero solo fue dos veces más potente en la estimulación del crecimiento de la próstata (29).
- ^ Suvisaari J, Sundaram K, Noé G, Kumar N, Aguillaume C, Tsong YY, Lähteenmäki P, Bardin CW (mayo de 1997). "Farmacocinética y farmacodinamia de 7alfa-metil-19-nortestosterona después de la administración intramuscular en hombres sanos". Tararear. Reproducción . 12 (5): 967–73. doi : 10.1093/humrep/12.5.967 . PMID 9194649.
- ^ Kumar N, Didolkar AK, Ladd A, Thau R, Monder C, Bardin CW, Sundaram K (noviembre de 1990). "Radioinmunoensayo de 7 alfa-metil-19-nortestosterona e investigación de su farmacocinética en animales". J. Steroid Biochem. Mol. Biol . 37 (4): 587–91. doi :10.1016/0960-0760(90)90405-a. PMID 2278844. S2CID 37597215.

