Modelos compartimentados en epidemiología
Los modelos compartimentados son una técnica de modelado muy general. A menudo se aplican al modelado matemático de enfermedades infecciosas . La población se asigna a compartimentos con etiquetas, por ejemplo, S , I o R ( susceptible , infeccioso o recuperado ) . Las personas pueden progresar entre compartimentos. El orden de las etiquetas generalmente muestra los patrones de flujo entre los compartimentos; por ejemplo, SEIS significa susceptible, expuesto, infeccioso y luego susceptible nuevamente.
El origen de estos modelos se remonta a principios del siglo XX, con trabajos importantes como los de Ross [1] en 1916, Ross y Hudson en 1917, [2] [3] Kermack y McKendrick en 1927, [4] y Kendall en 1956. [5] El modelo Reed-Frost también fue un antecesor significativo y ampliamente pasado por alto de los enfoques modernos de modelado epidemiológico. [6]
Los modelos se ejecutan con mayor frecuencia con ecuaciones diferenciales ordinarias (que son deterministas), pero también se pueden utilizar con un marco estocástico (aleatorio), que es más realista pero mucho más complicado de analizar.
Estos modelos se utilizan para analizar la dinámica de la enfermedad y estimar el número total de personas infectadas, el número total de personas recuperadas y para estimar parámetros epidemiológicos como el número básico de reproducción o el número efectivo de reproducción . Estos modelos pueden mostrar cómo diferentes intervenciones de salud pública pueden afectar el resultado de la epidemia.
El modelo SIR
El modelo SIR [7] [8] [9] [10] es uno de los modelos compartimentados más simples, y muchos modelos son derivados de esta forma básica. El modelo consta de tres compartimentos:
- S : Número de individuos susceptibles . Cuando un individuo susceptible y un individuo infeccioso entran en "contacto infeccioso", el individuo susceptible contrae la enfermedad y pasa al compartimento infeccioso.
- I : Número de individuos infecciosos . Son aquellos individuos que han sido infectados y son capaces de infectar a individuos susceptibles.
- R es el número de individuos eliminados (e inmunes) o fallecidos. Se trata de individuos que han sido infectados y se han recuperado de la enfermedad y han entrado en el compartimento eliminado, o han muerto. Se supone que el número de muertes es insignificante con respecto a la población total. Este compartimento también puede denominarse " recuperado " o " resistente ".
Este modelo es razonablemente predictivo [11] para enfermedades infecciosas que se transmiten de persona a persona y donde la recuperación confiere resistencia duradera, como el sarampión , las paperas y la rubéola .

Estas variables ( S , I y R ) representan el número de personas en cada compartimento en un momento determinado. Para representar que el número de individuos susceptibles, infecciosos y eliminados puede variar con el tiempo (incluso si el tamaño total de la población permanece constante), hacemos que los números precisos sean una función de t (tiempo): S ( t ), I ( t ) y R ( t ). Para una enfermedad específica en una población específica, estas funciones se pueden calcular para predecir posibles brotes y controlarlos. [11] Nótese que en el modelo SIR, y son cantidades diferentes: la primera describe el número de recuperados en t = 0, mientras que la segunda describe la relación entre la frecuencia de contactos y la frecuencia de recuperación.
Como lo implica la función variable de t , el modelo es dinámico en el sentido de que los números en cada compartimento pueden fluctuar con el tiempo. La importancia de este aspecto dinámico es más obvia en una enfermedad endémica con un período infeccioso corto, como el sarampión en el Reino Unido antes de la introducción de una vacuna en 1968. Tales enfermedades tienden a ocurrir en ciclos de brotes debido a la variación en el número de susceptibles (S( t )) a lo largo del tiempo. Durante una epidemia , el número de individuos susceptibles cae rápidamente a medida que más de ellos se infectan y, por lo tanto, ingresan a los compartimentos infecciosos y eliminados. La enfermedad no puede volver a estallar hasta que el número de susceptibles se haya recuperado, por ejemplo, como resultado del nacimiento de crías en el compartimento susceptible. [ cita requerida ]

Cada miembro de la población suele pasar de ser susceptible a infectivo y luego a recuperarse. Esto se puede representar mediante un diagrama de flujo en el que los recuadros representan los diferentes compartimentos y las flechas la transición entre ellos (véase el diagrama).

Tasas de transición
Para la especificación completa del modelo, las flechas deben estar etiquetadas con las tasas de transición entre compartimentos. Entre S e I , se supone que la tasa de transición es , donde es la población total, es el número promedio de contactos por persona por tiempo, multiplicado por la probabilidad de transmisión de la enfermedad en un contacto entre un sujeto susceptible y uno infeccioso, y es la fracción de esos contactos entre un individuo infeccioso y uno susceptible que resultan en que la persona susceptible se infecte. (Esto es matemáticamente similar a la ley de acción de masas en química en la que las colisiones aleatorias entre moléculas dan como resultado una reacción química y la tasa fraccionaria es proporcional a la concentración de los dos reactivos. [12] )
Entre I y R , se supone que la tasa de transición es proporcional al número de individuos infecciosos, que es . Si un individuo es infeccioso durante un período de tiempo promedio , entonces . Esto también es equivalente a la suposición de que el tiempo que pasa un individuo en estado infeccioso es una variable aleatoria con una distribución exponencial . El modelo SIR "clásico" puede modificarse utilizando distribuciones más complejas y realistas para la tasa de transición IR (por ejemplo, la distribución Erlang ). [13]
Para el caso especial en el que no hay eliminación del compartimento infeccioso ( ), el modelo SIR se reduce a un modelo SI muy simple, que tiene una solución logística , en la que cada individuo eventualmente se infecta.
El modelo SIR sin nacimiento ni muerte

La dinámica de una epidemia, por ejemplo, la gripe , suele ser mucho más rápida que la dinámica de nacimientos y muertes, por lo que los nacimientos y las muertes suelen omitirse en los modelos compartimentados simples. El sistema SIR sin la denominada dinámica vital (nacimientos y muertes, a veces llamada demografía) descrita anteriormente se puede expresar mediante el siguiente sistema de ecuaciones diferenciales ordinarias : [8] [14]

donde es el stock de población susceptible, es el stock de infectados, es el stock de población eliminada (ya sea por muerte o recuperación), y es la suma de estos tres.
Este modelo fue propuesto por primera vez por William Ogilvy Kermack y Anderson Gray McKendrick como un caso especial de lo que ahora llamamos teoría de Kermack-McKendrick , y siguió el trabajo que McKendrick había realizado con Ronald Ross . [ cita requerida ]
Este sistema no es lineal , sin embargo es posible derivar su solución analítica en forma implícita. [7] En primer lugar, observe que:
resulta que:
Expresando en términos matemáticos la constancia de la población . Nótese que la relación anterior implica que solo es necesario estudiar la ecuación para dos de las tres variables.
En segundo lugar, observamos que la dinámica de la clase infecciosa depende de la siguiente relación:
el llamado número básico de reproducción (también llamado índice básico de reproducción). Este índice se deriva como el número esperado de nuevas infecciones (estas nuevas infecciones a veces se denominan infecciones secundarias) a partir de una sola infección en una población donde todos los sujetos son susceptibles. [15] [16] Esta idea probablemente se puede ver más fácilmente si decimos que el tiempo típico entre contactos es , y el tiempo típico hasta la eliminación es . De aquí se deduce que, en promedio, el número de contactos de un individuo infeccioso con otros antes de que el infeccioso haya sido eliminado es:
Dividiendo la primera ecuación diferencial por la tercera, separando las variables e integrando obtenemos
donde y son los números iniciales de, respectivamente, sujetos susceptibles y eliminados. Escribiendo para la proporción inicial de individuos susceptibles, y y para la proporción de individuos susceptibles y eliminados respectivamente en el límite se tiene
(nótese que el compartimento infeccioso se vacía en este límite). Esta ecuación trascendental tiene una solución en términos de la función W de Lambert , [17] a saber
Esto demuestra que al final de una epidemia que se ajusta a los supuestos simples del modelo SIR, a menos que , no todos los individuos de la población hayan sido eliminados, por lo que algunos deben seguir siendo susceptibles. Una fuerza impulsora que conduce al final de una epidemia es una disminución en el número de individuos infecciosos. La epidemia no suele terminar debido a una falta total de individuos susceptibles.
El papel tanto del número básico de reproducción como de la susceptibilidad inicial son extremadamente importantes. De hecho, al reescribir la ecuación para los individuos infecciosos de la siguiente manera:
se obtiene que si:
entonces:
Es decir, se producirá un brote epidémico propiamente dicho con un aumento del número de personas infectadas (que puede alcanzar una fracción considerable de la población). Por el contrario, si
entonces
Es decir, independientemente del tamaño inicial de la población susceptible, la enfermedad nunca puede causar un brote epidémico propiamente dicho. En consecuencia, es evidente que tanto el número básico de reproducción como la susceptibilidad inicial son extremadamente importantes.
La fuerza de la infección
Tenga en cuenta que en el modelo anterior la función:
modela la tasa de transición del compartimento de individuos susceptibles al compartimento de individuos infecciosos, de modo que se denomina fuerza de infección . Sin embargo, para grandes clases de enfermedades transmisibles es más realista considerar una fuerza de infección que no depende del número absoluto de sujetos infecciosos, sino de su fracción (con respecto a la población constante total ):
Capasso [18] y, posteriormente, otros autores han propuesto fuerzas de infección no lineales para modelar de forma más realista el proceso de contagio.
Soluciones analíticas exactas para el modelo SIR
En 2014, Harko y coautores derivaron una solución analítica exacta (que implica una integral que solo se puede calcular numéricamente) para el modelo SIR. [7] En el caso sin configuración de dinámica vital, para , etc., corresponde a la siguiente parametrización de tiempo
para
con condiciones iniciales
donde satisface . Por la ecuación trascendental para anterior, se deduce que , si y .
Una solución analítica equivalente (que implica una integral que solo se puede calcular numéricamente) encontrada por Miller [19] [20] produce
Aquí se puede interpretar como el número esperado de transmisiones que ha recibido un individuo en el tiempo . Las dos soluciones están relacionadas por .
En efecto, el mismo resultado se puede encontrar en el trabajo original de Kermack y McKendrick. [4]
Estas soluciones se pueden entender fácilmente si se observa que todos los términos en el lado derecho de las ecuaciones diferenciales originales son proporcionales a . Las ecuaciones se pueden dividir por , y el tiempo se puede reescalar de modo que el operador diferencial en el lado izquierdo se convierta simplemente en , donde , es decir . Las ecuaciones diferenciales ahora son todas lineales, y la tercera ecuación, de la forma const., muestra que y (y anteriores) están simplemente relacionadas linealmente.
Kröger y Schlickeiser [9] proporcionaron un aproximador analítico de alta precisión del modelo SIR, así como expresiones analíticas exactas para los valores finales , y , de modo que no es necesario realizar una integración numérica para resolver el modelo SIR ( aquí se puede encontrar un ejemplo práctico simplificado de simulación numérica de COVID-19 con Microsoft Excel [21] ), para obtener sus parámetros a partir de datos existentes o para predecir la dinámica futura de una epidemia modelada por el modelo SIR. El aproximador implica la función W de Lambert , que forma parte de todo el software básico de visualización de datos, como Microsoft Excel, MATLAB y Mathematica .
Mientras que Kendall [5] consideró el llamado modelo SIR de todos los tiempos, donde las condiciones iniciales , , y están acopladas a través de las relaciones anteriores, Kermack y McKendrick [4] propusieron estudiar el caso semitemporal más general, para el cual y son ambos arbitrarios. Esta última versión, denominada modelo SIR de semitiempo, [9] hace predicciones solo para tiempos futuros . También están disponibles una aproximación analítica y expresiones exactas para los valores finales para el modelo SIR de semitiempo. [10]
Soluciones numéricas del modelo SIR con aproximaciones
En la literatura se pueden encontrar soluciones numéricas del modelo SIR. Un ejemplo es el uso del modelo para analizar los datos de propagación de COVID-19 . [21] [22] Se pueden extraer tres números de reproducción de los datos analizados con aproximación numérica,
- el número de reproducción en tiempo real:
- y el número de reproducción efectiva en tiempo real:
representa la velocidad de la tasa de reproducción al comienzo de la propagación cuando se supone que todas las poblaciones son susceptibles, p. ej., si y significa que una persona infecciosa en promedio infecta a 0,4 personas susceptibles por día y se recupera en 1/0,2 = 5 días. Por lo tanto, cuando esta persona se recupera, hay dos personas todavía infecciosas contraídas directamente de esta persona y , es decir, el número de personas infecciosas se duplicó en un ciclo de 5 días. Los datos simulados por el modelo con o datos reales ajustados producirán una duplicación del número de personas infecciosas más rápido que 5 días porque las dos personas infectadas están infectando a personas. A partir del modelo SIR, podemos decir que está determinado por la naturaleza de la enfermedad y también es una función de la frecuencia interactiva entre la persona infecciosa con las personas susceptibles y también la intensidad/duración de la interacción como qué tan cerca interactúan durante cuánto tiempo y si ambos usan o no máscaras, por lo tanto, cambia con el tiempo cuando cambia el comportamiento promedio de los portadores y las personas susceptibles. El modelo se utiliza para representar estos factores, pero en realidad se refiere a la etapa inicial, cuando no se toman medidas para evitar la propagación y toda la población es susceptible, por lo que todos los cambios son absorbidos por el cambio de .
Por lo general, es más estable en el tiempo, suponiendo que cuando la persona infectada muestra síntomas, buscará atención médica o se autoaislará. Entonces, si encontramos cambios, lo más probable es que los comportamientos de las personas en la comunidad hayan cambiado de sus patrones normales antes del brote, o la enfermedad haya mutado a una nueva forma. La detección masiva y el aislamiento costosos de contactos cercanos susceptibles tienen efectos en la reducción, pero cuya eficiencia está en debate. Este debate se basa en gran medida en la incertidumbre del número de días reducidos desde después de la infección o la detección, lo que ocurra primero, hasta antes de que aparezca un síntoma para una persona susceptible infectada. Si la persona es infecciosa después de que aparecen los síntomas, o la detección solo funciona para una persona con síntomas, entonces estos métodos de prevención no son necesarios, y el autoaislamiento y/o la atención médica son la mejor manera de reducir los valores. El inicio típico del período infeccioso de COVID-19 es del orden de un día desde que aparecen los síntomas, lo que hace que la detección masiva con la frecuencia típica en unos pocos días sea inútil.
no nos dice si la propagación se acelerará o se ralentizará en las últimas etapas, cuando la fracción de personas susceptibles en la comunidad haya disminuido significativamente después de la recuperación o la vacunación. corrige este efecto de dilución multiplicando la fracción de la población susceptible sobre la población total. Corrige la interacción efectiva/transmisible entre una persona infecciosa y el resto de la comunidad cuando gran parte de la interacción es inmune en las etapas medias y tardías de la propagación de la enfermedad. Por lo tanto, cuando , veremos un brote de tipo exponencial; cuando , se alcanza un estado estable y no cambia el número de personas infecciosas con el tiempo; y cuando , la enfermedad decae y se desvanece con el tiempo.
Utilizando las ecuaciones diferenciales del modelo SIR y convirtiéndolas a formas numéricas discretas, se pueden establecer las ecuaciones recursivas y calcular las poblaciones S, I y R con cualquier condición inicial dada, pero acumular errores durante un largo tiempo de cálculo desde el punto de referencia. A veces se necesita una prueba de convergencia para estimar los errores. Dado un conjunto de condiciones iniciales y los datos de propagación de la enfermedad, también se pueden ajustar los datos con el modelo SIR y extraer los tres números de reproducción cuando los errores son generalmente insignificantes debido al corto paso de tiempo desde el punto de referencia. [21] [22] Cualquier punto del tiempo se puede utilizar como condición inicial para predecir el futuro después de él utilizando este modelo numérico con el supuesto de parámetros evolucionados en el tiempo, como la población, y . Sin embargo, lejos de este punto de referencia, los errores se acumularán con el tiempo, por lo que se necesita una prueba de convergencia para encontrar un paso de tiempo óptimo para obtener resultados más precisos.
Entre estos tres números de reproducción, es muy útil juzgar la presión de control, por ejemplo, un valor grande significa que la enfermedad se propagará muy rápido y es muy difícil de controlar. es más útil para predecir tendencias futuras, por ejemplo, si sabemos que las interacciones sociales se han reducido un 50% con frecuencia desde antes del brote y las intensidades de interacción entre las personas son las mismas, entonces podemos establecer . Si el distanciamiento social y las mascarillas añaden otro 50% de reducción en la eficiencia de la infección, podemos establecer . se correlacionará perfectamente con las olas de propagación y siempre que , la propagación se acelere, y cuando , la propagación se desacelere, por lo que es útil para establecer una predicción sobre las tendencias a corto plazo. Además, se puede utilizar para calcular directamente la población umbral de vacunación/inmunización para la etapa de inmunidad colectiva estableciendo , y , es decir .
El modelo SIR con dinámica vital y población constante
Consideremos una población caracterizada por una tasa de mortalidad y una tasa de natalidad , y donde se está propagando una enfermedad contagiosa. [8] El modelo con transmisión por acción masiva es:
para el cual el equilibrio libre de enfermedad (ELE) es:
En este caso, podemos derivar un número de reproducción básico :
que tiene propiedades de umbral. De hecho, independientemente de los valores iniciales biológicamente significativos, se puede demostrar que:
El punto EE se denomina Equilibrio Endémico (la enfermedad no se erradica totalmente y permanece en la población). Con argumentos heurísticos, se puede demostrar que puede leerse como el número promedio de infecciones causadas por un solo sujeto infeccioso en una población totalmente susceptible, la relación anterior significa biológicamente que si este número es menor o igual a uno la enfermedad se extingue, mientras que si este número es mayor que uno la enfermedad permanecerá permanentemente endémica en la población.
El modelo SIR


En 1927, WO Kermack y AG McKendrick crearon un modelo en el que consideraron una población fija con solo tres compartimentos: susceptible, ; infectado, ; y recuperado, . Los compartimentos utilizados para este modelo consisten en tres clases: [4]
- Se utiliza para representar a los individuos que aún no están infectados con la enfermedad en el momento t, o aquellos susceptibles a la enfermedad de la población.
- designa a los individuos de la población que han sido infectados con la enfermedad y son capaces de transmitirla a aquellos en la categoría susceptible.
- Es el compartimento que se utiliza para los individuos de la población que han sido infectados y luego eliminados de la enfermedad, ya sea por inmunización o por muerte. Los que se encuentran en esta categoría no pueden volver a infectarse ni transmitir la infección a otros.
El flujo de este modelo puede considerarse de la siguiente manera:
Usando una población fija, en las tres funciones se resuelve que el valor debe permanecer constante dentro de la simulación, si se usa una simulación para resolver el modelo SIR. Alternativamente, el aproximante analítico [9] se puede usar sin realizar una simulación. El modelo se inicia con valores de , y . Estos son el número de personas en las categorías susceptibles, infectadas y eliminadas en el tiempo igual a cero. Si se supone que el modelo SIR se mantiene en todo momento, estas condiciones iniciales no son independientes. [9] Posteriormente, el modelo de flujo actualiza las tres variables para cada punto de tiempo con valores establecidos para y . La simulación primero actualiza la categoría infectada de la susceptible y luego la categoría eliminada se actualiza de la categoría infectada para el siguiente punto de tiempo (t = 1). Esto describe el flujo de personas entre las tres categorías. Durante una epidemia, la categoría susceptible no se desplaza con este modelo, cambia a lo largo de la epidemia y también lo hace . Estas variables determinan la duración de la epidemia y tendrían que actualizarse con cada ciclo.
Se hicieron varias suposiciones en la formulación de estas ecuaciones: primero, se debe considerar que un individuo en la población tiene una probabilidad igual a cualquier otro individuo de contraer la enfermedad con una tasa de y una fracción igual de personas con las que un individuo hace contacto por unidad de tiempo. Entonces, sea la multiplicación de y . Esta es la probabilidad de transmisión por la tasa de contacto. Además, un individuo infectado hace contacto con personas por unidad de tiempo mientras que solo una fracción, de ellas son susceptibles. Por lo tanto, tenemos que cada infectivo puede infectar a personas susceptibles y, por lo tanto, el número total de susceptibles infectados por infectivos por unidad de tiempo es . Para la segunda y tercera ecuaciones, considere la población que abandona la clase susceptible como igual al número que ingresa a la clase infectada. Sin embargo, un número igual a la fracción (que representa la tasa media de recuperación/muerte, o el período infectivo medio) de infectivos abandonan esta clase por unidad de tiempo para ingresar a la clase eliminada. Estos procesos que ocurren simultáneamente se conocen como la Ley de Acción de Masas, una idea ampliamente aceptada que sostiene que la tasa de contacto entre dos grupos de una población es proporcional al tamaño de cada uno de los grupos involucrados. Finalmente, se supone que la tasa de infección y recuperación es mucho más rápida que la escala temporal de nacimientos y muertes y, por lo tanto, estos factores se ignoran en este modelo. [23]
Soluciones de estado estacionario
La única solución de estado estable para el modelo SIR clásico, tal como se define en las ecuaciones diferenciales anteriores, es I=0; por lo tanto, S y R pueden adoptar cualquier valor. El modelo se puede modificar manteniendo los tres compartimentos para obtener una solución endémica de estado estable añadiendo alguna entrada al compartimento S.
Por ejemplo, se puede postular que la duración esperada de la susceptibilidad será donde refleja el tiempo de vida (esperanza de vida) y refleja el tiempo en el estado susceptible antes de infectarse, lo que se puede simplificar [24] a:
de modo que el número de personas susceptibles es el número que entra al compartimento susceptible multiplicado por la duración de la susceptibilidad:
De manera análoga, el número de personas infectadas en estado estable es el número de personas que entran al estado infectado desde el estado susceptible (número susceptible, multiplicado por la tasa de infección) multiplicado por la duración de la infecciosidad :
Otros modelos compartimentados
Existen muchas modificaciones del modelo SIR, incluidas aquellas que incluyen nacimientos y muertes, donde tras la recuperación no hay inmunidad (modelo SIS), donde la inmunidad dura solo por un corto período de tiempo (SIRS), donde hay un período latente de la enfermedad donde la persona no es infecciosa (SEIS y SEIR), y donde los bebés pueden nacer con inmunidad (MSIR). Los modelos compartimentados también se pueden utilizar para modelar múltiples grupos de riesgo, e incluso la interacción de múltiples patógenos. [25]
Variaciones del modelo básico SIR
El modelo SIS
Algunas infecciones, como el resfriado común y la gripe , no confieren inmunidad duradera. Estas infecciones pueden generar resistencia temporal, pero no dan inmunidad a largo plazo una vez que se recuperan de la infección, y las personas se vuelven susceptibles nuevamente.

Tenemos el modelo:
Nótese que al denotar con N la población total se cumple que:
- .
Resulta que:
- ,
Es decir, la dinámica de las infecciones está regida por una función logística , de modo que :
Es posible encontrar una solución analítica para este modelo (haciendo una transformación de variables: y sustituyéndola en las ecuaciones de campo medio), [26] de manera que la tasa básica de reproducción sea mayor que la unidad. La solución se da como
- .
donde es la población infecciosa endémica, y . Como se supone que el sistema está cerrado, la población susceptible es entonces .
Siempre que la naturaleza entera del número de agentes es evidente (poblaciones con menos de decenas de miles de individuos), las fluctuaciones inherentes en el proceso de propagación de la enfermedad causadas por agentes discretos resultan en incertidumbres. [27] En este escenario, la evolución de la enfermedad predicha por ecuaciones compartimentales se desvía significativamente de los resultados observados. Estas incertidumbres pueden incluso hacer que la epidemia termine antes de lo previsto por las ecuaciones compartimentales.
Como caso especial, se obtiene la función logística habitual suponiendo . Esto también se puede considerar en el modelo SIR con , es decir, no se producirá ninguna eliminación. Ese es el modelo SI . [28] El sistema de ecuaciones diferenciales que utiliza se reduce así a:
A largo plazo, en el modelo SI, todos los individuos se infectarán.
El modelo SIRD


El modelo Susceptible-Infeccioso-Recuperado-Muerto diferencia entre Recuperado (es decir, específicamente individuos que han sobrevivido a la enfermedad y ahora son inmunes) y Muerto . [15] El modelo SIRD tiene soluciones semianalíticas basadas en el método de las cuatro partes. [29] Este modelo utiliza el siguiente sistema de ecuaciones diferenciales:
donde son las tasas de infección, recuperación y mortalidad, respectivamente. [30]
El modelo SIRV
El modelo Susceptible-Infeccioso-Recuperado-Vacunado es un modelo SIR extendido que tiene en cuenta la vacunación de la población susceptible. [31] Este modelo utiliza el siguiente sistema de ecuaciones diferenciales:
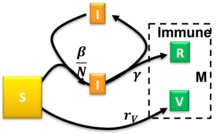
donde son las tasas de infección, recuperación y vacunación, respectivamente. Para las condiciones iniciales de semi-tiempo , , y proporciones constantes y el modelo se había resuelto de forma aproximada. [31] La ocurrencia de un brote pandémico requiere y hay una tasa de vacunación crítica reducida más allá de la cual el tamaño en estado estacionario del compartimento susceptible permanece relativamente cerca de . Las condiciones iniciales arbitrarias que satisfacen se pueden mapear al caso especial resuelto con . [31]
La solución numérica de este modelo para calcular el número de reproducción en tiempo real de COVID-19 se puede practicar en base a la información de las diferentes poblaciones de una comunidad. [22] La solución numérica es un método comúnmente utilizado para analizar redes cinéticas complicadas cuando la solución analítica es difícil de obtener o está limitada por requisitos tales como condiciones de contorno o parámetros especiales. Utiliza ecuaciones recursivas para calcular el siguiente paso convirtiendo la integración numérica en la suma de Riemann de pasos de tiempo discretos, por ejemplo, utilizar el capital y la tasa de interés de ayer para calcular el interés de hoy, lo que supone que la tasa de interés es fija durante el día. El cálculo contiene errores proyectados si no se incluyen las correcciones analíticas en el tamaño del paso numérico, por ejemplo, cuando la tasa de interés de la recaudación anual se simplifica a 12 veces la tasa mensual, se introduce un error proyectado. Por lo tanto, los resultados calculados conllevarán errores acumulativos cuando el paso de tiempo esté muy alejado del punto de referencia y se necesite una prueba de convergencia para estimar el error. Sin embargo, este error suele ser aceptable para el ajuste de datos. Al ajustar un conjunto de datos con un paso de tiempo cercano, el error es relativamente pequeño porque el punto de referencia está cerca en comparación con cuando se predice un largo período de tiempo después de un punto de referencia. Una vez que se extrae el tiempo real, se puede comparar con el número básico de reproducción . Antes de la vacunación, proporciona al responsable de las políticas y al público en general una medida de la eficiencia de las actividades de mitigación social, como el distanciamiento social y el uso de mascarillas, simplemente dividiendo . Con la vacunación masiva, el objetivo del control de la enfermedad es reducir el número efectivo de reproducción , donde es el número de población susceptible en ese momento y es la población total. Cuando , la propagación disminuye y los casos diarios de infección disminuyen.
El modelo SIRVD
El modelo de compartimento epidémico susceptible-infectado-recuperado-vacunado-fallecido (SIRVD) extiende el modelo SIR para incluir los efectos de las campañas de vacunación y las tasas de mortalidad dependientes del tiempo en los brotes epidémicos. Abarca los modelos SIR, SIRV, SIRD y SI como casos especiales, con tasas individuales dependientes del tiempo que rigen las transiciones entre diferentes fracciones. [32] Este modelo utiliza el siguiente sistema de ecuaciones diferenciales para las fracciones de población :

donde son las tasas de infección, vacunación, recuperación y mortalidad, respectivamente. Para las condiciones iniciales de semitiempo , , y proporciones constantes , , y el modelo se había resuelto de manera aproximada y exacta para algunos casos especiales, independientemente de la forma funcional de . [32] Esto se logra al reescribir las ecuaciones del modelo SIRVD anteriores en forma equivalente, pero reducida
dónde
es un tiempo reducido y adimensional. La dependencia temporal de la fracción infectada y la tasa de nuevas infecciones difieren cuando se consideran los efectos de las vacunaciones y cuando la dependencia en tiempo real de las tasas de mortalidad y recuperación divergen. Estas diferencias se han destacado para las tasas de mortalidad estacionarias y las tasas de mortalidad que disminuyen gradualmente. [32] El caso de las tasas estacionarias permite construir un método de diagnóstico para extraer analíticamente todos los parámetros del modelo SIRVD a partir de los datos medidos de COVID-19 de una ola pandémica completa. [32]
El modelo MSIR
En el caso de muchas infecciones, incluida la del sarampión , los bebés no nacen en el compartimento susceptible, pero son inmunes a la enfermedad durante los primeros meses de vida debido a la protección que les brindan los anticuerpos maternos (que se transmiten a través de la placenta y, además, a través del calostro ). Esto se denomina inmunidad pasiva . Este detalle adicional se puede mostrar incluyendo una clase M (para la inmunidad derivada de la madre) al comienzo del modelo.

Para indicar esto matemáticamente, se añade un compartimento adicional, M ( t ) . Esto da como resultado las siguientes ecuaciones diferenciales:
Estado del portador
Algunas personas que han tenido una enfermedad infecciosa como la tuberculosis nunca se recuperan por completo y continúan siendo portadoras de la infección, aunque no sufren la enfermedad. Entonces pueden volver al compartimento infeccioso y sufrir síntomas (como en la tuberculosis) o pueden seguir infectando a otros en su estado de portadoras, aunque no presenten síntomas. El ejemplo más famoso de esto es probablemente el de Mary Mallon , que infectó a 22 personas con fiebre tifoidea . El compartimento portador está etiquetado como C.
El modelo SEIR
En el caso de muchas infecciones importantes, existe un período de latencia significativo durante el cual las personas se han infectado pero aún no son infecciosas. Durante este período, la persona se encuentra en el compartimento E (expuesta).

Suponiendo que el periodo de latencia es una variable aleatoria con distribución exponencial con parámetro (es decir, el periodo de latencia promedio es ), y asumiendo también la presencia de una dinámica vital con tasa de natalidad igual a la tasa de mortalidad (de modo que el número total es constante), tenemos el modelo:
Lo tenemos , pero esto es constante sólo debido al supuesto simplificador de que las tasas de natalidad y mortalidad son iguales; en general es una variable.
Para este modelo, el número de reproducción básico es:
De manera similar al modelo SIR, también en este caso tenemos un Equilibrio Libre de Enfermedades ( N ,0,0,0) y un Equilibrio Endémico EE, y se puede demostrar que, independientemente de las condiciones iniciales biológicamente significativas
Se sostiene que:
En el caso de una tasa de contacto que varía periódicamente, la condición para el atractivo global de DFE es que el siguiente sistema lineal con coeficientes periódicos:
es estable (es decir, tiene sus valores propios de Floquet dentro del círculo unitario en el plano complejo).
El modelo SEIS
El modelo SEIS es como el modelo SEIR (arriba) excepto que no se adquiere inmunidad al final.
En este modelo, una infección no deja inmunidad, por lo que los individuos que se han recuperado vuelven a ser susceptibles y vuelven al compartimento S ( t ). Las siguientes ecuaciones diferenciales describen este modelo:
El modelo MSEIR
Para el caso de una enfermedad, con los factores de inmunidad pasiva y un periodo de latencia existe el modelo MSEIR.
El modelo MSEIRS
Un modelo MSEIRS es similar al MSEIR, pero la inmunidad en la clase R sería temporal, de modo que los individuos recuperarían su susceptibilidad cuando terminara la inmunidad temporal.
Tarifas de contacto variables
Es bien sabido que la probabilidad de contraer una enfermedad no es constante en el tiempo. A medida que avanza una pandemia, las reacciones a la misma pueden cambiar las tasas de contacto, que se suponen constantes en los modelos más simples. Las contramedidas, como el uso de mascarillas, el distanciamiento social y el confinamiento, alterarán la tasa de contacto de manera que reducirán la velocidad de la pandemia.
Además, algunas enfermedades son estacionales, como los virus del resfriado común , que son más frecuentes durante el invierno. En el caso de las enfermedades infantiles, como el sarampión, las paperas y la rubéola, existe una fuerte correlación con el calendario escolar, de modo que durante las vacaciones escolares la probabilidad de contraer una de ellas disminuye drásticamente. En consecuencia, para muchas clases de enfermedades, se debe considerar una fuerza de infección con una tasa de contacto que varía periódicamente ("estacional").
con período T igual a un año.
Así pues, nuestro modelo se convierte en
(la dinámica de la recuperación se deduce fácilmente de ), es decir, un conjunto no lineal de ecuaciones diferenciales con parámetros que varían periódicamente. Es bien sabido que esta clase de sistemas dinámicos puede experimentar fenómenos muy interesantes y complejos de resonancia paramétrica no lineal. Es fácil ver que si:
mientras que si la integral es mayor que uno la enfermedad no se extinguirá y pueden existir tales resonancias. Por ejemplo, considerando la tasa de contacto que varía periódicamente como la 'entrada' del sistema, se tiene que la salida es una función periódica cuyo período es un múltiplo del período de la entrada. Esto permitió dar una contribución para explicar los brotes epidémicos polianuales (normalmente bienales) de algunas enfermedades infecciosas como interacción entre el período de las oscilaciones de la tasa de contacto y el pseudoperíodo de las oscilaciones amortiguadas cerca del equilibrio endémico. Cabe destacar que, en algunos casos, el comportamiento también puede ser cuasiperiódico o incluso caótico.
Modelo SIR con difusión
Los modelos compartimentados espaciotemporales no describen el número total, sino la densidad de personas susceptibles/infectantes/recuperadas. Por consiguiente, también permiten modelar la distribución de las personas infectadas en el espacio. En la mayoría de los casos, esto se hace combinando el modelo SIR con una ecuación de difusión.
- [33]
donde , y son constantes de difusión. De este modo, se obtiene una ecuación de reacción-difusión. (Tenga en cuenta que, por razones dimensionales, el parámetro debe cambiarse en comparación con el modelo SIR simple). Los primeros modelos de este tipo se han utilizado para modelar la propagación de la peste negra en Europa. [34] Se han utilizado extensiones de este modelo para incorporar, por ejemplo, los efectos de intervenciones no farmacéuticas como el distanciamiento social. [35]
Modelo SEIR de subpoblaciones interactuantes
Como los contactos sociales, la gravedad y letalidad de la enfermedad, así como la eficacia de las medidas profilácticas pueden diferir sustancialmente entre subpoblaciones que interactúan, por ejemplo, los ancianos frente a los jóvenes, se pueden utilizar modelos SEIR separados para cada subgrupo que estén conectados mutuamente a través de vínculos de interacción. [33] Dichos modelos SEIR de subpoblaciones que interactúan se han utilizado para modelar la pandemia de COVID-19 a escala continental para desarrollar estrategias de vacunación personalizadas, aceleradas y dirigidas a subpoblaciones [36] que prometen un acortamiento de la pandemia y una reducción de los recuentos de casos y muertes en el contexto de un acceso limitado a las vacunas durante una ola de variantes de virus de preocupación.
Modelo SIR en redes
El modelo SIR se ha estudiado en redes de diversos tipos con el fin de modelar una forma de conexión más realista que la condición de mezcla homogénea que se requiere habitualmente. Un modelo simple para epidemias en redes en las que un individuo tiene una probabilidad p de ser infectado por cada uno de sus vecinos infectados en un paso de tiempo dado conduce a resultados similares a la formación de componentes gigantes en los gráficos aleatorios de Erdos Renyi . [37]
SEÑOREspartanoModelo - combinación de SIR con modelado de estrés social
La dinámica de las epidemias depende de cómo cambia el comportamiento de las personas con el tiempo. Por ejemplo, al principio de la epidemia, las personas son ignorantes y descuidadas, luego, después del brote de epidemias y la alarma, comienzan a cumplir con las diversas restricciones y la propagación de las epidemias puede disminuir. Con el tiempo, algunas personas se cansan/frustran por las restricciones y dejan de cumplirlas (agotamiento), especialmente si el número de nuevos casos disminuye. Después de descansar durante algún tiempo, pueden volver a cumplir con las restricciones. Pero durante esta pausa, la segunda ola puede llegar y volverse incluso más fuerte que la primera. Se debe considerar la dinámica social . Los modelos de física social del estrés social complementan los modelos clásicos de epidemias. [38]
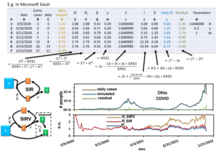
El modelo de estrés social SIR más simple (SIR SS ) se organiza de la siguiente manera. Los individuos susceptibles (S) se pueden dividir en tres subgrupos según los tipos de comportamiento: ignorantes o inconscientes de la epidemia (S ign ), racionalmente resistentes (S res ) y exhaustos (S exh ) que no reaccionan a los estímulos externos (se trata de una especie de período refractario). En otras palabras: S(t) = S ign (t) + S res (t) + S exh (t). Simbólicamente, el modelo de estrés social se puede presentar mediante el "esquema de reacción" (donde I denota a los individuos infectados):
- – reacción de movilización (la forma autocatalítica aquí significa que la tasa de transición es proporcional al cuadrado de la fracción infectada I);
- – proceso de agotamiento debido a la fatiga por las restricciones antiepidémicas;
- – relajación lenta hasta el estado inicial (fin del período refractario).
La principal reacción a la epidemia del SIR
tiene constantes de velocidad de reacción diferentes para S ign , S res y S exh . Presumiblemente, para S res , es menor que para S ign y S ign .
Las diferencias entre países se concentran en dos constantes cinéticas: la tasa de movilización y la tasa de agotamiento calculadas para la epidemia de COVID-19 en 13 países. [38] Estas constantes para esta epidemia en todos los países se pueden extraer mediante el ajuste del modelo SIR SS a los datos disponibles públicamente [39].
La ecuación KdV-SIR
Basándose en el modelo SIR clásico, se ha propuesto una ecuación Korteweg-de Vries (KdV)–SIR y su solución analítica para ilustrar la dinámica fundamental de una ola epidémica, la dependencia de las soluciones de los parámetros y la dependencia de los horizontes de predictibilidad de varios tipos de soluciones. [40] La ecuación KdV-SIR se escribe de la siguiente manera:
.
Aquí,
,
,
y
.
indica el valor inicial de la variable de estado . Los parámetros (σ-cero) y (R-cero) son la tasa de crecimiento relativa independiente del tiempo y el número básico de reproducción, respectivamente. presenta el máximo de las variables de estado (para el número de personas infectadas). Una solución analítica para la ecuación KdV-SIR se escribe de la siguiente manera:
,
que representa una solución de onda solitaria.
Modelo heterogéneo (estructurado, bayesiano)
Modelar una población completa de posiblemente millones de personas usando dos constantes parece una tarea descabellada; cada individuo tiene características personales que influyen en la propagación: estado de inmunidad, hábitos de contacto, etc. Por lo tanto, es interesante saber qué sucede si, por ejemplo, y no son dos constantes sino algunas variables aleatorias (un par para cada individuo). Este procedimiento tiene varios nombres: "modelo heterogéneo", "estructuración" (ver también más abajo los modelos estructurados por edad) o visión "bayesiana". [41] [42] [43] Surgen resultados sorprendentes, por ejemplo, se demostró en [41] que el número de infectados en el pico de una epidemia heterogénea es menor que la epidemia determinista que tiene el mismo promedio ; lo mismo es válido para el tamaño total de la epidemia y otros modelos, por ejemplo, SEIR. [41]
Modelización de la vacunación
El modelo SIR se puede modificar para modelar la vacunación. [44] Normalmente, estos introducen un compartimento adicional al modelo SIR, , para las personas vacunadas. A continuación se presentan algunos ejemplos.
Vacunación de recién nacidos
En caso de enfermedades contagiosas, una de las principales tareas es erradicarlas mediante medidas de prevención y, si es posible, mediante el establecimiento de un programa de vacunación masiva. Consideremos una enfermedad para la que se vacuna a los recién nacidos (con una vacuna que otorga inmunidad de por vida) a un ritmo :
donde es la clase de sujetos vacunados. Es inmediato demostrar que:
Así pues, trataremos el comportamiento a largo plazo de y , para lo cual se cumple que:
En otras palabras, si
El programa de vacunación no logra erradicar la enfermedad, por el contrario, ésta seguirá siendo endémica, aunque en niveles inferiores a los que se darían en caso de ausencia de vacunación. Esto significa que el modelo matemático sugiere que para una enfermedad cuyo número básico de reproducción puede llegar a 18, se debería vacunar al menos al 94,4% de los recién nacidos para erradicarla.
Vacunación e información
Las sociedades modernas se enfrentan al reto de la exención "racional", es decir, la decisión de la familia de no vacunar a los niños como consecuencia de una comparación "racional" entre el riesgo percibido de infección y el de sufrir daños por la vacuna. Para evaluar si este comportamiento es realmente racional, es decir, si puede conducir igualmente a la erradicación de la enfermedad, se puede suponer simplemente que la tasa de vacunación es una función creciente del número de sujetos infecciosos:
En tal caso la condición de erradicación pasa a ser:
Es decir, la tasa de vacunación de referencia debería ser mayor que el umbral de "vacunación obligatoria", que, en caso de exención, no puede cumplirse. Por lo tanto, la exención "racional" podría ser miope, ya que se basa únicamente en la baja incidencia actual debido a la alta cobertura de vacunación, en lugar de tener en cuenta el resurgimiento futuro de la infección debido a la disminución de la cobertura.
Vacunación de no recién nacidos
En caso de que también haya vacunaciones de no recién nacidos a una tasa ρ la ecuación para el sujeto susceptible y vacunado debe modificarse de la siguiente manera:
conduciendo a la siguiente condición de erradicación:
Estrategia de vacunación por pulsos
Esta estrategia consiste en vacunar repetidamente a una cohorte de edad definida (como niños pequeños o ancianos) en una población susceptible a lo largo del tiempo. Con esta estrategia, el bloque de individuos susceptibles se elimina inmediatamente, lo que permite eliminar una enfermedad infecciosa (como el sarampión) de toda la población. Cada T unidades de tiempo, se vacuna una fracción constante p de sujetos susceptibles en un tiempo relativamente corto (con respecto a la dinámica de la enfermedad). Esto conduce a las siguientes ecuaciones diferenciales impulsivas para los sujetos susceptibles y vacunados:
Es fácil ver que fijando I = 0 se obtiene que la dinámica de los sujetos susceptibles viene dada por:
y que la condición de erradicación es:
Juegos de vacunación
Una gran cantidad de literatura reconoce que la vacunación puede ser vista como un juego: en una población donde todos están vacunados, cualquier epidemia desaparecerá inmediatamente, por lo que una persona adicional no tendrá ningún interés en vacunarse. Por el contrario, una persona que llegue a una población donde nadie está vacunado tendrá todos los incentivos para vacunarse (la epidemia se desatará en esa población). Por lo tanto, parece que el individuo tiene interés en hacer lo contrario de la población en su conjunto. Pero la población es la suma de todos los individuos, y la afirmación anterior debería ser falsa. Por lo tanto, de hecho, se alcanza un equilibrio de Nash . [45] [46] [47] [48] [49] Las herramientas técnicas para tratar tales situaciones involucran la teoría de juegos o herramientas modernas como la teoría de juegos de campo medio . [49] [50]
La influencia de la edad: modelos estructurados por edad
La edad tiene una profunda influencia en la tasa de propagación de la enfermedad en una población, especialmente en la tasa de contacto. Esta tasa resume la efectividad de los contactos entre sujetos susceptibles e infecciosos. Teniendo en cuenta las edades de las clases epidémicas (para limitarnos al esquema susceptible-infeccioso-eliminado) de manera que:
(donde es la edad máxima admisible) y su dinámica no se describe, como podría pensarse, mediante ecuaciones diferenciales parciales "simples", sino mediante ecuaciones integro-diferenciales :
dónde:
es la fuerza de la infección, que, por supuesto, dependerá, aunque el núcleo de contacto, de las interacciones entre las edades.
La complejidad se ve aumentada por las condiciones iniciales para los recién nacidos (es decir, para a=0), que son sencillas para los infecciosos y se eliminan:
pero que no son locales para la densidad de recién nacidos susceptibles:
¿Dónde están las fertilidades de los adultos?
Además, definiendo ahora la densidad de la población total se obtiene:
En el caso más simple de fecundidad igual en las tres clases epidémicas, tenemos que para que haya equilibrio demográfico debe cumplirse la siguiente condición necesaria y suficiente que vincula la fecundidad con la mortalidad :
y el equilibrio demográfico es
garantizando automáticamente la existencia de la solución libre de enfermedades:
Un número de reproducción básico se puede calcular como el radio espectral de un operador funcional apropiado.
Método de próxima generación
Una forma de calcularlo es promediar el número esperado de nuevas infecciones entre todos los tipos de infección posibles. El método de la próxima generación es un método general para derivar cuando está involucrada más de una clase de infectantes. Este método, introducido originalmente por Diekmann et al . (1990), [51] se puede utilizar para modelos con estructura de edad subyacente o estructura espacial, entre otras posibilidades. [52] En esta imagen, el radio espectral de la matriz de la próxima generación da el número básico de reproducción, [53]
Consideremos una enfermedad de transmisión sexual. En una población ingenua donde casi todos son susceptibles, pero la semilla de la infección, si el número esperado de género 1 es y el número esperado de infectados de género 2 es , podemos saber cuántos se infectarían en la próxima generación. De modo que la matriz de la próxima generación se puede escribir como: [54] donde cada elemento es el número esperado de infecciones secundarias de género causadas por un solo individuo infectado de género , asumiendo que la población de género es completamente susceptible. Los elementos diagonales son cero porque las personas del mismo género no pueden transmitirse la enfermedad entre sí pero, por ejemplo, cada una puede transmitir la enfermedad a , en promedio. Lo que significa que cada elemento es un número de reproducción, pero uno donde se tiene en cuenta quién infecta a quién. Si la generación se representa con entonces la próxima generación sería .
El radio espectral de la matriz de la próxima generación es el número básico de reproducción, , es decir, aquí, la media geométrica del número esperado de cada género en la próxima generación. Nótese que los factores de multiplicación y se alternan porque la persona infecciosa tiene que "pasar por" un segundo género antes de poder entrar en un nuevo huésped del primer género. En otras palabras, se necesitan dos generaciones para volver al mismo tipo, y cada dos generaciones los números se multiplican por × . Por lo tanto, el factor de multiplicación promedio por generación es . Nótese que es una matriz no negativa, por lo que tiene un valor propio real único, positivo, que es estrictamente mayor que todos los demás.
Matriz de próxima generación para modelos compartimentados
En el modelado matemático de enfermedades infecciosas , la dinámica de propagación se describe generalmente a través de un conjunto de ecuaciones diferenciales ordinarias no lineales (EDO). Por lo tanto, siempre hay ecuaciones acopladas de la forma que muestran cómo cambia el número de personas en el compartimento con el tiempo. Por ejemplo, en un modelo SIR, , y . Los modelos compartimentados tienen un equilibrio libre de enfermedad (EBP), lo que significa que es posible encontrar un equilibrio mientras se establece el número de personas infectadas en cero, . En otras palabras, como regla, hay un estado estable libre de infección . Esta solución, también suele garantizar que el equilibrio libre de enfermedad sea también un equilibrio del sistema. Hay otro punto fijo conocido como Equilibrio Endémico (EE) donde la enfermedad no se erradica por completo y permanece en la población. Matemáticamente, es un umbral para la estabilidad de un equilibrio libre de enfermedad tal que:
Para calcular , el primer paso es linealizar alrededor del equilibrio libre de enfermedad (DFE), pero para el subsistema infectado de EDO no lineales que describen la producción de nuevas infecciones y cambios en el estado entre individuos infectados. Epidemiológicamente, la linealización refleja que caracteriza el potencial de propagación inicial de una persona infecciosa en una población ingenua, asumiendo que el cambio en la población susceptible es insignificante durante la propagación inicial. [55] Un sistema lineal de EDO siempre se puede describir mediante una matriz. Entonces, el siguiente paso es construir un operador positivo lineal que proporcione la próxima generación de personas infectadas cuando se aplica a la generación actual. Tenga en cuenta que este operador (matriz) es responsable del número de personas infectadas, no de todos los compartimentos. La iteración de este operador describe la progresión inicial de la infección dentro de la población heterogénea. Entonces, comparar el radio espectral de este operador con la unidad determina si las generaciones de personas infectadas crecen o no. se puede escribir como un producto de la tasa de infección cerca del equilibrio libre de enfermedad y la duración promedio de la infecciosidad. Se utiliza para encontrar el pico y el tamaño final de una epidemia.
El modelo SEIR con dinámica vital y población constante
Como se describe en el ejemplo anterior, muchos procesos epidémicos pueden describirse con un modelo SIR. Sin embargo, para muchas infecciones importantes, como la COVID-19 , hay un período de latencia significativo durante el cual los individuos han sido infectados pero aún no son infecciosos. Durante este período, el individuo está en el compartimento E (para expuesto). Aquí, la formación de la matriz de próxima generación a partir del modelo SEIR implica determinar dos compartimentos, infectado y no infectado, ya que son las poblaciones que propagan la infección. Por lo tanto, solo necesitamos modelar los compartimentos expuesto, E , e infectado, I . Consideremos una población caracterizada por una tasa de mortalidad y una tasa de natalidad donde se está propagando una enfermedad transmisible. Como en el ejemplo anterior, podemos usar las tasas de transición entre los compartimentos per cápita de manera que sea la tasa de infección, sea la tasa de recuperación y sea la tasa a la que un individuo latente se vuelve infeccioso. Luego, podemos definir la dinámica del modelo utilizando las siguientes ecuaciones: [52] [56]
Aquí tenemos 4 compartimentos y podemos definir el vector donde denota el número o la proporción de individuos en el compartimento -ésimo. Sea la tasa de aparición de nuevas infecciones en el compartimento de modo que incluya solo las infecciones que surgen recientemente, pero no incluya los términos que describen la transferencia de individuos infecciosos de un compartimento infectado a otro. Entonces, si es la tasa de transferencia de individuos al compartimento por todos los demás medios y es la tasa de transferencia de individuos fuera del compartimento -ésimo, entonces la diferencia da la tasa de cambio de tal que .
Ahora podemos hacer matrices de derivadas parciales de y tales que
y , donde está el equilibrio libre de enfermedad.
Ahora podemos formar la matriz de próxima generación (operador) . [57] [53] Básicamente, es una matriz no negativa que representa las tasas de infección cerca del equilibrio, y es una matriz M para términos de transición lineal que forman una matriz que representa la duración promedio de la infecciosidad. Por lo tanto, da la tasa a la que los individuos infectados en producen nuevas infecciones en , multiplicado por el tiempo promedio que un individuo pasa en una sola visita al compartimento
Finalmente, para este proceso SEIR podemos tener:
Y y entonces
Métodos de estimación
El número básico de reproducción se puede estimar mediante el examen de cadenas de transmisión detalladas o mediante secuenciación genómica . Sin embargo, se calcula con mayor frecuencia utilizando modelos epidemiológicos. [58] Durante una epidemia, normalmente se conoce el número de infecciones diagnosticadas a lo largo del tiempo . En las primeras etapas de una epidemia, el crecimiento es exponencial, con una tasa de crecimiento logarítmica. Para el crecimiento exponencial, se puede interpretar como el número acumulado de diagnósticos (incluidos los individuos que se han recuperado) o el número actual de casos de infección; la tasa de crecimiento logarítmica es la misma para ambas definiciones. Para estimar , son necesarias suposiciones sobre el retraso temporal entre la infección y el diagnóstico y el tiempo entre la infección y el comienzo de la infección.
En el crecimiento exponencial, se relaciona con el tiempo de duplicación como
Modelo simple
Si un individuo, después de infectarse, infecta a exactamente nuevos individuos solo después de que haya transcurrido exactamente un tiempo (el intervalo serial), entonces el número de individuos infecciosos a lo largo del tiempo crece como o La ecuación diferencial coincidente subyacente es o En este caso, o .
Por ejemplo, con y , encontraríamos .
Si depende del tiempo , se demuestra que puede ser importante mantenerlo por debajo de 0, promediado en el tiempo, para evitar un crecimiento exponencial.
Período infeccioso latente, aislamiento tras el diagnóstico
En este modelo, una infección individual tiene las siguientes etapas:
- Expuesto: un individuo está infectado, pero no presenta síntomas y aún no infecta a otros. La duración media del estado de exposición es de .
- Estado infeccioso latente: un individuo está infectado, no presenta síntomas, pero infecta a otros. La duración media del estado infeccioso latente es de . El individuo infecta a otros individuos durante este período.
- Aislamiento después del diagnóstico: se toman medidas para prevenir más infecciones, por ejemplo aislando a la persona infectada.
Este es un modelo SEIR y puede escribirse de la siguiente forma [59] Este método de estimación se ha aplicado a COVID-19 y SARS . Se deduce de la ecuación diferencial para el número de individuos expuestos y el número de individuos infecciosos latentes , El valor propio más grande de la matriz es la tasa de crecimiento logarítmica , que se puede resolver para .
En el caso especial , este modelo da como resultado , que es diferente del modelo simple anterior ( ). Por ejemplo, con los mismos valores y , encontraríamos , en lugar del valor verdadero de . La diferencia se debe a una diferencia sutil en el modelo de crecimiento subyacente; la ecuación matricial anterior supone que los pacientes recién infectados ya están contribuyendo a las infecciones, mientras que, de hecho, las infecciones solo ocurren debido al número de infectados en ese momento. Un tratamiento más correcto requeriría el uso de ecuaciones diferenciales de retardo . [60]
El período de latencia es el tiempo de transición entre el evento de contagio y la manifestación de la enfermedad. En casos de enfermedades con períodos de latencia variables, el número básico de reproducción se puede calcular como la suma de los números de reproducción para cada tiempo de transición hacia la enfermedad. Un ejemplo de esto es la tuberculosis (TB). Blower y coautores calcularon a partir de un modelo simple de TB el siguiente número de reproducción: [61] En su modelo, se supone que los individuos infectados pueden desarrollar TB activa ya sea por progresión directa (la enfermedad se desarrolla inmediatamente después de la infección) considerada anteriormente como tuberculosis RÁPIDA o reactivación endógena (la enfermedad se desarrolla años después de la infección) considerada anteriormente como tuberculosis LENTA. [62]
Otras consideraciones dentro de los modelos epidémicos compartimentados
Transmisión vertical
En el caso de algunas enfermedades, como el SIDA y la hepatitis B, es posible que los hijos de padres infectados nazcan infectados. Esta transmisión de la enfermedad de la madre hacia abajo se denomina transmisión vertical. La afluencia de miembros adicionales a la categoría infectada se puede considerar dentro del modelo incluyendo una fracción de los miembros recién nacidos en el compartimento infectado. [63]
Transmisión vectorial
Las enfermedades que se transmiten de persona a persona de forma indirecta, es decir, la malaria que se propaga a través de mosquitos, se transmiten a través de un vector. En estos casos, la infección se transfiere de persona a insecto y un modelo epidémico debe incluir ambas especies, lo que generalmente requiere muchos más compartimentos que un modelo de transmisión directa. [63] [64]
Otros
Otros hechos que pueden tener que tenerse en cuenta al modelar una epidemia incluyen cosas como las siguientes: [63]
- Mezcla no homogénea
- Infectividad variable
- Distribuciones que no son uniformes espacialmente
- Enfermedades causadas por macroparásitos
Modelos epidémicos deterministas y estocásticos
Los modelos deterministas presentados aquí son válidos solo en caso de poblaciones suficientemente grandes y, como tal, deben usarse con cautela. [65] [66] Estos modelos solo son válidos en el límite termodinámico , donde la población es efectivamente infinita. En los modelos estocásticos, el equilibrio endémico de largo plazo derivado anteriormente no se cumple, ya que existe una probabilidad finita de que el número de individuos infectados caiga por debajo de uno en un sistema. En un sistema verdadero, entonces, el patógeno puede no propagarse, ya que ningún huésped será infectado. Pero, en los modelos deterministas de campo medio, el número de infectados puede tomar valores reales, es decir, no enteros de huéspedes infectados, y el número de huéspedes en el modelo puede ser menor que uno, pero mayor que cero, lo que permite que el patógeno en el modelo se propague. La confiabilidad de los modelos compartimentados está limitada a las aplicaciones compartimentadas.
Una de las posibles extensiones de los modelos de campo medio considera la propagación de epidemias en una red basada en conceptos de la teoría de la percolación . [37] Los modelos epidémicos estocásticos se han estudiado en diferentes redes [67] [68] [69] y más recientemente se han aplicado a la pandemia de COVID-19 . [70]
Véase también
- Tasa de ataque
- Número básico de reproducción
- Aplanar la curva
- Lista de modelos de simulación de COVID-19
- Modelización matemática en epidemiología
- Problema de unidad de área modificable
- Matriz de próxima generación
- Evaluación de riesgos
Referencias
- ^ Ross R (1 de febrero de 1916). "Una aplicación de la teoría de probabilidades al estudio de la patometría a priori. Parte I". Actas de la Royal Society de Londres. Serie A, que contiene artículos de carácter matemático y físico . 92 (638): 204–230. Bibcode :1916RSPSA..92..204R. doi : 10.1098/rspa.1916.0007 .
- ^ Ross R, Hudson H (3 de mayo de 1917). "Una aplicación de la teoría de probabilidades al estudio de la patometría a priori. Parte II". Actas de la Royal Society de Londres. Serie A, que contiene artículos de carácter matemático y físico . 93 (650): 212–225. Bibcode :1917RSPSA..93..212R. doi : 10.1098/rspa.1917.0014 .
- ^ Ross R, Hudson H (1917). "Una aplicación de la teoría de probabilidades al estudio de la patometría a priori. Parte III". Actas de la Royal Society de Londres. Serie A, que contiene artículos de carácter matemático y físico . 89 (621): 225–240. Bibcode :1917RSPSA..93..225R. doi : 10.1098/rspa.1917.0015 .
- ^ abcd Kermack WO, McKendrick AG (1927). "Una contribución a la teoría matemática de las epidemias". Actas de la Royal Society de Londres. Serie A, que contiene artículos de carácter matemático y físico . 115 (772): 700–721. Bibcode :1927RSPSA.115..700K. doi : 10.1098/rspa.1927.0118 .
- ^ ab Kendall DG (1956). "Epidemias deterministas y estocásticas en poblaciones cerradas". Contribuciones a la biología y los problemas de salud . Vol. 4. University of California Press. págs. 149-165. doi :10.1525/9780520350717-011. ISBN 978-0-520-35071-7.MR 0084936.Zbl 0070.15101 .
- ^ Engelmann, Lukas (30 de agosto de 2021). "Una caja, un comedero y canicas: cómo la teoría de la epidemia de Reed-Frost dio forma al razonamiento epidemiológico en el siglo XX". Historia y filosofía de las ciencias de la vida . 43 (3): 105. doi :10.1007/s40656-021-00445-z. ISSN 1742-6316. PMC 8404547 . PMID 34462807.
- ^ abc Harko T, Lobo FS, Mak MK (2014). "Soluciones analíticas exactas del modelo epidémico Susceptible-Infectado-Recuperado (SIR) y del modelo SIR con tasas de mortalidad y natalidad iguales". Matemáticas Aplicadas y Computación . 236 : 184–194. arXiv : 1403.2160 . Código Bibliográfico :2014arXiv1403.2160H. doi :10.1016/j.amc.2014.03.030. S2CID 14509477.
- ^ abc Beckley R, Weatherspoon C, Alexander M, Chandler M, Johnson A, Bhatt GS (2013). "Modeling epidemics with differentiation equations" (PDF) ( Modelado de epidemias con ecuaciones diferenciales) . Informe interno de la Universidad Estatal de Tennessee . Consultado el 19 de julio de 2020 .
- ^ abcde Kröger M, Schlickeiser R (2020). "Solución analítica del modelo SIR para la evolución temporal de epidemias. Parte A: Factor de reproducción independiente del tiempo". Journal of Physics A . 53 (50): 505601. Bibcode :2020JPhA...53X5601K. doi : 10.1088/1751-8121/abc65d . S2CID 225555567.
- ^ ab Schlickeiser R, Kröger M (2021). "Solución analítica del modelo SIR para la evolución temporal de epidemias. Parte B: Caso semitemporal". Journal of Physics A . 54 (17): 175601. Bibcode :2021JPhA...54q5601S. doi : 10.1088/1751-8121/abed66 . hdl : 20.500.11850/479548 .
- ^ ab Yang W, Zhang D, Peng L, Zhuge C, Hong L (2020). "Evaluación racional de varios modelos epidémicos basados en los datos de COVID-19 de China". arXiv : 2003.05666v1 [q-bio.PE].
- ^ Simon, Cory (2020). "El modelo dinámico SIR de transmisión de enfermedades infecciosas y su analogía con la cinética química". PeerJ Physical Chemistry . 2 (2): e14. doi : 10.7717/peerj-pchem.14 .
- ^ Krylova O, Earn DJ (julio de 2013). "Efectos de la distribución del período infeccioso en las transiciones previstas en la dinámica de las enfermedades infantiles". Journal of the Royal Society, Interface . 10 (84): 20130098. doi : 10.1098/rsif.2013.0098 . PMC 3673147 . PMID 23676892.
- ^ Hethcote H (2000). "Las matemáticas de las enfermedades infecciosas". SIAM Review . 42 (4): 599–653. Bibcode :2000SIAMR..42..599H. doi :10.1137/s0036144500371907. S2CID 10836889.
- ^ ab Bailey, Norman TJ (1975). La teoría matemática de las enfermedades infecciosas y sus aplicaciones (2.ª ed.). Londres: Griffin. ISBN 0-85264-231-8.
- ^ Sonia Altizer; Nunn, Charles (2006). Enfermedades infecciosas en primates: comportamiento, ecología y evolución . Oxford Series in Ecology and Evolution. Oxford [Oxfordshire]: Oxford University Press. ISBN 0-19-856585-2.
- ^ Wolfram Research, Inc. "Mathematica, versión 12.1". Champaign, Illinois, 2020.
- ^ Capasso V (1993). Estructura matemática de los sistemas epidémicos . Berlín: Springer. ISBN 3-540-56526-4.
- ^ Miller JC (septiembre de 2012). "Una nota sobre la derivación de los tamaños finales de las epidemias". Boletín de biología matemática . 74 (9): 2125–2141. doi :10.1007/s11538-012-9749-6. PMC 3506030 . PMID 22829179.
Sección 4.1
- ^ Miller JC (febrero de 2017). "Modelos matemáticos de propagación de la enfermedad SIR con vías de transmisión sexual y no sexual combinadas". Infectious Disease Modelling . 2 (1): 35–55. doi :10.1016/j.idm.2016.12.003. PMC 5963332 . PMID 29928728.
Sección 2.1.3
- ^ abcd Hart KD, Thompson C, Burger C, Hardwick D, Michaud AH, Bulushi A, Pridemore C, Ward C, Chen J (2021). "Aprendizaje remoto del análisis cinético de COVID-19 en una clase de laboratorio de química física". ACS Omega . 6 (43): 29223–29232. doi :10.1021/acsomega.1c04842. PMC 8547164 . PMID 34723043.
- ^ abcd Smith DK, Lauro K, Kelly D, Fish J, Lintelman E, McEwen D, Smith C, Stecz M, Ambagaspitiya TD, Chen J (2022). "Enseñanza de laboratorio de química física de pregrado con análisis cinético de COVID-19 en los Estados Unidos". Revista de educación química . 99 (10): 3471–3477. Código Bibliográfico :2022JChEd..99.3471S. doi :10.1021/acs.jchemed.2c00416. PMC 9799982 . PMID 36589277. S2CID 251484056.
- ^ Padua RN, Tulang AB (2 de diciembre de 2010). "Un modelo epidemiológico dependiente de la densidad para la propagación de enfermedades infecciosas". Liceo Journal of Higher Education Research . 6 (2). doi :10.7828/ljher.v6i2.62.
- ^ May RM , Anderson B (24 de septiembre de 1992). Enfermedades infecciosas de los seres humanos: dinámica y control (edición revisada). Oxford: Oxford University Press. ISBN 978-0-19-854040-3.
- ^ von Csefalvay, Chris (1 de enero de 2023), von Csefalvay, Chris (ed.), "Factores del huésped", Modelado computacional de enfermedades infecciosas , Academic Press, págs. 93-119, doi : 10.1016/b978-0-32-395389-4.00012-8 , ISBN 978-0-323-95389-4
- ^ Hethcote HW (1989). "Tres modelos epidemiológicos básicos". En Levin SA, Hallam TG, Gross LJ (eds.). Ecología matemática aplicada . Biomatemáticas. Vol. 18. Berlín: Springer. págs. 119-144. doi :10.1007/978-3-642-61317-3_5. ISBN . 3-540-19465-7.
- ^ Nakamura, GM; Cardoso, GC; Martínez, AS (2020). "Ecuaciones epidémicas susceptibles-infecciosas-susceptibles mejoradas basadas en incertidumbres y funciones de autocorrelación". Royal Society Open Science . 7 (2): 191504. Bibcode :2020RSOS....791504N. doi :10.1098/rsos.191504. PMC 7062106 . PMID 32257317.
- ^ "(p. 19) El modelo SI" (PDF) .
- ^ Al-Raeei, Marwan (2021). "El número básico de reproducción de la nueva pandemia de coronavirus con mortalidad para la India, la República Árabe Siria, los Estados Unidos, Yemen, China, Francia, Nigeria y Rusia con diferentes tasas de casos". Epidemiología clínica y salud global . 9 : 147–149. doi :10.1016/j.cegh.2020.08.005. ISSN 2452-0918. PMC 7438206 . PMID 32844133.
- ^ La primera y la segunda ecuación diferencial se transforman y se llevan a la misma forma que para el modelo SIR anterior.
- ^ abc Schlickeiser R, Kröger M (2021). "Modelado analítico de la evolución temporal de los brotes epidémicos teniendo en cuenta las vacunaciones". Física . 3 (2): 386. Bibcode :2021Physi...3..386S. doi : 10.3390/physics3020028 . hdl : 20.500.11850/487253 . S2CID 233589998.
- ^ abcd Schlickeiser R, Kröger M (2024). "Matemáticas de epidemias: solución general de los modelos SIRVD, SIRV, SIRD y SIR". Matemáticas . 12 : 941. doi : 10.3390/math12070941 . hdl : 20.500.11850/665745 .
- ^ ab Hunziker P (24 de julio de 2021). "Vacunación contra la COVID-19 con dosis personalizadas en una ola de variantes del virus que suscitan preocupación: intercambiar la eficacia individual por el beneficio social". Precision Nanomedicine . 4 (3): 805–820. doi : 10.33218/001c.26101 .
- ^ Noble JV (agosto de 1974). «Desarrollo geográfico y temporal de las plagas». Nature . 250 (5469): 726–729. Bibcode :1974Natur.250..726N. doi :10.1038/250726a0. PMID 4606583. S2CID 4210869.
- ^ Te Vrugt M, Bickmann J, Wittkowski R (noviembre de 2020). "Efectos del distanciamiento social y el aislamiento en la propagación de epidemias modelados a través de la teoría funcional de la densidad dinámica". Nature Communications . 11 (1): 5576. arXiv : 2003.13967 . Bibcode :2020NatCo..11.5576T. doi : 10.1038/s41467-020-19024-0 . PMC 7643184 . PMID 33149128.
- ^ Hunziker P (7 de marzo de 2021). "Estrategias de vacunación para minimizar la pérdida de vidas por Covid-19 en una Europa con escasez de vacunas". medRxiv 10.1101/2021.01.29.21250747 .
- ^ ab Croccolo F, Roman HE (octubre de 2020). "Propagación de infecciones en gráficos aleatorios: un modelo de tipo percolación para COVID-19". Caos, solitones y fractales . 139 : 110077. arXiv : 2006.10490 . Código Bibliográfico :2020CSF...13910077C. doi :10.1016/j.chaos.2020.110077. PMC 7332959 . PMID 32834619. S2CID 219792089.
- ^ ab Kastalskiy, IA; Pankratova, EV; Mirkes, EM; et al. (2021). "El estrés social impulsa la dinámica de múltiples ondas de los brotes de COVID-19". Scientific Reports . 11 (1): 22497. arXiv : 2106.08966 . Bibcode :2021NatSR..1122497K. doi : 10.1038/s41598-021-01317-z . PMC 8602246 . PMID 34795311.
- ^ El repositorio de datos de COVID-19. El Centro de Ciencia e Ingeniería de Sistemas (CSSE) de la Universidad Johns Hopkins (JHU); los datos preprocesados se encuentran aquí: Proyecto World in Data.
- ^ Paxson, Wei; Shen, Bo-Wen (1 de octubre de 2022). "Una ecuación KdV–SIR y sus soluciones analíticas para ondas epidémicas solitarias". Revista internacional de bifurcación y caos . 32 (13): 2250199–2250780. Código Bibliográfico :2022IJBC...3250199P. doi :10.1142/S0218127422501991. ISSN 0218-1274. S2CID 253314121.
- ^ abc Dolbeault, Jean; Turinici, Gabriel (2020). "Interacciones sociales heterogéneas y el resultado del confinamiento por COVID-19 en un modelo SEIR multigrupo". Math. Model. Nat. Phenom . 15 : 36. arXiv : 2005.00049 . doi :10.1051/mmnp/2020025.
- ^ Berihuete, Ángel; Sánchez-Sánchez, Marta; Suárez-Llorens, Alfonso (2021). "Un modelo bayesiano de casos de COVID-19 basado en la curva de Gompertz". Matemáticas . 9 (3): 228. doi : 10.3390/math9030228 . ISSN 2227-7390.
- ^ Berestycki, Henri; Desjardins, Benoît; Weitz, Joshua S.; Oury, Jean-Marc (2023). "Modelado de epidemias con heterogeneidad y difusión social". Revista de biología matemática . 86 (4): 60. doi :10.1007/s00285-022-01861-w.
- ^ Gao S, Teng Z, Nieto JJ, Torres A (2007). "Análisis de un modelo epidémico SIR con vacunación en pulso y retardo temporal distribuido". Journal of Biomedicine & Biotechnology . 2007 : 64870. doi : 10.1155/2007/64870 . PMC 2217597 . PMID 18322563.
- ^ Fine, Paul EM; Clarkson, Jacqueline A. (1986). "Prioridades individuales versus públicas en la determinación de políticas óptimas de vacunación". American Journal of Epidemiology . 124 (6). Oxford University Press: 1012–1020. doi :10.1093/oxfordjournals.aje.a114471. PMID 3096132.
- ^ Geoffard, Pierre-Yves; Philipson, Tomas (1997). "Erradicación de enfermedades: vacunación privada versus pública". The American Economic Review . 87 (1). JSTOR: 222–230.
- ^ Bauch, Chris T.; Earn, David JD (2004). "Vacunación y la teoría de juegos". Actas de la Academia Nacional de Ciencias . 101 (36). National Acad Sciences: 13391–13394. Bibcode :2004PNAS..10113391B. doi : 10.1073/pnas.0403823101 . PMID 15329411.
- ^ Shim, Eunha; Chapman, Gretchen B; Townsend, Jeffrey P; Galvani, Alison P (2012). "La influencia del altruismo en las decisiones de vacunación contra la gripe". Journal of the Royal Society Interface . 9 (74). La Royal Society: 2234–2243. doi :10.1098/rsif.2012.0115. PMC 3405754 . PMID 22496100.
- ^ ab Laguzet, Laetitia; Turinici, Gabriel (1 de octubre de 2015). "Vacunación individual como equilibrio de Nash en un modelo SIR con aplicación a la epidemia de influenza A (H1N1) de 2009-2010 en Francia". Boletín de biología matemática . 77 (10): 1955–1984. doi :10.1007/s11538-015-0111-7. ISSN 1522-9602. PMID 26443437.
- ^ Elie, Romuald; Hubert, Emma; Turinici, Gabriel (2020). "Control de la epidemia de COVID-19 mediante la tasa de contacto: una visión de equilibrio". Modelado matemático de fenómenos naturales . 15 . EDP Sciences: 35. doi :10.1051/mmnp/2020022.
- ^ Diekmann, O.; Heesterbeek, JAP; Metz, JAJ (1990-06-01). "Sobre la definición y el cálculo de la tasa básica de reproducción R0 en modelos para enfermedades infecciosas en poblaciones heterogéneas". Journal of Mathematical Biology . 28 (4): 365–382. doi :10.1007/BF00178324. hdl : 1874/8051 . ISSN 1432-1416. PMID 2117040. S2CID 22275430.
- ^ ab Heffernan, JM; Smith, RJ; Wahl, LM (22 de septiembre de 2005). "Perspectivas sobre la proporción reproductiva básica". Revista de la Royal Society Interface . 2 (4): 281–293. doi :10.1098/rsif.2005.0042. ISSN 1742-5689. PMC 1578275 . PMID 16849186.
- ^ ab van den Driessche, P.; Watmough, James (1 de noviembre de 2002). "Números de reproducción y equilibrios endémicos subumbral para modelos compartimentados de transmisión de enfermedades". Ciencias biológicas matemáticas . 180 (1): 29–48. doi :10.1016/S0025-5564(02)00108-6. ISSN 0025-5564. PMID 12387915. S2CID 17313221.
- ^ JH Jones, Notas sobre R0. Universidad de Stanford (2007).
- ^ Diekmann, Odo; Heesterbeek, Hans; Britton, Tom (18 de noviembre de 2012). Herramientas matemáticas para comprender la dinámica de las enfermedades infecciosas. Princeton University Press. ISBN 978-0-691-15539-5.
- ^ van den Driessche, P.; Watmough, James (2008), Brauer, Fred; van den Driessche, Pauline; Wu, Jianhong (eds.), "Notas adicionales sobre el número de reproducción básico", Epidemiología matemática , Lecture Notes in Mathematics, vol. 1945, Berlín, Heidelberg: Springer, págs. 159-178, doi :10.1007/978-3-540-78911-6_6, ISBN 978-3-540-78911-6, consultado el 8 de noviembre de 2022
- ^ Diekmann O, Heesterbeek JA, Metz JA (1990). "Sobre la definición y el cálculo de la tasa básica de reproducción R0 en modelos de enfermedades infecciosas en poblaciones heterogéneas". Journal of Mathematical Biology . 28 (4): 365–82. doi :10.1007/BF00178324. hdl : 1874/8051 . PMID 2117040. S2CID 22275430.
- ^ Wohl S, Schaffner SF, Sabeti PC (septiembre de 2016). "Análisis genómico de brotes virales". Revisión anual de virología . 3 (1): 173–195. doi :10.1146/annurev-virology-110615-035747. PMC 5210220 . PMID 27501264.
- ^ Lipsitch M, Cohen T, Cooper B, Robins JM, Ma S, James L, et al. (junio de 2003). "Dinámica de transmisión y control del síndrome respiratorio agudo severo". Science . 300 (5627): 1966–70. Bibcode :2003Sci...300.1966L. doi :10.1126/science.1086616. PMC 2760158 . PMID 12766207.
- ^ Rihan, Fathalla A.; Anwar, M. Naim (2012). "Análisis cualitativo del modelo epidémico SIR retardado con una tasa de incidencia saturada". Revista internacional de ecuaciones diferenciales . 2012 : 1–13. doi : 10.1155/2012/408637 .
- ^ Blower SM, McLean AR, Porco TC, Small PM, Hopewell PC, Sanchez MA, Moss AR (agosto de 1995). "La dinámica de transmisión intrínseca de las epidemias de tuberculosis". Nature Medicine . 1 (8): 815–21. doi :10.1038/nm0895-815. PMID 7585186. S2CID 19795498.
- ^ Ma Y, Horsburgh CR, White LF, Jenkins HE (septiembre de 2018). "Cuantificación de la transmisión de la tuberculosis: una revisión sistemática de las estimaciones del número de reproducción y del intervalo serial para la tuberculosis". Epidemiología e infección . 146 (12): 1478–1494. doi :10.1017/S0950268818001760. PMC 6092233 . PMID 29970199.
- ^ abc Brauer F, Castillo-Chávez C (2001). Modelos matemáticos en biología de poblaciones y epidemiología . Nueva York: Springer. ISBN 0-387-98902-1.
- ^ Para más información sobre este tipo de modelo, véase Anderson RM , ed. (1982). Population Dynamics of Infectious Diseases: Theory and Applications . Londres-Nueva York: Chapman and Hall. ISBN 0-412-21610-8.
- ^ Tembine, H (2020). "COVID-19: perspectiva de juego de tipo campo medio basada en datos". Games Journal . 11, 51 (4): 1–111 . Consultado el 24 de noviembre de 2022 .
- ^ Bartlett MS (1957). "Periodicidad del sarampión y tamaño de la comunidad". Revista de la Royal Statistical Society, Serie A. 120 ( 1): 48–70. doi :10.2307/2342553. JSTOR 2342553. S2CID 91114210.
- ^ May RM, Lloyd AL (diciembre de 2001). "Dinámica de infecciones en redes sin escala". Physical Review E . 64 (6 Pt 2): 066112. Bibcode :2001PhRvE..64f6112M. doi :10.1103/PhysRevE.64.066112. PMID 11736241.
- ^ Pastor-Satorras R, Vespignani A (abril de 2001). "Propagación de epidemias en redes sin escala". Physical Review Letters . 86 (14): 3200–3203. arXiv : cond-mat/0010317 . Código Bibliográfico :2001PhRvL..86.3200P. doi :10.1103/PhysRevLett.86.3200. hdl :2117/126209. PMID 11290142. S2CID 16298768.
- ^ Newman ME (julio de 2002). "Propagación de enfermedades epidémicas en redes". Physical Review E . 66 (1 Pt 2): 016128. arXiv : cond-mat/0205009 . Bibcode :2002PhRvE..66a6128N. doi :10.1103/PhysRevE.66.016128. PMID 12241447. S2CID 15291065.
- ^ Wong F, Collins JJ (noviembre de 2020). "Evidencia de que la superpropagación del coronavirus es de cola gruesa". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 117 (47): 29416–29418. Bibcode :2020PNAS..11729416W. doi : 10.1073/pnas.2018490117 . PMC 7703634 . PMID 33139561. S2CID 226242440.
Lectura adicional
- May RM , Anderson RM (1991). Enfermedades infecciosas de los seres humanos: dinámica y control . Oxford: Oxford University Press. ISBN 0-19-854040-X.
- Vynnycky E, White RG, eds. (2010). Introducción a la modelización de enfermedades infecciosas . Oxford: Oxford University Press. ISBN 978-0-19-856576-5.
- Capasso V (2008). Estructuras matemáticas de sistemas epidémicos. 2.ª edición . Heidelberg: Springer. ISBN 978-3-540-56526-0.
- Carlson CS, Rubin DM, Heikkilä V, Postema M (2021). "Extracción de parámetros de transmisión y recuperación para un modelo adaptativo de dinámica de sistemas globales de la pandemia de COVID-19". 2021 IEEE Africon (PDF) . págs. 456–459. doi :10.1109/AFRICON51333.2021.9570946. ISBN . 978-1-6654-1984-0.S2CID239899862 .
Enlaces externos
- Modelo SIR: experimentos en línea con JSXGraph
- "Simulando una epidemia". 3Blue1Brown . 27 de marzo de 2020 – vía YouTube .










![{\displaystyle \left\{{\begin{aligned}&{\frac {dS}{dt}}=-\beta IS,\\[6pt]&{\frac {dI}{dt}}=\beta IS-\gamma I,\\[6pt]&{\frac {dR}{dt}}=\gamma I,\end{aligned}}\right.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f001627c826e1cf2bd5742356b38762ee50742d6)





































![{\displaystyle {\begin{aligned}S(t)&=S(0)e^{-\xi (t)}\\[8pt]I(t)&=NS(t)-R(t)\\[8pt]R(t)&=R(0)+\rho \xi (t)\\[8pt]\xi (t)&={\frac {\beta }{N}}\int _{0}^{t}I(t^{*})\,dt^{*}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6f6ac0eda5b1278f31690939cdfa1f4daa6b1762)


































![{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=\Lambda -\mu S-{\frac {\beta IS}{N}}\\[8pt]{\frac {dI}{dt}}&={\frac {\beta IS}{N}}-\gamma I-\mu I\\[8pt]{\frac {dR}{dt}}&=\gamma I-\mu R\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0dad81f67db0f075bec720950feaeeb653916028)

























![{\displaystyle \operatorname {E} [\min(T_{L}\mid T_{S})]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c4a1be62e9d674a94ab536644fa3f56c77503cdf)


![{\displaystyle \operatorname {E} [\min(T_{L}\mid T_{S})]=\int _{0}^{\infty }e^{-(\mu +\delta )x}\,dx={\frac {1}{\mu +\delta }},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6cd0d8220231a82d54da2c2e818ee2b426c23e62)





![{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=-{\frac {\beta SI}{N}}+\gamma I\\[6pt]{\frac {dI}{dt}}&={\frac {\beta SI}{N}}-\gamma I\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/605895c64d824511c45ba20ba151ce5b1cec12fc)



![{\displaystyle {\begin{aligned}&{\frac {\beta }{\gamma }}\leq 1\Rightarrow \lim _{t\to +\infty }I(t)=0,\\[6pt]&{\frac {\beta }{\gamma }}>1\Rightarrow \lim _{t\to +\infty }I(t)=\left(1-{\frac {\gamma }{\beta }}\right)N.\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/05a8022e25ade4141cdf7a411b25dbb8abfc66b9)















![{\displaystyle {\begin{aligned}&{\frac {dS}{dt}}=-{\frac {\beta IS}{N}},\\[6pt]&{\frac {dI}{dt}}={\frac {\beta IS}{N}}-\gamma I-\mu I,\\[6pt]&{\frac {dR}{dt}}=\gamma I,\\[6pt]&{\frac {dD}{dt}}=\mu I,\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1211c5146940bacb8a0df97780330a2599eb4625)

![{\displaystyle {\begin{aligned}&{\frac {dS}{dt}}=-{\frac {\beta (t)IS}{N}}-v(t)S,\\[6pt]&{\frac {dI}{dt}}={\frac {\beta (t)IS}{N}}-\gamma (t)I,\\[6pt]&{\frac {dR}{dt}}=\gamma (t)I,\\[6pt]&{\frac {dV}{dt}}=v(t)S,\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/15bce40926efffe7fce767afe2ead314829ff41c)












![{\displaystyle {\begin{aligned}&{\frac {dS}{dt}}=-a(t)SI-v(t)S,\\[6pt]&{\frac {dI}{dt}}=a(t)SI-\mu (t)I-\psi (t)I,\\[6pt]&{\frac {dR}{dt}}=\mu (t)I,\\[6pt]&{\frac {dV}{dt}}=v(t)S,\\[6pt]&{\frac {dD}{dt}}=\psi (t)I\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/497e87f78743475960052d107c647e8258aee060)








![{\displaystyle {\begin{aligned}&{\frac {dS}{d\tau}}=-SI-b(\tau )S,\\[6pt]&{\frac {dI}{d\tau}}=SI-[k(\tau )+q(\tau )]I,\\[6pt]&{\frac {dR}{d\tau}}=k(\tau )I,\\[6pt]&{\frac {dV}{d\tau}}=b(\tau )S,\\[6pt]&{\frac {dD}{d\tau}}=q(\tau )S\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f07bfceed5bb590bda65d793ba6076d6bebf3cb0)



![{\displaystyle {\begin{aligned}{\frac {dM}{dt}}&=\Lambda -\delta M-\mu M\\[8pt]{\frac {dS}{dt}}&=\delta M-{\frac {\beta SI}{N}}-\mu S\\[8pt]{\frac {dI}{dt}}&={\frac {\beta SI}{N}}-\gamma I-\mu I\\[8pt]{\frac {dR}{dt}}&=\gamma I-\mu R\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f5a17da090fac7ceb0999445ceb4b217e575c524)



![{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=\mu N-\mu S-{\frac {\beta IS}{N}}\\[8pt]{\frac {dE}{dt}}&={\frac {\beta IS}{N}}-(\mu +a)E\\[8pt]{\frac {dI}{dt}}&=aE-(\gamma +\mu )I\\[8pt]{\frac {dR}{dt}}&=\gamma I-\mu R.\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3da10d1a165eef9e341aae30f70418730fbfa6e5)


![{\displaystyle \left(S(0),E(0),I(0),R(0)\right)\in \left\{(S,E,I,R)\in [0,N]^{4}:S\geq 0,E\geq 0,I\geq 0,R\geq 0,S+E+I+R=N\right\}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3190cc59889dab0e9167d4241c117e8a2cefe0e0)



![{\displaystyle {\begin{aligned}{\frac {dE_{1}}{dt}}&=\beta (t)I_{1}-(\gamma +a)E_{1}\\[8pt]{\frac {dI_{1}}{dt}}&=aE_{1}-(\gamma +\mu )I_{1}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e4e137f34047a193685ff0b616c6f86e702f677b)

![{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=\Lambda -{\frac {\beta SI}{N}}-\mu S+\gamma I\\[6pt]{\frac {dE}{dt}}&={\frac {\beta SI}{N}}-(\epsilon +\mu )E\\[6pt]{\frac {dI}{dt}}&=\varepsilon E-(\gamma +\mu )I\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c285f849fed79fdc4a6ef0798104d773cda7510a)

![{\displaystyle {\begin{aligned}{\frac {dM}{dt}}&=\Lambda -\delta M-\mu M\\[6pt]{\frac {dS}{dt}}&=\delta M-{\frac {\beta SI}{N}}-\mu S\\[6pt]{\frac {dE}{dt}}&={\frac {\beta SI}{N}}-(\varepsilon +\mu )E\\[6pt]{\frac {dI}{dt}}&=\varepsilon E-(\gamma +\mu )I\\[6pt]{\frac {dR}{dt}}&=\gamma I-\mu R\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/893a707bc8c2fec6f5ecd6cb93a46ab0652252c2)


![{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=\mu N-\mu S-\beta (t){\frac {I}{N}}S\\[8pt]{\frac {dI}{dt}}&=\beta (t){\frac {I}{N}}S-(\gamma +\mu )I\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6fc5024950a3e4b440788219d6c97f29cab91895)


![{\displaystyle {\begin{aligned}&\partial _{t}S=D_{S}\nabla ^{2}S-{\frac {\beta IS}{N}},\\[6pt]&\partial _{t}I=D_{I}\nabla ^{2}I+{\frac {\beta IS}{N}}-\gamma I,\\[6pt]&\partial _{t}R=D_{R}\nabla ^{2}R+\gamma I,\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2ff4604a302c4b9d30ea91a042665061ab969e00)



















![{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=\nu N(1-P)-\mu S-\beta {\frac {I}{N}}S\\[8pt]{\frac {dI}{dt}}&=\beta {\frac {I}{N}}S-(\mu +\gamma )I\\[8pt]{\frac {dV}{dt}}&=\nu NP-\mu V\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/63771aa3a5908cf37d4614cbdc9d655f2d734f10)






![{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=\mu N(1-P)-\mu S-\rho S-\beta {\frac {I}{N}}S\\[8pt]{\frac {dV}{dt}}&=\mu NP+\rho S-\mu V\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b556735b37a851da6eeffe357d39ef0e64a20187)

![{\displaystyle {\begin{aligned}{\frac {dS}{dt}}&=\mu N-\mu S-\beta {\frac {I}{N}}S,\quad S(nT^{+})=(1-p)S(nT^{-}),&&n=0,1,2,\ldots \\[8pt]{\frac {dV}{dt}}&=-\mu V,\quad V(nT^{+})=V(nT^{-})+pS(nT^{-}),&&n=0,1,2,\ldots \end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fa20fd9c5facbd652241be938c9ac9fb3dae0204)





























































































