Ácido maleico
 | |
 | |
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Ácido (2 Z )-But-2-enedioico | |
| Otros nombres Ácido ( Z )-butenedioico; Ácido cis -butenedioico; Ácido maleico; Ácido maleínico; Ácido toxílico | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| 3DMet |
|
| 605762 | |
| EBICh | |
| Química biológica | |
| Araña química | |
| Banco de medicamentos |
|
| Tarjeta informativa de la ECHA | 100.003.403 |
| Número CE |
|
| 49854 | |
| BARRIL | |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C4H4O4 | |
| Masa molar | 116,072 g·mol −1 |
| Apariencia | Sólido blanco |
| Densidad | 1,59 g/cm3 [ 1] |
| Punto de fusión | 135 °C (275 °F; 408 K) (se descompone) [2] |
| 478,8 g/L a 20 C [2] | |
| Acidez (p K a ) | p k a1 = 1,90 p k a2 = 6,07 [3] |
| -49,71·10 −6 cm3 / mol | |
| Peligros | |
| Etiquetado SGA : | |
 | |
| Advertencia | |
| H302 , H315 , H317 , H319 , H335 | |
| P261 , P264 , P270 , P271 , P272 , P280 , P301+P312 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P321 , P330 , P332 +P313 , P333+P313. , P337+ P313 , P362 , P363 , P403+P233 , P405 , P501 | |
| NFPA 704 (rombo cortafuegos) | |
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad de JT Baker |
| Compuestos relacionados | |
Ácidos carboxílicos relacionados | ácido fumárico ácido succínico ácido crotónico |
Compuestos relacionados | anhídrido maleico maleimida |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
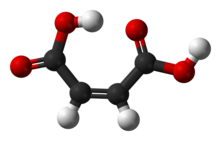
El ácido maleico o ácido cis -butenedioico es un compuesto orgánico que es un ácido dicarboxílico , una molécula con dos grupos carboxilo . Su fórmula química es HO2CCH =CHCO2H . El ácido maleico es el isómero cis del ácido butenedioico, mientras que el ácido fumárico es el isómero trans . El ácido maleico se utiliza principalmente como precursor del ácido fumárico, y en relación con su progenitor, el anhídrido maleico , que tiene muchas aplicaciones. [4]
Propiedades físicas
El ácido maleico tiene un calor de combustión de -1.355 kJ/mol, [5] 22,7 kJ/mol más alto que el del ácido fumárico. El ácido maleico es más soluble en agua que el ácido fumárico . El punto de fusión del ácido maleico (135 °C) también es mucho más bajo que el del ácido fumárico (287 °C). Como lo confirma la cristalografía de rayos X , el ácido maleico es plano. Se observan dos enlaces de hidrógeno normales, uno intramolecular y otro intermolecular. El análisis cristalográfico muestra que el enlace de hidrógeno intramolecular se ve poco afectado en la sal monopotásica. [6]
Aplicaciones industriales y de producción
En la industria, el ácido maleico se deriva por hidrólisis del anhídrido maleico , este último se produce por oxidación del benceno o del butano . [4]
El ácido maleico es una materia prima industrial para la producción de ácido glioxílico por ozonólisis . [7]
El ácido maleico se puede utilizar para formar sales de adición de ácido con medicamentos para hacerlos más estables, como el maleato de indacaterol.
El ácido maleico también se utiliza como promotor de adhesión para diferentes sustratos, como nailon y metales recubiertos de zinc, por ejemplo acero galvanizado, en adhesivos a base de metacrilato de metilo.
Isomerización a ácido fumárico
El principal uso industrial del ácido maleico es su conversión en ácido fumárico . Esta conversión, una isomerización , está catalizada por una variedad de reactivos, como ácidos minerales y tiourea . Nuevamente, la gran diferencia en la solubilidad en agua hace que la purificación del ácido fumárico sea fácil.
La isomerización es un tema popular en las escuelas. El ácido maleico y el ácido fumárico no se interconvierten espontáneamente porque la rotación alrededor de un doble enlace carbono-carbono no es energéticamente favorable. Sin embargo, la conversión del isómero cis en el isómero trans es posible por fotólisis en presencia de una pequeña cantidad de bromo . [8] La luz convierte el bromo elemental en un radical bromo , que ataca al alqueno en una reacción de adición radical a un radical bromo-alcano; y ahora es posible la rotación del enlace simple. Los radicales bromo se recombinan y se forma ácido fumárico. En otro método (usado como demostración en el aula), el ácido maleico se transforma en ácido fumárico a través del proceso de calentamiento del ácido maleico en solución de ácido clorhídrico . La adición reversible (de H + ) conduce a la rotación libre alrededor del enlace CC central y la formación del ácido fumárico más estable y menos soluble.
Algunas bacterias producen la enzima maleato isomerasa , que es utilizada por las bacterias en el metabolismo del nicotinato . Esta enzima cataliza la isomerización entre fumarato y maleato.
Otras reacciones
Aunque no se practica comercialmente, el ácido maleico se puede convertir en anhídrido maleico por deshidratación , en ácido málico por hidratación y en ácido succínico por hidrogenación ( etanol / paladio sobre carbono ). [9] Reacciona con cloruro de tionilo o pentacloruro de fósforo para dar el cloruro de ácido maleico (no es posible aislar el cloruro de monoácido). El ácido maleico, al ser electrófilo, participa como dienófilo en muchas reacciones de Diels-Alder .
Maleatos
El ion maleato es la forma ionizada del ácido maleico. El ion maleato es útil en bioquímica como inhibidor de las reacciones de las transaminasas . Los ésteres de ácido maleico también se denominan maleatos, por ejemplo, maleato de dimetilo .
Uso en medicamentos farmacéuticos
Muchos medicamentos que contienen aminas se proporcionan como sal de ácido maleato , por ejemplo , carfenazina , clorfeniramina , pirilamina , metilergonovina y tietilperazina . [10]
Véase también
Referencias
- ^ Budavari, Susan, ed. (1996), El índice Merck: una enciclopedia de productos químicos, fármacos y productos biológicos (12.ª ed.), Merck, ISBN 0911910123
- ^ ab Registro en la base de datos de sustancias GESTIS del Instituto de Seguridad y Salud Ocupacional
- ^ Manual de química y física del CRC, 73.ª edición; CRC Press: Boca Raton, Florida, 1993
- ^ ab Lohbeck, Kurt; Haferkorn, Herbert; Fuhrmann, Werner; Fedtke, Norbert (2000). "Ácidos maleico y fumárico". Ullmann's Encyclopedia of Industrial Chemistry . doi :10.1002/14356007.a16_053. ISBN 9783527303854.
- ^ Anhídrido maleico, ácido maleico y ácido fumárico Archivado el 2 de noviembre de 2013 en Wayback Machine , Huntsman Petrochemical Corporation
- ^ MN G James, GJ B Williams (1974). "Un refinamiento de la estructura cristalina del ácido maleico". Acta Crystallographica . B30 (5) (5): 1249–1275. Código Bibliográfico :1974AcCrB..30.1249J. doi : 10.1107/S0567740874004626 .
- ^ Producción de ácido glioxílico DSM Archivado el 30 de noviembre de 2005 en Wayback Machine.
- ^ Experimento de isomerización de luz Archivado el 27 de noviembre de 2005 en Wayback Machine. (de la Universidad de Ratisbona , con vídeo)
- ^ Kwesi Amoa (2007). "Hidrogenación catalítica del ácido maleico a presiones moderadas: una demostración en laboratorio". Revista de educación química . 84 (12): 1948. Bibcode :2007JChEd..84.1948A. doi :10.1021/ed084p1948.
- ^ "NCATS Inxight Drugs — Ácido fumárico". drugs.ncats.io . Consultado el 10 de noviembre de 2023 .
Enlaces externos
- Ficha internacional de seguridad química 1186
- Calculadora: actividades de agua y solutos en ácido maleico acuoso




