Sulfóxido

En química orgánica , un sulfóxido , también llamado sulfóxido , es un compuesto organosulfurado que contiene un grupo funcional sulfinilo ( >SO ) unido a dos átomos de carbono . Es un grupo funcional polar . Los sulfóxidos son derivados oxidados de sulfuros . Ejemplos de sulfóxidos importantes son la aliina , un precursor del compuesto que le da su aroma al ajo recién machacado, y el dimetilsulfóxido (DMSO), un solvente común . [1]
Estructura y unión

Los sulfóxidos presentan distancias S–O relativamente cortas. En DMSO, la distancia S–O es 1,531 Å. El centro de azufre es piramidal; la suma de los ángulos en el azufre es de aproximadamente 306°. [3] Los sulfóxidos se representan generalmente con la fórmula estructural R−S(=O)−R', donde R y R' son grupos orgánicos. El enlace entre los átomos de azufre y oxígeno es intermedio entre un enlace dativo y un doble enlace polarizado . [4] La forma de resonancia de doble enlace implica 10 electrones alrededor del azufre (10-S-3 en notación NXL ). El carácter de doble enlace del enlace S−O puede explicarse por la donación de densidad electrónica en orbitales antienlazantes C−S (formas de resonancia "sin enlace" en el lenguaje de enlace de valencia). Sin embargo, debido a su simplicidad y falta de ambigüedad, la IUPAC recomienda el uso de la estructura de doble enlace de octeto expandido para representar sulfóxidos, en lugar de la estructura dipolar o estructuras que invocan contribuyentes de resonancia "sin enlace". [5] La interacción S–O tiene un aspecto electrostático , lo que resulta en un carácter dipolar significativo , con carga negativa centrada en el oxígeno.
Quiralidad

Un par solitario de electrones reside en el átomo de azufre, lo que le da una geometría de par de electrones tetraédrica y una forma piramidal trigonal (número estérico 4 con un par solitario; consulte la teoría VSEPR ). Cuando los dos residuos orgánicos son diferentes, el átomo de azufre es un centro quiral , por ejemplo, en el metil fenil sulfóxido . La barrera de energía requerida para invertir este estereocentro es suficientemente alta como para que los sulfóxidos sean ópticamente estables cerca de la temperatura ambiente. Es decir, la tasa de racemización es lenta a temperatura ambiente. La entalpía de activación para la racemización está en el rango de 35 - 42 kcal/mol y la entropía de activación correspondiente es de -8 - +4 cal/mol-K. Las barreras son más bajas para los sustituyentes alílicos y bencílicos. [6]
Preparación
Los sulfóxidos se preparan típicamente por oxidación de sulfuros , a veces denominada sulfoxidación . [7] El peróxido de hidrógeno es un oxidante típico, pero también se ha utilizado peryodato. [8] En estas oxidaciones, se requiere cuidado para evitar la oxidación excesiva para formar la sulfona . Por ejemplo, el sulfuro de dimetilo se oxida a dimetilsulfóxido y luego a dimetilsulfona . Los sulfuros asimétricos son proquirales , por lo que su oxidación da sulfóxidos quirales. Este proceso se puede realizar de forma enantioselectiva. [9] [10]
Se pueden formar sulfóxidos simétricos a partir de un compuesto de diorganilzinc y dióxido de azufre líquido . [11]
Sulfóxidos de arilo
Además de las rutas de oxidación, los sulfóxidos de diarilo se pueden preparar mediante dos arilaciones de Friedel-Crafts de dióxido de azufre utilizando un catalizador ácido:
- 2ArH + SO2 → Ar2SO + H2O
Tanto los cloruros de aril sulfinilo como los sulfóxidos de diarilo también se pueden preparar a partir de arenos mediante la reacción con cloruro de tionilo en presencia de catalizadores de ácido de Lewis como BiCl 3 , Bi(OTf) 3 , LiClO 4 o NaClO 4 . [12] [13]
Reacciones
Desoxigenación y oxigenación
Los sulfóxidos sufren una desoxigenación para dar sulfuros. Normalmente se utilizan complejos metálicos para catalizar la reacción, utilizando hidrosilanos como reductor estequiométrico. [14] La desoxigenación del dimetilsulfóxido es catalizada por la DMSO reductasa , una molibdenoenzima: [15]
- OSMe 2 + 2 e − + 2 H + → SMe 2 + H 2 O
Reacciones ácido-base
Los grupos α-CH de los sulfóxidos de alquilo son susceptibles a la desprotonación por bases fuertes, como el hidruro de sodio : [16]
- CH3S (O)CH3 + NaH → CH3S ( O ) CH2Na + H2
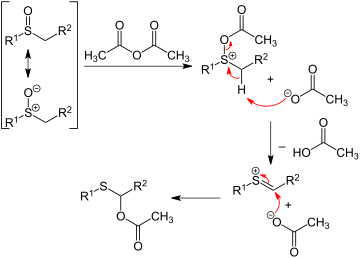
En la transposición de Pummerer , los sulfóxidos de alquilo reaccionan con anhídrido acético para generar la migración del oxígeno desde el azufre al carbono adyacente como un éster de acetato . El primer paso de la secuencia de reacción implica que el oxígeno del sulfóxido actúe como nucleófilo :
Reacciones de eliminación
El sulfóxido sufre una eliminación térmica a través de un mecanismo E i para producir alquenos de vinilo y ácidos sulfénicos . [17] [18]
- CH3S ( O ) CH2CH2R → CH3SOH + CH2 = CHR
Los ácidos son poderosos antioxidantes , pero carecen de estabilidad a largo plazo. [19] Por lo tanto, algunos sulfóxidos originales se comercializan como estabilizadores de polímeros antioxidantes . [20] Las estructuras basadas en ésteres de tiodipropionato son populares. [21] La reacción inversa es posible.
Química de coordinación

Los sulfóxidos, especialmente el DMSO, forman complejos de coordinación con metales de transición. Dependiendo de las propiedades duras o blandas del metal, el sulfóxido se une a través del átomo de azufre o del átomo de oxígeno. Este último es particularmente común. [22]
Aplicaciones y ocurrencia

El DMSO es un disolvente ampliamente utilizado.
El grupo funcional sulfóxido se encuentra en varios fármacos. Destaca el esomeprazol , la forma ópticamente pura del inhibidor de la bomba de protones omeprazol . Otros sulfóxidos de importancia comercial son el armodafinilo .
El sulfóxido de metionina se forma a partir del aminoácido metionina y su acumulación está asociada con el envejecimiento. La enzima DMSO reductasa cataliza la interconversión de DMSO y sulfuro de dimetilo.
Los sulfóxidos quirales que se encuentran naturalmente incluyen la aliina y el ajoeno .
Lectura adicional
- Gama Á, Flores-López LZ, Aguirre G, Parra-Hake M, Hellberg LH, Somanathan R (2003). "Oxidación de sulfuros a sulfóxidos quirales utilizando complejos de base de Schiff-vanadio (IV)". Arkivoc . 2003 (11): 4–15. doi : 10.3998/ark.5550190.0004.b02 . hdl : 2027/spo.5550190.0004.b02 .
Referencias
- ^ Patai S, Rappoport Z, eds. (1995). Síntesis de sulfonas, sulfóxidos y sulfuros cíclicos . Química de grupos funcionales de PATai. John Wiley & Sons. doi :10.1002/9780470666357. ISBN . 9780470666357.
- ^ Yanagisawa S , Itami K (2011). " Catalizador de paladio/2,2′-bipiridilo/Ag2CO3 para la arilación del enlace C–H de heteroarenos con haloarenos". Tetrahedron . 67 (24): 4425–4430. doi :10.1016/j.tet.2011.03.093.
- ^ Thomas R, Shoemaker CB, Eriks K (1966). "La estructura molecular y cristalina del dimetilsulfóxido, (H 3 C) 2 SO". Acta Crystallogr . 21 : 12–20. doi :10.1107/S0365110X66002263..
- ^ Cunningham TP, Cooper DL, Gerratt J, Karadakov PB, Raimondi M (1997). "Enlace químico en oxofluoruros de azufre hipercoordinado". Revista de la Sociedad Química, Faraday Transactions . 93 (13): 2247–2254. doi :10.1039/A700708F.
- ^ Brecher J (2008). "Estándares de representación gráfica para diagramas de estructura química" (PDF) . Química pura y aplicada . 80 : 277–410 (en la pág. 389). doi :10.1351/pac200880020277. hdl : 10092/2052 . S2CID 98211634.
- ^ Fernández I, Khiar N (septiembre de 2003). "Desarrollos recientes en la síntesis y utilización de sulfóxidos quirales". Chemical Reviews . 103 (9): 3651–705. doi :10.1021/cr990372u. PMID 12964880.
- ^ Roy KM (2002). "Sulfonas y sulfóxidos". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a25_487. ISBN 978-3527306732.
- ^ Johnson CR, Keiser JE (1966). "Metilfenilsulfóxido". Org. Síntesis . 46 : 78. doi :10.15227/orgsyn.046.0078.
- ^ Kagan HB, Chellappan SK, Lattanzi A (2015). "( R )-(+)-Metil sulfóxido de fenilo". Enciclopedia E-EROS de reactivos para síntesis orgánica . doi :10.1002/047084289X.rn00456. ISBN 978-0471936237.
- ^ Holland, Herbert Leslie (1988). "Sulfoxidación quiral por biotransformación de sulfuros orgánicos". Chemical Reviews . 88 (3): 473–485. doi :10.1021/cr00085a002.
- ^ Audrieth, Ludwig F.; Kleinberg, Jacob (1953). Disolventes no acuosos. Nueva York: John Wiley & Sons. pág. 222. LCCN 52-12057.
- ^ Peyronneau M, Roques N, Mazières S, Le Roux C (2003). "Activación catalítica del cloruro de tionilo mediante ácido Lewis: aplicación a la síntesis de cloruros de arilsulfinilo catalizados por sales de bismuto (III)". Synlett (5): 0631–0634. doi :10.1055/s-2003-38358.
- ^ Bandgar BP, Makone SS (2004). "Síntesis de sulfóxidos de diarilo simétricos catalizada por perclorato de litio/sodio". Synth. Commun . 34 (4): 743–750. doi :10.1081/SCC-120027723. S2CID 96348273.
- ^ Shiri L, Kazemi M (2017). "Desoxigenación de sulfóxidos". Res. Química. Intermedio . 43 : 6007–6041. doi :10.1016/j.ccr.2014.09.008.
- ^ Sousa SC, Fernandes AC (2015). "Metodologías de desoxigenación eficientes catalizadas por complejos de oxo-molibdeno y oxo-renio". Coord. Chem. Rev. 284 : 67–92. doi :10.1007/s11164-017-2976-6. S2CID 102494853.
- ^ Iwai I, Ide J (1988). "2,3-Difenil-1,3-Butadieno". Síntesis orgánicas; Volúmenes recopilados , vol. 6, pág. 531.
- ^ Michael Carrasco, Robert J. Jones, Scott Kamel, H. Rapoport, Thien Truong (1992). "Éster metílico de N-(benciloxicarbonil)-L-vinilglicina". Organic Syntheses . 70 : 29. doi :10.15227/orgsyn.070.0029.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Cubbage, Jerry W.; Guo, Yushen; McCulla, Ryan D.; Jenks, William S. (1 de diciembre de 2001). "Termólisis de sulfóxidos de alquilo y derivados: una comparación de experimentos y teoría". The Journal of Organic Chemistry . 66 (26): 8722–8736. doi :10.1021/jo0160625. PMID 11749600.
- ^ Koelewijn, P.; Berger, H. (2 de septiembre de 2010). "Mecanismo de acción antioxidante de los dialquilsulfóxidos". Recueil des Travaux Chimiques des Pays-Bas . 91 (11): 1275-1286. doi :10.1002/recl.19720911102.
- ^ Kröhnke, C. (2016). "Estabilización de polímeros". Módulo de referencia en ciencia de materiales e ingeniería de materiales . doi :10.1016/B978-0-12-803581-8.01487-9. ISBN 978-0-12-803581-8.
- ^ Armstrong, C.; Plant, MA; Scott, G. (febrero de 1975). "Mecanismos de acción antioxidante: la naturaleza del comportamiento redox de los ésteres de tiodipropionato en polipropileno". European Polymer Journal . 11 (2): 161–167. doi :10.1016/0014-3057(75)90141-X.
- ^ Calligaris M (2004). "Estructura y enlace en complejos de sulfóxido metálico: una actualización". Coordination Chemistry Reviews . 248 (3–4): 351–375. doi :10.1016/j.ccr.2004.02.005.