Energía de activación

En el modelo de Arrhenius de velocidades de reacción, la energía de activación es la cantidad mínima de energía que debe estar disponible para los reactivos para que se produzca una reacción química . [1] La energía de activación ( E a ) de una reacción se mide en kilojulios por mol (kJ/mol) o kilocalorías por mol (kcal/mol). [2] La energía de activación puede considerarse como la magnitud de la barrera de potencial (a veces llamada barrera de energía) que separa los mínimos de la superficie de energía potencial pertenecientes al estado termodinámico inicial y final . Para que una reacción química se lleve a cabo a una velocidad razonable, la temperatura del sistema debe ser lo suficientemente alta como para que exista un número apreciable de moléculas con energía de traslación igual o mayor que la energía de activación. El término "energía de activación" fue introducido en 1889 por el científico sueco Svante Arrhenius . [3]
Otros usos
Aunque se utiliza con menos frecuencia, la energía de activación también se aplica a las reacciones nucleares [4] y a varios otros fenómenos físicos. [5] [6] [7]
Dependencia de la temperatura y relación con la ecuación de Arrhenius
La ecuación de Arrhenius proporciona la base cuantitativa de la relación entre la energía de activación y la velocidad a la que se produce una reacción. A partir de la ecuación, la energía de activación se puede hallar mediante la relación
donde A es el factor preexponencial de la reacción, R es la constante universal de los gases , T es la temperatura absoluta (normalmente en kelvins ) y k es el coeficiente de velocidad de reacción . Incluso sin conocer A , E a se puede evaluar a partir de la variación de los coeficientes de velocidad de reacción en función de la temperatura (dentro de la validez de la ecuación de Arrhenius).
En un nivel más avanzado, el término de energía de activación neta de Arrhenius de la ecuación de Arrhenius se considera mejor como un parámetro determinado experimentalmente que indica la sensibilidad de la velocidad de reacción a la temperatura. Hay dos objeciones a la asociación de esta energía de activación con la barrera umbral para una reacción elemental. En primer lugar, a menudo no está claro si la reacción se produce o no en un solo paso; las barreras umbral que se promedian en todos los pasos elementales tienen poco valor teórico. En segundo lugar, incluso si la reacción que se estudia es elemental, un espectro de colisiones individuales contribuye a las constantes de velocidad obtenidas a partir de experimentos en masa ("bulbo") que involucran miles de millones de moléculas, con muchas geometrías y ángulos de colisión de reactivos diferentes, diferentes energías traslacionales y (posiblemente) vibracionales, todo lo cual puede conducir a diferentes velocidades de reacción microscópicas. [ cita requerida ]
Catalizadores
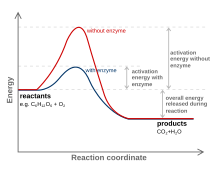

Una sustancia que modifica el estado de transición para reducir la energía de activación se denomina catalizador ; un catalizador compuesto únicamente de proteínas y (si corresponde) cofactores de moléculas pequeñas se denomina enzima . Un catalizador aumenta la velocidad de reacción sin consumirse en la reacción. [8] Además, el catalizador reduce la energía de activación, pero no cambia las energías de los reactivos o productos originales, y por lo tanto no cambia el equilibrio. [9] En cambio, la energía del reactivo y la energía del producto permanecen iguales y solo se altera (reduce) la energía de activación .
Un catalizador es capaz de reducir la energía de activación mediante la formación de un estado de transición de una manera más favorable. Los catalizadores, por naturaleza, crean un ajuste más "cómodo" para que el sustrato de una reacción progrese a un estado de transición. Esto es posible debido a una liberación de energía que ocurre cuando el sustrato se une al sitio activo de un catalizador. Esta energía se conoce como energía de enlace. Al unirse a un catalizador, los sustratos participan en numerosas fuerzas estabilizadoras mientras están dentro del sitio activo (por ejemplo, enlaces de hidrógeno o fuerzas de van der Waals ). Se produce una unión específica y favorable dentro del sitio activo hasta que el sustrato se forma para convertirse en el estado de transición de alta energía. La formación del estado de transición es más favorable con el catalizador porque las interacciones estabilizadoras favorables dentro del sitio activo liberan energía. Una reacción química es capaz de fabricar una molécula de estado de transición de alta energía más fácilmente cuando hay un ajuste estabilizador dentro del sitio activo de un catalizador. La energía de enlace de una reacción es esta energía liberada cuando ocurren interacciones favorables entre el sustrato y el catalizador. La energía de enlace liberada ayuda a lograr el estado de transición inestable. Las reacciones sin catalizadores necesitan un mayor aporte de energía para alcanzar el estado de transición. Las reacciones no catalizadas no tienen energía libre disponible proveniente de interacciones estabilizadoras del sitio activo, como las reacciones enzimáticas catalíticas. [10]
Relación con la energía de activación de Gibbs
En la ecuación de Arrhenius , el término energía de activación ( E a ) se utiliza para describir la energía necesaria para alcanzar el estado de transición , y se cumple la relación exponencial k = A exp(− E a / RT ) . En la teoría del estado de transición, se utiliza un modelo más sofisticado de la relación entre las velocidades de reacción y el estado de transición, una relación matemática superficialmente similar, la ecuación de Eyring , para describir la constante de velocidad de una reacción: k = ( k B T / h ) exp(−Δ G ‡ / RT ) . Sin embargo, en lugar de modelar fenomenológicamente la dependencia de la temperatura de la velocidad de reacción, la ecuación de Eyring modela los pasos elementales individuales de una reacción. Por lo tanto, para un proceso de varios pasos, no existe una relación directa entre los dos modelos. Sin embargo, las formas funcionales de las ecuaciones de Arrhenius y Eyring son similares, y para un proceso de un solo paso, se pueden establecer correspondencias simples y químicamente significativas entre los parámetros de Arrhenius y Eyring.
En lugar de utilizar también E a , la ecuación de Eyring utiliza el concepto de energía de Gibbs y el símbolo Δ G ‡ para denotar la energía de activación de Gibbs para alcanzar el estado de transición . En la ecuación, k B y h son las constantes de Boltzmann y Planck, respectivamente. Aunque las ecuaciones parecen similares, es importante notar que la energía de Gibbs contiene un término entrópico además del entálpico. En la ecuación de Arrhenius, este término entrópico se explica por el factor preexponencial A . Más específicamente, podemos escribir la energía libre de activación de Gibbs en términos de entalpía y entropía de activación : Δ G ‡ = Δ H ‡ − T Δ S ‡ . Entonces, para una reacción unimolecular de un solo paso, las relaciones aproximadas E a = Δ H ‡ + RT y A = ( k B T / h ) exp(1 + Δ S ‡ / R ) se mantienen. Sin embargo, tenga en cuenta que en la teoría de Arrhenius propiamente dicha, A es independiente de la temperatura, mientras que aquí, hay una dependencia lineal de T . Para un proceso unimolecular de un solo paso cuya vida media a temperatura ambiente es de aproximadamente 2 horas, Δ G ‡ es aproximadamente 23 kcal/mol. Esta es también aproximadamente la magnitud de E a para una reacción que se desarrolla durante varias horas a temperatura ambiente. Debido a la magnitud relativamente pequeña de T Δ S ‡ y RT a temperaturas ordinarias para la mayoría de las reacciones, en un discurso descuidado, E a , Δ G ‡ y Δ H ‡ a menudo se combinan y se hace referencia a todos ellos como la "energía de activación".
La entalpía, la entropía y la energía de Gibbs de activación se escriben más correctamente como Δ ‡ H o , Δ ‡ S o y Δ ‡ G o respectivamente, donde la o indica una cantidad evaluada entre estados estándar . [11] [12] Sin embargo, algunos autores omiten la o para simplificar la notación. [13] [14]
Sin embargo, el cambio total de energía libre de una reacción es independiente de la energía de activación. Las reacciones físicas y químicas pueden ser exergónicas o endergónicas , pero la energía de activación no está relacionada con la espontaneidad de una reacción. El cambio total de energía de reacción no se ve alterado por la energía de activación.
Energía de activación negativa
En algunos casos, las velocidades de reacción disminuyen con el aumento de la temperatura. Si se sigue una relación aproximadamente exponencial, de modo que la constante de velocidad pueda ajustarse a una expresión de Arrhenius, esto da como resultado un valor negativo de E a .
Las reacciones elementales que presentan energías de activación negativas son típicamente reacciones sin barreras, en las que el proceso de reacción depende de la captura de las moléculas en un pozo de potencial. El aumento de la temperatura conduce a una menor probabilidad de que las moléculas en colisión se capturen entre sí (y las colisiones más superficiales no conducen a una reacción, ya que el mayor momento lleva a las partículas en colisión fuera del pozo de potencial), expresada como una sección eficaz de reacción que disminuye con el aumento de la temperatura. Una situación de este tipo ya no conduce a interpretaciones directas como la altura de una barrera de potencial. [15]
Algunas reacciones de varios pasos también pueden tener energías de activación negativas aparentes. Por ejemplo, la constante de velocidad general k para una reacción de dos pasos A ⇌ B, B → C está dada por k = k 2 K 1 , donde k 2 es la constante de velocidad del segundo paso lento limitante de velocidad y K 1 es la constante de equilibrio del primer paso rápido. En algunas reacciones, K 1 disminuye con la temperatura más rápidamente de lo que aumenta k 2 , de modo que k en realidad disminuye con la temperatura, lo que corresponde a una energía de activación observada negativa. [16] [17] [18]
Un ejemplo es la oxidación del óxido nítrico , que es una reacción termolecular . La ley de velocidad es con una energía de activación negativa. [19] [20] Esto se explica por el mecanismo de dos pasos: y .
Ciertas reacciones de polimerización catiónica tienen energías de activación negativas, de modo que la velocidad disminuye con la temperatura. Para la polimerización por crecimiento en cadena , la energía de activación total es , donde i, p y t se refieren respectivamente a los pasos de iniciación, propagación y terminación. El paso de propagación normalmente tiene una energía de activación muy pequeña, de modo que el valor total es negativo si la energía de activación para la terminación es mayor que la de la iniciación. El rango normal de energías de activación totales para la polimerización catiónica varía de40 a 60 kJ/mol . [21]
Véase también
- Asintótica de energía de activación
- Cinética química
- Temperatura cinética media
- Temperatura de autoignición
- Tunelaje cuántico
Referencias
- ^ "Energía de activación". www.chem.fsu.edu . Archivado desde el original el 7 de diciembre de 2016. Consultado el 13 de enero de 2017 .
- ^ Espenson, James (1995). Cinética química y mecanismos de reacción . McGraw-Hill. ISBN 0070202605.
- ^ "Energía de activación y ecuación de Arrhenius – Química introductoria – 1.ª edición canadiense". opentextbc.ca . Archivado desde el original el 8 de julio de 2017 . Consultado el 5 de abril de 2018 .
- ^ Kagan, Harris; Barrett, Tom. "Energía en una sociedad moderna: XIV. Energía nuclear" (Curso). Universidad Estatal de Ohio. Archivado desde el original el 22 de marzo de 2019. Consultado el 15 de octubre de 2021 .
- ^ Wang, Jenqdaw; Raj, Rishi (1990). "Estimación de las energías de activación para la difusión límite a partir de la sinterización controlada por velocidad de alúmina pura y alúmina dopada con zirconia o titania". Journal of the American Ceramic Society . 73 (5): 1172. doi :10.1111/j.1151-2916.1990.tb05175.x.
- ^ Kiraci, A; Yurtseven, H (2012). "Dependencia de la temperatura de la frecuencia Raman, la constante de amortiguamiento y la energía de activación de un modo de óptica blanda en titanato de bario ferroeléctrico". Ferroelectrics . 432 : 14–21. doi :10.1080/00150193.2012.707592. S2CID 121142463.
- ^ Terracciano, Anthony C; De Oliveira, Samuel; Vazquez-Molina, Demetrius; Uribe-Romo, Fernando J; Vasu, Subith S; Orlovskaya, Nina (2017). "Efecto del recubrimiento catalíticamente activo Ce 0.8 Gd 0.2 O 1.9 en la combustión heterogénea de metano dentro de cerámica porosa de ZrO 2 estabilizada con MgO". Combustion and Flame . 180 : 32–39. doi :10.1016/j.combustflame.2017.02.019.
- ^ "Química general en línea: Preguntas frecuentes: Cambio químico: ¿Cuáles son algunos ejemplos de reacciones que involucran catalizadores?". antoine.frostburg.edu . Archivado desde el original el 29 de noviembre de 2016 . Consultado el 13 de enero de 2017 .
- ^ Bui, Matthew (2 de octubre de 2013). "La ley de Arrhenius: energías de activación". Chemistry LibreTexts . UC Davis. Archivado desde el original el 18 de febrero de 2017 . Consultado el 17 de febrero de 2017 .
- ^ Berg, Jeremy (2019). Bioquímica - Novena edición . Nueva York, NY: WH Freeman and Company. págs. 240–244. ISBN 978-1-319-11467-1.
- ^ "Entalpía de activación". Libro de Oro de la IUPAC (2.ª edición, versión en línea) . IUPAC (Unión Internacional de Química Pura y Aplicada). 2019. doi :10.1351/goldbook.E02142. Archivado desde el original el 21 de febrero de 2020. Consultado el 10 de mayo de 2020 .
- ^ Steinfeld, Jeffrey I.; Francisco, Joseph S.; Hase, William L. (1999). Cinética y dinámica química (2.ª ed.). Prentice Hall. pág. 301. ISBN 0-13-737123-3.
- ^ Atkins, Peter; de Paula, Julio (2006). Química física de Atkins (8.ª ed.). WHFreeman. pág. 883. ISBN 0-7167-8759-8...
pero omitiremos el signo de estado estándar para evitar sobrecargar la notación.
- ^ Laidler, Keith J.; Meiser, John H. (1982). Química física . Benjamin/Cummings. pág. 381. ISBN 0-8053-5682-7.
- ^ Mozurkewich, Michael; Benson, Sidney (1984). "Energías de activación negativas y diagramas de Arrhenius curvos. 1. Teoría de reacciones sobre pozos de potencial". J. Phys. Chem . 88 (25): 6429–6435. doi :10.1021/j150669a073.
- ^ Espenson, James H. (1981). Cinética química y mecanismos de reacción . McGraw-Hill. pág. 121. ISBN 0-07-019667-2.
- ^ Atkins, Peter; de Paula, Julio (2006). Química física de Atkins (8.ª ed.). WH Freeman. pág. 822. ISBN 0-7167-8759-8.
- ^ Kadir, Tamara (10 de septiembre de 2020). "3.2.2: Aproximación de preequilibrio". Textos de Chem Libre . Consultado el 23 de enero de 2022.
La energía de activación total es negativa si Ea
1
+ Ea
2
< Ea
−1
- ^ Moore, John W.; Pearson, Ralph G. (1981). Cinética y mecanismo (3.ª ed.). John Wiley and Sons. pág. 316. ISBN 0-471-03558-0.
- ^ Engel, Thomas; Reid, Philip (2006). Química física . Pearson. Benjamin-Cummings. pág. *34. ISBN 0-8053-3842-X.
- ^ Cowie, JMG (1991). Polímeros: química y física de materiales modernos (2.ª ed.). Blackie (Estados Unidos: Chapman & Hall+). pág. 88. ISBN 0-216-92980-6.



![{\displaystyle v=k\,\left[{\rm {NO}}\right]^{2}\,\left[{\rm {O_{2}}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae77cc1d5a0ef31cc0ac2b83fbb421dcca3d9e68)



