Losartán
El losartán , que se vende bajo la marca Cozaar , entre otras, es un medicamento que se utiliza para tratar la presión arterial alta (hipertensión). [4] Pertenece a la familia de medicamentos bloqueadores del receptor de angiotensina (BRA) y se considera que protege los riñones. Además de la hipertensión, también se utiliza en la enfermedad renal diabética , la insuficiencia cardíaca y el agrandamiento del ventrículo izquierdo . [4] Se presenta en forma de comprimidos que se toman por vía oral . [4] Se puede utilizar solo o junto con otros medicamentos para la presión arterial . [4] Pueden necesitarse hasta seis semanas para que se produzcan los efectos completos. [4]
Los efectos adversos comunes incluyen calambres musculares, congestión nasal, mareos, tos, potasio alto en sangre y anemia . [4] Los efectos adversos graves pueden incluir angioedema , presión arterial baja y problemas renales . [4] El uso durante el embarazo puede resultar perjudicial para el bebé. [4] [1] No se recomienda su uso durante la lactancia . [1] Funciona bloqueando la angiotensina II . [4]
El losartán fue patentado en 1986 y aprobado para uso médico en los Estados Unidos en 1995. [4] [5] Está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud . [6] Está disponible como medicamento genérico . [7] En 2022, fue el octavo medicamento más recetado en los Estados Unidos, con más de 53 millones de recetas. [8] [9] Está disponible una versión combinada con hidroclorotiazida [4] que, en 2022, fue el 75.º medicamento más recetado en los Estados Unidos, con más de 8 millones de recetas. [8] [10]
Química
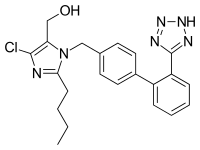
El losartán potásico se describe químicamente como sal monopotásica de 2-butil-4-cloro-1-[p-(o-1H-tetrazol-5-ilfenil)bencil]imidazol-5-metanol. Su fórmula empírica es C 22 H 23 CIKN 6 O y su peso molecular es 422,9. [11]
El losartán se comercializa generalmente como la sal de potasio (básica) del tetrazol aromatizado con carga negativa , llamado "losartán potásico". [12] La molécula tiene un grupo bifenilo extendido con un tetrazol que se utiliza en lugar del ácido carboxílico como bioisóstero . [13]
Usos médicos
El losartán se utiliza para la hipertensión , incluso en personas con hipertrofia ventricular izquierda (músculo cardíaco agrandado) y disfunción renal entre los diabéticos tipo II. [3] También puede retrasar la progresión de la nefropatía diabética . Es un agente farmacológico adecuado para la reducción de la progresión de la enfermedad renal en pacientes con diabetes tipo 2, hipertensión y microalbuminuria (>30 mg/24 horas) o proteinuria (>900 mg/24 horas). [14]
Aunque la evidencia muestra que los bloqueadores de los canales de calcio y los diuréticos de tipo tiazídico son los tratamientos de primera línea preferidos para la mayoría de las personas (debido tanto a la eficacia como al costo), se recomienda un antagonista del receptor de angiotensina II como el losartán como tratamiento de primera línea en personas menores de 55 años que no pueden tolerar un inhibidor de la ECA . [15] Un estudio demostró que el losartán era superior al atenolol en la prevención primaria de eventos cardiovasculares adversos (infarto de miocardio o accidente cerebrovascular), con una reducción en la morbilidad y mortalidad cardiovascular para una reducción comparable en la presión arterial. Los efectos máximos en la presión arterial generalmente ocurren dentro de las 3 a 6 semanas de comenzar el tratamiento con losartán. [16]
Efectos adversos
Los efectos adversos más comunes del losartán en adultos son infecciones de las vías respiratorias superiores , mareos y dolor de espalda . [3] Las personas con diabetes tipo 2 y enfermedad renal pueden experimentar diarrea , fatiga, presión arterial baja, glucosa en sangre baja, potasio elevado, dolor en el pecho o reacción alérgica . [3] Las personas diabéticas que toman aliskiren no deben tomar losartán . [3] Puede producirse anemia debido a la inhibición del sistema renina-angiotensina. [17] Al igual que con otros bloqueadores de los receptores de angiotensina, el losartán puede dañar el hígado, aunque este efecto parece ser poco frecuente. [18] Pueden producirse desequilibrios electrolíticos en personas con problemas renales que toman losartán. [3] Los resultados adversos no difieren según el sexo, la edad o la raza. [3]
Embarazo
En octubre de 2014, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) emitió una advertencia de recuadro negro indicando que el losartán puede causar toxicidad fetal y debe suspenderse tan pronto como se detecte el embarazo. [19] [3] El uso de losartán durante el embarazo puede provocar lesiones o la muerte del feto. [19] [3]
Sobredosis
La sobredosis probablemente resultaría en una disminución de la presión arterial, que podría manifestarse como un aumento de la frecuencia cardíaca, mareos, sensación de aturdimiento o pérdida de la conciencia. Los estudios con ratones mostraron que la letalidad se produjo con una dosis de entre 44 y 170 veces la dosis máxima recomendada después de tener en cuenta el peso de los ratones. [3]
Interacciones
El losartán puede tener interacciones adversas con fenobarbital , rifampicina o fluconazol , posiblemente inhibiendo sus efectos reductores de la presión arterial. [3]
Contaminación
Entre noviembre de 2018 y septiembre de 2019, la FDA anunció múltiples retiradas de comprimidos que contenían losartán de Sandoz , Torrent Pharmaceuticals , Hetero Labs , Camber Pharmaceuticals, Legacy Pharmaceutical Packaging, Teva Pharmaceuticals , Vivimed Life Sciences y Macleods Pharmaceutical Limited debido a la detección de uno de los posibles carcinógenos N-nitrosodietilamina , ácido N-metilnitrosobutírico o ácido N-nitroso-N-metil-4-aminobutírico en el ingrediente farmacéutico activo (API). [20] [21] [22] [23] [24 ] [25] [26] [27] [28] [29] [30] [31] [32] [ 33] [34] [35] [36] [37]
Mecanismo de acción

Losartán es un antagonista selectivo y competitivo del receptor de angiotensina II tipo 1 (AT1 ) , que reduce las respuestas de los órganos terminales a la angiotensina II. La administración de losartán produce una disminución de la resistencia periférica total (poscarga) y del retorno venoso cardíaco (precarga). Todos los efectos fisiológicos de la angiotensina II, incluida la liberación de aldosterona , se antagonizan en presencia de losartán. La reducción de la presión arterial se produce independientemente del estado del sistema renina-angiotensina . Como resultado de la dosificación de losartán, la actividad de la renina plasmática aumenta debido a la eliminación de la retroalimentación de la angiotensina II. La renina se libera de los riñones cuando hay una presión arterial renal reducida, activación simpática o aumento del aporte de sodio al túbulo renal distal. [38] La renina actúa entonces convirtiendo el angiotensinógeno en angiotensina I; la enzima convertidora de angiotensina (ECA) convierte la angiotensina I en angiotensina II; la angiotensina II causa vasoconstricción y liberación de aldosterona. [38] La aldosterona sirve para retener el sodio del túbulo renal distal. La retención de sodio en última instancia produce un aumento de la presión arterial. [39] Por lo tanto, el uso de antagonistas del receptor de angiotensina II como el losartán produce un bloqueo del efecto secundario de la renina, la angiotensina II, y en última instancia, una disminución de la presión arterial.
Los antagonistas del receptor de angiotensina II incluyen losartán, valsartán , azilsartán , candesartán , eprosartán , irbesartán , olmesartán y telmisartán . Todos ellos tienen el mismo mecanismo de acción y potencialmente inhiben las acciones de la angiotensina mejor que los inhibidores de la ECA , como el lisinopril , porque hay otras enzimas además de la ECA que tienen la capacidad de producir angiotensina II. [38]
El losartán es un uricosúrico . Como inhibidor específico del transportador de urato 1 ( SLC22A12 , URAT1), el losartán bloquea la captación de ácido úrico en las células, dejando así más cantidad disponible en el torrente sanguíneo para ser filtrada y excretada por los riñones. [40] Debido a que el losartán puede causar hipercalemia , las personas no deben utilizar suplementos de potasio o sustitutos de la sal que contengan potasio sin la supervisión adecuada de un médico. [41]
Farmacocinética
El losartán se absorbe bien tras la administración oral y sufre un metabolismo de primer paso significativo para producir el metabolito ácido 5-carboxílico , denominado EXP3174. Alrededor del 14% de una dosis oral se convierte en este metabolito, que tiene una acción prolongada (6 a 8 horas) y es un antagonista no competitivo del receptor AT1 , lo que contribuye a los efectos farmacológicos del losartán. El EXP3174 es entre 10 y 40 veces más potente para bloquear los receptores AT1 que el losartán. Además, la unión a la enzima diana es sensible al pH, y el anillo de tetrazol con carga negativa, que es similar en tamaño al derivado de ácido carboxílico negativo, puede contribuir a la actividad del fármaco. [42]
La biodisponibilidad del losartán es de alrededor del 33%. [43]
El metabolismo se realiza principalmente por las isoenzimas CYP2C9 y CYP3A4 del citocromo P450 . [44] Las concentraciones plasmáticas máximas de losartán y EXP3174 se producen aproximadamente una hora y de tres a cuatro horas, respectivamente, después de una dosis oral. [45] Tanto losartán como EXP3174 se unen a las proteínas plasmáticas en más del 98%. [46] El losartán se excreta en la orina y en las heces a través de la bilis, como fármaco y metabolitos inalterados. [47] Aproximadamente el 4% de una dosis oral se excreta inalterada en la orina, y aproximadamente el 6% se excreta en la orina como metabolito activo. [48] Las semividas de eliminación terminal de losartán y EXP3174 son de aproximadamente 1,5 a 2,5 horas y de 3 a 9 horas, respectivamente. [49]
El losartán y otros antagonistas de los receptores de angiotensina presentan toxicidad fetal y deben evitarse durante el embarazo, particularmente en el segundo y tercer trimestre. [50]
Historia
Referencias
- ^ abc "Uso de losartán (Cozaar) durante el embarazo". Drugs.com . Archivado desde el original el 10 de diciembre de 2017. Consultado el 10 de diciembre de 2017 .
- ^ "Lista de todos los medicamentos con advertencias de recuadro negro obtenida por la FDA (use los enlaces Descargar resultados completos y Ver consulta)". nctr-crs.fda.gov . FDA . Consultado el 22 de octubre de 2023 .
- ^ abcdefghijk "Comprimido recubierto con película de cozaar-losartán potásico". DailyMed . 14 de noviembre de 2019. Archivado desde el original el 28 de abril de 2021 . Consultado el 20 de marzo de 2020 .
- ^ abcdefghijk "Losartan Potassium". Sociedad Estadounidense de Farmacéuticos de Sistemas de Salud. Archivado desde el original el 10 de diciembre de 2017. Consultado el 8 de diciembre de 2017 .
- ^ Fischer J, Ganellin CR (2006). Descubrimiento de fármacos basado en análogos. John Wiley & Sons. pág. 470. ISBN 9783527607495Archivado del original el 28 de agosto de 2021 . Consultado el 26 de agosto de 2020 .
- ^ Organización Mundial de la Salud (2023). Selección y uso de medicamentos esenciales 2023: anexo web A: Lista modelo de medicamentos esenciales de la Organización Mundial de la Salud: 23.ª lista (2023) . Ginebra: Organización Mundial de la Salud. hdl : 10665/371090 . OMS/MHP/HPS/EML/2023.02.
- ^ Formulario nacional británico: BNF 69 (69.ª ed.). Asociación Médica Británica. 2015. pág. 127. ISBN 9780857111562.
- ^ ab "Los 300 mejores de 2022". ClinCalc . Archivado desde el original el 30 de agosto de 2024 . Consultado el 30 de agosto de 2024 .
- ^ "Estadísticas de uso del fármaco Losartan, Estados Unidos, 2013-2022". ClinCalc . Consultado el 30 de agosto de 2024 .
- ^ "Hidroclorotiazida; Estadísticas de uso del fármaco Losartan, Estados Unidos, 2013-2022". ClinCalc . Consultado el 30 de agosto de 2024 .
- ^ "Formulación farmacéutica de losartán". Archivado desde el original el 5 de enero de 2022 . Consultado el 5 de enero de 2022 .
- ^ "Véase la estructura del tetrazol con carga negativa". Archivado desde el original el 22 de enero de 2021 . Consultado el 21 de octubre de 2017 .
- ^ "DailyMed - Losartan Potassium 25 mg - comprimidos de losartan potásico recubiertos con película; Losartan Potassium 50 mg - comprimidos de losartan potásico recubiertos con película; Losartan Potassium 100 mg - comprimidos de losartan potásico recubiertos con película". Archivado desde el original el 27 de abril de 2022. Consultado el 27 de abril de 2022 .
- ^ Boersma C, Atthobari J, Gansevoort RT, de Jong-Van den Berg LT, de Jong PE, de Zeeuw D, et al. (2006). "Farmacoeconomía de los antagonistas de la angiotensina II en pacientes diabéticos tipo 2 con nefropatía: implicaciones para la toma de decisiones". Farmacoeconomía . 24 (6): 523–35. doi :10.2165/00019053-200624060-00001. PMID 16761901. S2CID 22960961.
- ^ "Hipertensión en adultos: diagnóstico y tratamiento". Instituto Nacional para la Excelencia en la Salud y la Atención (NICE) . 24 de agosto de 2011. Archivado desde el original el 9 de abril de 2017. Consultado el 8 de abril de 2017 .
- ^ Abrams A (2007). 'Fundamentos de la farmacoterapia clínica para la práctica de enfermería'. Filadelfia, Pensilvania: Lippincott Williams & Wilkins. pág. 846. ISBN 978-0-7817-6263-2.
- ^ Cheungpasitporn W, Thongprayoon C, Chiasakul T, Korpaisarn S, Erickson SB (noviembre de 2015). "Inhibidores del sistema renina-angiotensina vinculados a la anemia: una revisión sistemática y un metanálisis". QJM . 108 (11): 879–884. doi : 10.1093/qjmed/hcv049 . PMID 25697787.
- ^ Patti R, Sinha A, Sharma S, Yoon TS, Kupfer Y (mayo de 2019). "Lesión hepática grave inducida por losartán: informe de un caso y revisión de la literatura". Cureus . 11 (5): e4769. doi : 10.7759/cureus.4769 . PMC 6663042 . PMID 31363450.
- ^ ab "Comprimidos de Cozaar (losartán potásico) de 25 mg, 50 mg y 100 mg". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 16 de octubre de 2014. Archivado desde el original el 12 de enero de 2017. Consultado el 21 de julio de 2015 .
- ^ "La FDA proporciona información actualizada sobre su investigación en curso sobre los medicamentos ARB; informa sobre el hallazgo de una nueva impureza de nitrosamina en ciertos lotes de losartán y el retiro del producto" (Comunicado de prensa). Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). 3 de octubre de 2019. Archivado desde el original el 3 de octubre de 2019 . Consultado el 3 de octubre de 2019 .
- ^ "Sandoz Inc. emite retiro voluntario a nivel nacional de un lote de losartán potásico e hidroclorotiazida debido a la detección de trazas de impureza NDEA (N-nitrosodietilamina) en el ingrediente farmacéutico activo (API)". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 8 de noviembre de 2018. Archivado desde el original el 7 de septiembre de 2019. Consultado el 5 de octubre de 2019 .
- ^ "Torrent Pharmaceuticals Limited emite un retiro voluntario a nivel nacional de tabletas de Losartan Potassium, USP". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 20 de diciembre de 2018. Archivado desde el original el 7 de septiembre de 2019. Consultado el 5 de octubre de 2019 .
- ^ "Torrent Pharmaceuticals Limited amplía el retiro voluntario a nivel nacional de comprimidos de losartán potásico, USP". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 3 de enero de 2019. Archivado desde el original el 7 de septiembre de 2019. Consultado el 5 de octubre de 2019 .
- ^ "Actualizado: Torrent Pharmaceuticals Limited emite un retiro voluntario a nivel nacional de los comprimidos de losartán potásico, USP y de los comprimidos de losartán potásico e hidroclorotiazida, USP". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 22 de enero de 2019. Archivado desde el original el 7 de septiembre de 2019. Consultado el 5 de octubre de 2019 .
- ^ "Actualizado: Torrent Pharmaceuticals Limited emite un retiro voluntario a nivel nacional de los comprimidos de losartán potásico, USP y de los comprimidos de losartán potásico/hidroclorotiazida, USP". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 1 de marzo de 2019. Archivado desde el original el 7 de septiembre de 2019. Consultado el 5 de octubre de 2019 .
- ^ "Actualizado: Torrent Pharmaceuticals Limited amplía el retiro voluntario a nivel nacional de los comprimidos de losartán potásico, USP y de los comprimidos de losartán potásico/hidroclorotiazida, USP". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 18 de abril de 2019. Archivado desde el original el 6 de octubre de 2019. Consultado el 5 de octubre de 2019 .
- ^ "Actualizado: Torrent Pharmaceuticals Limited amplía el retiro voluntario a nivel nacional de los comprimidos de losartán potásico, USP y de los comprimidos de losartán potásico/hidroclorotiazida, USP". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 23 de septiembre de 2019. Archivado desde el original el 6 de octubre de 2019. Consultado el 23 de septiembre de 2019 .
- ^ "Legacy Pharmaceutical Packaging, LLC amplía el retiro voluntario a nivel nacional de tabletas de losartán potásico, USP, 50 mg debido a la detección de trazas de impureza de ácido N-nitroso N-metil 4-amino butírico (NMBA) encontradas en el ingrediente farmacéutico activo (API)". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 15 de julio de 2019. Archivado desde el original el 13 de septiembre de 2019. Consultado el 5 de octubre de 2019 .
- ^ "Macleods Pharmaceutical Limited emite un retiro voluntario a nivel nacional a nivel de consumidor de los comprimidos de combinación de losartán potásico de 50 mg y losartán potásico/hidroclorotiazida de 50 mg/12,5 mg, 100 mg/12,5 mg y 100 mg/25 mg debido a la detección de la impureza NMBA (ácido N-nitroso-N-metil-4-aminobutírico)". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 26 de junio de 2019. Archivado desde el original el 1 de octubre de 2019. Consultado el 5 de octubre de 2019 .
- ^ "Teva Pharmaceuticals USA, Inc. amplía el retiro voluntario a nivel nacional de losartán potásico a tabletas de 50 mg y 100 mg USP, vendidas exclusivamente a Golden State Medical Supply, Inc". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 11 de junio de 2019. Archivado desde el original el 13 de septiembre de 2019. Consultado el 5 de octubre de 2019 .
- ^ "Vivimed Life Sciences Pvt Ltd emite retiro voluntario a nivel nacional de comprimidos de losartán potásico de 25 mg, 50 mg y 100 mg, USP debido a la detección de trazas de impureza de ácido N-nitroso-N-metil-4-aminobutírico (NMBA)". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 3 de mayo de 2019. Archivado desde el original el 13 de septiembre de 2019. Consultado el 5 de octubre de 2019 .
- ^ "Teva Pharmaceuticals USA, Inc. emite un retiro voluntario a nivel nacional de los comprimidos de Losartan Potassium de 25 mg y 100 mg USP, vendidos exclusivamente a Golden State Medical Supply". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 26 de abril de 2019. Archivado desde el original el 13 de septiembre de 2019. Consultado el 5 de octubre de 2019 .
- ^ "Legacy Pharmaceutical Packaging, LLC emite un retiro voluntario a nivel nacional de tabletas de losartán potásico, USP, 25 mg, 50 mg y 100 mg debido a la detección de trazas de impureza de ácido N-nitroso N-metil 4-aminobutírico (NMBA) encontradas en el ingrediente farmacéutico activo (API)". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 19 de marzo de 2019. Archivado desde el original el 7 de septiembre de 2019. Consultado el 5 de octubre de 2019 .
- ^ "Legacy Pharmaceutical Packaging, LLC emite retiro voluntario a nivel nacional de tabletas de losartán potásico, USP, 25 mg, 50 mg y 100 mg debido a la detección de trazas de impureza de ácido N-nitroso N-metil 4-aminobutírico (NMBA) encontradas en el ingrediente farmacéutico activo (API)". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 28 de marzo de 2019. Archivado desde el original el 7 de septiembre de 2019 . Consultado el 5 de octubre de 2019 .
- ^ "Legacy Pharmaceutical Packaging, LLC emite un retiro voluntario a nivel nacional de tabletas de losartán potásico, USP, 50 mg debido a la detección de trazas de impureza de ácido N-nitroso N-metil 4-amino butírico (NMBA) en el ingrediente farmacéutico activo (API)". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 15 de marzo de 2019. Archivado desde el original el 7 de septiembre de 2019. Consultado el 5 de octubre de 2019 .
- ^ "Camber Pharmaceuticals, Inc. emite un retiro voluntario a nivel nacional de comprimidos de losartán potásico, USP, de 25 mg, 50 mg y 100 mg debido a la detección de trazas de impureza de ácido N-nitroso N-metil 4-amino butírico (NMBA) en el ingrediente farmacéutico activo (API)". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 28 de febrero de 2019. Archivado desde el original el 7 de septiembre de 2019. Consultado el 5 de octubre de 2019 .
- ^ "Macleods Pharmaceuticals Limited emite un retiro voluntario a nivel nacional a nivel de consumidor de un lote (BLM 715A) de comprimidos combinados de losartán potásico/hidroclorotiazida de 100 mg/25 mg debido a la detección de la impureza NDEA (N-nitrosodietilamina)". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 22 de febrero de 2019. Archivado desde el original el 7 de septiembre de 2019. Consultado el 5 de octubre de 2019 .
- ^ abc Katzung, Bertram G., ed. (30 de noviembre de 2017). Farmacología básica y clínica . McGraw-Hill Education. ISBN 9781259641152.OCLC 1048625746 .
- ^ Graudal NA, Hubeck-Graudal T, Jürgens G (enero de 2012). "Efectos de una dieta baja en sodio frente a una dieta alta en sodio sobre la presión arterial, la renina, la aldosterona, las catecolaminas, el colesterol y los triglicéridos (revisión Cochrane)". American Journal of Hypertension . 25 (1): 1–15. doi : 10.1038/ajh.2011.210 . PMID 22068710.
- ^ Hamada T, Ichida K, Hosoyamada M, Mizuta E, Yanagihara K, et al. (1 de octubre de 2008). "Acción uricosúrica del losartán mediante la inhibición del transportador de urato 1 (URAT 1) en pacientes hipertensos". Revista Estadounidense de Hipertensión . 21 (10): 1157-1162. doi : 10.1038/ajh.2008.245 . PMID 18670416.
- ^ RxList. The Internet Drug Index. Clinical Pharmacology of Cozaar Archivado el 6 de enero de 2014 en Wayback Machine . Consultado el 6 de enero de 2014.
- ^ Noda K, Saad Y, Kinoshita A, Boyle TP, Graham RM, Husain A, et al. (febrero de 1995). "Los grupos tetrazole y carboxilato de los antagonistas del receptor de angiotensina se unen al mismo subsitio mediante diferentes mecanismos". The Journal of Biological Chemistry . 270 (5): 2284–2289. doi : 10.1074/jbc.270.5.2284 . PMID 7530721. Archivado desde el original el 19 de septiembre de 2022 . Consultado el 21 de octubre de 2017 .
- ^ "DailyMed - LOSARTAN POTASIO 25 MG- comprimido de losartan potásico, recubierto con película LOSARTAN POTASIO 50 MG- comprimido de losartan potásico, recubierto con película LOSARTAN POTASIO 100 MG- comprimido de losartan potásico, recubierto con película". Archivado desde el original el 27 de abril de 2022. Consultado el 27 de abril de 2022 .
- ^ "DailyMed - LOSARTAN POTASIO 25 MG- comprimido de losartan potásico, recubierto con película LOSARTAN POTASIO 50 MG- comprimido de losartan potásico, recubierto con película LOSARTAN POTASIO 100 MG- comprimido de losartan potásico, recubierto con película". Archivado desde el original el 27 de abril de 2022. Consultado el 27 de abril de 2022 .
- ^ "DailyMed - LOSARTAN POTASIO 25 MG- comprimido de losartan potásico, recubierto con película LOSARTAN POTASIO 50 MG- comprimido de losartan potásico, recubierto con película LOSARTAN POTASIO 100 MG- comprimido de losartan potásico, recubierto con película". Archivado desde el original el 27 de abril de 2022. Consultado el 27 de abril de 2022 .
- ^ "DailyMed - LOSARTAN POTASIO 25 MG- comprimido de losartan potásico, recubierto con película LOSARTAN POTASIO 50 MG- comprimido de losartan potásico, recubierto con película LOSARTAN POTASIO 100 MG- comprimido de losartan potásico, recubierto con película". Archivado desde el original el 27 de abril de 2022. Consultado el 27 de abril de 2022 .
- ^ "DailyMed - LOSARTAN POTASIO 25 MG- comprimido de losartan potásico, recubierto con película LOSARTAN POTASIO 50 MG- comprimido de losartan potásico, recubierto con película LOSARTAN POTASIO 100 MG- comprimido de losartan potásico, recubierto con película". Archivado desde el original el 27 de abril de 2022. Consultado el 27 de abril de 2022 .
- ^ "DailyMed - LOSARTAN POTASIO 25 MG- comprimido de losartan potásico, recubierto con película LOSARTAN POTASIO 50 MG- comprimido de losartan potásico, recubierto con película LOSARTAN POTASIO 100 MG- comprimido de losartan potásico, recubierto con película". Archivado desde el original el 27 de abril de 2022. Consultado el 27 de abril de 2022 .
- ^ "DailyMed - LOSARTAN POTASIO 25 MG- comprimido de losartan potásico, recubierto con película LOSARTAN POTASIO 50 MG- comprimido de losartan potásico, recubierto con película LOSARTAN POTASIO 100 MG- comprimido de losartan potásico, recubierto con película". Archivado desde el original el 27 de abril de 2022. Consultado el 27 de abril de 2022 .
- ^ Sica DA, Gehr TW, Ghosh S (2005). "Farmacocinética clínica del losartán". Clin Pharmacokinet . 44 (8): 797–814. doi :10.2165/00003088-200544080-00003. PMID 16029066. S2CID 41326620.
Lectura adicional
- Al-Majed AR, Assiri E, Khalil NY, Abdel-Aziz HA (2015). "Losartan: perfil completo". Perfiles de fármacos, sustancias, excip., relat., metodol . 40 : 159–94. doi :10.1016/bs.podrm.2015.02.003. PMID 26051686.
- Sica DA, Gehr TW, Ghosh S (2005). "Farmacocinética clínica del losartán". Clin Pharmacokinet . 44 (8): 797–814. doi :10.2165/00003088-200544080-00003. PMID 16029066. S2CID 41326620.