Catálisis enzimática
La catálisis enzimática es el aumento de la velocidad de un proceso por una " enzima ", una molécula biológica . La mayoría de las enzimas son proteínas y la mayoría de estos procesos son reacciones químicas. Dentro de la enzima, la catálisis generalmente ocurre en un sitio localizado, llamado sitio activo .
La mayoría de las enzimas están compuestas predominantemente de proteínas, ya sea una sola cadena proteica o muchas cadenas de este tipo en un complejo de múltiples subunidades . Las enzimas a menudo también incorporan componentes no proteicos, como iones metálicos o moléculas orgánicas especializadas conocidas como cofactores (por ejemplo, trifosfato de adenosina ). Muchos cofactores son vitaminas, y su papel como vitaminas está directamente relacionado con su uso en la catálisis de procesos biológicos dentro del metabolismo. La catálisis de reacciones bioquímicas en la célula es vital ya que muchas, pero no todas, las reacciones metabólicamente esenciales tienen tasas muy bajas cuando no están catalizadas. Un impulsor de la evolución de las proteínas es la optimización de tales actividades catalíticas, aunque solo las enzimas más cruciales operan cerca de los límites de eficiencia catalítica, y muchas enzimas están lejos de ser óptimas. Los factores importantes en la catálisis enzimática incluyen la catálisis general de ácidos y bases , la dirección orbital, la restricción entrópica, los efectos de orientación (es decir, la catálisis de cerradura y llave), así como los efectos de movimiento que involucran la dinámica de las proteínas [1].
Los mecanismos de catálisis enzimática varían, pero todos son similares en principio a otros tipos de catálisis química en que el factor crucial es una reducción de la(s) barrera(s) energética(s) que separan los reactivos (o sustratos ) de los productos. La reducción de la energía de activación ( E a ) aumenta la fracción de moléculas reactivas que pueden superar esta barrera y formar el producto. Un principio importante es que, dado que solo reducen las barreras energéticas entre productos y reactivos, las enzimas siempre catalizan reacciones en ambas direcciones y no pueden impulsar una reacción hacia adelante o afectar la posición de equilibrio, solo la velocidad con la que se alcanza. Al igual que con otros catalizadores, la enzima no se consume ni se modifica por la reacción (como lo hace un sustrato), sino que se recicla de manera que una sola enzima realiza muchas rondas de catálisis.
Las enzimas suelen ser muy específicas y actúan solo sobre determinados sustratos. Algunas enzimas son absolutamente específicas, es decir, actúan solo sobre un sustrato, mientras que otras muestran especificidad de grupo y pueden actuar sobre grupos químicos similares pero no idénticos, como el enlace peptídico en diferentes moléculas. Muchas enzimas tienen especificidad estereoquímica y actúan sobre un estereoisómero pero no sobre otro. [2]
Ajuste inducido
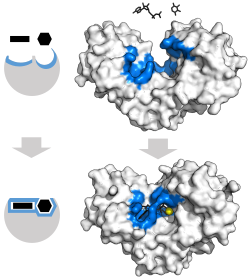

El modelo clásico para la interacción enzima- sustrato es el modelo de ajuste inducido. [3] Este modelo propone que la interacción inicial entre enzima y sustrato es relativamente débil, pero que estas interacciones débiles inducen rápidamente cambios conformacionales en la enzima que fortalecen la unión.
Las ventajas del mecanismo de ajuste inducido surgen debido al efecto estabilizador de la fuerte unión de la enzima. Hay dos mecanismos diferentes de unión del sustrato: la unión uniforme, que tiene una fuerte unión del sustrato, y la unión diferencial, que tiene una fuerte unión del estado de transición. El efecto estabilizador de la unión uniforme aumenta tanto la afinidad de unión del sustrato como del estado de transición, mientras que la unión diferencial aumenta solo la afinidad de unión del estado de transición. Ambos son utilizados por las enzimas y han sido elegidos evolutivamente para minimizar la energía de activación de la reacción. Las enzimas que están saturadas, es decir, tienen una alta afinidad de unión del sustrato, requieren una unión diferencial para reducir la energía de activación, mientras que las enzimas pequeñas no unidas al sustrato pueden utilizar la unión diferencial o uniforme. [4]
Estos efectos han llevado a que la mayoría de las proteínas utilicen el mecanismo de unión diferencial para reducir la energía de activación, por lo que la mayoría de los sustratos tienen una alta afinidad por la enzima mientras se encuentran en el estado de transición. La unión diferencial se lleva a cabo mediante el mecanismo de ajuste inducido: el sustrato primero se une débilmente, luego la enzima cambia de conformación aumentando la afinidad por el estado de transición y estabilizándolo, reduciendo así la energía de activación para alcanzarlo.
Es importante aclarar, sin embargo, que el concepto de ajuste inducido no puede utilizarse para racionalizar la catálisis. Es decir, la catálisis química se define como la reducción de E a ‡ (cuando el sistema ya está en el ES ‡ ) en relación con E a ‡ en la reacción no catalizada en agua (sin la enzima). El ajuste inducido solo sugiere que la barrera es menor en la forma cerrada de la enzima, pero no nos dice cuál es la razón de la reducción de la barrera.
El ajuste inducido puede ser beneficioso para la fidelidad del reconocimiento molecular en presencia de competencia y ruido a través del mecanismo de corrección conformacional . [5]
Mecanismos de una ruta de reacción alternativa
Estos cambios conformacionales también acercan los residuos catalíticos del sitio activo a los enlaces químicos del sustrato que se alterarán en la reacción. Una vez que se produce la unión, uno o más mecanismos de catálisis reducen la energía del estado de transición de la reacción , proporcionando una vía química alternativa para la reacción. Hay seis posibles mecanismos de catálisis "por encima de la barrera", así como un mecanismo "a través de la barrera":
Proximidad y orientación
Las interacciones enzima-sustrato alinean los grupos químicos reactivos y los mantienen juntos en una geometría óptima, lo que aumenta la velocidad de la reacción. Esto reduce la entropía de los reactivos y, por lo tanto, hace que las reacciones de adición o transferencia sean menos desfavorables, ya que se produce una reducción de la entropía general cuando dos reactivos se convierten en un solo producto. Sin embargo, este es un efecto general y se observa en reacciones de no adición o transferencia donde ocurre debido a un aumento en la "concentración efectiva" de los reactivos. Esto se entiende al considerar cómo los aumentos en la concentración conducen a aumentos en la velocidad de reacción: esencialmente, cuando los reactivos están más concentrados, chocan más a menudo y, por lo tanto, reaccionan más a menudo. En la catálisis enzimática, la unión de los reactivos a la enzima restringe el espacio conformacional de los reactivos, manteniéndolos en la "orientación adecuada" y cerca uno del otro, de modo que chocan con más frecuencia y con la geometría correcta, para facilitar la reacción deseada. La "concentración efectiva" es la concentración que tendría que tener el reactivo, libre en solución, para experimentar la misma frecuencia de colisión. A menudo, estas concentraciones teóricamente efectivas no son físicas y son imposibles de realizar en la realidad, lo que es un testimonio del gran poder catalítico de muchas enzimas, con aumentos masivos de velocidad en comparación con el estado no catalizado.
| Por ejemplo: |
| Reacciones similares ocurrirán mucho más rápido si la reacción es intramolecular. |
 |
| La concentración efectiva de acetato en la reacción intramolecular se puede estimar como k 2 /k 1 = 2 x 10 5 Molar. |
Sin embargo, la situación podría ser más compleja, ya que los estudios computacionales modernos han establecido que los ejemplos tradicionales de efectos de proximidad no pueden relacionarse directamente con los efectos entrópicos de las enzimas. [6] [7] [8] Además, se ha descubierto que la propuesta entrópica original [9] sobreestima en gran medida la contribución de la entropía de orientación a la catálisis. [10]
Donadores o aceptores de protones
Los donantes y aceptores de protones, es decir, los ácidos y las bases , pueden donar y aceptar protones para estabilizar las cargas en desarrollo en el estado de transición. Esto está relacionado con el principio general de la catálisis, el de reducir las barreras energéticas, ya que en general los estados de transición son estados de alta energía y al estabilizarlos se reduce esta alta energía, bajando la barrera. Una característica clave de la catálisis enzimática sobre muchas catálisis no biológicas es que tanto la catálisis ácida como la básica se pueden combinar en la misma reacción. En muchos sistemas abióticos, los ácidos (grandes [H+]) o las bases (grandes sumideros de H+ o especies con pares de electrones) pueden aumentar la velocidad de la reacción; pero, por supuesto, el entorno solo puede tener un pH general (medida de acidez o basicidad [alcalinidad]). Sin embargo, dado que las enzimas son moléculas grandes, pueden colocar tanto grupos ácidos como grupos básicos en su sitio activo para interactuar con sus sustratos y emplear ambos modos independientemente del pH en masa.
A menudo se emplea la catálisis ácida o básica general para activar grupos nucleófilos y/o electrófilos , o para estabilizar grupos salientes. Muchos aminoácidos con grupos ácidos o básicos se emplean en el sitio activo, como el ácido glutámico y aspártico, la histidina, la cistina, la tirosina, la lisina y la arginina, así como la serina y la treonina. Además, a menudo se emplea la cadena principal peptídica, con grupos N carbonilo y amida. La cistina y la histidina están muy comúnmente involucradas, ya que ambas tienen un pKa cercano al pH neutro y, por lo tanto, pueden aceptar y donar protones.
Muchos mecanismos de reacción que implican catálisis ácido-base suponen un pKa sustancialmente alterado. Esta alteración del pKa es posible a través del entorno local del residuo [ cita requerida ] .
| Condiciones | Ácidos | Bases |
|---|---|---|
| Entorno hidrofóbico | Aumentar pKa | Disminuir pKa |
| Residuos adyacentes de igual carga | Aumentar pKa | Disminuir pKa |
| Formación de puentes salinos (y enlaces de hidrógeno) | Disminuir pKa | Aumentar pKa |
El pKa también puede verse influenciado significativamente por el entorno circundante, hasta el punto de que los residuos que son básicos en solución pueden actuar como donadores de protones, y viceversa.
| Por ejemplo: |
| Tríada catalítica de una serina proteasa |
 |
| El paso inicial del mecanismo catalítico de la serina proteasa implica que la histidina del sitio activo acepte un protón del residuo de serina. Esto prepara a la serina como nucleófilo para atacar el enlace amida del sustrato. Este mecanismo incluye la donación de un protón de la serina (una base, pKa 14) a la histidina (un ácido, pKa 6), lo que es posible gracias al entorno local de las bases. |
La modificación de los pKa es una parte pura del mecanismo electrostático. [11] El efecto catalítico del ejemplo anterior está asociado principalmente con la reducción del pKa del oxianión y el aumento del pKa de la histidina, mientras que la transferencia de protones de la serina a la histidina no se cataliza de manera significativa, ya que no es la barrera que determina la velocidad. [12] Nótese que en el ejemplo mostrado, el ácido conjugado de histidina actúa como un catalizador ácido general para la pérdida posterior de la amina de un intermediario tetraédrico. Sin embargo, la evidencia que apoya este mecanismo propuesto (Figura 4 en Ref. 13) [13] ha sido controvertida. [14]
Catálisis electrostática
La estabilización de los estados de transición cargados también puede ser mediante residuos en el sitio activo que forman enlaces iónicos (o interacciones de carga iónica parcial) con el intermediario. Estos enlaces pueden provenir de cadenas laterales ácidas o básicas que se encuentran en aminoácidos como la lisina , la arginina , el ácido aspártico o el ácido glutámico o pueden provenir de cofactores metálicos como el zinc . Los iones metálicos son particularmente efectivos y pueden reducir el pKa del agua lo suficiente como para convertirla en un nucleófilo eficaz.
Estudios sistemáticos de simulación por ordenador han demostrado que los efectos electrostáticos son los que más contribuyen a la catálisis [11] . Pueden aumentar la velocidad de reacción hasta en un factor de 10 7 . [15] En particular, se ha descubierto que la enzima proporciona un entorno más polar que el agua y que los estados de transición iónicos se estabilizan mediante dipolos fijos. Esto es muy diferente de la estabilización del estado de transición en el agua, donde las moléculas de agua deben pagar con "energía de reorganización". [16] Para estabilizar los estados iónicos y cargados, la catálisis está asociada, por tanto, al hecho de que los grupos polares de la enzima están preorganizados [17].
Se ha demostrado que la magnitud del campo electrostático ejercido por el sitio activo de una enzima está altamente correlacionada con la mejora de la tasa catalítica de la enzima. [18]
La unión del sustrato generalmente excluye el agua del sitio activo, lo que reduce la constante dieléctrica local a la de un solvente orgánico. Esto fortalece las interacciones electrostáticas entre los sustratos cargados/polares y los sitios activos. Además, los estudios han demostrado que las distribuciones de carga alrededor de los sitios activos están organizadas de manera que estabilizan los estados de transición de las reacciones catalizadas. En varias enzimas, estas distribuciones de carga aparentemente sirven para guiar a los sustratos polares hacia sus sitios de unión de modo que las velocidades de estas reacciones enzimáticas sean mayores que sus límites aparentes controlados por difusión [ cita requerida ] .
| Por ejemplo: |
| Mecanismo catalítico de la carboxipeptidasa |
 |
| El intermedio tetraédrico está estabilizado por un enlace iónico parcial entre el ion Zn 2+ y la carga negativa del oxígeno. |
Catálisis covalente
La catálisis covalente implica que el sustrato forme un enlace covalente transitorio con residuos en el sitio activo de la enzima o con un cofactor. Esto agrega un intermediario covalente adicional a la reacción y ayuda a reducir la energía de los estados de transición posteriores de la reacción. El enlace covalente debe, en una etapa posterior de la reacción, romperse para regenerar la enzima. Este mecanismo es utilizado por la tríada catalítica de enzimas como las proteasas como la quimotripsina y la tripsina , donde se forma un intermediario acil-enzima. Un mecanismo alternativo es la formación de la base de Schiff utilizando la amina libre de un residuo de lisina , como se ve en la enzima aldolasa durante la glucólisis .
Algunas enzimas utilizan cofactores que no son aminoácidos, como el fosfato de piridoxal (PLP) o el pirofosfato de tiamina (TPP), para formar intermediarios covalentes con moléculas reactivas. [19] [20] Estos intermediarios covalentes funcionan para reducir la energía de los estados de transición posteriores, de manera similar a cómo los intermediarios covalentes formados con residuos de aminoácidos del sitio activo permiten la estabilización, pero las capacidades de los cofactores permiten a las enzimas llevar a cabo reacciones que los residuos de aminoácidos por sí solos no podrían. Las enzimas que utilizan estos cofactores incluyen la enzima aspartato transaminasa dependiente de PLP y la enzima piruvato deshidrogenasa dependiente de TPP . [21] [22]
En lugar de reducir la energía de activación de una vía de reacción, la catálisis covalente proporciona una vía alternativa para la reacción (a través del intermediario covalente) y, por lo tanto, es distinta de la catálisis verdadera. [11] Por ejemplo, la energía del enlace covalente a la molécula de serina en la quimotripsina debe compararse con el enlace covalente bien entendido al nucleófilo en la reacción en solución no catalizada. Una verdadera propuesta de una catálisis covalente (donde la barrera es menor que la barrera correspondiente en solución) requeriría, por ejemplo, un enlace covalente parcial al estado de transición por un grupo enzimático (por ejemplo, un enlace de hidrógeno muy fuerte), y tales efectos no contribuyen significativamente a la catálisis.
Catálisis de iones metálicos
Un ion metálico en el sitio activo participa en la catálisis coordinando la estabilización de carga y el apantallamiento. Debido a la carga positiva de un metal, solo las cargas negativas pueden estabilizarse a través de iones metálicos. [23] Sin embargo, los iones metálicos son ventajosos en la catálisis biológica porque no se ven afectados por los cambios de pH. [24] Los iones metálicos también pueden actuar para ionizar el agua al actuar como un ácido de Lewis . [25] Los iones metálicos también pueden ser agentes de oxidación y reducción. [26]
Tensión de enlace
Este es el principal efecto de la unión por ajuste inducido, en el que la afinidad de la enzima por el estado de transición es mayor que por el propio sustrato. Esto induce reordenamientos estructurales que fuerzan los enlaces del sustrato a una posición más cercana a la conformación del estado de transición, lo que reduce la diferencia de energía entre el sustrato y el estado de transición y ayuda a catalizar la reacción.
Sin embargo, el efecto de tensión es, de hecho, un efecto de desestabilización del estado fundamental, en lugar de un efecto de estabilización del estado de transición. [11] [27] [ página necesaria ] Además, las enzimas son muy flexibles y no pueden aplicar grandes efectos de tensión. [28]
Además de la tensión de enlace en el sustrato, también se puede inducir una tensión de enlace dentro de la propia enzima para activar residuos en el sitio activo.
| Por ejemplo: |
| Conformaciones de sustrato, sustrato unido y estado de transición de la lisozima . |
 |
| El sustrato, al unirse, se distorsiona desde la conformación de media silla del anillo de hexosa (debido al impedimento estérico con los aminoácidos de la proteína que fuerzan al c6 ecuatorial a estar en la posición axial) a la conformación de silla, [29] que es similar en forma al estado de transición. |
Tunelización cuántica
Estos mecanismos tradicionales "sobre la barrera" han sido desafiados en algunos casos por modelos y observaciones de mecanismos "a través de la barrera" ( efecto túnel cuántico ). Algunas enzimas operan con cinéticas que son más rápidas que las que se predecirían con el ΔG ‡ clásico . En los modelos "a través de la barrera", un protón o un electrón pueden atravesar barreras de activación. [30] [31] Se ha observado efecto túnel cuántico para protones en la oxidación de triptamina por la amina aromática deshidrogenasa . [32]
El efecto túnel cuántico no parece proporcionar una ventaja catalítica importante, ya que las contribuciones del efecto túnel son similares en las reacciones catalizadas y no catalizadas en solución. [31] [33] [34] [35] Sin embargo, la contribución del efecto túnel (que normalmente mejora las constantes de velocidad en un factor de ~1000 [32] en comparación con la velocidad de reacción para la ruta clásica "sobre la barrera") es probablemente crucial para la viabilidad de los organismos biológicos. Esto enfatiza la importancia general de las reacciones de efecto túnel en biología.
En 1971-1972 se formuló el primer modelo mecánico cuántico de catálisis enzimática. [36] [37] [ fuente de terceros necesaria ]
Enzima activa
La energía de enlace del complejo enzima-sustrato no puede considerarse como una energía externa necesaria para la activación del sustrato. La enzima de alto contenido energético puede transferir primero un grupo energético específico X 1 desde el sitio catalítico de la enzima al lugar final del primer reactivo enlazado, luego otro grupo X 2 del segundo reactivo enlazado (o del segundo grupo del reactivo único) debe transferirse al sitio activo para finalizar la conversión del sustrato en producto y la regeneración de la enzima. [38]
Podemos presentar toda la reacción enzimática como dos reacciones de acoplamiento:
| S1 + EX1 → S1EX1 → P1 + EP2 | ( 1 ) |
| S2 + EP2 → S2EP2 → P2 + EX2 | ( 2 ) |
Se puede ver en la reacción ( 1 ) que el grupo X 1 de la enzima activa aparece en el producto debido a la posibilidad de la reacción de intercambio dentro de la enzima para evitar tanto la inhibición electrostática como la repulsión de átomos. Por lo tanto, representamos la enzima activa como un reactivo poderoso de la reacción enzimática. La reacción ( 2 ) muestra una conversión incompleta del sustrato porque su grupo X 2 permanece dentro de la enzima. Este enfoque como idea se había propuesto anteriormente basándose en las conversiones enzimáticas extremadamente altas hipotéticas (enzima catalíticamente perfecta). [39]
El punto crucial para la verificación del presente enfoque es que el catalizador debe ser un complejo de la enzima con el grupo de transferencia de la reacción. Este aspecto químico está respaldado por los mecanismos bien estudiados de las diversas reacciones enzimáticas. Considérese la reacción de hidrólisis del enlace peptídico catalizada por una proteína pura, la α-quimotripsina (una enzima que actúa sin un cofactor), que es un miembro bien estudiado de la familia de las serina proteasas, véase. [40]
Presentamos los resultados experimentales para esta reacción en dos pasos químicos:
| S1 + EH → P1 + EP2 | ( 3 ) |
| EP2 + H−O−H → EH + P2 | ( 4 ) |
donde S 1 es un polipéptido, P 1 y P 2 son productos. El primer paso químico ( 3 ) incluye la formación de un intermediario covalente acil-enzima. El segundo paso ( 4 ) es el paso de desacilación. Es importante notar que el grupo H+, inicialmente encontrado en la enzima, pero no en el agua, aparece en el producto antes del paso de hidrólisis, por lo tanto puede ser considerado como un grupo adicional de la reacción enzimática.
Así, la reacción ( 3 ) muestra que la enzima actúa como un potente reactante de la reacción. Según el concepto propuesto, el transporte de H desde la enzima promueve la conversión del primer reactante, la ruptura del primer enlace químico inicial (entre los grupos P 1 y P 2 ). La etapa de hidrólisis conduce a una ruptura del segundo enlace químico y a la regeneración de la enzima.
El mecanismo químico propuesto no depende de la concentración de los sustratos o productos en el medio. Sin embargo, un cambio en su concentración causa principalmente cambios de energía libre en los pasos primero y final de las reacciones ( 1 ) y ( 2 ) debido a los cambios en el contenido de energía libre de cada molécula, ya sea S o P, en solución acuosa. Este enfoque está de acuerdo con el siguiente mecanismo de contracción muscular. El paso final de la hidrólisis de ATP en el músculo esquelético es la liberación del producto causada por la asociación de las cabezas de miosina con la actina. [41] El cierre de la hendidura de unión de la actina durante la reacción de asociación está estructuralmente acoplado con la apertura del bolsillo de unión de nucleótidos en el sitio activo de la miosina. [42]
En particular, los pasos finales de la hidrólisis de ATP incluyen la liberación rápida de fosfato y la liberación lenta de ADP. [43] [44] La liberación de un anión fosfato del anión ADP unido en una solución acuosa puede considerarse una reacción exergónica porque el anión fosfato tiene una masa molecular baja.
De esta manera, llegamos a la conclusión de que la liberación primaria del fosfato inorgánico H 2 PO 4 − conduce a la transformación de una parte significativa de la energía libre de la hidrólisis del ATP en energía cinética del fosfato solvatado, lo que produce un flujo activo. Esta suposición de una transducción mecanoquímica local concuerda con el mecanismo de contracción muscular de Tirosh, donde la fuerza muscular deriva de una acción integrada de flujo activo creado por la hidrólisis del ATP. [45] [46]
Ejemplos de mecanismos catalíticos
En realidad, la mayoría de los mecanismos enzimáticos implican una combinación de varios tipos diferentes de catálisis.
Triosa fosfato isomerasa
La triosa fosfato isomerasa ( EC 5.3.1.1) cataliza la interconversión reversible de los dos isómeros de triosa fosfato, dihidroxiacetona fosfato y D- gliceraldehído 3-fosfato .
Tripsina
La tripsina ( EC 3.4.21.4) es una serina proteasa que escinde los sustratos proteicos después de los residuos de lisina o arginina utilizando una tríada catalítica para realizar la catálisis covalente y un agujero de oxianión para estabilizar la acumulación de carga en los estados de transición .
Aldolasa
La aldolasa ( EC 4.1.2.13) cataliza la descomposición de la fructosa 1,6-bisfosfato (F-1,6-BP) en gliceraldehído 3-fosfato y dihidroxiacetona fosfato ( DHAP ).
Difusividad enzimática
La aparición de estudios de moléculas individuales en la década de 2010 condujo a la observación de que el movimiento de enzimas no ligadas aumenta con el aumento de la concentración de sustrato y el aumento de la entalpía de reacción . [47] Observaciones posteriores sugieren que este aumento en la difusividad es impulsado por el desplazamiento transitorio del centro de masa de la enzima , lo que resulta en un "efecto de retroceso que impulsa la enzima". [48]
Similitud de reacción
La similitud entre reacciones enzimáticas (CE) se puede calcular utilizando cambios de enlace, centros de reacción o métricas de subestructura (EC-BLAST Archivado el 30 de mayo de 2019 en Wayback Machine ). [49]
Véase también
- Tríada catalítica
- Ensayo enzimático
- Inhibidor de enzimas
- Cinética enzimática
- Promiscuidad enzimática
- Dinámica de proteínas
- Pseudoenzimas , cuya ubicuidad a pesar de su inactividad catalítica sugiere implicaciones ómicas
- Tunelización cuántica
- El mapa de la proteólisis
- Cristalografía resuelta en el tiempo
Referencias
- ^ Kamerlin SC, Warshel A (mayo de 2010). "En los albores del siglo XXI: ¿es la dinámica el eslabón perdido para comprender la catálisis enzimática?". Proteins . 78 (6): 1339–1375. doi :10.1002/prot.22654. PMC 2841229 . PMID 20099310.
- ^ Laidler KJ (1978). Química física con aplicaciones biológicas . Benjamin/Cummings. pág. 427. ISBN 978-0-8053-5680-9.
- ^ Koshland DE (febrero de 1958). "Aplicación de una teoría de la especificidad enzimática a la síntesis de proteínas". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 44 (2): 98–104. Bibcode :1958PNAS...44...98K. doi : 10.1073/pnas.44.2.98 . PMC 335371 . PMID 16590179.

- ^ Anslyn EV, Dougherty DA (2006). Química orgánica física moderna . Libros de ciencias universitarias. ISBN 978-1-891389-31-3.
- ^ Savir Y, Tlusty T (mayo de 2007). Scalas E (ed.). "Corrección conformacional: el impacto de los cambios conformacionales en la especificidad del reconocimiento molecular". PLOS ONE . 2 (5): e468. Bibcode :2007PLoSO...2..468S. doi : 10.1371/journal.pone.0000468 . PMC 1868595 . PMID 17520027.

- ^ Stanton RV, Peräkylä M, Bakowies D, Kollman PA (1998). "Cálculos combinados de energía libre y ab initio para estudiar reacciones en enzimas y soluciones: hidrólisis de amida en tripsina y solución acuosa". J. Am. Chem. Soc . 120 (14): 3448–3457. doi :10.1021/ja972723x.
- ^ Kuhn B, Kollman PA (2000). "Cálculos de dinámica molecular y QM-FE sobre la catecol O-metiltransferasa: energía libre de activación en la enzima y en solución acuosa y regioselectividad de la reacción catalizada por la enzima". J. Am. Chem. Soc . 122 (11): 2586–2596. doi :10.1021/ja992218v.
- ^ Bruice TC, Lightstone FC (1999). "Contribuciones del estado fundamental y del estado de transición a las tasas de reacciones intramoleculares y enzimáticas". Acc. Chem. Res . 32 (2): 127–136. doi :10.1021/ar960131y.
- ^ Page MI, Jencks WP (agosto de 1971). "Contribuciones entrópicas a las aceleraciones de velocidad en reacciones enzimáticas e intramoleculares y el efecto quelato". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 68 (8): 1678–1683. Bibcode :1971PNAS...68.1678P. doi : 10.1073/pnas.68.8.1678 . PMC 389269 . PMID 5288752.
- ^ Warshel A, Parson WW (noviembre de 2001). "Dinámica de las reacciones bioquímicas y biofísicas: perspectivas obtenidas mediante simulaciones por computadora". Quarterly Reviews of Biophysics . 34 (4): 563–679. doi :10.1017/s0033583501003730. PMID 11852595. S2CID 28961992.
- ^ abcd Warshel A, Sharma PK, Kato M, Xiang Y, Liu H, Olsson MH (agosto de 2006). "Base electrostática para la catálisis enzimática". Chemical Reviews . 106 (8): 3210–3235. doi :10.1021/cr0503106. PMID 16895325.
- ^ Warshel A, Naray-Szabo G, Sussman F, Hwang JK (mayo de 1989). "¿Cómo funcionan realmente las serina proteasas?". Bioquímica . 28 (9): 3629–3637. doi :10.1021/bi00435a001. PMID 2665806.
- ^ Fersht AR, Requena Y (diciembre de 1971). "Mecanismo de la hidrólisis de amidas catalizada por -quimotripsina. Dependencia del pH de kc y K m. Detección cinética de un intermedio". Journal of the American Chemical Society . 93 (25): 7079–7087. doi :10.1021/ja00754a066. PMID 5133099.
- ^ Zeeberg B, Caswell M, Caplow M (abril de 1973). "Sobre un cambio informado en el paso determinante de la velocidad en la catálisis de la quimotripsina". Journal of the American Chemical Society . 95 (8): 2734–2735. doi :10.1021/ja00789a081. PMID 4694533.
- ^ Voet D, Voet JG (2011). Bioquímica . John Wiley e hijos. OCLC 808679090.
- ^ Marcus RA (1965). "Sobre la teoría de las reacciones de transferencia de electrones. VI. Tratamiento unificado para reacciones homogéneas y de electrodos" (PDF) . J. Chem. Phys . 43 (2): 679–701. Bibcode :1965JChPh..43..679M. doi :10.1063/1.1696792.
- ^ Warshel A (noviembre de 1978). "Energética de la catálisis enzimática". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 75 (11): 5250–5254. Bibcode :1978PNAS...75.5250W. doi : 10.1073/pnas.75.11.5250 . PMC 392938 . PMID 281676.
- ^ Fried SD, Bagchi S, Boxer SG (diciembre de 2014). "Los campos eléctricos extremos impulsan la catálisis en el sitio activo de la isomerasa de cetoesteroide". Science . 346 (6216). Nueva York, NY: 1510–4. Bibcode :2014Sci...346.1510F. doi :10.1126/science.1259802. PMC 4668018 . PMID 25525245.
- ^ Toney, MD "Especificidad de la reacción en las enzimas piridoxales". Archivos de bioquímica y biofísica (2005) 433: 279-287
- ^ "Centro de Información sobre Micronutrientes, Universidad Estatal de Oregón". Archivado desde el original el 21 de marzo de 2015. Consultado el 30 de septiembre de 2009 .
- ^ Voet D, Voet JG (2004). Bioquímica. John Wiley & Sons Inc. págs. 986–989. ISBN 978-0-471-25090-6.
- ^ Voet D, Voet JG (2004). Bioquímica. John Wiley & Sons Inc. págs. ISBN 978-0-471-25090-6.
- ^ Piccirilli JA, Vyle JS, Caruthers MH, Cech TR (enero de 1993). "Catálisis de iones metálicos en la reacción de la ribozima de Tetrahymena". Nature . 361 (6407): 85–88. Bibcode :1993Natur.361...85P. doi :10.1038/361085a0. PMID 8421499. S2CID 4326584.
- ^ Bender ML (1 de enero de 1962). "Catálisis de iones metálicos de reacciones orgánicas nucleófilas en solución". Reacciones de ligandos coordinados . Avances en química. Vol. 37. Sociedad Química Americana. págs. 19–36. doi :10.1021/ba-1963-0037.ch002. ISBN. 978-0-8412-0038-8.
- ^ Fife TH, Przystas TJ (1 de febrero de 1985). "Catálisis de iones metálicos divalentes en la hidrólisis de ésteres de ácido picolínico. Reacciones catalizadas por iones hidróxido y agua promovidas por iones metálicos". Journal of the American Chemical Society . 107 (4): 1041–1047. doi :10.1021/ja00290a048. ISSN 0002-7863.
- ^ Stadtman ER (1 de enero de 1990). "Oxidación de proteínas catalizada por iones metálicos: mecanismo bioquímico y consecuencias biológicas". Biología y medicina de radicales libres . 9 (4): 315–325. doi :10.1016/0891-5849(90)90006-5. PMID 2283087.
- ^ Jencks WP (1987) [1969]. Catálisis en química y enzimología . Serie McGraw-Hill sobre química avanzada (edición reimpresa). Nueva York: Dover Publications . ISBN 978-0-486-65460-7.
- ^ Warshel A, Levitt M (mayo de 1976). "Estudios teóricos de reacciones enzimáticas: estabilización dieléctrica, electrostática y estérica del ion carbonio en la reacción de la lisozima". Journal of Molecular Biology . 103 (2): 227–249. doi :10.1016/0022-2836(76)90311-9. PMID 985660.

- ^ Voet D, Voet JG, Pratt CW (2013). Fundamentos de bioquímica: la vida a nivel molecular (cuarta edición). Hoboken, Nueva Jersey: Wiley. ISBN 978-0-470-54784-7.
- ^ Garcia-Viloca M, Gao J, Karplus M, Truhlar DG (enero de 2004). "Cómo funcionan las enzimas: análisis mediante la teoría de velocidad moderna y simulaciones por computadora". Science . 303 (5655): 186–195. Bibcode :2004Sci...303..186G. doi :10.1126/science.1088172. PMID 14716003. S2CID 17498715.
- ^ ab Olsson MH, Siegbahn PE, Warshel A (marzo de 2004). "Simulaciones del efecto de isótopos cinéticos grandes y la dependencia de la temperatura de la transferencia de átomos de hidrógeno en lipoxigenasa". Journal of the American Chemical Society . 126 (9): 2820–2828. doi :10.1021/ja037233l. PMID 14995199.
- ^ ab Masgrau L, Roujeinikova A, Johannissen LO, Hothi P, Basran J, Ranaghan KE, et al. (abril de 2006). "Descripción atómica de una reacción enzimática dominada por el efecto túnel de protones". Science . 312 (5771): 237–241. Bibcode :2006Sci...312..237M. doi :10.1126/science.1126002. PMID 16614214. S2CID 27201250.
- ^ Hwang JK, Warshel A (1996). "¿Qué importancia tienen los movimientos nucleares mecánicos cuánticos en la catálisis enzimática?". J. Am. Chem. Soc . 118 (47): 11745–11751. doi :10.1021/ja962007f.
- ^ Ball P (septiembre de 2004). "Enzimas: ¿por casualidad o por diseño?". Nature . 431 (7007): 396–397. Bibcode :2004Natur.431..396B. doi : 10.1038/431396a . PMID 15385982. S2CID 228263.
- ^ Olsson MH, Parson WW, Warshel A (mayo de 2006). "Contribuciones dinámicas a la catálisis enzimática: pruebas críticas de una hipótesis popular". Chemical Reviews . 106 (5): 1737–1756. doi :10.1021/cr040427e. PMID 16683752.
- ^ Vol'kenshtein MV, Dogonadze RR, Madumarov AK, Urushadze ZD, Kharkats YI (1972). "La teoría de la catálisis enzimática". Biología molecular . 6 (3). Moscú: 347–353. PMID 4645409.
- ^ Volkenshtein MV, Dogonadze RR, Madumarov AK, Urushadze ZD, Kharkats Yu I (1973). "Interacciones electrónicas y conformacionales en catálisis enzimática". Konformatsionnie Izmenenia Biopolimerov contra Rastvorakh . Moscú: Editorial Nauka. págs. 153-157.
- ^ Foigel AG (junio de 2011). "¿Es la enzima un reactivo potente de la reacción bioquímica?". Bioquímica molecular y celular . 352 (1–2): 87–89. doi :10.1007/s11010-011-0742-4. PMID 21318350. S2CID 11133081.
- ^ Fogel AG (agosto de 1982). "Cooperatividad de las reacciones enzimáticas y aspectos moleculares de la transducción de energía". Bioquímica molecular y celular . 47 (1): 59–64. doi :10.1007/bf00241567. PMID 7132966. S2CID 21790380.
- ^ Hengge AC, Stein RL (enero de 2004). "El papel de la movilidad conformacional de las proteínas en la catálisis enzimática: acilación de la alfa-quimotripsina por sustratos peptídicos específicos". Bioquímica . 43 (3): 742–747. doi :10.1021/bi030222k. PMID 14730979.
- ^ Lymn RW, Taylor EW (diciembre de 1971). "Mecanismo de hidrólisis del trifosfato de adenosina por actomiosina". Bioquímica . 10 (25): 4617–4624. doi :10.1021/bi00801a004. PMID 4258719.
- ^ Holmes KC, Angert I, Kull FJ, Jahn W, Schröder RR (septiembre de 2003). "La criomicroscopía electrónica muestra cómo la fuerte unión de la miosina a la actina libera nucleótidos". Nature . 425 (6956): 423–427. Bibcode :2003Natur.425..423H. doi :10.1038/nature02005. PMID 14508495. S2CID 2686184.
- ^ Siemankowski RF, Wiseman MO, White HD (febrero de 1985). "La disociación de ADP del subfragmento 1 de actomiosina es lo suficientemente lenta como para limitar la velocidad de acortamiento sin carga en el músculo de vertebrados". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 82 (3): 658–662. Bibcode :1985PNAS...82..658S. doi : 10.1073/pnas.82.3.658 . PMC 397104 . PMID 3871943.
- ^ White HD, Belknap B, Webb MR (septiembre de 1997). "Cinética de la escisión del trifosfato de nucleósido y los pasos de liberación de fosfato por la actomiosina esquelética de conejo asociada, medida utilizando una nueva sonda fluorescente para fosfato". Bioquímica . 36 (39): 11828–11836. doi :10.1021/bi970540h. PMID 9305974.
- ^ Tirosh R, Low WZ, Oplatka A (marzo de 1990). "Movimiento traslacional de filamentos de actina en presencia de meromiosina pesada y MgATP medido por ensanchamiento Doppler de dispersión de luz láser". Biochimica et Biophysica Acta (BBA) - Estructura de proteínas y enzimología molecular . 1037 (3): 274–280. doi :10.1016/0167-4838(90)90025-b. PMID 2178685.
- ^ Tirosh R (2006). "Protones balísticos y soluciones de agua inducidas por microondas (solitones) en transformaciones bioenergéticas". Int. J. Mol. Sci . 7 (9): 320–345. doi : 10.3390/i7090320 .
- ^ Muddana HS, Sengupta S, Mallouk TE, Sen A, Butler PJ (febrero de 2010). "La catálisis de sustrato mejora la difusión de una sola enzima". Revista de la Sociedad Química Estadounidense . 132 (7): 2110–2111. doi :10.1021/ja908773a. PMC 2832858. PMID 20108965 .

- ^ Riedel C, Gabizon R, Wilson CA, Hamadani K, Tsekouras K, Marqusee S, et al. (enero de 2015). "El calor liberado durante el recambio catalítico mejora la difusión de una enzima". Nature . 517 (7533): 227–230. Bibcode :2015Natur.517..227R. doi :10.1038/nature14043. PMC 4363105 . PMID 25487146.

- ^ Rahman SA, Cuesta SM, Furnham N, Holliday GL, Thornton JM (febrero de 2014). "EC-BLAST: una herramienta para buscar y comparar automáticamente reacciones enzimáticas". Nature Methods . 11 (2): 171–174. doi :10.1038/nmeth.2803. PMC 4122987 . PMID 24412978.
Lectura adicional
- Fersht A (1998). Estructura y mecanismo en la ciencia de las proteínas: una guía para la catálisis enzimática y el plegamiento de proteínas . Nueva York: WH Freeman. ISBN 978-0-7167-3268-6.
- Sutcliffe M, Munro A (agosto de 2006). "Catálisis cuántica en enzimas: más allá de la teoría del estado de transición". Philosophical Transactions B . 361 (1472): 1291–1455. doi : 10.1098/rstb.2006.1879 . PMC 1647302 .


