Glicosaminoglicano
Este artículo puede resultar demasiado técnico para la mayoría de los lectores . ( Julio de 2015 ) |
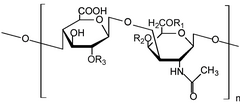
Los glicosaminoglicanos [1] ( GAG ) o mucopolisacáridos [2] son polisacáridos largos y lineales que consisten en unidades de disacáridos repetidas (es decir, unidades de dos azúcares). La unidad repetida de dos azúcares consiste en un azúcar urónico y un aminoazúcar , excepto en el caso del glicosaminoglicano sulfatado queratán , donde, en lugar del azúcar urónico hay una unidad de galactosa . [3] Los GAG se encuentran en vertebrados, invertebrados y bacterias. [4] Debido a que los GAG son moléculas altamente polares y atraen agua, el cuerpo los usa como lubricantes o amortiguadores.
Las mucopolisacaridosis son un grupo de trastornos metabólicos en los que se producen acumulaciones anormales de glicosaminoglicanos debido a deficiencias enzimáticas.
Producción
Los glicosaminoglicanos varían mucho en masa molecular, estructura de disacáridos y sulfatación . Esto se debe a que la síntesis de GAG no está impulsada por plantillas, como las proteínas o los ácidos nucleicos, sino que se modifica constantemente mediante enzimas procesadoras. [5]
Los GAG se clasifican en cuatro grupos, según sus estructuras disacáridas centrales: [6]
- Heparina /sulfato de heparán (HSGAG)
- Sulfato de condroitina / sulfato de dermatán (CSGAG), que junto con los HSGAG se sintetizan en el aparato de Golgi , donde los núcleos de proteínas , fabricados en el retículo endoplasmático rugoso , se modifican postraduccionalmente a través de la glicosilación ligada a O por las glicosiltransferasas , formando así proteoglicanos .
- Sulfato de queratán que puede modificar las proteínas centrales a través de la glicosilación ligada a N o la glicosilación ligada a O del proteoglicano.
- Ácido hialurónico (también conocido como hialuronano), que es sintetizado por las sintasas integrales de membrana, que secretan inmediatamente la cadena de disacáridos alargada dinámicamente. [ aclaración necesaria ]
HSGAG y CSGAG
Los proteoglicanos modificados con HSGAG y CSGAG comienzan primero con un motivo de consenso Ser-Gly/Ala-X-Gly en la proteína central. La construcción de un enlace tetrasacárido que consiste en -GlcAβ1–3Galβ1–3Galβ1–4Xylβ1-O-(Ser)-, donde la xilosiltransferasa , la β4-galactosil transferasa (GalTI), la β3-galactosil transferasa (GalT-II) y la β3-GlcA transferasa (GlcAT-I) transfieren los cuatro monosacáridos, comienza la síntesis de la proteína modificada con GAG. La primera modificación del enlace tetrasacárido determina si se agregarán HSGAG o CSGAG. La adición de una GlcNAc promueve la adición de HSGAG, mientras que la adición de GalNAc al enlace tetrasacárido promueve el desarrollo de CSGAG. [6] La GlcNAcT-I transfiere la GlcNAc al enlazador tetrasacárido, que es distinto de la glicosiltransferasa GlcNAcT-II, la enzima que se utiliza para construir HSGAG. Se ha demostrado que EXTL2 y EXTL3, dos genes de la familia de supresores tumorales EXT, tienen actividad GlcNAcT-I. Por el contrario, la GalNAc es transferida al enlazador por la enzima GalNAcT para iniciar la síntesis de CSGAG, una enzima que puede o no tener una actividad distinta en comparación con la actividad de la transferasa GalNAc de la condroitina sintasa. [6]
Con respecto a los HSGAG, una enzima multimérica codificada por EXT1 y EXT2 de la familia de genes EXT, transfiere tanto GlcNAc como GlcA para la elongación de la cadena HSGAG. Mientras se elonga, el HSGAG se modifica dinámicamente, primero por la N-desacetilasa, N-sulfotransferasa ( NDST1 ), que es una enzima bifuncional que escinde el grupo N-acetilo de GlcNAc y posteriormente sulfata la posición N. A continuación, la C-5 uronil epimerasa convierte d-GlcA en l-IdoA seguida de la 2- O sulfatación del azúcar de ácido urónico por la 2 -O sulfotransferasa ( Heparan sulfato 2-O-sulfotransferasa ). Finalmente, las posiciones 6- O y 3- O de las fracciones GlcNAc son sulfatadas por las sulfotransferasas 6- O ( heparán sulfato 6-O-sulfotransferasa ) y 3-O (3-OST).
El sulfato de condroitina y el sulfato de dermatán, que comprenden los CSGAG, se diferencian entre sí por la presencia de epímeros GlcA e IdoA respectivamente. De manera similar a la producción de HSGAG, la C-5 uronil epimerasa convierte d-GlcA en l-IdoA para sintetizar sulfato de dermatán. Ocurren tres eventos de sulfatación de las cadenas CSGAG: sulfatación 4- O y/o 6- O de GalNAc y sulfatación 2- O de ácido urónico. Cuatro isoformas de las sulfotransferasas 4- O GalNAc (C4ST-1, C4ST-2, C4ST-3 y D4ST-1) y tres isoformas de las sulfotransferasas 6- O GalNAc (C6ST, C6ST-2 y GalNAc4S-6ST) son responsables de la sulfatación de GalNAc. [7]
Tipos de sulfato de queratán
A diferencia de los HSGAG y CSGAG, la tercera clase de GAG, los que pertenecen a los tipos de queratán sulfato , son impulsados hacia la biosíntesis a través de motivos de secuencia de proteína particulares. Por ejemplo, en la córnea y el cartílago, el dominio de queratán sulfato del agrecano consiste en una serie de hexapéptidos repetidos en tándem con una secuencia de consenso de E(E/L)PFPS. [8] Además, para otros tres proteoglicanos sulfatados con queratán, lumican , queratocan y mimecan ( OGN ), se determinó que la secuencia de consenso NX(T/S) junto con la estructura secundaria de la proteína estaba involucrada en la extensión de oligosacáridos N -ligados con queratán sulfato. [8] La elongación del queratán sulfato comienza en los extremos no reductores de tres oligosacáridos de enlace, que definen las tres clases de queratán sulfato. El queratán sulfato I (KSI) está N -ligado a través de un oligosacárido precursor de tipo manosa alto. El sulfato de queratán II (KSII) y el sulfato de queratán III (KSIII) están unidos por enlaces O , con enlaces KSII idénticos a los de la estructura central de la mucina , y KSIII unido a una manosa 2- O . La elongación del polímero de sulfato de queratán ocurre a través de la adición de Gal y GlcNAc por la glicosiltransferasa. La adición de galactosa ocurre principalmente a través de la enzima β-1,4-galactosiltransferasa (β4Gal-T1), mientras que las enzimas responsables de la β-3-Nacetilglucosamina no se han identificado claramente. Finalmente, la sulfatación del polímero ocurre en la posición 6 de ambos residuos de azúcar. La enzima KS-Gal6ST ( CHST1 ) transfiere grupos sulfato a la galactosa, mientras que la N-acetilglucosaminil-6-sulfotransferasa (GlcNAc6ST) ( CHST2 ) transfiere grupos sulfato a la GlcNAc terminal en el sulfato de queratán. [9]
Clase de ácido hialurónico

La cuarta clase de GAG, el ácido hialurónico (HA), no está sulfatado y es sintetizado por tres proteínas sintasa transmembrana HAS1 , HAS2 y HAS3 . HA, un polisacárido lineal, está compuesto de unidades de disacárido repetidas de →4)GlcAβ(1→3)GlcNAcβ(1→ y tiene una masa molecular muy alta, que varía de 10 5 a 10 7 Da. Cada enzima HAS es capaz de transglicosilación cuando se suministra con UDP-GlcA y UDP-GlcNAc. [10] [11] HAS2 es responsable de polímeros de ácido hialurónico muy grandes, mientras que HAS1 y HAS3 sintetizan tamaños más pequeños de HA. Si bien cada isoforma de HAS cataliza la misma reacción biosintética, cada isoforma de HAS es activa de forma independiente. También se ha demostrado que las isoformas de HAS tienen diferentes valores de K m para UDP-GlcA y UDPGlcNAc. [12] Se cree que a través de las diferencias en la actividad y expresión enzimática, se puede regular el amplio espectro de funciones biológicas mediadas por HA, como su participación en la regulación de las células madre neurales en la zona subgranular del cerebro.
Farmacodinamia
- HSGAG
- La heparina endógena se localiza y almacena en los gránulos secretores de los mastocitos . La histamina presente en los gránulos está protonada (H 2 A 2+ ) a un pH dentro de los gránulos (5,2–6,0), por lo que se cree que la heparina, que tiene una carga muy negativa, funciona para retener y almacenar electrostáticamente la histamina. [13] En la clínica, la heparina se administra como anticoagulante y también es la primera opción para las enfermedades tromboembólicas. [14] [15] El heparán sulfato (HS) tiene numerosas actividades y funciones biológicas, entre ellas la adhesión celular, la regulación del crecimiento y la proliferación celular, los procesos de desarrollo, la unión a la superficie celular de la lipoproteína lipasa y otras proteínas, la angiogénesis, la invasión viral y la metástasis tumoral. [13]
Los CSGAG interactúan con las proteínas de unión a la heparina, específicamente las interacciones del sulfato de dermatán con el factor de crecimiento de fibroblastos FGF-2 y FGF-7 se han implicado en la proliferación celular y la reparación de heridas [16] mientras que las interacciones con el factor de crecimiento hepático/factor de dispersión (HGF/SF) activan la vía de señalización de HGF/SF ( c-Met ) a través de su receptor. Los CSGAG son importantes para proporcionar soporte y adhesividad en el hueso, la piel y el cartílago. Otras funciones biológicas para las que se sabe que los CSGAG desempeñan funciones críticas incluyen la inhibición del crecimiento axonal y la regeneración en el desarrollo del SNC, funciones en el desarrollo cerebral, la actividad neuritogénica y la infección por patógenos. [17]
- Sulfatos de queratán
- Una de las principales funciones de la tercera clase de GAG, los queratán sulfatos, es el mantenimiento de la hidratación tisular. [18] Los queratán sulfatos se encuentran en el hueso, el cartílago y la córnea del ojo. [19] Dentro de la córnea normal, el dermatán sulfato está completamente hidratado mientras que el queratán sulfato está solo parcialmente hidratado, lo que sugiere que el queratán sulfato puede comportarse como un amortiguador controlado dinámicamente para la hidratación. [18] En estados patológicos como la distrofia corneal macular , en la que se alteran los niveles de GAG como el KS, se cree que la pérdida de hidratación dentro del estroma corneal es la causa de la opacidad corneal, lo que respalda la hipótesis de larga data de que la transparencia corneal depende de los niveles adecuados de queratán sulfato. Los GAG de sulfato de queratán se encuentran en muchos otros tejidos además de la córnea, donde se sabe que regulan la adhesión de los macrófagos , forman barreras para el crecimiento de las neuritas , regulan la implantación del embrión en el revestimiento uterino endometrial durante los ciclos menstruales y afectan la motilidad de las células endoteliales de la córnea. [18] En resumen, el KS desempeña un papel antiadhesivo, lo que sugiere funciones muy importantes del KS en la motilidad y la adhesión celular, así como en otros posibles procesos biológicos.
Sulfatos de dermatán
Los sulfatos de dermatán actúan en la piel, los tendones, los vasos sanguíneos y las válvulas cardíacas. [19]
- Ácido hialurónico
- El ácido hialurónico es un componente importante de los tejidos y el líquido sinovial , así como la sustancia fundamental de otros tejidos conectivos. El ácido hialurónico une las células, lubrica las articulaciones y ayuda a mantener la forma de los globos oculares. [19] La viscoelasticidad del ácido hialurónico lo hace ideal para lubricar las articulaciones y las superficies que se mueven unas a otras, como el cartílago. Una solución de ácido hialurónico sometida a un esfuerzo cortante bajo tiene una viscosidad mucho mayor que cuando está sometida a un esfuerzo cortante alto. [20] La hialuronidasa , una enzima producida por los glóbulos blancos, los espermatozoides y algunas bacterias, descompone el ácido hialurónico, lo que hace que la solución se vuelva más líquida. [19]
- In vivo , el ácido hialurónico forma espirales enroscadas al azar que se enredan para formar una red de hialuronano, lo que ralentiza la difusión y forma una barrera de difusión que regula el transporte de sustancias entre las células. Por ejemplo, el hialuronano ayuda a repartir las proteínas plasmáticas entre los espacios vasculares y extravasculares, lo que afecta a la solubilidad de las macromoléculas en el intersticio, cambia los equilibrios químicos y estabiliza la estructura de las fibras de colágeno. [20]
- Otras funciones incluyen interacciones de la matriz con proteínas de unión a hialuronano como la hialuronectina, la proteína de unión a hialuronano glial, la proteína de unión a hialuronano enriquecida en el cerebro, el colágeno VI , TSG-6 y el inhibidor de inter-alfa-tripsina . Las interacciones de la superficie celular que involucran al hialuronano son su conocido acoplamiento con CD44 , que puede estar relacionado con la progresión tumoral, y también con RHAMM ( receptor de motilidad mediado por hialuronano ), que se ha implicado en procesos de desarrollo, metástasis tumoral y procesos reparadores patológicos.
- Los fibroblastos, las células mesoteliales y ciertos tipos de células madre se rodean de una "capa" pericelular , parte de la cual está formada por ácido hialurónico, para protegerse de las bacterias, los glóbulos rojos u otras moléculas de la matriz. Por ejemplo, en lo que respecta a las células madre, el ácido hialurónico, junto con el sulfato de condroitina, ayuda a formar el nicho de células madre . Las células madre están protegidas de los efectos de los factores de crecimiento por un escudo de ácido hialurónico y sulfato de condroitina mínimamente sulfatado. Durante la división progenitora, la célula hija se mueve fuera de este escudo pericelular donde puede ser influenciada por los factores de crecimiento para diferenciarse aún más.
Clasificación
Los miembros de la familia de los glicosaminoglicanos varían en el tipo de unidad de hexosamina, hexosa o ácido hexurónico que contienen (por ejemplo, ácido glucurónico , ácido idurónico , galactosa , galactosamina , glucosamina ).
También varían en la geometría del enlace glucosídico .
Algunos ejemplos de GAG incluyen:
| Nombre | Ácido hexurónico o hexosa (para queratán) | Hexosamina | Geometría de enlace entre unidades monoméricas predominantes | Características únicas |
|---|---|---|---|---|
| Sulfato de condroitina | GlcUA o GlcUA(2S) | GalNAc o GalNAc(4S) o GalNAc(6S) o GalNAc(4S,6S) | GlcUA β (1→3)GalNAc β (1→4) | GAG más prevalente |
| Sulfato de dermatán | GlcUA o IdoUA o IdoUA(2S) | GalNAc o GalNAc(4S) o GalNAc(6S) o GalNAc(4S,6S) | ' IdoUA β 1-3' GalNAc β 1-4 | Se distingue del sulfato de condroitina por la presencia de ácido idurónico , aunque algunos monosacáridos de ácido hexurónico pueden ser ácido glucurónico . [16] |
| Sulfato de queratán | Gal o Gal(6S) | GlcNAc o GlcNAc(6S) | - Gal(6S) β1-4 GlcNAc( 6S ) β1-3 | El sulfato de queratán tipo II puede estar fucosilado . [21] |
| Heparina | GlcUA o IdoUA(2S) | GlcNAc o GlcNS o GlcNAc(6S) o GlcNS(6S) | - IdoUA(2S) α 1-4 GlcNS(6S) α 1-4 | La densidad de carga negativa más alta de cualquier molécula biológica conocida. |
| Sulfato de heparán | GlcUA o IdoUA o IdoUA(2S) | GlcNAc o GlcNS o GlcNAc(6S) o GlcNS(6S) | - GlcUA β 1-4 GlcNAc α 1-4 | Muy similar en estructura a la heparina, sin embargo las unidades de disacárido del sulfato de heparán están organizadas en dominios sulfatados y no sulfatados distintos. [22] |
| Ácido hialurónico | GlcUA | GlcNAc | - GlcUA β 1-3 GlcNAc β 1-4 | El único GAG que no contiene ningún tipo de sulfatación. |
Abreviaturas
- GlcUA = ácido β -D- glucurónico
- GlcUA(2S) = ácido 2-O-sulfo- β -D-glucurónico
- IdoUA = ácido α -L- idurónico
- IdoUA(2S) = ácido 2-O-sulfo- α -L-idurónico
- Gal = β -D- galactosa
- Gal(6S) = 6-O-sulfo- β -D-galactosa
- GalNAc = β -D- N-acetilgalactosamina
- GalNAc(4S) = β -DN-acetilgalactosamina-4-O-sulfato
- GalNAc(6S) = β -DN-acetilgalactosamina-6-O-sulfato
- GalNAc(4S,6S) = β -DN-acetilgalactosamina-4-O, 6-O-sulfato
- GlcNAc = α -D- N-acetilglucosamina
- GlcNS = α -DN-sulfoglucosamina
- GlcNS(6S) = α -DN-sulfoglucosamina-6-O-sulfato
Véase también
- Glicoproteína : proteína con modificaciones de oligosacáridos.
- Lipopolisacárido : Clase de moléculas que se encuentran en la membrana externa de las bacterias gramnegativas.
- Baba de caracol : Secreción corporal externa producida por los caracoles
- Glicocáliz : capa viscosa rica en carbohidratos que se encuentra en la periferia más externa de la célula. Capa pericelular.
Referencias
- ^ "glicosaminoglicano" en el Diccionario médico de Dorland
- ^ "mucopolisacárido" en el Diccionario médico de Dorland
- ^ Esko, Jeffrey D; Kimata, Koji; Lindahl, Ulf (2009). "Capítulo 16: Proteoglicanos y glicosaminoglicanos sulfatados". Fundamentos de glicobiología . Cold Spring Harbor Laboratory Press. ISBN 978-0879695590.
- ^ DeAngelis, Paul L. (1 de noviembre de 2002). "Evolución de los glicosaminoglicanos y sus glicosiltransferasas: implicaciones para las matrices extracelulares de animales y las cápsulas de bacterias patógenas". The Anatomical Record . 268 (3): 317–326. doi : 10.1002/ar.10163 . ISSN 0003-276X. PMID 12382327. S2CID 38827411.
- ^ Caligur, Vicki (2008). "Sulfatación y señalización de glicosaminoglicanos" . Consultado el 25 de noviembre de 2012 .
- ^ abc Sasisekharan, Ram; Raman, Rahul; Prabhakar, Vikas (agosto de 2006). "Enfoque glicómico para las relaciones estructura-función de los glicosaminoglicanos". Revisión anual de ingeniería biomédica . 8 (1): 181–231. doi : 10.1146/annurev.bioeng.8.061505.095745 . PMID 16834555.
- ^ Kusche-Gullberg M, Kjellén L (2003). "Sulfotransferasas en la biosíntesis de glicosaminoglicanos". Current Opinion in Structural Biology . 13 (5): 605–11. doi :10.1016/j.sbi.2003.08.002. PMID 14568616.
- ^ ab Funderburgh JL. (2002). "Biosíntesis de sulfato de queratán". IUBMB Life . 54 (4): 187–94. doi :10.1080/15216540214932. PMC 2874674 . PMID 12512857.
- ^ Yamamoto Y, Takahashi I, Ogata N, Nakazawa K (2001). "Purificación y caracterización de la N-acetilglucosaminil sulfotransferasa de córneas de pollo". Archivos de bioquímica y biofísica . 392 (1): 87–92. doi :10.1006/abbi.2001.2422. PMID 11469798.
- ^ Yoshida M, Itano N, Yamada Y, Kimata K (2000). "Síntesis in vitro de ácido hialurónico por una única proteína derivada del gen HAS1 de ratón y caracterización de los residuos de aminoácidos esenciales para la actividad". The Journal of Biological Chemistry . 275 (1): 497–506. doi : 10.1074/jbc.275.1.497 . PMID 10617644.
- ^ DeAngelis PL, Weigel PH (1994). "Confirmación inmunoquímica de la estructura primaria de la hialuronano sintasa estreptocócica y síntesis de un producto de alto peso molecular por la enzima recombinante". Bioquímica . 33 (31): 9033–39. doi :10.1021/bi00197a001. PMID 8049203.
- ^ Itano N; Sawai T; Yoshida M; Lenas P; Yamada Y; Imagawa M; Shinomura T; Hamaguchi M; Yoshida Y; Ohnuki Y; Miyauchi S; Spicer AP; McDonald JA; Kimata K (1999). "Tres isoformas de hialuronano sintasas de mamíferos tienen propiedades enzimáticas distintas". Journal of Biological Chemistry . 274 (35): 25085–92. doi : 10.1074/jbc.274.35.25085 . PMID 10455188.
- ^ ab Rabenstein DL. (2002). "Heparina y sulfato de heparán: estructura y función". Natural Product Reports . 19 (3): 312–31. doi :10.1039/B100916H. PMID 12137280.
- ^ Jin L, Abrahams JP, Skinner R, Petitou M, Pike RN, Carrell RW (1997). "La activación anticoagulante de la antitrombina por la heparina". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 94 (26): 14683–88. Bibcode :1997PNAS...9414683J. doi : 10.1073/pnas.94.26.14683 . PMC 25092 . PMID 9405673.
- ^ Rodén, L. (1989). Lane, DA (ed.). Heparina: propiedades químicas y biológicas, aplicaciones clínicas . CRC Press, Inc. pág. 1.
- ^ ab Trowbridge JM, Gallo RL (2002). "Sulfato de dermatán: nuevas funciones de un antiguo glicosaminoglicano". Glicobiología . 12 (9): 117R–125R. doi : 10.1093/glycob/cwf066 . PMID 12213784.
- ^ Sugahara K, Mikami T, Uyama T, Mizuguchi S, Nomura K, Kitagawa H (2003). "Avances recientes en la biología estructural del sulfato de condroitina y el sulfato de dermatán". Current Opinion in Structural Biology . 13 (5): 612–20. doi :10.1016/j.sbi.2003.09.011. PMID 14568617.
- ^ abc Funderburgh, JL. (2000). "Sulfato de queratán: estructura, biosíntesis y función". Glicobiología . 10 (10): 951–58. doi : 10.1093/glycob/10.10.951 . PMID 11030741.
- ^ abcd Tortora, Gerard J. (31 de diciembre de 2013). Principios de anatomía y fisiología . Derrickson, Bryan (14.ª ed.). Danvers, MA. ISBN 978-1-118-34500-9.OCLC 871018672 .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ ab Laurent TC, Laurent UB, Fraser JR (1996). "La estructura y función del ácido hialurónico: una descripción general". Inmunología y biología celular . 74 (2): A1-7. doi :10.1038/icb.1996.32. PMID 8724014.
- ^ Funderburgh JL. (2000). "Sulfato de queratán: estructura, biosíntesis y función". Glycobiology . 10 (10): 951–58. doi : 10.1093/glycob/10.10.951 . PMID 11030741.
- ^ Gallagher, JT, Lyon, M. (2000). "Estructura molecular del sulfato de heparán e interacciones con factores de crecimiento y morfógenos". En Iozzo, M, V. (ed.). Proteoglicanos: estructura, biología e interacciones moleculares . Nueva York: Marcel Dekker Inc. págs. 27–59. ISBN 978-0-8247-0334-9.
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace )
Enlaces externos
- King M. 2005. Glycosaminoglycans Archivado el 8 de febrero de 2023 en Wayback Machine . Facultad de Medicina de la Universidad de Indiana . Consultado el 31 de diciembre de 2006.
- Glicosaminoglicanos en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Evaluación de la pérdida de glicosaminoglicanos mediante resonancia magnética (evaluación dGEMRIC) Archivado el 22 de agosto de 2011 en Wayback Machine
