Proteína inductora del ensamblaje de actina
| Proteína inductora del ensamblaje de actina | |||||||
|---|---|---|---|---|---|---|---|
 Complejo peptídico ActA-dominio EVH1 | |||||||
| Identificadores | |||||||
| Símbolo | Acta A | ||||||
| Gen NCBI | 2798121 | ||||||
| Protección unificada | P33379 | ||||||
| |||||||
La proteína inductora del ensamblaje de actina ( ActA ) es una proteína codificada y utilizada por Listeria monocytogenes para impulsarse a través de una célula huésped de mamífero. ActA es una proteína de superficie bacteriana que comprende una región que abarca la membrana. [1] En una célula de mamífero, la ActA bacteriana interactúa con el complejo Arp2/3 y los monómeros de actina para inducir la polimerización de actina en la superficie bacteriana generando una cola de cometa de actina. El gen que codifica ActA se llama actA o prtB. [2]
Introducción
En cuanto las bacterias L. monocytogenes son ingeridas por los seres humanos, se internalizan en las células del epitelio intestinal y rápidamente intentan escapar de su vacuola de internalización. [3] [4] En el citosol, comienzan a polimerizar actina en su superficie con la ayuda de la proteína ActA. Se ha demostrado que ActA no solo es necesaria sino también suficiente para inducir la motilidad de las bacterias en ausencia de otros factores bacterianos. [5]
Descubrimiento
ActA se descubrió mediante el análisis de mutantes de Listeria Tn 917-lac negativos a la lecitinasa debido al fenotipo de que no podían propagarse de una célula a otra. Estas bacterias mutantes aún escapaban de los fagosomas con la misma eficiencia que las bacterias de tipo salvaje y se multiplicaban dentro de las células infectadas, pero no estaban rodeadas de actina como las bacterias de tipo salvaje. Un análisis posterior mostró que Tn 917-lac se había insertado en actA , el segundo gen de un operón. El tercer gen de este operón, plcB , codifica la lecitinasa de L. monocytogenes . Para determinar si actA en sí, plcB u otras regiones co-transcritas aguas abajo están involucradas en el ensamblaje de actina, se generaron mutaciones en los genes apropiados. Todos los mutantes excepto los mutantes actA fueron similares a los de tipo salvaje en lo que respecta a la asociación con F-actina y la propagación de célula a célula. La complementación con actA restauró el fenotipo de tipo salvaje en los mutantes actA . [1]
Función

ActA es una proteína que actúa como un imitador de la proteína del síndrome de Wiskott-Aldrich (WASP), un factor promotor de nucleación (NPF) presente en las células huésped. Los NPF en la célula de mamífero reclutan y se unen al complejo de proteína relacionada con actina 2 y 3 ya existente (complejo Arp2/3) e inducen un cambio conformacional activador del complejo Arp2/3. [6] Debido a este cambio conformacional, los NPF inician la polimerización de un nuevo filamento de actina en un ángulo de 70°, lo que conduce a las características estructuras de actina ramificadas en Y en el borde delantero de las células móviles. ActA se localiza en el polo antiguo de la bacteria y abarca tanto la membrana celular bacteriana como la pared celular, la difusión lateral se inhibe; por lo tanto, ActA se localiza de manera polarizada y anclada en la superficie bacteriana. En consecuencia, la polimerización de actina solo comienza en esta región en la superficie de la bacteria. [7] La expresión de ActA se induce solo después de ingresar a una célula huésped de mamífero. [8]
El ensamblaje de filamentos de actina genera la fuerza que empuja a la bacteria hacia adelante en el citoplasma del huésped mamífero. La polimerización continua de actina es suficiente para la movilidad en el citoplasma e incluso para la infección de células adyacentes. [9]
Investigación
Nuevos datos indican que ActA también desempeña un papel en la disrupción vacuolar. Un mutante de deleción de ActA era defectuoso en la permeabilización de la vacuola. Se demostró que un tramo de 11 aminoácidos del extremo N de la región ácida (32-42) era importante para la disrupción del fagosoma . [10]
Estructura
El producto proteico primario del gen actA consta de 639 aminoácidos e incluye el péptido señal (primeros 29 aminoácidos N-terminales) y la cadena ActA (610 aminoácidos C-terminales). Por lo tanto, la secuencia de la proteína ActA madura consta de 610 aminoácidos. ActA tiene un peso molecular de 70.349 Da y es una proteína de superficie. [1] [2]
ActA es una proteína desplegada de forma nativa que se puede dividir en tres dominios funcionales (Fig. 2): [1] [11] [12]
- Dominio N-terminal altamente cargado: residuos de aminoácidos 1-234
- Dominio central con repeticiones ricas en prolina: residuos de aminoácidos 235-394
- Dominio C-terminal con un dominio transmembrana: residuos de aminoácidos 395-610
Dominio N-terminal
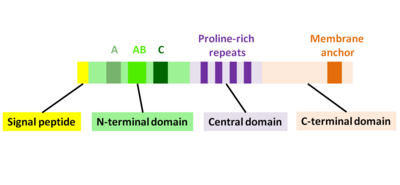
Los primeros 156 aminoácidos del dominio N-terminal constan de tres regiones [10] [13] (Fig. 2):
- Región A con un tramo de residuos ácidos: 32-45
- Región AB, región de unión del monómero de actina: 59-102
- Región C, secuencia de homología de cofilina: 145-156
La porción N-terminal de ActA juega un papel importante en la polimerización de actina. [14] El dominio muestra elementos de consenso presentes en los NPF de la familia WASP eucariotas que incluyen una región de unión al monómero de actina, así como una región C (homología central o de cofilina) y A (ácida) de unión a Arp2/3. [7] La región de unión al monómero de actina de ActA tiene propiedades funcionales como el dominio WASP-Homology-2 (WH2) o V, pero difiere en la secuencia. [15] Por lo tanto, en los NPF de la familia WASP, el orden de los dominios es WH2 seguido de C y luego de A, lo que no es el caso en ActA.
Dominio central
La región central rica en prolina de ActA es crucial para asegurar una motilidad bacteriana eficiente. Hay cuatro repeticiones ricas en prolina que contienen motivos FPPPP o FPPIP. Estas regiones imitan las de la proteína citoesquelética de la célula huésped zyxin , vinculin y palladin , conocidas por asociarse con adherencias focales o fibras de estrés. [16] La fosfoproteína estimulada por vasodilatadores ( VASP ) puede unirse a través de su dominio de homología 1 Ena/VASP ( dominio EVH1 ) a la región central rica en prolina y recluta profilina , una proteína de unión a monómero de actina, que promueve la polimerización en los extremos con púas de los filamentos de actina. Además, VASP parece interactuar con F-actina a través de su dominio EVH2 carboxiterminal, que proporciona un enlace de la bacteria a la cola. [17] Esta afirmación está respaldada por el hecho de que ActA puede unirse a múltiples proteínas Ena/VASP simultáneamente y tiene una alta afinidad entre ActA y Ena/VASP. Se ha demostrado que VASP reduce la frecuencia de ramificaciones de actina-Y in vitro y, por lo tanto, aumenta la proporción de filamentos que se organizan en una alineación paralela en las colas de los cometas. [18] [19]
Dominio C-terminal
El dominio C-terminal de ActA tiene una región hidrofóbica que ancla la proteína en la membrana bacteriana. [20] [21] [22]
En resumen, además
- la ausencia de homología de secuencia en la región de unión a la actina y
- una alteración en la secuencia de los dominios activadores de ARP2/3 típica de los NPF de la familia WASP (V(WH2)-CA),
- Una diferencia importante entre ActA y los NPF del huésped es que ActA no tiene elementos que se unan a proteínas reguladoras como las GTPasas de la familia Rho. Esta diferencia estructural entre ActA y los NPF del huésped puede ser ventajosa para L. monocytogenes y su patogénesis porque la actividad de nucleación de actina de L. monocytogenes es independiente de la regulación del huésped. [7]
Análogos
WASP/N-WASP, que es imitada funcionalmente por ActA, está altamente conservada en eucariotas. Es un importante organizador del citoesqueleto de actina y es fundamental para procesos como la endocitosis y la motilidad celular. Activada por Cdc42 , una GTPasa pequeña de la familia Rho, WASP/N-WASP activa el complejo Arp2/3, lo que conduce a una rápida polimerización de la actina. [23]
Motilidad basada en actina de otros patógenos
En Shigella, la proteína IcsA activa N-WASP , que en células de mamíferos no infectados es activada por la GTPasa Cdc42. La N-WASP/WASP activa conduce a la polimerización de actina al activar el complejo Arp2/3. Por el contrario, la proteína ActA de Listeria interactúa con el complejo Arp2/3 y lo activa directamente. [7]
La proteína RickA de Rickettsia también es capaz de activar el complejo Arp2/3 de una manera similar a la de WASP. A diferencia de Listeria , los filamentos de actina están organizados en haces paralelos largos y no ramificados. El complejo Arp2/3 solo se localiza cerca de la superficie bacteriana y, por lo tanto, se supone que se produce una elongación más frecuente independiente del complejo Arp2/3. [16]
En Burkholderia pseudomallei, BimA inicia la polimerización de actina in vitro. Se supone que la migración intracelular de esta bacteria funciona independientemente del complejo Arp2/3. [16]
Véase también
Referencias
- ^ abcd Kocks C, Gouin E, Tabouret M, Berche P, Ohayon H, Cossart P (febrero de 1992). "El ensamblaje de actina inducido por L. monocytogenes requiere el producto del gen actA, una proteína de superficie". Cell . 68 (3): 521–31. doi :10.1016/0092-8674(92)90188-I. PMID 1739966. S2CID 27231730.
- ^ de Uniprot P33379
- ^ Cossart P, Sansonetti PJ (abril de 2004). "Invasión bacteriana: los paradigmas de los patógenos enteroinvasivos". Science . 304 (5668): 242–8. Bibcode :2004Sci...304..242C. doi :10.1126/science.1090124. PMID 15073367. S2CID 34536253.
- ^ Cossart P, Pizarro-Cerdá J, Lecuit M (enero de 2003). "Invasión de células de mamíferos por Listeria monocytogenes: mimetismo funcional para subvertir las funciones celulares". Tendencias en biología celular . 13 (1): 23–31. doi :10.1016/S0962-8924(02)00006-5. PMID 12480337.
- ^ Zigmond SH (febrero de 2004). "Nucleación de filamentos de actina inducida por formina". Current Opinion in Cell Biology . 16 (1): 99–105. doi :10.1016/j.ceb.2003.10.019. PMID 15037312.
- ^ Goley ED, Rodenbusch SE, Martin AC, Welch MD (octubre de 2004). "Los cambios conformacionales críticos en el complejo Arp2/3 son inducidos por nucleótidos y factores promotores de la nucleación". Molecular Cell . 16 (2): 269–79. doi : 10.1016/j.molcel.2004.09.018 . PMID 15494313.
- ^ abcd Gouin E, Welch MD, Cossart P (febrero de 2005). "Motilidad basada en actina de patógenos intracelulares". Current Opinion in Microbiology . 8 (1): 35–45. doi :10.1016/j.mib.2004.12.013. PMID 15694855.
- ^ Rafelski SM, Theriot JA (febrero de 2006). "Mecanismo de polarización de la proteína de superficie ActA de Listeria monocytogenes". Microbiología molecular . 59 (4): 1262–79. doi :10.1111/j.1365-2958.2006.05025.x. PMC 1413586 . PMID 16430699.
- ^ Goldberg MB (diciembre de 2001). "Motilidad basada en actina de patógenos microbianos intracelulares". Microbiology and Molecular Biology Reviews . 65 (4): 595–626. doi :10.1128/MMBR.65.4.595-626.2001. PMC 99042 . PMID 11729265.
- ^ ab Poussin MA, Goldfine H (enero de 2010). "Evidencia de la participación de ActA en la maduración del fagosoma de Listeria monocytogenes". Cell Research . 20 (1): 109–12. doi :10.1038/cr.2009.142. PMC 2802179 . PMID 20029388.
- ^ Ireton K, Cossart P (1997). "Interacciones huésped-patógeno durante la entrada y el movimiento basado en actina de Listeria monocytogenes". Revisión anual de genética . 31 : 113–38. doi :10.1146/annurev.genet.31.1.113. PMID 9442892.
- ^ Pie de página MJ, Lyo JK, Theriot JA (29 de agosto de 2008). "El empaquetamiento compacto de Listeria monocytogenes ActA, una proteína desplegada de forma nativa, mejora el ensamblaje de F-actina sin dimerización". The Journal of Biological Chemistry . 283 (35): 23852–23862. doi : 10.1074/jbc.M803448200 . ISSN 0021-9258. PMC 2527104 . PMID 18577520.
- ^ Welch MD (2007). "Motilidad basada en actina y propagación de Listeria monocytogenes de célula a célula". En Goldfine H, Shen H (eds.). Listeria monocytogenes: patogénesis y respuesta del huésped . Nueva York: Springer. págs. 197–223. doi :10.1007/978-0-387-49376-3_10. ISBN 978-0-387-49373-2.
- ^ Welch MD, Rosenblatt J, Skoble J, Portnoy DA, Mitchison TJ (julio de 1998). "Interacción del complejo Arp2/3 humano y la proteína ActA de Listeria monocytogenes en la nucleación del filamento de actina". Science . 281 (5373): 105–8. Bibcode :1998Sci...281..105W. doi :10.1126/science.281.5373.105. PMID 9651243.
- ^ Zalevsky J, Grigorova I, Mullins RD (febrero de 2001). "Activación del complejo Arp2/3 por la proteína Listeria acta. Acta se une a dos monómeros de actina y tres subunidades del complejo Arp2/3". The Journal of Biological Chemistry . 276 (5): 3468–75. doi : 10.1074/jbc.M006407200 . PMID 11029465.
- ^ abc Lambrechts A, Gevaert K, Cossart P, Vandekerckhove J, Van Troys M (mayo de 2008). "Colas de cometa de Listeria: la maquinaria de motilidad basada en actina en acción". Tendencias en biología celular . 18 (5): 220–7. doi :10.1016/j.tcb.2008.03.001. PMID 18396046.
- ^ Laurent V, Loisel TP, Harbeck B, et al. (marzo de 1999). "El papel de las proteínas de la familia Ena/VASP en la motilidad basada en actina de Listeria monocytogenes". The Journal of Cell Biology . 144 (6): 1245–58. doi :10.1083/jcb.144.6.1245. PMC 2150578 . PMID 10087267.
- ^ Skoble J, Auerbuch V, Goley ED, Welch MD, Portnoy DA (octubre de 2001). "Función fundamental de VASP en la nucleación de actina mediada por el complejo Arp2/3, la formación de ramificaciones de actina y la motilidad de Listeria monocytogenes". The Journal of Cell Biology . 155 (1): 89–100. doi :10.1083/jcb.200106061. PMC 2150787 . PMID 11581288.
- ^ Bear JE, Svitkina TM, Krause M., et al. (mayo de 2002). "El antagonismo entre las proteínas Ena/VASP y la protección de los filamentos de actina regula la motilidad de los fibroblastos". Cell . 109 (4): 509–21. doi :10.1016/S0092-8674(02)00731-6. hdl : 1721.1/83477 . PMID 12086607. S2CID 2848293.
- ^ Vazquez-Boland JA, Kocks C, Dramsi S, et al. (enero de 1992). "Secuencia de nucleótidos del operón lecitinasa de Listeria monocytogenes y posible papel de la lecitinasa en la propagación de célula a célula". Infección e inmunidad . 60 (1): 219–30. doi :10.1128/iai.60.1.219-230.1992. PMC 257526 . PMID 1309513.
- ^ Domann E, Wehland J, Rohde M, et al. (mayo de 1992). "Un nuevo gen de virulencia bacteriana en Listeria monocytogenes necesario para la interacción de microfilamentos de células huésped con homología con la región rica en prolina de la vinculina". The EMBO Journal . 11 (5): 1981–90. doi :10.1002/j.1460-2075.1992.tb05252.x. PMC 556658 . PMID 1582425.
- ^ Kocks C, Hellio R, Gounon P, Ohayon H, Cossart P (julio de 1993). "Distribución polarizada de la proteína de superficie ActA de Listeria monocytogenes en el sitio de ensamblaje direccional de actina". Journal of Cell Science . 105 (3): 699–710. doi :10.1242/jcs.105.3.699. PMID 8408297.
- ^ Kurisu S, Takenawa T (2009). "Las proteínas de la familia WASP y WAVE". Genome Biology . 10 (6): 226. doi : 10.1186/gb-2009-10-6-226 . PMC 2718491 . PMID 19589182.
Enlaces externos
- Vídeo de YouTube de Nature , Listeria monocytogenes [2:00–4:12]