ATPasa tipo P
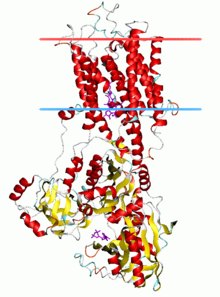 ATPasa de calcio , estado E2-Pi | |||||||||
| Identificadores | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Símbolo | E1-E2_ATPasa | ||||||||
| Pfam | PF00122 | ||||||||
| Interprofesional | IPR008250 | ||||||||
| PROSITIO | PDOC00139 | ||||||||
| SCOP2 | 1su4 / ALCANCE / SUPFAM | ||||||||
| Base de datos de datos termodinámica | 3.A.3 | ||||||||
| Superfamilia OPM | 22 | ||||||||
| Proteína OPM | 3b9b | ||||||||
| Membranoma | 224 | ||||||||
| |||||||||
Las ATPasas de tipo P , también conocidas como ATPasas E 1 -E 2 , son un gran grupo de bombas de iones y lípidos relacionadas evolutivamente que se encuentran en bacterias , arqueas y eucariotas . [1] Las ATPasas de tipo P son transportadores primarios de haz α-helicoidal nombrados en base a su capacidad para catalizar la auto- (o auto-) fosforilación (de ahí P) de un residuo de aspartato conservado clave dentro de la bomba y su fuente de energía, trifosfato de adenosina (ATP). Además, todos parecen interconvertirse entre al menos dos conformaciones diferentes, denotadas por E 1 y E 2 . [2] Las ATPasas de tipo P pertenecen a la Superfamilia de ATPasas de tipo P (P-ATPasa) (TC# 3.A.3) que, a principios de 2016, incluye 20 familias de proteínas diferentes.
La mayoría de los miembros de esta superfamilia de transportadores catalizan la captación y/o eflujo de cationes, sin embargo, una subfamilia, las flipasas (TC# 3.A.3.8) está involucrada en la inversión de los fosfolípidos para mantener la naturaleza asimétrica de la biomembrana .
En los seres humanos, las ATPasas de tipo P sirven como base para los impulsos nerviosos , la relajación de los músculos, la secreción y absorción en el riñón , la absorción de nutrientes en el intestino y otros procesos fisiológicos. Ejemplos destacados de ATPasas de tipo P son la bomba de sodio-potasio (Na + /K + -ATPasa), la bomba de protones-potasio (H + /K + -ATPasa), la bomba de calcio (Ca2 + -ATPasa) y la bomba de protones de la membrana plasmática (H + -ATPasa) de plantas y hongos.
Reacción general del transporte
La reacción generalizada para las ATPasas de tipo P es
nLigando 1 (salida) + mLigando 2 (entrada) + ATP → nLigando 1 (entrada) + mLigando 2 (salida) + ADP + P i .
donde el ligando puede ser un ion metálico o una molécula de fosfolípido.
Descubrimiento
La primera ATPasa de tipo P descubierta fue la Na + /K + -ATPasa , que el premio Nobel Jens Christian Skou aisló en 1957. [3] La Na + /K + -ATPasa fue solo el primer miembro de una gran familia de proteínas en constante crecimiento (véase el motivo Swiss-Prot Prosite PS00154).
Estructura
Las ATPasas de tipo P tienen una única subunidad catalítica de 70 - 140 kDa. La subunidad catalítica hidroliza el ATP, contiene el sitio de fosforilación de aspartilo y los sitios de unión para el ligando o ligandos transportados y cataliza el transporte de iones. Varias subfamilias de ATPasas de tipo P también necesitan subunidades adicionales para funcionar correctamente. Las subunidades adicionales que carecen de actividad catalítica están presentes en los complejos ATPasa de las ATPasas P1A, P2A, P2C y P4. Por ejemplo, la subunidad catalítica alfa de la Na + /K + -ATPasa consta de dos subunidades adicionales, beta y gamma, involucradas en el tráfico, plegamiento y regulación de estas bombas. La primera ATPasa de tipo P que se cristalizó fue SERCA1a , una Ca 2+ -ATPasa del retículo sarco(endo)plásmico del músculo de contracción rápida del conejo adulto . [4] Se reconoce generalmente que la estructura de SERCA1a es representativa de la superfamilia de ATPases de tipo P. [5]
La subunidad catalítica de las ATPasas de tipo P se compone de una sección citoplasmática y una sección transmembrana con sitios de unión para el o los ligandos transportados. La sección citoplasmática consta de tres dominios citoplasmáticos, denominados dominios P, N y A, que contienen más de la mitad de la masa de la proteína.
Sección de membrana
La sección transmembrana ( dominio M ) tiene típicamente diez hélices transmembrana (M1-M10), con los sitios de unión para los ligandos transportados ubicados cerca del punto medio de la bicapa. Si bien la mayoría de las subfamilias tienen 10 hélices transmembrana, existen algunas excepciones notables. Se predice que las ATPasas P1A tienen 7, y se predice que la gran subfamilia de bombas de metales pesados P1B tiene 8 hélices transmembrana. Las ATPasas P5 parecen tener un total de 12 hélices transmembrana.
Todas las ATPasas de tipo P tienen en común un núcleo de 6 segmentos que atraviesan la membrana (también llamados "dominio de transporte (T)"; M1-M6 en SERCA), que alberga los sitios de unión para el o los ligandos translocados. El o los ligandos ingresan a través de un semicanal al sitio de unión y salen por el otro lado de la membrana a través de otro semicanal.
Lo que varía entre las ATPasas de tipo P es el número adicional de segmentos transmembrana (también llamados "dominio de soporte (S)"), que entre las subfamilias varía de 2 a 6. Los segmentos transmembrana adicionales probablemente brindan soporte estructural para el dominio T y también pueden tener funciones especializadas.
Dominio de fosforilación (P)
El dominio P contiene el residuo de ácido aspártico canónico fosforilado (en un motivo DKTGT conservado; la "D" es la abreviatura de una letra del aminoácido aspartato) durante el ciclo de reacción. Está compuesto de dos partes muy separadas en secuencia. Estas dos partes se ensamblan en una lámina β paralela de siete hebras con ocho hélices α cortas asociadas, formando un pliegue de Rossmann .
El patrón de plegamiento y las ubicaciones de los aminoácidos críticos para la fosforilación en las ATPasas de tipo P tienen el plegamiento característico de la superfamilia de las dehalogenasas de haloácido (HAD) , como se predijo por la homología de secuencia. La superfamilia HAD funciona sobre el tema común de una formación de éster de aspartato mediante un mecanismo de reacción S N 2 . Esta reacción S N 2 se observa claramente en la estructura resuelta de SERCA con ADP más AlF 4 − . [6]
Dominio de unión de nucleótidos (N)
El dominio N funciona como una proteína quinasa incorporada que fosforila el dominio P. El dominio N se inserta entre los dos segmentos del dominio P y está formado por una lámina β antiparalela de siete hebras entre dos haces de hélices. Este dominio contiene el bolsillo de unión de ATP, que apunta hacia el solvente cerca del dominio P.
Dominio del actuador (A)
El dominio A actúa como una fosfatasa proteica incorporada que funciona para desfosforilar el dominio P fosforilado. El dominio A es el más pequeño de los tres dominios citoplasmáticos. Consta de una estructura de rollo de gelatina distorsionada y dos hélices cortas. Es el dominio actuador que modula la oclusión del ligando o ligandos transportados en los sitios de unión transmembrana, y es fundamental en la transposición de la energía de la hidrólisis de ATP en los dominios citoplasmáticos al transporte vectorial de cationes en el dominio transmembrana. El dominio A desfosforila el dominio P como parte del ciclo de reacción utilizando un motivo TGES altamente conservado ubicado en un extremo del rollo de gelatina.
Dominio regulador (R)
Algunos miembros de la familia de ATPasas de tipo P tienen dominios reguladores (R) adicionales fusionados a la bomba. Las bombas de metales pesados P1B pueden tener varios dominios de unión a metales pesados N- y C-terminales que se ha descubierto que están involucrados en la regulación. Las ATPasas Ca 2+ P2B tienen dominios autoinhibitorios en sus regiones amino-terminales (plantas) o carboxi-terminales (animales), que contienen sitios de unión para calmodulina , que, en presencia de Ca 2+ , activa las ATPasas P2B neutralizando la restricción terminal. Las bombas de protones de membrana plasmática P3A tienen un dominio regulador C-terminal, que, cuando no está fosforilado, inhibe el bombeo.
Mecanismo
Todas las ATPasas de tipo P utilizan la energía derivada del ATP para impulsar el transporte. Forman un intermediario de aspartil-fosfoanhídrido de alta energía en el ciclo de reacción, y se interconvierten entre al menos dos conformaciones diferentes, denotadas por E 1 y E 2 . La notación E 1 -E 2 proviene de los estudios iniciales sobre esta familia de enzimas realizados en la Na + /K + -ATPasa, donde la forma de sodio y la forma de potasio se denominan E 1 y E 2 , respectivamente, en el "esquema Post-Albers". Se ha demostrado que el esquema E 1 -E 2 funciona, pero existen más de dos estados conformacionales principales. La notación E 1 -E 2 resalta la selectividad de la enzima . En E 1 , la bomba tiene alta afinidad por el sustrato exportado y baja afinidad por el sustrato importado. En E 2 , tiene baja afinidad por el sustrato exportado y alta afinidad por el sustrato importado. Cuatro estados enzimáticos principales forman las piedras angulares del ciclo de reacción. Se interponen varios intermediarios de reacción adicionales. Estos se denominan E 1 ~P, E 2 P, E 2 -P* y E 1 /E 2 . [7]
La hidrólisis del ATP se produce en la cabeza citoplasmática, en la interfaz entre el dominio N y el P. Dos sitios de iones Mg forman parte del sitio activo. La hidrólisis del ATP está estrechamente relacionada con la translocación del o los ligandos transportados a través de la membrana, a más de 40 Å de distancia, por el dominio A.
Clasificación
Un análisis filogenético de 159 secuencias realizado en 1998 por Axelsen y Palmgren sugirió que las ATPasas de tipo P se pueden dividir en cinco subfamilias (tipos; designados como P1-P5), basándose estrictamente en un núcleo de secuencia conservada que excluye las regiones terminales N y C altamente variables. [8] Chan et al. (2010) también analizaron las ATPasas de tipo P en todos los filos procariotas principales para los que estaban disponibles datos completos de la secuencia del genoma y compararon los resultados con los de las ATPasas de tipo P eucariotas. [9] El análisis filogenético agrupó las proteínas independientemente del organismo del que están aisladas y mostró que la diversificación de la familia de ATPasas de tipo P ocurrió antes de la separación de eubacterias , arqueas y eucariotas . Esto subraya la importancia de esta familia de proteínas para la supervivencia celular en condiciones de estrés. [8]
ATPasas P1
Las ATPasas P1 (o ATPasas de tipo I) están compuestas por ATPasas de transición/metales pesados. Las ATPasas de tipo P de tipo I (metales pesados) predominan en los procariotas (aproximadamente diez veces más). [10]
P1A ATPases (bombas de potasio)
Las ATPasas P1A (o Tipo IA) participan en la importación de K + (TC# 3.A.3.7). Son ATPasas de tipo P atípicas porque, a diferencia de otras ATPasas de tipo P, funcionan como parte de un complejo heterotetramérico (llamado KdpFABC), donde el transporte real de K + está mediado por otro subcomponente del complejo.
ATPasas P1B (bombas de metales pesados)
Las ATPasas P1B (o ATPasas Tipo IB) participan en el transporte de los ácidos de Lewis blandos : Cu + , Ag + , Cu2 + , Zn2 + , Cd2 + , Pb2 + y Co2 + (TC#s 3.A.3.5 y 3.A.3.6). Son elementos clave para la resistencia a los metales y la homeostasis de los metales en una amplia gama de organismos.
La unión del metal a los sitios de unión al metal transmembrana (TM-MBS) en las Cu + -ATPasas es necesaria para la fosforilación enzimática y el transporte posterior. Sin embargo, Cu + no accede a las Cu + -ATPasas en forma libre ( hidratada ), sino que está unido a una proteína chaperona . Se ha estudiado la entrega de Cu + por la Cu + -chaperona de Archaeoglobus fulgidus , CopZ (ver TC# 3.A.3.5.7), a la Cu + -ATPasa correspondiente, CopA (TC# 3.A.3.5.30). [11] CopZ interactuó con y entregó el metal al dominio(s) de unión al metal N-terminal de CopA (MBD). Los MBD cargados con Cu + , que actúan como donantes de metal, no pudieron activar CopA o una CopA truncada que carecía de MBD. Por el contrario, la CopZ cargada con Cu + activó la ATPasa CopA y los constructos CopA en los que los MBD se volvieron incapaces de unirse a Cu + . Además, en condiciones sin recambio, CopZ transfirió Cu + al TM-MBS de una CopA que carecía por completo de MBD. Por lo tanto, los MBD pueden cumplir una función reguladora sin participar directamente en el transporte de metales, y la chaperona entrega Cu + directamente a los sitios de transporte transmembrana de las ATPasas Cu + . [11] Wu et al. (2008) han determinado las estructuras de dos constructos de la bomba Cu (CopA) de Archaeoglobus fulgidus mediante microscopía crioelectrónica de cristales tubulares, lo que reveló la arquitectura general y la organización de dominios de la molécula. Localizaron su MBD N-terminal dentro de los dominios citoplasmáticos que utilizan la hidrólisis de ATP para impulsar el ciclo de transporte y construyeron un modelo pseudoatómico ajustando las estructuras cristalográficas existentes en los mapas de microscopía crioelectrónica para CopA. Los resultados también sugirieron de manera similar un papel regulador dependiente de Cu para el MBD. [12]
En la CopA de Archaeoglobus fulgidus (TC# 3.A.3.5.7), los residuos invariantes en las hélices 6, 7 y 8 forman dos sitios de unión de metales transmembrana (TM-MBS). Estos se unen al Cu + con alta afinidad en una geometría plana trigonal. La chaperona de Cu + citoplasmática CopZ transfiere el metal directamente a los TM-MBS; sin embargo, la carga de ambos TM-MBS requiere la unión de nucleótidos a la enzima. De acuerdo con el mecanismo de transporte clásico de las ATPasas de tipo P, la ocupación de ambos sitios transmembrana por el Cu + citoplasmático es un requisito para la fosforilación de la enzima y el posterior transporte al medio periplásmico o extracelular. Los estudios de transporte han demostrado que la mayoría de las ATPasas de Cu + impulsan el eflujo de Cu + citoplasmático , aunque con velocidades de transporte bastante diferentes en sintonía con sus diversas funciones fisiológicas. Las bombas de eflujo Cu + arquetípicas responsables de la tolerancia al Cu + , como la CopA de Escherichia coli , tienen tasas de recambio diez veces superiores a las implicadas en el ensamblaje de cuproproteínas (o funciones alternativas). Esto explica la incapacidad de este último grupo de contribuir significativamente al eflujo de metales necesario para la supervivencia en entornos con alto contenido de cobre. Se han descrito los detalles estructurales y mecanísticos de la función de la ATPasa de tipo P transportadora de cobre. [13]
ATPasas P2
Las ATPasas P2 (o ATPasas de tipo II) se dividen en cuatro grupos. Las ATPasas de tipo II topológicas (específicas para Na + , K + , H +, Ca2 + , Mg2 + y fosfolípidos) predominan en los eucariotas (aproximadamente el doble). [10]
ATPasas P2A (bombas de calcio)
Las ATPasas P2A (o ATPasas de tipo IIA) son ATPasas de Ca 2+ que transportan Ca 2+ . Las ATPasas P2A se dividen en dos grupos. Los miembros del primer grupo se denominan ATPasas de Ca 2+ del retículo sarcoplasmático (también conocidas como SERCA). Estas bombas tienen dos sitios de unión de iones Ca 2+ y a menudo están reguladas por proteínas accesorias inhibidoras que tienen un solo segmento que abarca la membrana (por ejemplo, fosfolamban y sarcolipina ). En la célula, se encuentran en el retículo sarcoplásmico o endoplasmático . SERCA1a es una bomba de tipo IIA. El segundo grupo de P2A ATPases se llama Ca 2+ -ATPases de la vía secretora (también conocidas como SPCA). Estas bombas tienen un solo sitio de unión de iones Ca 2+ y se encuentran en vesículas secretoras (animales) o en la membrana vacuolar (hongos). (TC# 3.A.3.2)
Las estructuras cristalinas de las bombas de calcio impulsadas por ATP del retículo sarcoplásmico/endoplasmático se pueden encontrar en RCSB. [14]
SERCA1a se compone de una sección citoplasmática y una sección transmembrana con dos sitios de unión de Ca 2+ . La sección citoplasmática consta de tres dominios citoplasmáticos, denominados dominios P, N y A, que contienen más de la mitad de la masa de la proteína. La sección transmembrana tiene diez hélices transmembrana (M1-M10), con los dos sitios de unión de Ca 2+ ubicados cerca del punto medio de la bicapa. Los sitios de unión están formados por cadenas laterales y carbonilos de la estructura principal de M4, M5, M6 y M8. M4 se desenrolla en esta región debido a una prolina conservada (P308). Este desenrollado de M4 se reconoce como una característica estructural clave de las ATPasas de tipo P.
Hay estructuras disponibles para los estados E 1 y E 2 de la ATPasa Ca 2+ que muestran que la unión de Ca 2+ induce cambios importantes en los tres dominios citoplasmáticos entre sí. [15]
En el caso de SERCA1a , la energía del ATP se utiliza para transportar 2 iones Ca 2+ desde el lado citoplasmático hasta el lumen del retículo sarcoplasmático y para contratransportar 1-3 protones al citoplasma . Comenzando en el estado E 1 /E 2 , el ciclo de reacción comienza cuando la enzima libera 1-3 protones de los residuos de ligadura de cationes, a cambio de iones Ca 2+ citoplasmáticos . Esto conduce al ensamblaje del sitio de fosforilación entre el dominio N unido a ATP y el dominio P, mientras que el dominio A dirige la oclusión del Ca 2+ unido . En este estado ocluido, los iones Ca 2+ están enterrados en un entorno proteínico sin acceso a ninguno de los lados de la membrana. El estado Ca 2 E 1 ~P se forma a través de una reacción de quinasa, donde el dominio P se fosforila, produciendo ADP. La escisión del enlace β-fosfodiéster libera el gamma-fosfato del ADP y libera el dominio N del dominio P.
Esto permite que el dominio A rote hacia el sitio de fosforilación, formando una asociación firme con los dominios P y N. Este movimiento del dominio A ejerce un empuje hacia abajo sobre M3-M4 y un arrastre sobre M1-M2, obligando a la bomba a abrirse en el lado luminal y formando el estado E2P . Durante esta transición, los residuos transmembrana que se unen al Ca2 + se separan, destruyendo el sitio de unión de alta afinidad. Esto concuerda con el modelo general de translocación del sustrato, que muestra que la energía en el transporte primario no se utiliza para unir el sustrato sino para liberarlo nuevamente de los contraiones enterrados. Al mismo tiempo, el dominio N queda expuesto al citosol, listo para el intercambio de ATP en el sitio de unión del nucleótido.
A medida que el Ca 2+ se disocia hacia el lado luminal, los sitios de unión de los cationes se neutralizan mediante la unión de protones, lo que favorece el cierre de los segmentos transmembrana. Este cierre está acoplado a una rotación descendente del dominio A y a un movimiento del dominio P, que luego conduce al estado ocluido E 2 -P*. Mientras tanto, el dominio N intercambia ADP por ATP.
El dominio P es desfosforilado por el dominio A, y el ciclo se completa cuando el fosfato se libera de la enzima, estimulado por el ATP recién unido, mientras se abre una vía citoplasmática para intercambiar los protones por dos nuevos iones Ca 2+ . [7]
Xu et al. propusieron cómo la unión de Ca 2+ induce cambios conformacionales en TMS 4 y 5 en el dominio de membrana (M) que a su vez inducen la rotación del dominio de fosforilación (P). [15] Los dominios de unión de nucleótidos (N) y de lámina β (β) son altamente móviles, con N unido de forma flexible a P y β unido de forma flexible a M. El modelado de la H + ATPasa fúngica, basado en las estructuras de la bomba de Ca 2+ , sugirió una rotación comparable de 70º de N en relación con P para entregar ATP al sitio de fosforilación. [16]
Un informe sugiere que esta ATPasa de Ca 2+ del retículo sarcoplásmico (SR) es homodímera. [17]
Las estructuras cristalinas han demostrado que el bucle TGES conservado de la Ca 2+ -ATPasa está aislado en el estado Ca 2 E 1 pero se inserta en el sitio catalítico en estados E 2. [18] Anthonisen et al. (2006) caracterizaron la cinética de los pasos de reacción parcial del ciclo de transporte y la unión de los análogos de fosforilo BeF, AlF, MgF y vanadato en mutantes con alteraciones en los residuos conservados del bucle TGES. Los datos proporcionan evidencia funcional que respalda un papel de Glu 183 en la activación de la molécula de agua involucrada en la desfosforilación E 2 P → E 2 y sugieren una participación directa de las cadenas laterales del bucle TGES en el control y la facilitación de la inserción del bucle en el sitio catalítico. Las interacciones del bucle TGES además parecen facilitar su desacoplamiento del sitio catalítico durante la transición E 2 → Ca 2 E 1. [18]
Las estructuras cristalinas de la ATPasa de calcio están disponibles en RCSB e incluyen: PDB : 4AQR , 2L1W , 2M7E , 2M73 , entre otras. [19]
ATPasas P2B (bombas de calcio)
Las P2B (o ATPasas de tipo IIB) son ATPasas de Ca 2+ que transportan Ca 2+ . Estas bombas tienen un único sitio de unión de iones de Ca 2+ y están reguladas por la unión de la calmodulina a dominios incorporados autoinhibitorios situados en el extremo carboxiterminal (animales) o aminoterminal (plantas) de la proteína de bomba. En la célula, están situadas en la membrana plasmática (animales y plantas) y en las membranas internas (plantas). La ATPasa de Ca 2+ de la membrana plasmática (PMCA) de los animales es una ATPasa P2B (TC# 3.A.3.2)
ATPasas P2C (bombas de sodio/potasio y protón/potasio)
Las ATPasas P2C (o Tipo IIC) incluyen las ATPasas Na + /K + y H + /K + estrechamente relacionadas de las células animales. (TC# 3.A.3.1)
La estructura cristalina de rayos X a una resolución de 3,5 Å de la Na + /K + -ATPasa renal de cerdo se ha determinado con dos iones de rubidio unidos en un estado ocluido en la parte transmembrana de la subunidad α. [20] Varios de los residuos que forman la cavidad para la oclusión de rubidio/potasio en la Na + /K + -ATPasa son homólogos a los que se unen al calcio en la Ca2 + -ATPasa del retículo sarco(endo)plásmico. El extremo carboxiterminal de la subunidad α está contenido dentro de un bolsillo entre hélices transmembrana y parece ser un nuevo elemento regulador que controla la afinidad por el sodio, posiblemente influenciado por el potencial de membrana .
Las estructuras cristalinas están disponibles en RCSB e incluyen: PDB : 4RES , 4RET , 3WGU , 3WGV , entre otras. [21]
ATPasas P2D (bombas de sodio)
Las ATPasas P2D (o Tipo IID) incluyen una pequeña cantidad de ATPasas exportadoras de Na + (y K + ) que se encuentran en hongos y musgos. (Transportadores de K + fúngicos ; TC# 3.A.3.9)
ATPasas P3
Las ATPasas P3 (o ATPasas tipo III) se dividen en dos grupos.
ATPasas P3A (bombas de protones)
Las ATPasas P3A (o Tipo IIIA) contienen las ATPasas H + de la membrana plasmática de procariotas, protistas, plantas y hongos.
La H + -ATPasa de la membrana plasmática se caracteriza mejor en plantas y levaduras. Mantiene el nivel de pH intracelular y el potencial transmembrana . [22] Diez hélices transmembrana y tres dominios citoplasmáticos definen la unidad funcional del transporte de protones acoplado a ATP a través de la membrana plasmática, y la estructura está bloqueada en un estado funcional no observado previamente en las ATPasas de tipo P. El dominio transmembrana revela una gran cavidad, que es probable que esté llena de agua, ubicada cerca del medio del plano de la membrana donde está revestida por residuos hidrófilos y cargados conservados. El transporte de protones contra un alto potencial de membrana se explica fácilmente por esta disposición estructural. [23]
ATPasas P3B (bombas de magnesio)
Las ATPasas P3B (o Tipo IIIB) son presuntas ATPasas de Mg 2+ que se encuentran en eubacterias y plantas. Transportadores fúngicos de H + (TC# 3.A.3.3) y Mg 2+ (TC# 3.A.3.4)
P4 ATPases (flippasas de fosfolípidos)
Las ATPasas P4 (o ATPasas Tipo IV) son flipasas involucradas en el transporte de fosfolípidos , [24] como la fosfatidilserina , la fosfatidilcolina y la fosfatidiletanolamina . [25]
ATPasas P5
Las ATPasas P5 (o ATPasas tipo V) tienen una especificidad desconocida. Este gran grupo se encuentra únicamente en eucariotas y se divide a su vez en dos grupos.
ATPasas P5A
Las ATPasas P5A (o tipo VA) están involucradas en la regulación de la homeostasis en el retículo endoplásmico . [26]
ATPasas P5B
Las ATPasas P5B (o tipo VB) se encuentran en la membrana lisosomal de los animales. Las mutaciones en estas bombas están vinculadas a una variedad de enfermedades neurológicas. [27] [28]
Clasificación filogenética adicional
Además de las subfamilias de ATPasas de tipo P enumeradas anteriormente, se han identificado varias familias procariotas de función desconocida. [29] La base de datos de clasificación de transportadores proporciona una lista representativa de los miembros de la superfamilia de las ATPasas de tipo P, que a principios de 2016 constaba de 20 familias. Los miembros de la superfamilia de las ATPasas de tipo P se encuentran en bacterias , arqueas y eucariotas . La agrupación en el árbol filogenético suele estar de acuerdo con la especificidad de los iones transportados.
En los eucariotas, están presentes en las membranas plasmáticas o reticulares endoplasmáticas . En los procariotas, se localizan en las membranas citoplasmáticas.
Posteriormente se analizaron las ATPasas de tipo P de 26 especies eucariotas. [10] [30]
Chan et al. (2010) realizaron un análisis equivalente pero más extenso de la superfamilia de ATPasas de tipo P en procariotas y las compararon con las de eucariotas. Si bien algunas familias están representadas en ambos tipos de organismos, otras se encuentran solo en uno del otro tipo. Las funciones principales de las ATPasas de tipo P procariotas parecen ser la protección frente a condiciones de estrés ambiental. Solo alrededor de la mitad de las familias de ATPasas de tipo P están caracterizadas funcionalmente. [29]
Transferencia horizontal de genes
Muchas familias de ATPasas de tipo P se encuentran exclusivamente en procariotas (por ejemplo, las ATPasas de captación de K + de tipo Kdp (tipo III) y todas las familias de ATPasas de tipo P funcionalmente no caracterizadas (FUPA) procariotas), mientras que otras están restringidas a eucariotas (por ejemplo, las flipasas de fosfolípidos y las 13 familias de FUPA eucariotas). [10] La transferencia horizontal de genes ha ocurrido con frecuencia entre bacterias y arqueas, que tienen distribuciones similares de estas enzimas , pero rara vez entre la mayoría de los reinos eucariotas, e incluso más raramente entre eucariotas y procariotas. En algunos filos bacterianos (por ejemplo, Bacteroidota y Fusobacteriota ), la ganancia y pérdida de genes de ATPasa, así como la transferencia horizontal, ocurrieron rara vez en contraste con la mayoría de los otros filos bacterianos. Algunas familias (es decir, las ATPasas de tipo Kdp) experimentaron mucha menos transferencia horizontal de genes que otras familias procariotas, posiblemente debido a sus características de múltiples subunidades. Los motivos funcionales se conservan mejor entre líneas familiares que entre líneas de organismos, y estos motivos pueden ser específicos de la familia, lo que facilita las predicciones funcionales. En algunos casos, los eventos de fusión de genes crearon ATPasas de tipo P unidas covalentemente a enzimas catalíticas reguladoras. En una familia (Familia FUPA 24), un gen de ATPasa de tipo I (N-terminal) se fusiona con un gen de ATPasa de tipo II (C-terminal) con retención de función solo para este último. La minimización del genoma condujo a la pérdida preferencial de genes de ATPasa de tipo P. Chan et al. (2010) sugirieron que en procariotas y algunos eucariotas unicelulares, la función principal de las ATPasas de tipo P es la protección contra condiciones de estrés ambiental extremo. La clasificación de las ATPasas de tipo P de función desconocida en familias filogenéticas proporciona guías para futuros estudios de biología molecular. [9]
Genes humanos
Los genes humanos que codifican ATPasas de tipo P o proteínas similares a ATPasas de tipo P incluyen:
- P1B: ATPasa Cu ++ : ATP7A , ATP7B
- P2A: SERCA Ca 2+ ATPasa : ATP2A1 , ATP2A2 , ATP2A3
- P2A: vía secretora Ca 2+ -ATPasa : ATP2C1 , ATP2C2
- P2B: Ca 2+ ATPasa : ATP2B1 , ATP2B2 , ATP2B3 , ATP2B4
- P2C: Na + /K + ATPasa : ATP1A1 , ATP1A2 , ATP1A3 , ATP1A4 , ATP1B1 , ATP1B2, ATP1B3 , ATP1B4
- P2C: H + /K + ATPasa, gástrico: ATP4A ;
- P2C: H + /K + ATPasa, no gástrica: ATP12A
- P4: Flippase : ATP8A1, ATP8B1 , ATP8B2, ATP8B3 , ATP8B4, ATP9A , ATP9B, ATP10A , ATP10B, ATP10D, ATP11A, ATP11B , ATP11C
- P5: ATP13A1, ATP13A2 , ATP13A3 , ATP13A4, ATP13A5
Véase también
- H + /K + -ATPasa
- Na + /K + -ATPasa
- Membrana plasmática H + -ATPasa
- Sarco/retículo endoplasmático Ca 2+ -ATPasa
- V-ATPasa
Referencias
- ^ Palmgren MG, Nissen P (2011). "ATPases de tipo P" (PDF) . Annu. Rev. Biophys . 40 : 243–66. doi :10.1146/annurev.biophys.093008.131331. PMID 21351879.
- ^ Pedersen PL, Carafoli E (1987). "ATPases con motivo iónico. I. Ubicuidad, propiedades y significado para la función celular". Tendencias en ciencias bioquímicas . 12 : 146–50. doi :10.1016/0968-0004(87)90071-5.
- ^ SKOU JC (febrero de 1957). "La influencia de algunos cationes en una adenosina trifosfatasa de los nervios periféricos". Biochim. Biophys. Acta . 23 (2): 394–401. doi :10.1016/0006-3002(57)90343-8. PMID 13412736.
- ^ Toyoshima C, Nakasako M, Nomura H, Ogawa H (junio de 2000). "Estructura cristalina de la bomba de calcio del retículo sarcoplásmico con una resolución de 2,6 A". Nature . 405 (6787): 647–55. Bibcode :2000Natur.405..647T. doi :10.1038/35015017. PMID 10864315. S2CID 4316039.
- ^ Stokes DL, Green NM (2003). "Estructura y función de la bomba de calcio". Annu Rev Biophys Biomol Struct . 32 : 445–68. doi :10.1146/annurev.biophys.32.110601.142433. PMID 12598367.
- ^ PDB : 1T5T ; Sørensen TL, Møller JV, Nissen P (junio de 2004). "Transferencia de fosforilo y oclusión de iones de calcio en la bomba de calcio". Science . 304 (5677): 1672–5. Bibcode :2004Sci...304.1672S. doi :10.1126/science.1099366. PMID 15192230. S2CID 30576015.
- ^ ab Olesen C, Picard M, Winther AM, et al. (diciembre de 2007). "La base estructural del transporte de calcio por la bomba de calcio". Nature . 450 (7172): 1036–42. Bibcode :2007Natur.450.1036O. doi :10.1038/nature06418. PMID 18075584. S2CID 4323780.
- ^ ab Axelsen KB, Palmgren MG (enero de 1998). "Evolución de las especificidades del sustrato en la superfamilia de ATPasas de tipo P". J. Mol. Evol . 46 (1): 84–101. Bibcode :1998JMolE..46...84A. doi :10.1007/PL00006286. PMID 9419228. S2CID 10238525. Archivado desde el original el 2000-09-15 . Consultado el 2009-06-10 .
- ^ ab Chan, Henry; Babayan, Vartan; Blyumin, Elya; Gandhi, Charmy; Hak, Kunal; Harake, Danielle; Kumar, Kris; Lee, Perry; Li, Tze T. (2010). "La superfamilia de ATPasas de tipo P". Revista de microbiología molecular y biotecnología . 19 (1–2): 5–104. doi :10.1159/000319588. PMID 20962537. S2CID 7316282.
- ^ abcd Thever, Mark D.; Jr, Milton H. Saier (23 de junio de 2009). "Caracterización bioinformática de las ATPasas de tipo P codificadas en los genomas completamente secuenciados de 26 eucariotas". Revista de biología de membranas . 229 (3): 115–130. doi :10.1007/s00232-009-9176-2. ISSN 0022-2631. PMC 2709905 . PMID 19548020.
- ^ ab González-Guerrero, Manuel; Argüello, José M. (2008-04-22). "Mecanismo de las ATPases transportadoras de Cu+: las chaperonas solubles de Cu+ transfieren directamente Cu+ a los sitios de transporte transmembrana". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 105 (16): 5992–5997. Bibcode :2008PNAS..105.5992G. doi : 10.1073/pnas.0711446105 . ISSN 1091-6490. PMC 2329688 . PMID 18417453.
- ^ Wu, Chen-Chou; Rice, William J.; Stokes, David L. (1 de junio de 2008). "La estructura de una bomba de cobre sugiere una función reguladora para su dominio de unión a metales". Estructura . 16 (6): 976–985. doi :10.1016/j.str.2008.02.025. ISSN 0969-2126. PMC 2705936 . PMID 18547529.
- ^ Meng, Dan; Bruschweiler-Li, Lei; Zhang, Fengli; Brüschweiler, Rafael (18 de agosto de 2015). "Modulación y papel funcional de las orientaciones de los dominios N y P de la ATPasa transportadora de Cu+ a lo largo del ciclo de transporte de iones". Bioquímica . 54 (32): 5095–5102. doi :10.1021/acs.biochem.5b00420. ISSN 1520-4995. PMID 26196187.
- ^ "Anteproyecto de Rcsb".
- ^ ab Xu, Chen; Rice, William J.; He, Wanzhong; Stokes, David L. (8 de febrero de 2002). "Un modelo estructural para el ciclo catalítico de la Ca(2+)-ATPasa". Revista de Biología Molecular . 316 (1): 201–211. doi :10.1006/jmbi.2001.5330. ISSN 0022-2836. PMID 11829513. S2CID 596014.
- ^ Kühlbrandt, Werner; Zeelen, Johan; Dietrich, Jens (6 de septiembre de 2002). "Estructura, mecanismo y regulación de la H+-ATPasa de la membrana plasmática de Neurospora". Science . 297 (5587): 1692–1696. Bibcode :2002Sci...297.1692K. doi :10.1126/science.1072574. ISSN 1095-9203. PMID 12169656. S2CID 16320388.
- ^ Ushimaru, Makoto; Fukushima, Yoshihiro (15 de septiembre de 2008). "La forma dimérica de la Ca2+-ATPasa está implicada en el transporte de Ca2+ en el retículo sarcoplásmico". The Biochemical Journal . 414 (3): 357–361. doi : 10.1042/BJ20071701 . ISSN 1470-8728. PMID 18471093. S2CID 698714.
- ^ ab Anthonisen, Anne Nyholm; Clausen, Johannes D.; Andersen, Jens Peter (2006-10-20). "Análisis mutacional del bucle TGES conservado de la Ca2+-ATPasa del retículo sarcoplásmico". The Journal of Biological Chemistry . 281 (42): 31572–31582. doi : 10.1074/jbc.M605194200 . ISSN 0021-9258. PMID 16893884.
- ^ "Anteproyecto de Rcsb".
- ^ Morth, J. Preben; Pedersen, Bjørn P.; Toustrup-Jensen, Mads S.; Sørensen, Thomas L.-M.; Petersen, Janne; Andersen, Jens Peter; Vilsen, Bente; Nissen, Poul (13 de diciembre de 2007). "Estructura cristalina de la bomba de sodio-potasio". Naturaleza . 450 (7172): 1043–1049. Código Bib : 2007Natur.450.1043M. doi : 10.1038/naturaleza06419. ISSN 1476-4687. PMID 18075585. S2CID 4344526.
- ^ "Anteproyecto de Rcsb".
- ^ Kühlbrandt, Werner; Zeelen, Johan; Dietrich, Jens (6 de septiembre de 2002). "Estructura, mecanismo y regulación de la H+-ATPasa de la membrana plasmática de Neurospora". Science . 297 (5587): 1692–1696. Bibcode :2002Sci...297.1692K. doi :10.1126/science.1072574. ISSN 0036-8075. PMID 12169656. S2CID 16320388.
- ^ Pedersen, Bjørn P.; Buch-Pedersen, Morten J.; Preben Morth, J.; Palmgren, Michael G.; Nissen, Poul (13 de diciembre de 2007). "Estructura cristalina de la bomba de protones de la membrana plasmática". Naturaleza . 450 (7172): 1111–1114. Código Bib : 2007Natur.450.1111P. doi : 10.1038/naturaleza06417. ISSN 0028-0836. PMID 18075595. S2CID 4413142.
- ^ Lenoir G, Williamson P, Holthuis JC (diciembre de 2007). "Sobre el origen de la asimetría lipídica: la otra cara del transporte iónico". Curr Opin Chem Biol . 11 (6): 654–61. doi :10.1016/j.cbpa.2007.09.008. hdl : 1874/26974 . PMID 17981493.
- ^ Lopez-Marques RL, Poulsen LR, Hanisch S, Meffert K, Buch-Pedersen MJ, Jakobsen MK, Pomorski TG, Palmgren MG (2010). "Las señales de orientación intracelular y los determinantes de especificidad lipídica del complejo ALA/ALIS P4-ATPasa residen en la subunidad catalítica ALA alfa". Mol Biol Cell . 21 (5): 791–801. doi :10.1091/mbc.E09-08-0656. PMC 2828965 . PMID 20053675.
- ^ Sørensen DM, Holen HW, Holemans T, Vangheluwe P, Palmgren MG (mayo de 2014). "Hacia la definición del sustrato de las P5A-ATPasas huérfanas" (PDF) . Biochim. Biofísica. Acta . 1850 (3): 524–35. doi :10.1016/j.bbagen.2014.05.008. PMID 24836520.
- ^ Ramirez, A; Heimbach, A; Gründemann, J; Stiller, B; Hampshire, D; Cid, L. P; Goebel, I; Mubaidin, A. F; Wriekat, A. L; Roeper, J; Al-Din, A; Hillmer, A. M; Karsak, M; Liss, B; Woods, C. G; Behrens, M. I; Kubisch, C (2006). "El parkinsonismo hereditario con demencia es causado por mutaciones en ATP13A2, que codifica una ATPasa de tipo P lisosomal tipo 5". Nature Genetics . 38 (10): 1184–91. doi :10.1038/ng1884. PMID 16964263. S2CID 6502952.
- ^ Di Fonzo, A; Chien, HF; Socal, M; Giraudo, S; Tassorelli, C; Iliceto, G; Fabbrini, G; Marconi, R; Fincati, E; Abbruzzese, G; Marini, P; Squitieri, F; Horstink, MW; Montaña, P; Libera, AD; Stocchi, F; Sierpe de oro, S; Ferreira, J. J; Meco, G; Martignoni, E; Lopiano, L; Jardim, LB; Oostra, BA; Barbosa, ER; Red Italiana de Genética del Parkinson; Bonifati, V (2007). "Mutaciones sin sentido de ATP13A2 en el parkinsonismo juvenil y la enfermedad de Parkinson de aparición temprana". Neurología . 68 (19): 1557–62. Código IATA : 10.1212/01.wnl.0000260963.08711.08. PMID 17485642. S2CID 24070567.
- ^ ab Chan, Henry; Babayan, Vartan; Blyumin, Elya; Gandhi, Charmy; Hak, Kunal; Harake, Danielle; Kumar, Kris; Lee, Perry; Li, Tze T. (1 de enero de 2010). "La superfamilia de ATPasas de tipo p". Revista de Microbiología Molecular y Biotecnología . 19 (1–2): 5–104. doi :10.1159/000319588. ISSN 1660-2412. PMID 20962537. S2CID 7316282.
- ^ Rodríguez-Navarro, Alonso; Benito, Begoña (1 de octubre de 2010). "ATPasa de eflujo de sodio o potasio: una ATPasa de hongos, briófitos y protozoarios". Biochimica et Biophysica Acta (BBA) - Biomembranas . 1798 (10): 1841–1853. doi : 10.1016/j.bbamem.2010.07.009 . PMID 20650263.
