Dineína

Las dineínas son una familia de proteínas motoras del citoesqueleto que se desplazan a lo largo de los microtúbulos de las células . Convierten la energía química almacenada en el ATP en trabajo mecánico . La dineína transporta diversas cargas celulares , proporciona fuerzas y desplazamientos importantes en la mitosis e impulsa el ritmo de los cilios y flagelos eucariotas . Todas estas funciones dependen de la capacidad de la dineína de moverse hacia el extremo negativo de los microtúbulos, conocido como transporte retrógrado ; por lo tanto, se denominan "motores dirigidos al extremo negativo". Por el contrario, la mayoría de las proteínas motoras de kinesina se mueven hacia el extremo positivo de los microtúbulos, en lo que se denomina transporte anterógrado .
Clasificación
| Cadena pesada de dineína, región N-terminal 1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | Número de identificación personal 1 | ||||||||
| Pfam | PF08385 | ||||||||
| Interprofesional | IPR013594 | ||||||||
| |||||||||
| Cadena pesada de dineína, región N-terminal 2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | Número de identificación personal DH_N2 | ||||||||
| Pfam | PF08393 | ||||||||
| Interprofesional | IPR013602 | ||||||||
| |||||||||
| Cadena pesada de dineína y región D6 del motor de dineína | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | Dineína pesada | ||||||||
| Pfam | PF03028 | ||||||||
| Interprofesional | IPR004273 | ||||||||
| |||||||||
| Cadena intermedia ligera de dineína (DLIC) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||||
| Símbolo | DLIC | ||||||||||
| Pfam | PF05783 | ||||||||||
| Clan Pfam | CL0023 | ||||||||||
| |||||||||||
| Cadena ligera de dineína tipo 1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estructura del dímero PIN/LC8 humano con un péptido unido | |||||||||
| Identificadores | |||||||||
| Símbolo | Luz de dineína | ||||||||
| Pfam | PF01221 | ||||||||
| Interprofesional | IPR001372 | ||||||||
| PROSITIO | PDOC00953 | ||||||||
| SCOP2 | 1bkq / ALCANCE / SUPFAM | ||||||||
| |||||||||
| Barricada | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estructura de la proteína Roadblock/LC7 - RCSB PDB 1y4o | |||||||||
| Identificadores | |||||||||
| Símbolo | Robl1, Robl2 | ||||||||
| Pfam | PF03259 | ||||||||
| Interprofesional | IPR016561 | ||||||||
| SCOP2 | 1y4o / ALCANCE / SUPFAM | ||||||||
| |||||||||
Las dineínas se pueden dividir en dos grupos: dineínas citoplasmáticas y dineínas axonemales , también llamadas dineínas ciliares o flagelares.
- citoplasmático
- axonemal
Función
La dineína axonemal provoca el deslizamiento de los microtúbulos en los axonemas de los cilios y flagelos y se encuentra únicamente en células que tienen esas estructuras.
La dineína citoplasmática, presente en todas las células animales y posiblemente también en las vegetales, desempeña funciones necesarias para la supervivencia celular, como el transporte de orgánulos y el ensamblaje del centrosoma . [1] La dineína citoplasmática se mueve de forma procesiva a lo largo del microtúbulo; es decir, uno u otro de sus tallos está siempre unido al microtúbulo, de modo que la dineína puede "caminar" una distancia considerable a lo largo de un microtúbulo sin desprenderse.
La dineína citoplasmática ayuda a posicionar el complejo de Golgi y otros orgánulos en la célula. [1] También ayuda a transportar la carga necesaria para la función celular, como las vesículas producidas por el retículo endoplasmático , los endosomas y los lisosomas (Karp, 2005). La dineína está involucrada en el movimiento de los cromosomas y en el posicionamiento de los husos mitóticos para la división celular. [2] [3] La dineína transporta orgánulos, vesículas y posiblemente fragmentos de microtúbulos a lo largo de los axones de las neuronas hacia el cuerpo celular en un proceso llamado transporte axonal retrógrado . [1] Además, el motor de dineína también es responsable del transporte de endosomas degradativos de forma retrógrada en las dendritas. [4]
Posicionamiento del huso mitótico
La dineína citoplasmática posiciona el huso en el sitio de la citocinesis al anclarse a la corteza celular y tirar de los microtúbulos astrales que emanan del centrosoma . Mientras era estudiante postdoctoral en el MIT, Tomomi Kiyomitsu descubrió cómo la dineína tiene un papel como proteína motora en la alineación de los cromosomas en el medio de la célula durante la metafase de la mitosis. La dineína tira de los microtúbulos y cromosomas hacia un extremo de la célula. Cuando el extremo de los microtúbulos se acerca a la membrana celular, liberan una señal química que empuja la dineína hacia el otro lado de la célula. Hace esto repetidamente para que los cromosomas terminen en el centro de la célula, lo cual es necesario en la mitosis. [5] [6] [7] [8] La levadura en ciernes ha sido un organismo modelo poderoso para estudiar este proceso y ha demostrado que la dineína se dirige a los extremos positivos de los microtúbulos astrales y se entrega a la corteza celular a través de un mecanismo de descarga. [9] [10]
Replicación viral
Tanto la dineína como la kinesina pueden ser explotadas por los virus para mediar el proceso de replicación viral. Muchos virus utilizan el sistema de transporte de microtúbulos para transportar los núcleos de ácidos nucleicos/proteínas a los sitios de replicación intracelular después de la invasión de la membrana celular. [11] No se sabe mucho sobre los sitios de unión específicos del motor de los virus, pero se sabe que algunos virus contienen secuencias ricas en prolina (que divergen entre virus) que, cuando se eliminan, reducen la unión de dinactina , el transporte axonal (en cultivo) y la neuroinvasión in vivo. [12] Esto sugiere que las secuencias ricas en prolina pueden ser un sitio de unión importante que coopta la dineína.
Estructura

Cada molécula del motor de dineína es un complejo conjunto proteico compuesto por muchas subunidades polipeptídicas más pequeñas . La dineína citoplasmática y axonemal contienen algunos de los mismos componentes, pero también contienen algunas subunidades únicas.
Dineína citoplasmática
La dineína citoplasmática, que tiene una masa molecular de aproximadamente 1,5 megadaltons (MDa), es un dímero de dímeros, que contiene aproximadamente doce subunidades polipeptídicas: dos "cadenas pesadas" idénticas, de 520 kDa de masa, que contienen la actividad ATPasa y, por lo tanto, son responsables de generar movimiento a lo largo del microtúbulo; dos cadenas intermedias de 74 kDa que se cree que anclan la dineína a su carga; dos cadenas intermedias ligeras de 53-59 kDa; y varias cadenas ligeras.
La actividad ATPasa generadora de fuerza de cada cadena pesada de dineína se encuentra en su gran "cabeza" con forma de rosquilla, que está relacionada con otras proteínas AAA , mientras que dos proyecciones de la cabeza la conectan con otras estructuras citoplasmáticas. Una proyección, el tallo en espiral, se une y "camina" a lo largo de la superficie del microtúbulo a través de un ciclo repetido de desprendimiento y re-adherencia. La otra proyección, la cola extendida, se une a las subunidades de cadena intermedia ligera, intermedia y ligera que unen la dineína a su carga. La actividad alternante de las cadenas pesadas pareadas en el motor citoplasmático completo de dineína permite que una sola molécula de dineína transporte su carga "caminando" una distancia considerable a lo largo de un microtúbulo sin desprenderse por completo.
En el estado apo de la dineína, el motor está libre de nucleótidos, el anillo del dominio AAA existe en una conformación abierta, [14] y el MTBD existe en un estado de alta afinidad. [15] Mucho sobre los dominios AAA sigue siendo desconocido, [16] pero AAA1 está bien establecido como el sitio primario de hidrólisis de ATP en la dineína. [17] Cuando el ATP se une a AAA1, inicia un cambio conformacional del anillo del dominio AAA en la configuración "cerrada", el movimiento del contrafuerte, [14] y un cambio conformacional en el enlazador. [18] [19] El enlazador se dobla y cambia de AAA5 a AAA2 mientras permanece unido a AAA1. [14] [19] Una alfa -hélice unida del tallo es tirada por el contrafuerte, deslizando la hélice media repetición de heptada en relación con su pareja de bobina enrollada, [15] [20] y doblando el tallo. [14] Como resultado, el MTBD de la dineína entra en un estado de baja afinidad, lo que permite que el motor se mueva a nuevos sitios de unión. [21] [22] Después de la hidrólisis de ATP, el tallo gira, moviendo la dineína más a lo largo del MT. [18] Tras la liberación del fosfato, el MTBD vuelve a un estado de alta afinidad y se vuelve a unir al MT, lo que desencadena el golpe de potencia. [23] El enlazador vuelve a una conformación recta y oscila de nuevo a AAA5 desde AAA2 [24] [25] y crea una acción de palanca, [26] produciendo el mayor desplazamiento de dineína logrado por el golpe de potencia [18] El ciclo concluye con la liberación de ADP, que devuelve el anillo del dominio AAA a la configuración "abierta". [22]
La dineína de levadura puede caminar a lo largo de los microtúbulos sin desprenderse, sin embargo, en los metazoos, la dineína citoplasmática debe ser activada por la unión de dinactina , otra proteína multisubunidad que es esencial para la mitosis y un adaptador de carga. [27] El tricomplejo, que incluye dineína, dinactina y un adaptador de carga, es ultraprocesivo y puede caminar largas distancias sin desprenderse para alcanzar el destino intracelular de la carga. Los adaptadores de carga identificados hasta ahora incluyen BicD2 , Hook3 , FIP3 y Spindly. [27] La cadena intermedia ligera, que es miembro de la superfamilia Ras , media la unión de varios adaptadores de carga al motor de dineína. [28] Las otras subunidades de la cola también pueden ayudar a facilitar esta interacción como se evidencia en una estructura de baja resolución de dineína-dinactina-BicD2. [29]
Una forma importante de regulación motora dentro de las células para la dineína es la dinactina. Puede ser necesaria para casi todas las funciones de la dineína citoplasmática. [30] Actualmente, es el socio de la dineína mejor estudiado. La dinactina es una proteína que ayuda en el transporte intracelular a través de la célula al unirse a la dineína citoplasmática. La dinactina puede funcionar como un andamio al que se pueden unir otras proteínas. También funciona como un factor de reclutamiento que localiza la dineína donde debería estar. [31] [32] También hay alguna evidencia que sugiere que puede regular la kinesina-2. [33] El complejo de dinactina está compuesto por más de 20 subunidades, [29] de las cuales p150(Glued) es la más grande. [34] No hay evidencia definitiva de que la dinactina por sí sola afecte la velocidad del motor. Sin embargo, sí afecta la procesividad del motor. [35] Es probable que la regulación de la unión sea alostérica: los experimentos han demostrado que las mejoras proporcionadas en la procesividad del motor de dineína no dependen del dominio de unión de la subunidad p150 a los microtúbulos. [36]
Dineína axonemal
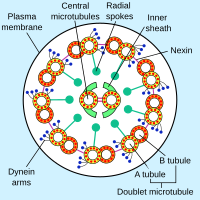
Las dineínas axonemales se presentan en múltiples formas que contienen una, dos o tres cadenas pesadas no idénticas (dependiendo del organismo y la ubicación en el cilio ). Cada cadena pesada tiene un dominio motor globular con una estructura en forma de rosquilla que se cree que se asemeja a la de otras proteínas AAA , un "tallo" en espiral que se une al microtúbulo y una cola extendida (o "tallo") que se une a un microtúbulo vecino del mismo axonema . Cada molécula de dineína forma así un puente cruzado entre dos microtúbulos adyacentes del axonema ciliar. Durante el "golpe de potencia", que provoca el movimiento, el dominio motor de la ATPasa AAA sufre un cambio conformacional que hace que el tallo de unión de los microtúbulos pivote con respecto a la cola de unión de la carga, con el resultado de que un microtúbulo se desliza con respecto al otro (Karp, 2005). Este deslizamiento produce el movimiento de flexión necesario para que los cilios golpeen e impulsen la célula u otras partículas. Los grupos de moléculas de dineína responsables del movimiento en direcciones opuestas probablemente se activan y desactivan de manera coordinada para que los cilios o flagelos puedan moverse hacia adelante y hacia atrás. Se ha propuesto que el radio radial es la estructura (o una de las estructuras) que sincroniza este movimiento.
La regulación de la actividad de la dineína axonemal es fundamental para la frecuencia del batido flagelar y la forma de onda de los cilios. Los modos de regulación de la dineína axonemal incluyen la fosforilación, la oxidación-reducción y el calcio. Las fuerzas mecánicas sobre el axonema también afectan la función de la dineína axonemal. Las cadenas pesadas de los brazos interno y externo de la dineína axonemal se fosforilan/desfosforilan para controlar la velocidad de deslizamiento de los microtúbulos. Las tiorredoxinas asociadas con los otros brazos de la dineína axonemal se oxidan/reducen para regular el lugar donde se une la dineína en el axonema. La centerina y los componentes de los brazos externos de la dineína axonemal detectan fluctuaciones en la concentración de calcio. Las fluctuaciones de calcio desempeñan un papel importante en la alteración de la forma de onda de los cilios y la frecuencia del batido flagelar (King, 2012). [37]
Historia
La proteína responsable del movimiento de los cilios y flagelos fue descubierta por primera vez y denominada dineína en 1963 (Karp, 2005). 20 años más tarde, se aisló e identificó la dineína citoplasmática, cuya existencia se sospechaba desde el descubrimiento de la dineína flagelar (Karp, 2005).
Segregación cromosómica durante la meiosis
La segregación de cromosomas homólogos a polos opuestos de la célula ocurre durante la primera división de la meiosis . La segregación adecuada es esencial para producir productos meióticos haploides con un complemento normal de cromosomas. La formación de quiasmas (eventos de recombinación cruzada) parece facilitar generalmente la segregación adecuada. Sin embargo, en la levadura de fisión Schizosaccharomyces pombe , cuando los quiasmas están ausentes, la dineína promueve la segregación. [38] Dhc1, la subunidad motora de la dineína, es necesaria para la segregación cromosómica tanto en presencia como en ausencia de quiasmas. [38] La proteína de cadena ligera de dineína Dlc1 también es necesaria para la segregación, específicamente cuando faltan quiasmas.
Véase también
Referencias
- ^ abc Karp G, Beginnen K, Vogel S, Kuhlmann-Krieg S (2005). Molekulare Zellbiologie (en francés). Saltador. ISBN 978-3-540-23857-7.
- ^ Samora CP, Mogessie B, Conway L, Ross JL, Straube A, McAinsh AD (agosto de 2011). "MAP4 y CLASP1 funcionan como un mecanismo de seguridad para mantener una posición estable del huso en la mitosis". Nature Cell Biology . 13 (9): 1040–50. doi :10.1038/ncb2297. PMID 21822276. S2CID 8869880.
- ^ Kiyomitsu T, Cheeseman IM (febrero de 2012). "Las señales derivadas de los polos de los cromosomas y del huso generan un código intrínseco para la posición y orientación del huso". Nature Cell Biology . 14 (3): 311–7. doi :10.1038/ncb2440. PMC 3290711 . PMID 22327364.
- ^ Yap CC, Digilio L, McMahon LP, Wang T, Winckler B (abril de 2022). "La dineína es necesaria para la maduración de endosomas dependiente de Rab7, el transporte dendrítico retrógrado y la degradación". The Journal of Neuroscience . 42 (22): 4415–4434. doi :10.1523/JNEUROSCI.2530-21.2022. PMC 9172292 . PMID 35474277.
- ^ https://www.researchgate.net/publication/325479623_Dynein-Dynactin-NuMA_clusters_generate_cortical_spindle-pulling_forces_as_a_multi-arm_ensemble doi :10.7554/eLife.36559
- ^ Eshel D, Urrestarazu LA, Vissers S, Jauniaux JC, van Vliet-Reedijk JC, Planta RJ, Gibbons IR (diciembre de 1993). "La dineína citoplásmica es necesaria para la segregación nuclear normal en la levadura". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 90 (23): 11172–6. Bibcode :1993PNAS...9011172E. doi : 10.1073/pnas.90.23.11172 . PMC 47944 . PMID 8248224.
- ^ Li YY, Yeh E, Hays T, Bloom K (noviembre de 1993). "Alteración de la orientación del huso mitótico en un mutante de dineína de levadura". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 90 (21): 10096–100. Bibcode :1993PNAS...9010096L. doi : 10.1073/pnas.90.21.10096 . PMC 47720 . PMID 8234262.
- ^ Carminati JL, Stearns T (agosto de 1997). "Los microtúbulos orientan el huso mitótico en la levadura a través de interacciones dependientes de la dineína con la corteza celular". The Journal of Cell Biology . 138 (3): 629–41. doi :10.1083/jcb.138.3.629. PMC 2141630 . PMID 9245791.
- ^ Lee WL, Oberle JR, Cooper JA (febrero de 2003). "El papel de la proteína de lisencefalia Pac1 durante la migración nuclear en levaduras en ciernes". The Journal of Cell Biology . 160 (3): 355–64. doi :10.1083/jcb.200209022. PMC 2172672 . PMID 12566428.
- ^ Lee WL, Kaiser MA, Cooper JA (enero de 2005). "El modelo de descarga para la función de la dineína: función diferencial de las subunidades motoras". The Journal of Cell Biology . 168 (2): 201–7. doi :10.1083/jcb.200407036. PMC 2171595 . PMID 15642746.
- ^ Valle-Tenney R, Opazo T, Cancino J, Goff SP, Arriagada G (agosto de 2016). "Los reguladores de dineína son importantes para la infección por el virus de la leucemia murina ecotrópica". Revista de Virología . 90 (15): 6896–6905. doi :10.1128/JVI.00863-16. PMC 4944281 . PMID 27194765.
- ^ Zaichick SV, Bohannon KP, Hughes A, Sollars PJ, Pickard GE, Smith GA (febrero de 2013). "La proteína VP1/2 del herpesvirus es un efector del transporte de la cápside mediado por dineína y la neuroinvasión". Cell Host & Microbe . 13 (2): 193–203. doi :10.1016/j.chom.2013.01.009. PMC 3808164 . PMID 23414759.
- ^ PDB : 4RH7 ; Carter AP (febrero de 2013). "Información clara sobre cómo se mueve el motor de la dineína". Journal of Cell Science . 126 (Pt 3): 705–13. doi : 10.1242/jcs.120725 . PMID 23525020.
- ^ abcd Schmidt H, Zalyte R, Urnavicius L, Carter AP (febrero de 2015). "Estructura de la dineína-2 citoplasmática humana preparada para su ataque de potencia". Nature . 518 (7539): 435–438. Bibcode :2015Natur.518..435S. doi :10.1038/nature14023. PMC 4336856 . PMID 25470043.
- ^ ab Carter AP, Vale RD (febrero de 2010). "Comunicación entre el anillo AAA+ y el dominio de unión a microtúbulos de la dineína". Bioquímica y biología celular . 88 (1): 15–21. doi :10.1139/o09-127. PMC 2894566 . PMID 20130675.
- ^ Kardon JR, Vale RD (diciembre de 2009). "Reguladores del motor dineína citoplasmático". Nature Reviews. Molecular Cell Biology . 10 (12): 854–65. doi :10.1038/nrm2804. PMC 3394690 . PMID 19935668.
- ^ PDB : 1HN5 ; Mocz G, Gibbons IR (febrero de 2001). "Modelo para el componente motor de la cadena pesada de dineína basado en homología con la familia AAA de ATPasas oligoméricas". Estructura . 9 (2). Londres, Inglaterra: 93–103. doi : 10.1016/S0969-2126(00)00557-8 . PMID 11250194.
- ^ abc Roberts AJ, Numata N, Walker ML, Kato YS, Malkova B, Kon T, Ohkura R, Arisaka F, Knight PJ, Sutoh K, Burgess SA (febrero de 2009). "Mecanismo de oscilación de anillo y enlazador AAA + en el motor de dineína". Celúla . 136 (3): 485–95. doi :10.1016/j.cell.2008.11.049. PMC 2706395 . PMID 19203583.
- ^ ab Roberts AJ, Malkova B, Walker ML, Sakakibara H, Numata N, Kon T, Ohkura R, Edwards TA, Knight PJ, Sutoh K, Oiwa K, Burgess SA (octubre de 2012). "Remodelación impulsada por ATP del dominio enlazador en el motor de dineína". Estructura . 20 (10): 1670–80. doi :10.1016/j.str.2012.07.003. PMC 3469822 . PMID 22863569.
- ^ Kon T, Imamula K, Roberts AJ, Ohkura R, Knight PJ, Gibbons IR, Burgess SA, Sutoh K (marzo de 2009). "La hélice que se desliza en el espiral del tallo de la dineína acopla la ATPasa y la unión de los microtúbulos". Nature Structural & Molecular Biology . 16 (3): 325–33. doi :10.1038/nsmb.1555. PMC 2757048 . PMID 19198589.
- ^ Carter AP (febrero de 2013). "Información clara sobre cómo se mueve el motor de la dineína". Journal of Cell Science . 126 (Pt 3): 705–13. doi : 10.1242/jcs.120725 . PMID 23525020.
- ^ ab Bhabha G, Cheng HC, Zhang N, Moeller A, Liao M, Speir JA, Cheng Y, Vale RD (noviembre de 2014). "Comunicación alostérica en el dominio motor de la dineína". Cell . 159 (4): 857–68. doi :10.1016/j.cell.2014.10.018. PMC 4269335 . PMID 25417161.
- ^ Bhabha G, Johnson GT, Schroeder CM, Vale RD (enero de 2016). "Cómo se mueve la dineína a lo largo de los microtúbulos". Tendencias en ciencias bioquímicas . 41 (1): 94–105. doi :10.1016/j.tibs.2015.11.004. PMC 4706479 . PMID 26678005.
- ^ Gennerich A, Carter AP, Reck-Peterson SL, Vale RD (noviembre de 2007). "Escalonamiento bidireccional inducido por fuerza de la dineína citoplasmática". Cell . 131 (5): 952–65. doi :10.1016/j.cell.2007.10.016. PMC 2851641 . PMID 18045537.
- ^ Burgess SA, Knight PJ (abril de 2004). "¿Es el motor de dineína un cabrestante?". Current Opinion in Structural Biology . 14 (2): 138–46. doi :10.1016/j.sbi.2004.03.013. PMID 15093827.
- ^ Reck-Peterson SL, Yildiz A, Carter AP, Gennerich A, Zhang N, Vale RD (julio de 2006). "Análisis de moléculas individuales de la procesividad de la dineína y el comportamiento de escalonamiento". Cell . 126 (2): 335–48. doi :10.1016/j.cell.2006.05.046. PMC 2851639 . PMID 16873064.
- ^ ab McKenney RJ, Huynh W, Tanenbaum ME, Bhabha G, Vale RD (julio de 2014). "Activación de la motilidad de la dineína citoplasmática por complejos adaptadores de carga-dinactina". Science . 345 (6194): 337–41. Bibcode :2014Sci...345..337M. doi :10.1126/science.1254198. PMC 4224444 . PMID 25035494.
- ^ Schroeder CM, Ostrem JM, Hertz NT, Vale RD (octubre de 2014). "Un dominio similar a Ras en la cadena intermedia ligera une el motor de dineína con una región de unión de carga". eLife . 3 : e03351. doi : 10.7554/eLife.03351 . PMC 4359372 . PMID 25272277.
- ^ ab Urnavicius L, Zhang K, Diamant AG, Motz C, Schlager MA, Yu M, Patel NA, Robinson CV, Carter AP (marzo de 2015). "La estructura del complejo dinactina y su interacción con la dineína". Science . 347 (6229): 1441–1446. Bibcode :2015Sci...347.1441U. doi :10.1126/science.aaa4080. PMC 4413427 . PMID 25814576.
- ^ Karki S, Holzbaur EL (febrero de 1999). "Dineína y dinactina citoplasmáticas en la división celular y el transporte intracelular". Current Opinion in Cell Biology . 11 (1): 45–53. doi : 10.1016/S0955-0674(99)80006-4 . PMID 10047518.
- ^ Moughamian AJ, Osborn GE, Lazarus JE, Maday S, Holzbaur EL (agosto de 2013). "El reclutamiento ordenado de dinactina al extremo positivo del microtúbulo es necesario para el inicio eficiente del transporte axonal retrógrado". The Journal of Neuroscience . 33 (32): 13190–203. doi :10.1523/JNEUROSCI.0935-13.2013. PMC 3735891 . PMID 23926272.
- ^ Moughamian AJ, Holzbaur EL (abril de 2012). "La dinactina es necesaria para la iniciación del transporte desde el axón distal". Neuron . 74 (2): 331–43. doi :10.1016/j.neuron.2012.02.025. PMC 3347924 . PMID 22542186.
- ^ Berezuk MA, Schroer TA (febrero de 2007). "Dynactin mejora la procesividad de la kinesina-2". Traffic . 8 (2): 124–9. doi :10.1111/j.1600-0854.2006.00517.x. PMID 17181772. S2CID 46446471.
- ^ Schroer TA (8 de octubre de 2004). "Dynactin". Revisión anual de biología celular y del desarrollo . 20 : 759–79. doi :10.1146/annurev.cellbio.20.012103.094623. PMID 15473859.
- ^ King SJ, Schroer TA (enero de 2000). "La dinactina aumenta la procesividad del motor dineína citoplasmático". Nature Cell Biology . 2 (1): 20–4. doi :10.1038/71338. PMID 10620802. S2CID 20349195.
- ^ Kardon JR, Reck-Peterson SL, Vale RD (abril de 2009). "Regulación de la procesividad y localización intracelular de la dineína de Saccharomyces cerevisiae por dinactina". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 106 (14): 5669–74. Bibcode :2009PNAS..106.5669K. doi : 10.1073/pnas.0900976106 . PMC 2657088 . PMID 19293377.
- ^ King SM (agosto de 2012). "Control integrado de los motores axonemales de dineína AAA(+)". Revista de biología estructural . 179 (2): 222–8. doi :10.1016/j.jsb.2012.02.013. PMC 3378790 . PMID 22406539.
- ^ ab Davis L, Smith GR (junio de 2005). "La dineína promueve la segregación de aquiasmatos en Schizosaccharomyces pombe". Genética . 170 (2): 581–90. doi :10.1534/genetics.104.040253. PMC 1450395 . PMID 15802518.
Lectura adicional
- Karp G (2005). Biología celular y molecular: conceptos y experimentos (4.ª ed.). Hoboken, Nueva Jersey: John Wiley and Sons. Págs. 346–358. ISBN. 978-0-471-19279-4.
- Schroer TA (2004). "Dynactin". Revisión anual de biología celular y del desarrollo . 20 : 759–79. doi :10.1146/annurev.cellbio.20.012103.094623. PMID 15473859.
Enlaces externos
- Recurso de motivo lineal eucariota de clase LIG_Dynein_DLC8_1
- Seminario de Ron Vale: “Proteínas motoras moleculares”
- Dineína en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- CE 3.6.4.2