Célula de Kupffer
| Célula de Kupffer | |
|---|---|
 Imagen de microscopía confocal que muestra la ubicación en estado estable y las interacciones entre las células de Kupffer (rojo), las células estrelladas hepáticas (verde) y las células endoteliales sinusoidales del hígado (azul). Los núcleos celulares están en gris. [1] | |
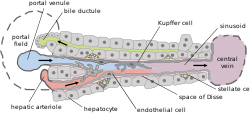 Estructura básica del hígado | |
| Detalles | |
| Ubicación | Hígado |
| Función | Macrófago |
| Identificadores | |
| latín | macrofagocito stellatus |
| Malla | D007728 |
| EL | H3.04.05.0.00016 |
| FMA | 14656 |
| Términos anatómicos de microanatomía [editar en Wikidata] | |
Las células de Kupffer , también conocidas como macrófagos estrellados y células de Kupffer-Browicz , son células especializadas localizadas en el hígado dentro del lumen de los sinusoides hepáticos y están adheridas a sus células endoteliales que forman las paredes de los vasos sanguíneos. Las células de Kupffer comprenden la población más grande de macrófagos residentes en los tejidos del cuerpo. Las bacterias intestinales, las endotoxinas bacterianas y los restos microbianos transportados al hígado desde el tracto gastrointestinal a través de la vena porta entrarán primero en contacto con las células de Kupffer, las primeras células inmunes del hígado. Es por esto que cualquier cambio en las funciones de las células de Kupffer puede estar relacionado con varias enfermedades hepáticas como la enfermedad hepática alcohólica, la hepatitis viral, la colestasis intrahepática, la esteatohepatitis, la activación o el rechazo del hígado durante el trasplante de hígado y la fibrosis hepática. [2] [3] Forman parte del sistema de fagocitos mononucleares .
Ubicación y estructura
Las células de Kupffer se pueden encontrar unidas a las células endoteliales sinusoidales tanto en las regiones centrolobulillares como periportales de los lóbulos hepáticos . La función y las estructuras de las células de Kupffer están especializadas según su ubicación. Las células de Kupffer periportales tienden a ser más grandes y tienen más actividad enzimática y fagocítica lisosomal, mientras que las células de Kupffer centrolobulillares crean más radicales superóxido.
Las células de Kupffer tienen un carácter ameboides, con características superficiales que incluyen microvellosidades , pseudópodos y lamelipodios , que se proyectan en todas las direcciones. Las microvellosidades y los pseudópodos desempeñan un papel en la endocitosis de partículas.
El núcleo es dentado y ovoide, y puede ser lobulado.
Entre los elementos citoplasmáticos más destacados se encuentran los ribosomas , los complejos de Golgi , los centriolos , los microtúbulos y los microfilamentos . Las células de Kupffer también contienen retículo endoplasmático rugoso , una envoltura nuclear y láminas anulares , todos los cuales muestran actividad de peroxidasa .
Es importante destacar que las células de Kupffer expresan el receptor depurador SR-AI/II . Este receptor participa en el reconocimiento y la unión del dominio de lípido A del lipopolisacárido (LPS) y el ácido lipoteicoico . (El lipopolisacárido (LPS) es una endotoxina bacteriana que se encuentra en la pared celular de las bacterias gramnegativas , mientras que el ácido lipoteicoico está presente en las bacterias grampositivas ). Debido a este sistema de detección, las células de Kupffer desempeñan un papel fundamental en la iniciación y mediación de las respuestas inmunitarias a la infección bacteriana del hígado. [4]
Desarrollo
El desarrollo de una población inicial de células de Kupffer comienza en el saco vitelino embrionario , donde las células precursoras se diferencian en macrófagos fetales . Una vez que ingresan al torrente sanguíneo, migran al hígado fetal , donde permanecen. Allí completan su diferenciación en células de Kupffer. En condiciones normales, estas poblaciones de células de Kupffer tienen una vida larga y se autorenuevan. [5]
Sin embargo, si las poblaciones de células de Kupffer residentes se agotan, los monocitos derivados de células madre hematopoyéticas en la médula ósea y transportados a través de la circulación sanguínea hasta el hígado también pueden diferenciarse completamente en células de Kupffer verdaderas. A diferencia de otros macrófagos tisulares, que deben renovarse continuamente mediante monocitos circulantes, estas células de Kupffer derivadas de monocitos son capaces de autorrenovarse una vez que se establece una población. [6]
El desarrollo de las células de Kupffer maduras está regulado por numerosos factores de crecimiento, y el factor estimulante de colonias de macrófagos ( CSF1 ) desempeña un papel fundamental. Las citocinas implicadas en la inflamación de tipo 2 , como la IL-4 , también pueden estimular la proliferación de las células de Kupffer. En estudios realizados con animales se ha demostrado que la reposición completa de las poblaciones de células de Kupffer requiere de 14 a 21 días. A pesar de la elevada afluencia de monocitos y de las altas tasas de maduración, las poblaciones de células de Kupffer hepáticas se mantienen en un nivel muy alto. Evidentemente, existe una alta tasa de recambio, y se estima que la vida media de una célula de Kupffer es de 3,8 días. Sin embargo, todavía no se entiende por completo el destino final de las células de Kupffer in vivo . [4] [7] [3]
Función
La función principal de las células de Kupffer es eliminar los desechos y partículas extrañas que provienen del sistema porta hepático al pasar por el hígado. Las células de Kupffer pueden absorber partículas grandes mediante fagocitosis y partículas más pequeñas mediante pinocitosis . [4] Las células de Kupffer son fundamentales en las respuestas innatas del sistema inmunológico. Son importantes para la defensa del huésped y desempeñan un papel en el metabolismo de muchos compuestos diferentes, incluidos lípidos, complejos proteicos y partículas pequeñas. También son útiles para eliminar células apoptóticas de la circulación. [2] [3]
La cantidad de células de Kupffer en el hígado se mantiene constante. Las células de Kupffer tienen una capacidad proliferativa que permite que las poblaciones celulares se repongan por sí mismas, lo que contrasta totalmente con los macrófagos derivados de monocitos, que no tienen potencial proliferativo. Las células viejas o defectuosas se eliminan mediante apoptosis y también mediante la fagocitación por las células de Kupffer vecinas.
Las células de Kupffer son heterogéneas en su función, dependiendo de su ubicación en los lóbulos hepáticos . Las células de la zona periportal están directamente expuestas al flujo sanguíneo y expresan una mayor actividad lisosomal para procesar de manera más eficiente las sustancias extrañas entrantes. Por el contrario, las células de la zona centrolobulillar experimentan una menor perfusión y están equipadas con mayores reservas de superóxido para combatir las lesiones e infecciones de penetración profunda.
En respuesta a una infección o irritación, las células de Kupffer pueden producir citocinas inflamatorias , TNF-alfa , radicales de oxígeno y proteasas . La producción excesiva de estos mediadores está relacionada con el desarrollo de lesiones hepáticas. [4]
Además de eliminar las bacterias, las células de Kupffer también son responsables de reciclar la hemoglobina destruyendo los glóbulos rojos senescentes mediante la acción fagocítica. Las cadenas de globina se reutilizan, mientras que la porción que contiene hierro, el hemo , se descompone aún más en hierro, que se reutiliza, y bilirrubina , que se conjuga con ácido glucurónico dentro de los hepatocitos y se secreta en la bilis .
Helmy et al. identificaron un receptor presente en las células de Kupffer, el receptor del complemento de la familia de las inmunoglobulinas (CRIg). Los ratones sin CRIg no pudieron eliminar los patógenos recubiertos por el sistema del complemento . El CRIg se conserva en ratones y humanos y es un componente crítico del sistema inmunitario innato. [8]
Importancia clínica
Las células de Kupffer son células increíblemente plásticas que tienen la capacidad de polarizar estados de activación específicos y pueden realizar diferentes funciones en diferentes microambientes. M1 (activación clásica) y M2 (activación alternativa) designan los dos extremos de la polarización de los macrófagos . Las células de Kupffer polarizadas por M1 producen una gran cantidad de citocinas proinflamatorias como el TNF-alfa. Por otro lado, las células de Kupffer polarizadas por M2 producen una gran cantidad de mediadores antiinflamatorios, por ejemplo, IL-10. [9] [4]
Las células de Kupffer desempeñan un papel en la patogenia de un hígado dañado en respuesta a la sepsis. Los macrófagos del hígado activan y liberan IL-1 y TNF-alfa. A su vez, esto activa los leucocitos y las células endoteliales sinusoidales para que expresen ICAM-1 . Esto da como resultado un daño tisular al endotelio debido a las proteasas, los radicales de oxígeno, los prostanoides y otras sustancias de los leucocitos.
La activación de las células de Kupffer contribuye a la patogénesis de la enfermedad hepática alcohólica crónica y aguda en respuesta a la lesión hepática inducida por el etanol, común en los alcohólicos crónicos. El alcoholismo crónico y la lesión hepática se relacionan con un sistema de dos impactos. Mientras que el primer impacto es directo, mediado por la toxicidad directa del etanol y sus subproductos metabólicos, el segundo impacto es indirecto, mediado por el aumento de la absorción de lipopolisacáridos (endotoxina) del intestino.
El etanol aumenta la permeabilidad del epitelio intestinal, lo que hace que la endotoxina producida por la flora intestinal se filtre desde el lumen intestinal hacia el hígado a través de la vena porta . La presencia de endotoxina induce una fuerte polarización M1 de las células de Kupffer. Las células de Kupffer activadas producen una gran cantidad de especies reactivas de oxígeno, citocinas proinflamatorias y quimiocinas que provocan daño hepático.
La cascada comienza con la activación mediada por endotoxinas del receptor tipo Toll 4 ( TLR4 ) y CD14 , receptores en la célula de Kupffer que internalizan la endotoxina. Esto, a su vez, activa la transcripción de citocinas proinflamatorias y del factor de necrosis tumoral alfa (TNFα), con la producción concurrente de superóxidos .
Las citocinas y los superóxidos provocan inflamación y daño oxidativo respectivamente, mientras que el TNFα activa las células estrelladas del hígado para que inicien la síntesis de colágeno . Estos procesos dan lugar a fibrosis o cicatrización del hígado. La fibrosis acabará provocando cirrosis , una pérdida de la función del hígado debido a una cicatrización extensa. [10]
Historia
Las células fueron observadas por primera vez por Karl Wilhelm von Kupffer en 1876. [11] El científico las llamó "Sternzellen" (células estrelladas o célula estrellada hepática ) pero pensó, de forma errónea, que eran parte integrante del endotelio de los vasos sanguíneos del hígado y que se originaban a partir de él. En 1898, tras varios años de investigación, Tadeusz Browicz las identificó, correctamente, como macrófagos . [12] [13] [14] [15]
Referencias
- ^ Bonnardel J, T'Jonck W, Gaublomme D, Browaeys R, Scott CL, Martens L, et al. (octubre de 2019). "Las células estrelladas, los hepatocitos y las células endoteliales imprimen la identidad de las células de Kupffer en los monocitos que colonizan el nicho de los macrófagos del hígado". Inmunidad . 51 (4): 638–654.e9. doi :10.1016/j.immuni.2019.08.017. PMC 6876284 . PMID 31561945.
- ^ ab Nguyen-Lefebvre, Anh Thu; Horuzsko, Anatolij (2015). "Metabolismo y función de las células de Kupffer". Revista de enzimología y metabolismo . 1 (1). PMC 4771376 . PMID 26937490.
- ^ abc Dixon, Laura J.; Barnes, Mark; Tang, Hui; Pritchard, Michele T.; Nagy, Laura E. (abril de 2013). "Células de Kupffer en el hígado". Fisiología integral . 3 (2): 785–797. doi :10.1002/cphy.c120026. ISSN 2040-4603. PMC 4748178 . PMID 23720329.
- ^ abcde Basit, Hajira; Tan, Michael L.; Webster, Daniel R. (2020), "Histología, célula de Kupffer", StatPearls , Treasure Island (FL): StatPearls Publishing, PMID 29630278 , consultado el 25 de agosto de 2020
- ^ Naito M, Hasegawa G, Takahashi K (noviembre de 1997). "Desarrollo, diferenciación y maduración de células de Kupffer". Microscopy Research and Technique . 39 (4): 350–64. doi :10.1002/(SICI)1097-0029(19971115)39:4<350::AID-JEMT5>3.0.CO;2-L. PMID 9407545. S2CID 21193303.
- ^ Scott C, Zheng F, De Baetselier P, et al. (27 de enero de 2016). "Los monocitos derivados de la médula ósea dan lugar a células de Kupffer autorrenovables y totalmente diferenciadas". Nature Communications . 7, 10321 (2016): 10321. Bibcode :2016NatCo...710321S. doi : 10.1038/ncomms10321 . PMC 4737801 . PMID 26813785.
- ^ Chen, Jiajia; Deng, Xiaoyi; Liu, Yongjian; Tan, Qiuhua; Huang, Guidong; Che, Qishi; Guo, Jiao; Su, Zhengquan (2020). "Células de Kupffer en la enfermedad del hígado graso no alcohólico: ¿amigas o enemigas?". Revista Internacional de Ciencias Biológicas . 16 (13): 2367–2378. doi :10.7150/ijbs.47143. PMC 7378652 . PMID 32760204 . Consultado el 31 de agosto de 2020 .
- ^ Helmy KY, Katschke KJ, Gorgani NN, Kljavin NM, Elliott JM, Diehl L, et al. (marzo de 2006). "CRIg: un receptor de complemento de macrófagos necesario para la fagocitosis de patógenos circulantes". Cell . 124 (5): 915–27. doi : 10.1016/j.cell.2005.12.039 . PMID 16530040. S2CID 15525209.
- ^ Zeng, Tao; Zhang, Cui-Li; Xiao, Mo; Yang, Rui; Xie, Ke-Qin (2016). "Funciones críticas de las células de Kupffer en la patogénesis de la enfermedad hepática alcohólica: de la ciencia básica a los ensayos clínicos". Frontiers in Immunology . 7 : 538. doi : 10.3389/fimmu.2016.00538 . ISSN 1664-3224. PMC 5126119 . PMID 27965666.
- ^ Wheeler MD (2003). "Endotoxina y activación de células de Kupffer en la enfermedad hepática alcohólica". Alcohol Research & Health . 27 (4): 300–6. PMC 6668869 . PMID 15540801.
- ^ Haubrich WS (julio de 2004). "Kupffer de células de Kupffer". Gastroenterología . 127 (1): 16. doi :10.1053/j.gastro.2004.05.041. PMID 15236167.
- ^ Szymańska R, Schmidt-Pospuła M (1979). "[Estudios de las células reticuloendoteliales del hígado realizados por Tadeusz Browicz y Karl Kupffer. Un resumen histórico]". Archiwum Historii Medycyny . 42 (3): 331–6. PMID 386989.
- ^ Stachura J, Gałązka K (diciembre de 2003). "Historia y estado actual de la patología gastroenterológica polaca". Revista de fisiología y farmacología . 54 Suppl 3: 183–92. PMID 15075472.
- ^ Śródka A, Gryglewski RW, Szczepański W (2006). "¿Células de Browicz o Kupffer?". Revista polaca de patología . 57 (4): 183–5. PMID 17285760.
- ^ Wake K (2009). "[Las células fagocíticas de Browicz y las llamadas células estrelladas de Kupffer]". Kaibogaku Zasshi . 84 (1): 17–21. PMID 19413196.
Enlaces externos
- Foto de anatomía: digestivo/mamífero/hígado 5/hígado 4 - Organología comparada en la Universidad de California, Davis - "Mamífero, hígado (EM, bajo)"
- Imagen de histología: 15508loa – Sistema de aprendizaje de histología en la Universidad de Boston