Transglutaminasa tisular
| TGM2 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificadores | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Alias | TGM2 , G-ALFA-h, GNAH, HEL-S-45, TG2, TGC, TG(C), transglutaminasa 2, G(h), hTG2, tTG | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificaciones externas | OMIM : 190196; MGI : 98731; HomoloGene : 3391; Tarjetas genéticas : TGM2; OMA :TGM2 - ortólogos | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidatos | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Proteína-glutamina gamma-glutamiltransferasa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| N.º CE | 2.3.2.13 | ||||||||
| N.º CAS | 80146-85-6 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista de IntEnz | ||||||||
| BRENDA | Entrada de BRENDA | ||||||||
| Expasí | Vista de NiceZyme | ||||||||
| BARRIL | Entrada de KEGG | ||||||||
| MetaCiclo | vía metabólica | ||||||||
| PRIAMO | perfil | ||||||||
| Estructuras del PDB | RCSB AP APBE APSUMA | ||||||||
| Ontología genética | AmiGO / QuickGO | ||||||||
| |||||||||
La transglutaminasa tisular (abreviada como tTG o TG2 ) es una enzima dependiente de calcio de 78 kDa ( EC 2.3.2.13) de la familia de las γ-glutamiltransferasas de proteína-glutamina (o simplemente familia de las transglutaminasas ). [5] [6] Al igual que otras transglutaminasas, reticula proteínas entre un grupo ε - amino de un residuo de lisina y un grupo γ- carboxamida de un residuo de glutamina , creando un enlace inter o intramolecular que es altamente resistente a la proteólisis (degradación de proteínas). Además de su función de reticulación, la tTG cataliza otros tipos de reacciones, incluidas la desamidación , la unión/hidrolización de GTP y las actividades de isopeptidasa. [7] A diferencia de otros miembros de la familia de las transglutaminasas, la tTG se puede encontrar tanto en los espacios intracelulares como extracelulares de varios tipos de tejidos y se encuentra en muchos órganos diferentes, incluidos el corazón, el hígado y el intestino delgado. La tTG intracelular es abundante en el citosol , pero también se pueden encontrar cantidades más pequeñas en el núcleo y las mitocondrias . [6] Se cree que la tTG intracelular desempeña un papel importante en la apoptosis . [8] En el espacio extracelular, la tTG se une a las proteínas de la matriz extracelular (ECM), [9] uniéndose particularmente fuerte a la fibronectina . [10] La tTG extracelular se ha relacionado con la adhesión celular, la estabilización de la ECM, la cicatrización de heridas, la señalización de receptores, la proliferación celular y la motilidad celular. [6]
La tTG es el autoantígeno de la enfermedad celíaca , una enfermedad crónica en la que el consumo de gluten en la dieta provoca una respuesta inmunitaria patológica que provoca la inflamación del intestino delgado y la posterior atrofia de las vellosidades . [11] [12] [13] También se ha implicado en la fisiopatología de muchas otras enfermedades, incluidos muchos tipos de cáncer y enfermedades neurodegenerativas. [14]
Estructura
Gene
El gen tTG humano se encuentra en el cromosoma 20 (20q11.2-q12).
Proteína
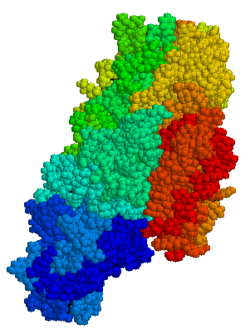
TG2 es una enzima multifuncional que pertenece a las transglutaminasas que catalizan la reticulación de proteínas por enlaces isopeptídicos épsilon-(gamma-glutamil)lisina. [15] De manera similar a otras transglutaminasas, tTG consta de un sitio de unión de GTP/GDP, un dominio catalítico , dos barriles beta y un sándwich beta . [16] Las estructuras cristalinas de TG2 con GDP , GTP o ATP unidos han demostrado que estas formas de TG2 adoptan una conformación "cerrada", mientras que TG2 con el sitio activo ocupado por un imitador de péptido de gluten inhibidor u otros inhibidores similares adopta una conformación "abierta". [17] [18] [19] En la conformación abierta, los cuatro dominios de TG2 están dispuestos en una configuración extendida, lo que permite la actividad catalítica, mientras que en la conformación cerrada, los dos dominios C-terminales están plegados en el dominio central catalítico que incluye el residuo Cys-277. [20] El dominio N-terminal solo muestra cambios estructurales menores entre las dos conformaciones diferentes. [21]
Mecanismo
El mecanismo catalítico para la reticulación en tTG humana involucra al grupo tiol de un residuo Cys en el sitio activo de tTG. [6] El grupo tiol ataca la carboxamida de un residuo de glutamina en la superficie de un sustrato proteico o peptídico, liberando amoníaco y produciendo un intermedio tioéster . El intermedio tioéster puede luego ser atacado por la amina superficial de un segundo sustrato (típicamente de un residuo de lisina ). El producto final de la reacción es un enlace isopeptídico estable entre los dos sustratos (es decir, reticulación). Alternativamente, el intermedio tioéster puede hidrolizarse, lo que resulta en la conversión neta del residuo de glutamina en ácido glutámico (es decir, desamidación). [6] Se cree que la desamidación de residuos de glutamina catalizada por tTG está vinculada a la respuesta inmune patológica al gluten en la enfermedad celíaca. [12] En la Figura 1 se proporciona un esquema de las reacciones de reticulación y desamidación.

Regulación
La expresión de tTG se regula a nivel transcripcional en función de complejas cascadas de señales . Una vez sintetizada, la mayor parte de la proteína se encuentra en el citoplasma, membrana plasmática y matriz extracelular, pero una pequeña fracción se transloca al núcleo , donde participa en el control de su propia expresión a través de la regulación de factores de transcripción . [22]
La actividad de reticulación de la tTG requiere la unión de iones Ca 2+ . [23] Múltiples Ca 2+ pueden unirse a una sola molécula de tTG. [6] Específicamente, la tTG se une a hasta 6 iones de calcio en 5 sitios de unión diferentes. Las mutaciones en estos sitios de unión que causan una menor afinidad por el calcio disminuyen la actividad transglutaminasa de la enzima. [14] Por el contrario, la unión de una molécula de GTP o GDP inhibe la actividad de reticulación de la enzima. [23] Por lo tanto, la tTG intracelular es mayoritariamente inactiva debido a la concentración relativamente alta de GTP/GDP y los bajos niveles de calcio dentro de la célula. [6] [12] Aunque se espera que la tTG extracelular sea activa debido a la baja concentración de nucleótidos de guanina y los altos niveles de calcio en el espacio extracelular, la evidencia ha demostrado que la tTG extracelular es mayoritariamente inactiva. [6] [12] [23] Estudios recientes sugieren que la tTG extracelular se mantiene inactiva por la formación de un enlace disulfuro entre dos residuos de cisteína vecinales , a saber, Cys 370 y Cys 371. [24] Cuando se forma este enlace disulfuro, la enzima permanece en una confirmación abierta pero se vuelve catalíticamente inactiva. [24] La oxidación/reducción del enlace disulfuro sirve como un tercer mecanismo regulador alostérico (junto con GTP/GDP y Ca 2+ ) para la activación de la tTG. [12] Se ha demostrado que la tiorredoxina -1 activa la tTG extracelular al reducir el enlace disulfuro. [23] Otro enlace disulfuro puede formarse en la tTG, entre los residuos Cys-230 y Cys-370. Si bien este enlace no existe en el estado nativo de la enzima, aparece cuando la enzima se inactiva mediante oxidación. [20] La presencia de calcio protege contra la formación de ambos enlaces disulfuro, haciendo así que la enzima sea más resistente a la oxidación. [20]

Estudios recientes han sugerido que el interferón-γ puede servir como activador de la tTG extracelular en el intestino delgado; estos estudios tienen una implicación directa en la patogénesis de la enfermedad celíaca. [12] Se ha demostrado que la activación de la tTG está acompañada de grandes cambios conformacionales, pasando de una conformación compacta (inactiva) a una conformación extendida (activa). (ver Figura 3) [23] [25] [26]

En la matriz extracelular , la TG2 se "apaga", debido principalmente a la actividad oxidante de la proteína 57 del retículo endoplásmico (ERp57). [24] Por lo tanto, la tTG está regulada alostéricamente por dos proteínas separadas, Erp57 y TRX-1. [24] (Ver Figura 4).

Función
La tTG se expresa de forma ubicua y está presente en varios compartimentos celulares, como el citosol, el núcleo y la membrana plasmática. [14] Requiere calcio como cofactor para la actividad de transamidación. La transcripción aumenta con el ácido retinoico . Entre sus muchas funciones supuestas, parece desempeñar un papel en la cicatrización de heridas , la apoptosis y el desarrollo de la matriz extracelular [11], así como en la diferenciación y la adhesión celular . [14] Se ha observado que la tTG puede tener una actividad muy diferente en diferentes tipos de células. Por ejemplo, en las neuronas , la tTG apoya la supervivencia de las células sometidas a una lesión, mientras que en los astrocitos, la eliminación de la expresión génica de la tTG es beneficiosa para la supervivencia celular. [27]
Se cree que la tTG participa en la regulación del citoesqueleto mediante la reticulación de varias proteínas del citoesqueleto, entre ellas la miosina, la actina y la espectrina . [28] La evidencia muestra que la tTG intracelular se reticula a sí misma con la miosina. También se cree que la tTG puede estabilizar la estructura de las células moribundas durante la apoptosis mediante la polimerización de los componentes del citoesqueleto, evitando así la fuga de los contenidos celulares al espacio extracelular. [7]
tTG también tiene actividad GTPasa : [5] En presencia de GTP, se sugiere que funciona como una proteína G que participa en procesos de señalización. [29] Además de su actividad transglutaminasa, se propone que tTG también actúa como quinasa, [30] y proteína disulfuro isomerasa, [31] y deamidasa. [32] Esta última actividad es importante en la desamidación de péptidos de gliadina, por lo que juega un papel importante en la patología de la enfermedad celíaca .
La tTG también presenta actividad PDI (Proteína Disulfuro Isomerasa). [33] [34] Basándose en su actividad PDI, la tTG juega un papel importante en la regulación de la proteostasis , al catalizar la trimerización de HSF1 (Heat Shock Factor 1) y por tanto la respuesta del organismo al choque térmico. En ausencia de tTG, la respuesta al choque térmico se ve afectada ya que no se forma el trímero necesario. [34]
Importancia clínica
La tTG es la transglutaminasa más estudiada y se la ha asociado con muchas enfermedades. Sin embargo, ninguna de estas enfermedades está relacionada con una deficiencia enzimática. De hecho, hasta ahora no se ha atribuido ninguna enfermedad a la falta de actividad de la tTG y esto se ha comprobado mediante el estudio de ratones deficientes en tTG. [35]
Enfermedad celíaca
La tTG es más conocida por su vínculo con la enfermedad celíaca . [13] Se asoció por primera vez con la enfermedad celíaca en 1997 cuando se descubrió que la enzima era el antígeno reconocido por los anticuerpos específicos de la enfermedad celíaca. [35] Los anticuerpos anti-transglutaminasa dan como resultado una forma de sensibilidad al gluten en la que una respuesta celular a los glutenes de Triticeae que están reticulados con tTG pueden estimular respuestas de células B específicas de transglutaminasa que eventualmente dan como resultado la producción de anticuerpos anti-transglutaminasa IgA e IgG. [36] [37] La tTG desamida específicamente los residuos de glutamina creando epítopos que aumentan la afinidad de unión del péptido del gluten a las células T presentadoras de antígeno , iniciando una respuesta inmune adaptativa. [35]
Cáncer
Estudios recientes sugieren que la tTG también desempeña un papel en la inflamación y la biología tumoral. [11] La expresión de tTG está elevada en múltiples tipos de células cancerosas y está implicada en la resistencia a los fármacos y la metástasis debido a su capacidad para promover la transición mesenquimal y propiedades similares a las de las células madre. En su forma unida a GTP, la tTG contribuye a la supervivencia de las células cancerosas y parece ser un impulsor del cáncer. La tTG está regulada positivamente en las células y tejidos cancerosos en muchos tipos de cáncer, incluidos la leucemia , el cáncer de mama , el cáncer de próstata , el cáncer de páncreas y el cáncer de cuello uterino . Una mayor expresión de tTG también se correlaciona con mayores instancias de metástasis , resistencia a la quimioterapia , menores tasas de supervivencia y, en general, un mal pronóstico. Las células cancerosas pueden eliminarse aumentando los niveles de calcio a través de la activación de la actividad de transamidación de tTG. Los ensayos preclínicos han demostrado ser prometedores en el uso de inhibidores de tTG como agentes terapéuticos contra el cáncer. [38] Sin embargo, otros estudios [33] han señalado que la actividad de transamidación de tTG podría estar relacionada con la inhibición de la invasividad de las células tumorales.
Otras enfermedades
Se cree que la tTG contribuye a varios trastornos neurodegenerativos, incluidas las enfermedades de Alzheimer , Parkinson y Huntington, al afectar la transcripción, la diferenciación, la migración y la adhesión. [39] [40] Estas enfermedades neurológicas se caracterizan en parte por la agregación anormal de proteínas debido a la mayor actividad de reticulación de proteínas en el cerebro afectado. [41] Además, se ha descubierto que proteínas específicas asociadas con estos trastornos son sustratos in vivo e in vitro de la tTG. [7] Aunque la tTG se regula positivamente en las áreas del cerebro afectadas por la enfermedad de Huntington, un estudio reciente mostró que el aumento de los niveles de tTG no afecta el inicio o la progresión de la enfermedad en ratones. [42] Estudios recientes muestran que la tTG puede no estar involucrada en la EA, ya que los estudios muestran que está asociada con la lisis de eritrocitos y es una consecuencia de la enfermedad en lugar de una causa.
La tTG también se ha relacionado con la patogenia de la fibrosis en varios órganos, incluidos el pulmón y el riñón . Específicamente, en la fibrosis renal, la tTG contribuye a la estabilización y acumulación de la matriz extracelular, lo que afecta la actividad del TGF beta . [16]
Diagnóstico
La serología para anticuerpos anti-tTG ha reemplazado a las pruebas serológicas más antiguas (antiendomisio, antigliadina y antirreticulina) y tiene una gran sensibilidad (99%) y especificidad (>90%) para identificar la enfermedad celíaca. Los ensayos anti-tTG modernos se basan en una proteína recombinante humana como antígeno. [43]
Terapéutico
El uso de tTG como una forma de pegamento quirúrgico aún es experimental. También se está estudiando como atenuador de la metástasis en ciertos tumores. [11] La tTG se muestra prometedora como un objetivo terapéutico potencial para tratar la fibrosis cardíaca , a través de la actividad de un inhibidor de tTG altamente selectivo . [44] También se ha demostrado que los inhibidores de tTG inhiben la formación de inclusiones tóxicas relacionadas con enfermedades neurodegenerativas . [45] Esto indica que los inhibidores de tTG también podrían servir como una herramienta para mitigar la progresión de las enfermedades cerebrales relacionadas con tTG. [45]
Interacciones
La TG2 participa en interacciones tanto enzimáticas como no enzimáticas . Las interacciones enzimáticas se forman entre la TG2 y sus proteínas sustrato que contienen los grupos donantes de glutamina y lisina en presencia de calcio . Se sabe que los sustratos de la TG2 afectan la actividad de la TG2, lo que le permite ejecutar posteriormente diversas funciones biológicas en la célula. Sin embargo, aún queda por revelar la importancia de las interacciones no enzimáticas en la regulación de las actividades de la TG2. Estudios recientes indican que las interacciones no enzimáticas desempeñan funciones fisiológicas y permiten diversas funciones de la TG2 de una manera específica del contexto. [46]
| Alelos mutantes de ratón para Tgm2 | |
|---|---|
| Símbolo marcador del gen del ratón. Este símbolo lo asigna el MGI al locus genómico | Tgm2 |
| Clones de células madre embrionarias de ratón mutantes. Estas son las mutaciones específicas conocidas para este gen en un ratón. | Tgm2tm1a(KOMP)Tsi |
| Ejemplo de estructura del alelo mutante condicional específico para este gen | |
Wtsi.jpg/440px-Tgm2_tm1a(KOMP)Wtsi.jpg) | |
| Estas células madre embrionarias mutantes pueden estudiarse directamente o utilizarse para generar ratones con este gen eliminado. El estudio de estos ratones puede arrojar luz sobre la función de Tgm2: véase Ratón eliminado | |
Erp57
La proteína 57 del retículo endoplásmico (Erp57) es una molécula chaperona involucrada en la carga de péptidos en las moléculas de MHC clase I en el retículo endoplásmico .
La transglutaminasa 2 (TG2) es una proteína expresada de forma ubicua (tanto intracelular como extracelular), con múltiples modos de regulación postraduccional , incluido un enlace disulfuro alostérico entre Cys-370-Cys-371 que vuelve a la enzima inactiva en la matriz extracelular. [24]
La proteína 57 residente en el retículo endoplasmático (RE) (ERp57), una proteína del RE que promueve el plegamiento de proteínas nacientes y también está presente en el entorno extracelular, tiene las características celulares y bioquímicas para inactivar TG2. Descubrimos que ERp57 se colocaliza con TG2 extracelular en células endoteliales de vena umbilical humana cultivadas (HUVEC). ERp57 oxidó TG2 con una constante de velocidad que fue 400-2000 veces mayor que las de los oxidantes de moléculas pequeñas antes mencionados. Además, su especificidad para TG2 también fue notablemente mayor que las de otras proteínas redox secretadas, incluidas la proteína disulfuro isomerasa (PDI), ERp72, TRX y la quiescina sulfhidrilo oxidasa 1 (QSOX1).
Referencias
- ^ abc GRCh38: Lanzamiento de Ensembl 89: ENSG00000198959 – Ensembl , mayo de 2017
- ^ abc GRCm38: Lanzamiento de Ensembl 89: ENSMUSG00000037820 – Ensembl , mayo de 2017
- ^ "Referencia de PubMed humana:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ "Referencia de PubMed sobre ratón". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ ab Király R, Demény M, Fésüs L (diciembre de 2011). "Transamidación de proteínas por la transglutaminasa 2 en células: una acción controvertida dependiente de Ca2+ de una proteína multifuncional". The FEBS Journal . 278 (24): 4717–39. doi : 10.1111/j.1742-4658.2011.08345.x . PMID 21902809. S2CID 19217277.
- ^ abcdefgh Klöck C, Diraimondo TR, Khosla C (julio de 2012). "El papel de la transglutaminasa 2 en la patogénesis de la enfermedad celíaca". Seminarios en inmunopatología . 34 (4): 513–22. doi :10.1007/s00281-012-0305-0. PMC 3712867. PMID 22437759 .
- ^ abc Facchiano F, Facchiano A, Facchiano AM (mayo de 2006). "El papel de la transglutaminasa-2 y sus sustratos en enfermedades humanas". Frontiers in Bioscience . 11 : 1758–73. doi : 10.2741/1921 . PMID 16368554.
- ^ McConkey DJ, Orrenius S (octubre de 1997). "El papel del calcio en la regulación de la apoptosis". Comunicaciones de investigación bioquímica y biofísica . 239 (2): 357–66. CiteSeerX 10.1.1.483.2738 . doi :10.1006/bbrc.1997.7409. PMID 9344835. S2CID 11242870.
- ^ Lortat-Jacob H, Burhan I, Scarpellini A, Thomas A, Imberty A, Vivès RR, Johnson T, Gutierrez A, Verderio EA (mayo de 2012). "Interacción de la transglutaminasa-2 con heparina: identificación de un sitio de unión de la heparina que regula la adhesión celular a la matriz de fibronectina-transglutaminasa-2". The Journal of Biological Chemistry . 287 (22): 18005–17. doi : 10.1074/jbc.M111.337089 . PMC 3365763 . PMID 22442151.
- ^ Akimov SS, Krylov D, Fleischman LF, Belkin AM (febrero de 2000). "La transglutaminasa tisular es un correceptor de adhesión de unión a integrina para la fibronectina". The Journal of Cell Biology . 148 (4): 825–38. doi :10.1083/jcb.148.4.825. PMC 2169362 . PMID 10684262.
- ^ abcd Griffin M, Casadio R, Bergamini CM (diciembre de 2002). "Transglutaminasas: los pegamentos biológicos de la naturaleza". The Biochemical Journal . 368 (Pt 2): 377–96. doi :10.1042/BJ20021234. PMC 1223021 . PMID 12366374.
- ^ abcdef Diraimondo TR, Klöck C, Khosla C (abril de 2012). "El interferón-γ activa la transglutaminasa 2 a través de una vía dependiente de la fosfatidilinositol-3-quinasa: implicaciones para la terapia de la enfermedad celíaca". Revista de farmacología y terapéutica experimental . 341 (1): 104–14. doi :10.1124/jpet.111.187385. PMC 3310700 . PMID 22228808.
- ^ ab Di Sabatino A, Vanoli A, Giuffrida P, Luinetti O, Solcia E, Corazza GR (agosto de 2012). "La función de la transglutaminasa tisular en la enfermedad celíaca". Reseñas de autoinmunidad . 11 (10): 746–53. doi :10.1016/j.autrev.2012.01.007. PMID 22326684.
- ^ abcd Király R, Csosz E, Kurtán T, Antus S, Szigeti K, Simon-Vecsei Z, Korponay-Szabó IR, Keresztessy Z, Fésüs L (diciembre de 2009). "Importancia funcional de cinco sitios de unión de Ca2 + no canónicos de la transglutaminasa 2 humana caracterizados por mutagénesis dirigida al sitio". El Diario FEBS . 276 (23): 7083–96. doi : 10.1111/j.1742-4658.2009.07420.x . PMID 19878304. S2CID 21883387.
- ^ "Gen Entrez: TGM2 transglutaminasa 2".
- ^ ab Hitomi K, Kojima S, Fesus L (2015). Transglutaminasas: múltiples modificadores funcionales y objetivos para el descubrimiento de nuevos fármacos . Tokio. ISBN 9784431558255. OCLC 937392418.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Pinkas DM, Strop P, Brunger AT, Khosla C (diciembre de 2007). "La transglutaminasa 2 sufre un gran cambio conformacional tras la activación". PLOS Biology . 5 (12): e327. doi : 10.1371/journal.pbio.0050327 . PMC 2140088 . PMID 18092889.
- ^ Liu S, Cerione RA, Clardy J (marzo de 2002). "Base estructural de la actividad de unión al nucleótido de guanina de la transglutaminasa tisular y su regulación de la actividad de transamidación". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 99 (5): 2743–7. Bibcode :2002PNAS...99.2743L. doi : 10.1073/pnas.042454899 . PMC 122418 . PMID 11867708.
- ^ Han BG, Cho JW, Cho YD, Jeong KC, Kim SY, Lee BI (agosto de 2010). "Estructura cristalina de la transglutaminasa humana 2 en complejo con trifosfato de adenosina". Revista internacional de macromoléculas biológicas . 47 (2): 190–5. doi :10.1016/j.ijbiomac.2010.04.023. PMID 20450932.
- ^ abc Stamnaes J, Pinkas DM, Fleckenstein B, Khosla C, Sollid LM (agosto de 2010). "Regulación redox de la actividad de la transglutaminasa 2". The Journal of Biological Chemistry . 285 (33): 25402–9. doi : 10.1074/jbc.M109.097162 . PMC 2919103 . PMID 20547769.
- ^ Chen X, Hnida K, Graewert MA, Andersen JT, Iversen R, Tuukkanen A, Svergun D, Sollid LM (agosto de 2015). "Base estructural para el reconocimiento de antígenos por autoanticuerpos específicos de la transglutaminasa 2 en la enfermedad celíaca". The Journal of Biological Chemistry . 290 (35): 21365–75. doi : 10.1074/jbc.M115.669895 . PMC 4571865 . PMID 26160175.
- ^ Bianchi N, Beninati S, Bergamini CM (mayo de 2018). "Foco en el gen de la transglutaminasa 2: un enfoque en los aspectos genómicos y transcripcionales" (PDF) . The Biochemical Journal . 475 (9): 1643–1667. doi :10.1042/BCJ20170601. hdl :11392/2388638. PMID 29764956.
- ^ abcde Jin X, Stamnaes J, Klöck C, DiRaimondo TR, Sollid LM, Khosla C (octubre de 2011). "Activación de la transglutaminasa 2 extracelular por tiorredoxina". La Revista de Química Biológica . 286 (43): 37866–73. doi : 10.1074/jbc.M111.287490 . PMC 3199528 . PMID 21908620.
- ^ abcde Yi MC, Melkonian AV, Ousey JA, Khosla C (febrero de 2018). "La proteína 57 residente en el retículo endoplásmico (ERp57) inactiva oxidativamente la transglutaminasa 2 humana". The Journal of Biological Chemistry . 293 (8): 2640–2649. doi : 10.1074/jbc.RA117.001382 . PMC 5827427 . PMID 29305423.
- ^ Pinkas DM, Strop P, Brunger AT, Khosla C (diciembre de 2007). "La transglutaminasa 2 sufre un gran cambio conformacional tras la activación". PLOS Biology . 5 (12): e327. doi : 10.1371/journal.pbio.0050327 . PMC 2140088 . PMID 18092889.
- ^ Colak G, Keillor JW, Johnson GV (enero de 2011). Polymenis M (ed.). "La forma deficiente de la transglutaminasa 2 (R580a) que se une al nucleótido de guanina citosólica potencia la muerte celular en la privación de oxígeno y glucosa". PLOS ONE . 6 (1): e16665. Bibcode :2011PLoSO...616665C. doi : 10.1371/journal.pone.0016665 . PMC 3031627 . PMID 21304968.
- ^ Quinn BR, Yunes-Medina L, Johnson GV (julio de 2018). "Transglutaminasa 2: ¿Amiga o enemiga? El papel discordante en neuronas y astrocitos". Journal of Neuroscience Research . 96 (7): 1150–1158. doi :10.1002/jnr.24239. PMC 5980740 . PMID 29570839.
- ^ Nurminskaya MV, Belkin AM (2012). Funciones celulares de la transglutaminasa tisular . Revista internacional de biología celular y molecular. Vol. 294. págs. 1–97. doi :10.1016/B978-0-12-394305-7.00001-X. ISBN. 9780123943057. PMC 3746560 . PMID 22364871.
- ^ Fesus L, Piacentini M (octubre de 2002). "Transglutaminasa 2: una enzima enigmática con diversas funciones". Tendencias en ciencias bioquímicas . 27 (10): 534–9. doi :10.1016/S0968-0004(02)02182-5. PMID 12368090.
- ^ Mishra S, Murphy LJ (junio de 2004). "La transglutaminasa tisular tiene actividad quinasa intrínseca: identificación de la transglutaminasa 2 como proteína 3 quinasa de unión al factor de crecimiento similar a la insulina". The Journal of Biological Chemistry . 279 (23): 23863–8. doi : 10.1074/jbc.M311919200 . PMID 15069073.
- ^ Hasegawa G, Suwa M, Ichikawa Y, Ohtsuka T, Kumagai S, Kikuchi M, Sato Y, Saito Y (agosto de 2003). "Una nueva función de la transglutaminasa de tipo tisular: proteína disulfuro isomerasa". La revista bioquímica . 373 (parte 3): 793–803. doi :10.1042/BJ20021084. PMC 1223550 . PMID 12737632.
- ^ Sakly W, Thomas V, Quash G, El Alaoui S (diciembre de 2006). "Un papel para la transglutaminasa tisular en la citotoxicidad del péptido alfa-gliadina". Inmunología clínica y experimental . 146 (3): 550–8. doi :10.1111/j.1365-2249.2006.03236.x. PMC 1810403 . PMID 17100777.
- ^ ab Tabolacci C, De Martino A, Mischiati C, Feriotto G, Beninati S (enero de 2019). "El papel de la transglutaminasa tisular en la iniciación, supervivencia y progresión de las células cancerosas". Ciencias Médicas . 7 (2): 19. doi : 10.3390/medsci7020019 . PMC 6409630 . PMID 30691081.
- ^ ab Rossin F, Villella VR, D'Eletto M, Farrace MG, Esposito S, Ferrari E, Monzani R, Occhigrossi L, Pagliarini V, Sette C, Cozza G, Barlev NA, Falasca L, Fimia GM, Kroemer G, Raia V, Maiuri L, Piacentini M (julio de 2018). "TG2 regula la respuesta al choque térmico mediante la modificación postraduccional de HSF1". Informes EMBO . 19 (7): e45067. doi :10.15252/embr.201745067. PMC 6030705 . PMID 29752334.
- ^ abc Lorand L, Iismaa SE (enero de 2019). "Enfermedades por transglutaminasa: de la bioquímica a la atención médica". FASEB Journal . 33 (1): 3–12. doi : 10.1096/fj.201801544R . PMID 30593123. S2CID 58551851.
- ^ Dieterich W, Ehnis T, Bauer M, Donner P, Volta U, Riecken EO, Schuppan D (julio de 1997). "Identificación de la transglutaminasa tisular como autoantígeno de la enfermedad celíaca". Medicina de la Naturaleza . 3 (7): 797–801. doi :10.1038/nm0797-797. PMID 9212111. S2CID 20033968.
- ^ Murray JA, Frey MR, Oliva-Hemker M (junio de 2018). "Enfermedad celíaca". Gastroenterología . 154 (8): 2005–2008. doi :10.1053/j.gastro.2017.12.026. PMC 6203336 . PMID 29550590.
- ^ Eckert, Richard L. (29 de enero de 2019). "La transglutaminasa 2 ocupa un lugar central como factor de supervivencia de las células cancerosas y objetivo terapéutico: la transglutaminasa en el cáncer". Carcinogénesis molecular . 58 (6): 837–853. doi :10.1002/mc.22986. PMC 7754084 . PMID 30693974. S2CID 59341070.
- ^ Wilhelmus MM, Verhaar R, Andringa G, Bol JG, Cras P, Shan L, Hoozemans JJ, Drukarch B (marzo de 2011). "La presencia de transglutaminasa tisular en el retículo endoplasmático granular es característica de las neuronas melanizadas en el cerebro con enfermedad de Parkinson". Patología cerebral . 21 (2): 130–9. doi :10.1111/j.1750-3639.2010.00429.x. PMC 8094245 . PMID 20731657. S2CID 586174.
- ^ Ricotta M, Iannuzzi M, Vivo GD, Gentile V (mayo de 2010). "Funciones fisiopatológicas de las reacciones catalizadas por transglutaminasa". Revista mundial de química biológica . 1 (5): 181–7. doi : 10.4331/wjbc.v1.i5.181 . PMC 3083958 . PMID 21541002.
- ^ Martin A, Giuliano A, Collaro D, De Vivo G, Sedia C, Serretiello E, Gentile V (enero de 2013). "Posible participación de las reacciones catalizadas por transglutaminasa en la fisiopatología de las enfermedades neurodegenerativas". Amino Acids . 44 (1): 111–8. doi :10.1007/s00726-011-1081-1. PMID 21938398. S2CID 16143202.
- ^ Kumar A, Kneynsberg A, Tucholski J, Perry G, van Groen T, Detloff PJ, Lesort M (septiembre de 2012). "La sobreexpresión de la transglutaminasa tisular no modifica el fenotipo de la enfermedad del modelo de ratón R6/2 de la enfermedad de Huntington". Neurología experimental . 237 (1): 78–89. doi :10.1016/j.expneurol.2012.05.015. PMC 3418489 . PMID 22698685.
- ^ Sblattero D, Berti I, Trevisiol C, Marzari R, Tommasini A, Bradbury A, Fasano A, Ventura A, Not T (mayo de 2000). "Ensayo ELISA de transglutaminasa tisular recombinante humana: un ensayo diagnóstico innovador para la enfermedad celíaca". The American Journal of Gastroenterology . 95 (5): 1253–7. doi :10.1111/j.1572-0241.2000.02018.x. PMID 10811336. S2CID 11018740.
- ^ Wang Z, Stuckey DJ, Murdoch CE, Camelliti P, Lip GY, Griffin M (abril de 2018). "La fibrosis cardíaca se puede atenuar bloqueando la actividad de la transglutaminasa 2 utilizando un inhibidor selectivo de moléculas pequeñas". Muerte celular y enfermedad . 9 (6): 613. doi :10.1038/s41419-018-0573-2. PMC 5966415. PMID 29795262 .
- ^ ab Min B, Chung KC (enero de 2018). "Nuevos conocimientos sobre la transglutaminasa 2 y su vínculo con las enfermedades neurodegenerativas". BMB Reports . 51 (1): 5–13. doi :10.5483/BMBRep.2018.51.1.227. PMC 5796628 . PMID 29187283.
- ^ Kanchan K, Fuxreiter M, Fésüs L (agosto de 2015). "Implicaciones fisiológicas, patológicas y estructurales de las interacciones proteína-proteína no enzimáticas de la transglutaminasa humana multifuncional 2". Ciencias de la vida celular y molecular . 72 (16): 3009–35. doi :10.1007/s00018-015-1909-z. PMC 11113818 . PMID 25943306. S2CID 14849506.
Enlaces externos
- Anticuerpos endomisiales Archivado el 12 de mayo de 2021 en Wayback Machine.
- Una colección de sustratos y socios de interacción de TG2 está accesible en TRANSDAB, una base de datos interactiva de sustratos de transglutaminasa.