Proteorodopsina
Este artículo puede resultar demasiado técnico para la mayoría de los lectores . ( Mayo de 2016 ) |
| Proteorodopsina | |
|---|---|
 Visualización de dibujos animados de proteorodopsina por ELViture | |
| Identificadores | |
| Símbolo | Bac_rodopsina |
| Interprofesional | IPR017402 |
| SCOP2 | 2brd / ALCANCE / SUPFAM |
| Base de datos de datos termodinámica | 3.E.1 |
| Superfamilia OPM | 6 |
| Proteína OPM | 4hyj |
La proteorodopsina (también conocida como pRodopsina ) es una familia de proteínas transmembrana que utilizan la retina como cromóforo para la funcionalidad mediada por la luz, en este caso, una bomba de protones . La pRodopsina se encuentra en bacterias planctónicas marinas , arqueas y eucariotas ( proteas ), pero se descubrió por primera vez en bacterias. [1] [2] [3] [4]
Su nombre se deriva de las proteobacterias (ahora llamadas Pseudomonadota ) que recibieron su nombre del griego antiguo Πρωτεύς ( Proteus ), un dios marino primitivo mencionado por Homero como " el anciano del mar ", Ῥόδος ( rhódon ) por " rosa ", debido a su color rosado, y ὄψις ( opsis ) por "vista". Algunos miembros de la familia, los pigmentos homólogos similares a la rodopsina , es decir, la bacteriorrodopsina (de la que hay más de 800 tipos) tienen funciones sensoriales como las opsinas , esenciales para la fototransducción visual . Muchas de estas funciones sensoriales son desconocidas, por ejemplo, la función de la neuropsina en la retina humana. [5] Se sabe que los miembros tienen diferentes espectros de absorción , incluida la luz visible verde y azul . [6] [7] [8] [9] [10] [11]
Historia
La proteorodopsina (PR o pRhodopsin) fue descubierta por primera vez en el año 2000 dentro de un cromosoma artificial bacteriano de Gammaproteobacteria marina no cultivada previamente , a la que todavía solo se hacía referencia por sus datos metagenómicos de ribotipo , SAR86. Se descubrió que más especies de Gammaproteobacteria, tanto Gram-positivas como Gram-negativas , expresaban la proteína. [1]
Distribución
Se han obtenido muestras de bacterias que expresan proteorodopsina del Océano Pacífico Oriental , el Océano Pacífico Norte Central y el Océano Austral , la Antártida . [12] Posteriormente, se han identificado genes de variantes de proteorodopsina en muestras del Mediterráneo , el Mar Rojo , el Mar de los Sargazos , el Mar de Japón y el Mar del Norte . [4] [6]
Las variantes de proteorodopsina no se propagan aleatoriamente, sino que se dispersan a lo largo de gradientes de profundidad basados en el ajuste máximo de absorción de la secuencia particular de holoproteína ; esto se debe principalmente a la absorción electromagnética por el agua que crea gradientes de longitud de onda en relación con la profundidad. Oxyrrhis marina es un protista dinoflagelado con proteorodopsina que absorbe verde (un resultado del grupo L109) que existe principalmente en charcas de marea y costas poco profundas, donde aún hay luz verde disponible. Karlodinium micrum , otro dinoflagelado, expresa una proteorodopsina sintonizada con azul (E109) que puede estar relacionada con sus migraciones verticales en aguas profundas . [3] Originalmente se creía que O. marina era un heterótrofo , sin embargo, la proteorodopsina bien puede participar de una manera funcionalmente significativa, ya que fue el gen nuclear expresado más abundantemente y, además, se dispersa de manera desigual en el organismo, lo que sugiere alguna función de membrana de orgánulo . Hasta ahora, las únicas proteínas eucariotas transductoras de energía solar conocidas eran el fotosistema I y el fotosistema II . Se ha planteado la hipótesis de que la transferencia lateral de genes es el método por el cual la proteorodopsina se ha abierto camino en numerosos filos. Las bacterias, las arqueas y los eucariotas colonizan la zona fótica donde salen a la luz; la proteorodopsina ha podido diseminarse a través de esta zona, pero no a otras partes de la columna de agua. [3] [4] [9] [13] [14]
Taxonomía
La proteorodopsina pertenece a una familia de proteínas retinilidén similares, más parecidas a sus homólogas arqueales, la halorrodopsina y la bacteriorrodopsina. La rodopsina sensorial fue descubierta por Franz Christian Boll en 1876. [11] [15] La bacteriorrodopsina fue descubierta en 1971 y nombrada en 1973 y actualmente solo se sabe que existe en arqueas, no en bacterias. [16] La halorrodopsina fue descubierta y nombrada por primera vez en 1977. [17] La bacteriorrodopsina y la halorrodopsina solo existen en arqueas, mientras que la proteorodopsina abarca bacterias, arqueas y eucariotas. La proteorodopsina comparte siete hélices α transmembrana unidas covalentemente por un mecanismo de base de Schiff a un residuo de lisina en la séptima hélice (hélice G). La bacteriorrodopsina, al igual que la proteorodopsina, es una bomba de protones impulsada por la luz. La rodopsina sensorial es una proteína acoplada a G que interviene en la visión. [1] [17]
Sitio activo
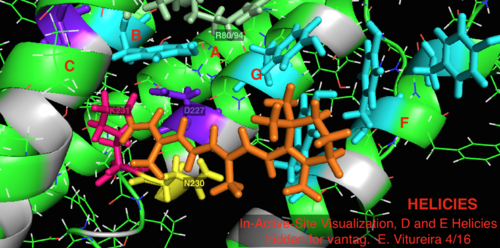
En comparación con su homólogo arqueológico más conocido, la bacteriorrodopsina, la mayoría de los residuos del sitio activo de importancia conocida para el mecanismo de la bacteriorrodopsina se conservan en la proteorrodopsina. Sin embargo, la similitud de secuencia no se conserva significativamente, ni en la halo- ni en la bacteriorrodopsina. Los homólogos de los residuos del sitio activo Arg 82, Asp 85 (el aceptor primario de protones ), Asp 212 y Lys 216 (el sitio de unión de la base de Schiff de la retina ) en la bacteriorrodopsina se conservan como Arg94, Asp97, Asp227 y Lys231 en la proteorrodopsina. Sin embargo, en la proteorodopsina no hay residuos de ácido carboxílico directamente homólogos a Glu 194 o Glu204 de la bacteriorodopsina (o Glu 108 y 204 dependiendo de la variante de bacRhodopsin), que se cree que están involucrados en la vía de liberación de protones en la superficie extracelular. Sin embargo, Asp97 y Arg94 pueden reemplazar esta funcionalidad sin la proximidad de residuos como en la bacteriorodopsina. El departamento de química de la Universidad de Syracuse demostró decisivamente que Asp97 no puede ser el grupo de liberación de protones ya que la liberación ocurrió en condiciones forzadas bajo las cuales el grupo de ácido aspártico permaneció protonado. [18] [19] [20] [21]
Ligando
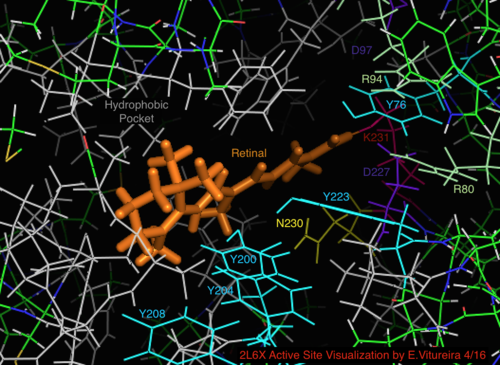
La familia de haloproteínas rodopsina comparte el ligando retinal, uno de los muchos tipos de vitamina A. El retinal es un cromóforo poliinsaturado conjugado ( polieno ) , obtenido de la dieta carnívora o por la vía del caroteno ( β-caroteno 15,15'-monoxigenasa ).
Función
La proteorodopsina funciona en todos los océanos de la Tierra como una bomba de H+ impulsada por la luz, mediante un mecanismo similar al de la bacteriorodopsina. Al igual que en la bacteriorodopsina, el cromóforo retiniano de la proteorodopsina está unido covalentemente a la apoproteína a través de una base de Schiff protonada en Lys231. La configuración del cromóforo retiniano en la proteorodopsina no fotolizada es predominantemente todo-trans, [18] y se isomeriza a 13-cis tras la iluminación con luz. Se han propuesto varios modelos del fotociclo completo de la proteorodopsina, basados en espectroscopia FTIR y UV-visible ; se parecen a los modelos de fotociclo establecidos para la bacteriorodopsina. [18] [20] [21] [22] Se han descubierto y expresado fotosistemas completos basados en proteorodopsina en E. coli, lo que les otorga una capacidad adicional de gradiente de energía mediada por luz para la generación de ATP sin necesidad externa de retinal o precursores; Junto con el gen PR, otras cinco proteínas codifican la vía biosintética del fotopigmento. [23]
Ingeniería genética
Si se inserta el gen de la proteorodopsina en E. coli y se administra retinal a estas bacterias modificadas , incorporarán el pigmento a su membrana celular y bombearán H+ en presencia de luz. Un morado oscuro es representativo de colonias claramente transformadas, debido a la absorción de luz. Los gradientes de protones se pueden utilizar para alimentar otras estructuras proteínicas de membrana o para acidificar un orgánulo de tipo vesícula. [1] Se demostró además que el gradiente de protones generado por la proteorodopsina podría utilizarse para generar ATP. [23]
Véase también
Galería
- Holoenzima (verde) con hélices marcadas con AG (violeta) y ligando de retina (naranja)
- Visualización de la superficie de la proteorodopsina que muestra las terminales.
- Visualización del sitio activo unido a la retina de la estructura de la proteína 2L6X de pRhodopsina, residuos codificados por color y etiquetados por actividad, el ligando es naranja.
- Visualización etiquetada y codificada por colores de dibujos animados del sitio activo 2L6x, hélices D y E ocultas para mayor ventaja, sitio de unión del ligando de la retina
Referencias
- ^ abcd Béjà O, Aravind L, Koonin EV, Suzuki MT, Hadd A, Nguyen LP, Jovanovich SB, Gates CM, Feldman RA, Spudich JL, Spudich EN, DeLong EF (septiembre de 2000). "Rodopsina bacteriana: evidencia de un nuevo tipo de fototrofia en el mar". Science . 289 (5486): 1902–6. Bibcode :2000Sci...289.1902B. doi :10.1126/science.289.5486.1902. PMID 10988064.
- ^ Lin S, Zhang H, Zhuang Y, Tran B, Gill J (noviembre de 2010). "Los análisis metatranscriptómicos basados en líderes empalmados conducen al reconocimiento de características genómicas ocultas en dinoflagelados". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 107 (46): 20033–8. Bibcode :2010PNAS..10720033L. doi : 10.1073/pnas.1007246107 . PMC 2993343 . PMID 21041634.
- ^ abc Slamovits CH, Okamoto N, Burri L, James ER, Keeling PJ (2011). "Una bomba de protones de proteorodopsina bacteriana en eucariotas marinos". Nature Communications . 2 (2): 183. Bibcode :2011NatCo...2..183S. doi : 10.1038/ncomms1188 . PMID 21304512.
- ^ abc Frigaard NU, Martinez A, Mincer TJ, DeLong EF (febrero de 2006). "Transferencia lateral de genes de proteorodopsina entre bacterias planctónicas marinas y arqueas". Nature . 439 (7078): 847–50. Bibcode :2006Natur.439..847F. doi :10.1038/nature04435. PMID 16482157. S2CID 4427548.
- ^ Buhr ED, Yue WW, Ren X, Jiang Z, Liao HW, Mei X, Vemaraju S, Nguyen MT, Reed RR, Lang RA, Yau KW, Van Gelder RN (20 de octubre de 2015). ""Fotoentrenamiento mediado por neuropsina (OPN5) de osciladores circadianos locales en la retina y la córnea de mamíferos"". Actas de la Academia Nacional de Ciencias . 112 (42): 13093–13098. Bibcode :2015PNAS..11213093B. doi : 10.1073/pnas.1516259112 . PMC 4620855 . PMID 26392540.
- ^ ab Béjà O, Spudich EN, Spudich JL, Leclerc M, DeLong EF (junio de 2001). "Fototrofia de proteorodopsina en el océano". Nature . 411 (6839): 786–9. Bibcode :2001Natur.411..786B. doi :10.1038/35081051. PMID 11459054. S2CID 4428964.
- ^ Man D, Wang W, Sabehi G, Aravind L, Post AF, Massana R, Spudich EN, Spudich JL, Béjà O (abril de 2003). "Diversificación y ajuste espectral en proteorodopsinas marinas". The EMBO Journal . 22 (8): 1725–31. doi :10.1093/emboj/cdg183. PMC 154475 . PMID 12682005.
- ^ Kelemen BR, Du M, Jensen RB (diciembre de 2003). "Proteorodopsina en color vivo: diversidad de propiedades espectrales dentro de células bacterianas vivas". Biochimica et Biophysica Acta (BBA) - Biomembranas . 1618 (1): 25–32. doi : 10.1016/j.bbamem.2003.10.002 . PMID 14643930.
- ^ ab Sabehi G, Kirkup BC, Rozenberg M, Stambler N, Polz MF, Béjà O (mayo de 2007). "Adaptación y ajuste espectral en proteorodopsinas marinas divergentes del Mediterráneo oriental y los mares de los Sargazos". The ISME Journal . 1 (1): 48–55. doi : 10.1038/ismej.2007.10 . PMID 18043613.
- ^ Enciclopedia de las ciencias neurológicas . Academic Press. 29 de abril de 2014. p. 441. ISBN 978-0-12-385158-1.
- ^ ab Giese, Arthur C (septiembre de 2013). Fotofisiología: principios generales; acción de la luz sobre las plantas . Elsevier. pág. 9. ISBN 978-1-4832-6227-7.
- ^ Venter JC, Remington K, Heidelberg JF, Halpern AL, Rusch D, Eisen JA, Wu D, Paulsen I, Nelson KE, Nelson W, Fouts DE, Levy S, Knap AH, Lomas MW, Nealson K, White O, Peterson J, Hoffman J, Parsons R, Baden-Tillson H, Pfannkoch C, Rogers YH, Smith HO (abril de 2004). "Secuenciación aleatoria del genoma ambiental del mar de los Sargazos". Science . 304 (5667): 66–74. Bibcode :2004Sci...304...66V. CiteSeerX 10.1.1.124.1840 . doi :10.1126/science.1093857. Número de modelo : PMID15001713 . Número de modelo: S2CID1454587 .
- ^ Giovannoni, SJ; Bibbs, L; Cho, JC; Stapels, MD; Desiderio, R; Vergin, KL; Rappé, MS; Laney, S; Wilhelm, LJ; Tripp, HJ; Mathur, EJ; Barofsky, DF (3 de noviembre de 2005). "Proteorodopsina en la bacteria marina ubicua SAR11". Nature . 438 (7064): 82–5. Bibcode :2005Natur.438...82G. doi :10.1038/nature04032. PMID 16267553. S2CID 4414677.
- ^ Kushwaha, SC; Kates, M (23 de agosto de 1973). "Aislamiento e identificación de "bacteriorrodopsina" y carotenoides C40 menores en Halobacterium cutirubrum". Biochimica et Biophysica Acta (BBA) - Lípidos y metabolismo lipídico . 316 (2): 235–43. doi :10.1016/0005-2760(73)90013-1. PMID 4741911.
- ^ Enciclopedia de las ciencias neurológicas . Academic Press. Abril de 2014. pág. 441. ISBN 978-0-12-385158-1.
- ^ Oesterhelt, D; Stoeckenius, W (29 de septiembre de 1971). "Proteína similar a la rodopsina de la membrana púrpura de Halobacterium halobium". Nature New Biology . 233 (39): 149–52. doi :10.1038/newbio233149a0. PMID 4940442.
- ^ ab Matsuno-Yagi, A; Mukohata, Y (9 de septiembre de 1977). "Dos posibles funciones de la bacteriorrodopsina; un estudio comparativo de cepas de Halobacterium halobium que difieren en pigmentación". Comunicaciones de investigación bioquímica y biofísica . 78 (1): 237–43. doi :10.1016/0006-291x(77)91245-1. PMID 20882.
- ^ abc Dioumaev AK, Brown LS, Shih J, Spudich EN, Spudich JL, Lanyi JK (abril de 2002). "Transferencias de protones en el ciclo de reacción fotoquímica de la proteorodopsina". Bioquímica . 41 (17): 5348–58. doi :10.1021/bi025563x. PMID 11969395.
- ^ Partha R, Krebs R, Caterino TL, Braiman MS (junio de 2005). "El acoplamiento debilitado de la arginina conservada al cromóforo de proteorodopsina y su contraión implica diferencias estructurales con respecto a la bacteriorodopsina". Biochimica et Biophysica Acta (BBA) - Bioenergetics . 1708 (1): 6–12. doi : 10.1016/j.bbabio.2004.12.009 . PMID 15949979.
- ^ ab Dioumaev AK, Wang JM, Bálint Z, Váró G, Lanyi JK (junio de 2003). "El transporte de protones por proteorodopsina requiere que el contraión de base de Schiff Asp-97 de la retina sea aniónico". Bioquímica . 42 (21): 6582–7. doi :10.1021/bi034253r. PMID 12767242.
- ^ ab Krebs RA, Alexiev U, Partha R, DeVita AM, Braiman MS (abril de 2002). "Detección de liberación rápida de H+ activada por luz y formación de intermediarios M a partir de proteorodopsina". BMC Physiology . 2 : 5. doi : 10.1186/1472-6793-2-5 . PMC 103662 . PMID 11943070.
- ^ Xiao Y, Partha R, Krebs R, Braiman M (enero de 2005). "Espectroscopia FTIR resuelta en el tiempo de los fotointermediarios involucrados en la liberación transitoria rápida de H+ por proteorodopsina". The Journal of Physical Chemistry B . 109 (1): 634–41. doi :10.1021/jp046314g. PMID 16851056.
- ^ ab Martinez A, Bradley AS, Waldbauer JR, Summons RE, DeLong EF (2007). "La expresión génica del fotosistema de proteorodopsina permite la fotofosforilación en un huésped heterólogo". PNAS . 104 (13): 5590–5595. Bibcode :2007PNAS..104.5590M. doi : 10.1073/pnas.0611470104 . PMC 1838496 . PMID 17372221.




