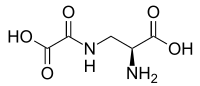
Ácido oxalildiaminopropiónico
 | |
| Nombres | |
|---|---|
| Nombre sistemático de la IUPAC Ácido (2 S )-2-amino-3-(oxaloamino)propanoico | |
Otros nombres
| |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Abreviaturas |
|
| EBICh | |
| Araña química | |
| BARRIL | |
| Malla | ácido oxalildiaminopropiónico |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| Propiedades | |
| C5H8N2O5 | |
| Masa molar | 176,128 g·mol −1 |
| Compuestos relacionados | |
Compuestos relacionados | Beta-metilamino-L-alanina |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El ácido oxalildiaminopropiónico ( ODAP ) es un análogo estructural del neurotransmisor glutamato que se encuentra en la hierba Lathyrus sativus . Es la neurotoxina responsable del síndrome de degeneración de la neurona motora, latirismo . [1]
Fuentes
La ODAP se encuentra en las semillas de la leguminosa L. sativus , una planta de guisante, en un rango de 0,5% p/p. [2] L. sativus se puede encontrar en áreas del sur, centro y este de Europa, la cuenca mediterránea, Irak y Afganistán, así como en áreas de Asia y África. [3]
Historia
En algunas regiones, como el subcontinente indio, Bangladesh, Etiopía y Nepal, la arveja se ha convertido en un alimento básico. [3] La planta tiene una gran tolerancia a las condiciones ambientales, lo que hace que sea la única fuente de alimento disponible en épocas de hambruna o sequía. Después de estas sequías de varios meses, pueden producirse epidemias de neurolatirismo. [4] El último caso de una epidemia de este tipo (hasta 2013) se produjo en Etiopía durante la sequía de 1995-1997 [5] durante la cual 2000 personas quedaron discapacitadas de forma permanente. [3]
Efectos biológicos
La ODAP es un agonista del receptor de glutamato ionotrópico [6] AMPA . [5] Se sabe que causa neurolatirismo en humanos, una enfermedad degenerativa de las neuronas motoras caracterizada por la degeneración de las neuronas del tracto piramidal en la médula espinal y en el área de la corteza que controla las piernas, lo que resulta en parálisis de la parte inferior del cuerpo. [6] No existe una explicación directa de cómo la ODAP causa neurolatirismo; sin embargo, ha habido evidencia que respalda algunos efectos biológicos. Una razón por la que el mecanismo de acción no está completamente claro puede ser porque, hasta ahora, no se ha encontrado un buen modelo animal para el efecto de la ODAP en humanos. [ 5] La DL50 también es desconocida.
Excitotoxicidad
La ODAP activa los receptores AMPA, lo que puede inducir excitotoxicidad o sobreestimulación de los receptores de glutamato. La liberación de demasiado glutamato, ya sea de una sola vez o durante un período prolongado, provocará un aumento de los niveles de Ca2+
en el citoplasma. Dado que Ca2+
es el ion de señalización para la liberación de glutamato en la sinapsis, esto puede dar como resultado la potenciación del ciclo de liberación de glutamato y la propagación del daño excitotóxico a las neuronas vecinas. Dentro de la neurona, el Ca extra2+
abandonará el citoplasma y entrará en la mitocondria o en el retículo endoplasmático (RE), lo que puede provocar la acumulación de proteínas mal plegadas o desplegadas en el RE y, en última instancia, la muerte celular en ambos casos. Además de actuar como agonista, hay evidencia que demuestra que la ODAP es transportada al interior de la célula por un antiportador que transporta simultáneamente glutamato a la sinapsis. [6]
Estrés oxidativo
El segundo efecto biológico de la ODAP es el estrés oxidativo . Las especies reactivas de oxígeno (ROS) se generan en las mitocondrias durante el metabolismo, y el cuerpo tiene mecanismos para neutralizar estas moléculas antes de que causen daño. El estrés oxidativo resulta de una alteración en el funcionamiento normal de estas vías. Un antioxidante en la vía neutralizante es el glutatión (GSH), cuya síntesis requiere los aminoácidos que contienen azufre metionina y cisteína como precursores. Se cree que la ODAP, posiblemente debido a la excitotoxicidad inducida, reduce la ingesta de cisteína a través de su antiportador . Esto inhibe la síntesis de GSH, lo que conduce a un aumento de la producción de ROS y daño mitocondrial. Las neuronas motoras pueden ser las más sensibles al envenenamiento por ODAP porque muestran una mayor dependencia del precursor de GSH, la metionina. Además, L. sativus , como alimento, es deficiente en aminoácidos que contienen azufre, lo que mejora los efectos a nivel de receptor de la ODAP en la producción de GSH cuando se ingiere. [6]
Síntesis
Biosíntesis
En L. sativus, la ODAP se sintetiza en las plántulas jóvenes a partir del precursor (β-isoxazolin-5-on-2-il)-alanina, también conocido como BIA. No se ha detectado BIA en partes maduras de la planta ni en semillas en maduración. La vía comienza con la formación de BIA a partir de O-acetil-L-serina (OAS) e isoxazolin-5-on. Una apertura del anillo conduce a la formación del intermediario de vida corta ácido 2,3-L-diaminopropanoico (DAPRO) que luego es oxalizado por la oxalil- coenzima A para formar ODAP. [7]

Síntesis química
El ODAP se puede sintetizar a partir del ácido L-α,β-diaminopropiónico y oxalato de dimetilo a un pH de 4,5-5. El óxido cúprico se puede utilizar para proteger temporalmente el grupo α-NH2 del ácido L-α,β-diaminopropiónico durante la reacción. [2]

Véase también
- β-Metilamino- L -alanina , una toxina relacionada
Referencias
- ^ ab Woldeamanuel, Yohannes W.; Hassan, Anhar; Zenebe, Guta (12 de noviembre de 2011). "Neurolatirismo: dos informes de casos etíopes y revisión de la literatura". Revista de neurología . 259 (7): 1263–1268. doi :10.1007/s00415-011-6306-4. ISSN 0340-5354. PMID 22081101. S2CID 27543906.
- ^ ab Rao, S; Adiga, P; Sarma, P (marzo de 1964). "El aislamiento y caracterización del ácido β-N-oxalil-L-α,β-diaminopropiónico: una neurotoxina de las semillas de Lathyrus sativus". Bioquímica . 3 (3): 432–436. doi :10.1021/bi00891a022. PMID 14155110.
- ^ abc Heuzé V., Tran G., Hassoun P., Lessire M., Lebas F., 2016. Guisante (Lathyrus sativus). Feedipedia, un programa del INRA, CIRAD, AFZ y FAO. https://www.feedipedia.org/node/285 Última actualización el 19 de abril de 2016 a las 15:36
- ^ "Investigación sobre Lathyrus". Universiteit Gent . Archivado desde el original el 16 de abril de 2015. Consultado el 8 de abril de 2015 .
- ^ abc Singh, S; Rao, S (julio de 2013). "Lecciones del neurolatirismo: una enfermedad del pasado y del futuro de Lathyrus sativus (Khesari dal)". Revista india de investigación médica . 138 (1): 32–37. PMC 3767245 . PMID 24056554.
- ^ abcd Moorhem, M; Lambein, F; Laybaert, L (marzo de 2011). "Descifrando el mecanismo de excitotoxicidad y estrés oxidativo inducidos por el ácido β-N-oxalil-α,β-diaminopropiónico (β-ODAP), relevancia para la prevención del neurolatirismo". Toxicología alimentaria y química . 49 (3): 550–555. doi :10.1016/j.fct.2010.03.054. PMID 20510327.
- ^ Kuo, Y; Khan, J; Lambein, F (marzo de 1994). "Biosíntesis de la neurotoxina β-odap en vainas en desarrollo de Lathyrus sativus". Fitoquímica . 35 (4): 911–913. Código Bibliográfico :1994PChem..35..911K. doi :10.1016/s0031-9422(00)90637-x.


