Gemcitabina
 | |
 | |
| Datos clínicos | |
|---|---|
| Pronunciación | / dʒ ɛ m ˈ s aɪ t ə b iː n / |
| Nombres comerciales | Gemzar, otros [1] |
| Otros nombres | 2',2'-difluoro-2'desoxicitidina, dFdC |
| AHFS / Drogas.com | Monografía |
Categoría de embarazo |
|
| Vías de administración | Intravenoso |
| Código ATC |
|
| Estatus legal | |
| Estatus legal | |
| Datos farmacocinéticos | |
| Unión de proteínas | <10% |
| Vida media de eliminación | Infusiones cortas: 32–94 minutos Infusiones largas: 245–638 minutos |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Unión Internacional para la Investigación y el Desarrollo (IUPHAR)/BPS |
|
| Banco de medicamentos | |
| Araña química | |
| UNIVERSIDAD |
|
| BARRIL | |
| EBICh | |
| Química biológica | |
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.124.343 |
| Datos químicos y físicos | |
| Fórmula | C9H11F2N3O4 |
| Masa molar | 263,201 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
| (verificar) | |
La gemcitabina , que se vende bajo la marca Gemzar , entre otras, [1] es un medicamento de quimioterapia utilizado para tratar el cáncer . [2] Se utiliza para tratar el cáncer testicular , [3] el cáncer de mama , el cáncer de ovario , el cáncer de pulmón de células no pequeñas , el cáncer de páncreas y el cáncer de vejiga . [2] [4] Se administra por infusión intravenosa . [2] Actúa contra el crecimiento neoplásico e inhibe la replicación del Orthohepevirus A , el agente causante de la hepatitis E , a través de la regulación positiva de la señalización del interferón . [5]
Los efectos secundarios comunes incluyen supresión de la médula ósea , problemas hepáticos y renales, náuseas , fiebre , sarpullido , dificultad para respirar , llagas en la boca, diarrea , neuropatía y caída del cabello . [2] El uso durante el embarazo probablemente resultará en daño fetal . [2] La gemcitabina pertenece a la familia de medicamentos análogos de nucleósidos . [2] Actúa bloqueando la creación de nuevo ADN , lo que resulta en la muerte celular. [2]
La gemcitabina fue patentada en 1983 y fue aprobada para uso médico en 1995. [6] Las versiones genéricas se introdujeron en Europa en 2009 y en los EE. UU. en 2010. [7] [8] Está en la Lista Modelo de Medicamentos Esenciales de la OMS . [9]
Usos médicos
La gemcitabina trata diversos carcinomas . Se utiliza como tratamiento de primera línea solo para el cáncer de páncreas y en combinación con cisplatino para el cáncer de vejiga avanzado o metastásico y el cáncer de pulmón de células no pequeñas avanzado o metastásico . Se utiliza como tratamiento de segunda línea en combinación con carboplatino para el cáncer de ovario y en combinación con paclitaxel para el cáncer de mama metastásico o que no se puede extirpar quirúrgicamente. [10] [11] [12]
Se utiliza fuera de indicación para tratar el colangiocarcinoma [13] y otros cánceres del tracto biliar . [14]
Contraindicaciones e interacciones
El uso de gemcitabina también puede afectar la fertilidad en hombres y mujeres, la vida sexual y la menstruación. Las mujeres que toman gemcitabina no deben quedar embarazadas, y las mujeres embarazadas o en período de lactancia no deben tomarla. [15]
Hasta 2014, no se habían estudiado las interacciones farmacológicas. [11] [10]
Efectos adversos
La gemcitabina es un fármaco de quimioterapia que actúa matando todas las células que se están dividiendo. [10] Las células cancerosas se dividen rápidamente y, por lo tanto, la gemcitabina se dirige a tasas más altas, pero muchas células esenciales también se dividen rápidamente, incluidas las células de la piel, el cuero cabelludo, el revestimiento del estómago y la médula ósea, lo que produce efectos adversos. [16] : 265
La etiqueta de la gemcitabina contiene advertencias de que puede inhibir la función de la médula ósea y causar pérdida de glóbulos blancos , plaquetas y glóbulos rojos , y que debe usarse con precaución en personas con trastornos hepáticos, renales o cardiovasculares. Las personas que la toman no deben recibir vacunas vivas. La etiqueta de advertencia también indica que puede causar síndrome de encefalopatía posterior reversible , síndrome de extravasación capilar , enfermedades pulmonares graves como edema pulmonar , neumonía y síndrome de dificultad respiratoria del adulto , y que puede dañar los espermatozoides. [10] [17]
Más del 10% de los usuarios desarrollan efectos adversos, incluyendo dificultad para respirar, recuentos bajos de glóbulos blancos y rojos, recuentos bajos de plaquetas, vómitos y náuseas, transaminasas elevadas , erupciones y picazón en la piel, pérdida de cabello, sangre y proteínas en la orina, síntomas similares a la gripe y edema . [10] [15]
Los efectos adversos comunes (que ocurren en el 1 al 10 % de los usuarios) incluyen fiebre, pérdida de apetito, dolor de cabeza, dificultad para dormir, cansancio, tos, secreción nasal, diarrea, llagas en la boca y los labios, sudoración, dolor de espalda y dolor muscular. [10]
La púrpura trombocitopénica trombótica (PTT) es un efecto secundario poco frecuente pero grave que se ha asociado con determinados medicamentos de quimioterapia, incluida la gemcitabina. La PTT es un trastorno sanguíneo y puede provocar anemia hemolítica microangipática (MAHA), anomalías neurológicas, fiebre y enfermedad renal. [18]
Farmacología
La gemcitabina es hidrófila y debe transportarse a las células a través de transportadores moleculares de nucleósidos (los transportadores más comunes para la gemcitabina son SLC29A1 , SLC28A1 y SLC28A3). [19] [20] Después de entrar en la célula, la gemcitabina se modifica primero uniendo un fosfato a ella, y así se convierte en monofosfato de gemcitabina (dFdCMP). [19] [20] Este es el paso determinante de la velocidad que es catalizado por la enzima desoxicitidina quinasa (DCK). [19] [20] Otras enzimas añaden dos fosfatos más. Después de la unión de los tres fosfatos, la gemcitabina finalmente es farmacológicamente activa como trifosfato de gemcitabina (dFdCTP). [19] [21]
Después de ser fosforilada tres veces , la gemcitabina puede enmascararse como trifosfato de desoxicitidina y se incorpora a nuevas cadenas de ADN que se sintetizan a medida que la célula se replica . [2] [19] [20]
Cuando la gemcitabina se incorpora al ADN, permite que se añada una base nucleosídica nativa o normal junto a ella. Esto conduce a una "terminación enmascarada de la cadena" porque la gemcitabina es una base "defectuosa", pero debido a su nucleósido nativo vecino, elude el sistema normal de reparación de la célula ( reparación por escisión de bases ). Por lo tanto, la incorporación de gemcitabina al ADN de la célula crea un error irreparable que conduce a la inhibición de una mayor síntesis de ADN y, por lo tanto, a la muerte celular. [2] [19] [20]
La forma de gemcitabina con dos fosfatos unidos (dFdCDP) también tiene actividad; inhibe la enzima ribonucleótido reductasa (RNR), que es necesaria para crear nuevos nucleótidos de ADN. La falta de nucleótidos impulsa a la célula a absorber más de los componentes que necesita para producir nucleótidos desde fuera de la célula, lo que también aumenta la absorción de gemcitabina. [2] [19] [20] [22]
Química
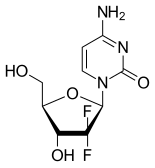
La gemcitabina es un profármaco nucleósido de pirimidina sintético , un análogo de nucleósido en el que los átomos de hidrógeno en el carbono 2' de la desoxicitidina son reemplazados por átomos de flúor . [2] [23] [24]
La síntesis descrita y representada a continuación es la síntesis original realizada en los laboratorios de Eli Lilly Company. La síntesis comienza con D-gliceraldehído (R)-2 enantiopuro como material de partida que se puede preparar a partir de D-manitol en 2 a 7 pasos. Luego se introduce flúor mediante un enfoque de "bloques de construcción" utilizando bromodifluoroacetato de etilo . Luego, la reacción de Reformatsky en condiciones estándar producirá una mezcla diastereomérica anti/sin 3:1, con un producto principal. La separación de los diastereómeros se lleva a cabo mediante HPLC, produciendo así la anti-3 gemcitabina con un rendimiento del 65%. [23] [24] Al menos otros dos métodos de síntesis completa también han sido desarrollados por diferentes grupos. [24]

Historia
La gemcitabina se sintetizó por primera vez en el laboratorio de Larry Hertel en Eli Lilly and Company a principios de la década de 1980. Estaba destinada a ser un fármaco antiviral , pero las pruebas preclínicas demostraron que mataba las células leucémicas in vitro . [25]
A principios de los años 90, la gemcitabina se estudió en ensayos clínicos. Los ensayos sobre cáncer de páncreas demostraron que la gemcitabina aumentaba significativamente el tiempo de supervivencia a un año, y en 1995 se aprobó en el Reino Unido [10] y en 1996 fue aprobada por la FDA para el cáncer de páncreas. [4] En 1998, la gemcitabina recibió la aprobación de la FDA para el tratamiento del cáncer de pulmón de células no pequeñas y en 2004 fue aprobada para el cáncer de mama metastásico. [4]
Las etiquetas europeas fueron armonizadas por la EMA en 2008. [26]
En 2008, las ventas mundiales de gemcitabina de Lilly fueron de aproximadamente 1.700 millones de dólares; en ese momento, sus patentes en Estados Unidos expirarían en 2013 y sus patentes europeas en 2009. [27] El primer genérico se lanzó en Europa en 2009, [7] y se presentaron impugnaciones de patentes en Estados Unidos que llevaron a la invalidación de una patente clave de Lilly sobre su método para fabricar el fármaco. [28] [29] Las empresas de genéricos comenzaron a vender el fármaco en Estados Unidos en 2010 cuando expiró la patente del propio producto químico. [29] [8] Los litigios sobre patentes en China fueron noticia allí y se resolvieron en 2010. [30]
Sociedad y cultura
En 2017, la gemcitabina se comercializaba con muchas marcas en todo el mundo: Abine, Accogem, Acytabin, Antoril, axigem, Bendacitabin, Biogem, Boligem, Celzar, Citegin, Cytigem, Cytogem, Daplax, DBL, Demozar, Dercin, Emcitab, Enekamub, Eriogem. , Fotinex, Gebina, Gemalata, Gembin, Gembine, Gembio, Gemcel, Gemcetin, Gemcibine, Gemcikal, Gemcipen, Gemcired, Gemcirena, Gemcit, Gemcitabin, Gemcitabina, Gemcitabine, Gemcitabinum, Gemcitan, Gemedac, Gemflor, Gemful, Gemita, Gemko, Gemliquid , Gemmis, Gemnil, Gempower, Gemsol, Gemstad, Gemstada, Gemtabine, Gemtavis, Gemtaz, Gemtero, Gemtra, Gemtro, Gemvic, Gemxit, Gemzar, Gentabim, Genuten, Genvir, Geroam, Gestredos, Getanosan, Getmisi, Gezt, Gitrabin, Gramagen, Haxanit, Jemta, Kalbezar, Medigem, Meditabine, Nabigem, Nallian, Oncogem, Oncoril, Pamigeno, Ribozar, Santabin, Sitagem, Symtabin, Yu Jie , Ze Fei y Zefei. [1]
Investigación
Debido a que es clínicamente valioso y sólo es útil cuando se administra por vía intravenosa, los métodos para reformularlo de modo que pueda administrarse por vía oral han sido objeto de investigación. [31] [32] [33]
La investigación sobre farmacogenómica y farmacogenética ha estado en curso. Hasta 2014, no estaba claro si las pruebas genéticas podrían ser útiles para guiar la dosificación y qué personas responden mejor a la gemcitabina. [19] Sin embargo, parece que la variación en la expresión de proteínas ( SLC29A1 , SLC29A2 , SLC28A1 y SLC28A3) utilizadas para el transporte de gemcitabina a la célula conduce a variaciones en su potencia. De manera similar, los genes que expresan proteínas que conducen a su inactivación ( desoxicitidina deaminasa , citidina deaminasa y NT5C ) y que expresan sus otros objetivos intracelulares ( RRM1 , RRM2 y RRM2B ) conducen a variaciones en la respuesta al fármaco. [19] También se han realizado investigaciones para comprender cómo las mutaciones en los cánceres de páncreas determinan la respuesta a la gemcitabina. [34]
Se ha estudiado como tratamiento para el sarcoma de Kaposi , un cáncer común en personas con SIDA que es poco común en el mundo desarrollado pero no infrecuente en el mundo en desarrollo. [35]
Referencias
- ^ abc "Marcas internacionales de gemcitabina". Drugs.com. Archivado desde el original el 25 de mayo de 2014. Consultado el 6 de mayo de 2017 .
- ^ abcdefghijk «Clorhidrato de gemcitabina». Sociedad Estadounidense de Farmacéuticos de Sistemas de Salud. Archivado desde el original el 2 de febrero de 2017. Consultado el 8 de diciembre de 2016 .
- ^ "Formulario de medicamentos/Medicamentos/gemcitabina - Monografía del proveedor". Cancer Care Ontario . Consultado el 6 de diciembre de 2020 .
- ^ abc "Aprobación de la FDA para el clorhidrato de gemcitabina". Instituto Nacional del Cáncer . 5 de octubre de 2006. Archivado desde el original el 5 de abril de 2017. Consultado el 22 de abril de 2017 .
- ^ Li Y, Li P, Li Y, Zhang R, Yu P, Ma Z, et al. (diciembre de 2020). "La detección de fármacos identificó que la gemcitabina inhibe el virus de la hepatitis E al inducir una respuesta similar al interferón a través de la activación de la fosforilación de STAT1". Antiviral Research . 184 : 104967. doi : 10.1016/j.antiviral.2020.104967 . hdl : 1765/133780 . PMID 33137361.
- ^ Fischer J, Ganellin CR (2006). Descubrimiento de fármacos basado en análogos. John Wiley & Sons. pág. 511. ISBN 9783527607495.
- ^ ab Myers C (13 de marzo de 2009). «Gemcitabina de Actavis lanzada al mercado de la UE tras expiración de patente». FierceBiotech . Archivado desde el original el 11 de septiembre de 2017.
- ^ ab "Nota de prensa: Hospira lanza un vial de dos gramos de clorhidrato de gemcitabina inyectable". Hospira vía News-Medical.Net. 16 de noviembre de 2010. Archivado desde el original el 2 de octubre de 2015.
- ^ Organización Mundial de la Salud (2023). Selección y uso de medicamentos esenciales 2023: anexo web A: Lista modelo de medicamentos esenciales de la Organización Mundial de la Salud: 23.ª lista (2023) . Ginebra: Organización Mundial de la Salud. hdl : 10665/371090 . OMS/MHP/HPS/EML/2023.02.
- ^ abcdefg «Etiqueta del Reino Unido». Compendio electrónico de medicamentos del Reino Unido. 5 de junio de 2014. Archivado desde el original el 10 de julio de 2017. Consultado el 6 de mayo de 2017 .
- ^ ab "US formLabel" (PDF) . FDA. Junio de 2014. Archivado (PDF) del original el 16 de febrero de 2017 . Consultado el 6 de mayo de 2017 .Para actualizaciones de etiquetas, consulte la página de índice de la FDA para NDA 020509 Archivado el 29 de abril de 2017 en Wayback Machine.
- ^ Zhang XW, Ma YX, Sun Y, Cao YB, Li Q, Xu CA (junio de 2017). "Gemcitabina en combinación con un segundo agente citotóxico en el tratamiento de primera línea del cáncer de páncreas localmente avanzado o metastásico: una revisión sistemática y un metanálisis". Targeted Oncology . 12 (3): 309–321. doi :10.1007/s11523-017-0486-5. PMID 28353074. S2CID 3833614.
- ^ Plentz RR, Malek NP (diciembre de 2016). "Terapia sistémica del colangiocarcinoma". Medicina visceral . 32 (6): 427–430. doi :10.1159/000453084. PMC 5290432 . PMID 28229078.
- ^ Jain A, Kwong LN, Javle M (noviembre de 2016). "Perfiles genómicos de cánceres de vías biliares e implicaciones para la práctica clínica". Opciones actuales de tratamiento en oncología . 17 (11): 58. doi :10.1007/s11864-016-0432-2. PMID 27658789. S2CID 25477593.
- ^ ab "Gemcitabina". Macmillan Cancer Support . Archivado desde el original el 25 de marzo de 2017. Consultado el 6 de mayo de 2017 .
- ^ Rachel Airley (2009). Quimioterapia contra el cáncer . Wiley-Blackwell. ISBN 978-0-470-09254-5.
- ^ Siddall E, Khatri M, Radhakrishnan J (julio de 2017). "Síndrome de fuga capilar: etiologías, fisiopatología y tratamiento". Kidney International . 92 (1): 37–46. doi : 10.1016/j.kint.2016.11.029 . PMID 28318633.
- ^ Kasi PM (enero de 2011). "Púrpura trombocitopénica trombótica y gemcitabina". Informes de casos en oncología . 4 (1): 143–148. doi :10.1159/000326801. PMC 3114619 . PMID 21691573.
- ^ abcdefghi Alvarellos ML, Lamba J, Sangkuhl K, Thorn CF, Wang L, Klein DJ, et al. (noviembre de 2014). "Resumen de PharmGKB: vía de la gemcitabina". Farmacogenética y genómica . 24 (11): 564–574. doi :10.1097/fpc.0000000000000086. PMC 4189987 . PMID 25162786.
- ^ abcdef Mini E, Nobili S, Caciagli B, Landini I, Mazzei T (mayo de 2006). "Farmacología celular de gemcitabina". Anales de Oncología . 17 (Suplemento 5): v7-12. doi : 10.1093/annonc/mdj941 . PMID 16807468.
- ^ Fatima, M., Iqbal Ahmed, MM, Batool, F., Riaz, A., Ali, M., Munch-Petersen, B. y Mutahir, Z. (2019). La desoxirribonucleósido quinasa recombinante de Drosophila melanogaster puede mejorar la quimioterapia/genética combinada basada en gemcitabina para atacar las células cancerosas. Bosnian Journal of Basic Medical Sciences, 19(4), 342-349. https://doi.org/10.17305/bjbms.2019.4136
- ^ Cerqueira NM, Fernandes PA, Ramos MJ (2007). "Comprensión de la inactivación de la ribonucleótido reductasa por gemcitabina". Química: una revista europea . 13 (30): 8507–8515. doi :10.1002/chem.200700260. PMID 17636467.
- ^ ab Brown K, Weymouth-Wilson A, Linclau B (abril de 2015). "Una síntesis lineal de gemcitabina". Investigación de carbohidratos . 406 : 71–75. doi : 10.1016/j.carres.2015.01.001 . PMID 25681996.
- ^ abc Brown K, Dixey M, Weymouth-Wilson A, Linclau B (marzo de 2014). "La síntesis de gemcitabina". Investigación de carbohidratos . 387 : 59–73. doi :10.1016/j.carres.2014.01.024. PMID 24636495.
- ^ Sneader, Walter (2005). Descubrimiento de fármacos: una historia . Nueva York: Wiley. p. 259. ISBN 978-0-471-89979-2.
- ^ "Gemzar". Agencia Europea de Medicamentos. 24 de septiembre de 2008. Archivado desde el original el 11 de septiembre de 2017.
- ^ Myers C (18 de agosto de 2009). «Invalidación de la patente del fármaco contra el cáncer de Lilly, Gemzar». FiercePharma . Archivado desde el original el 11 de septiembre de 2017.
- ^ Holman CM (verano de 2011). "Impredecibilidad en la legislación sobre patentes y su efecto en la innovación farmacéutica" (PDF) . Missouri Law Review . 76 (3): 645–693. Archivado desde el original (PDF) el 2017-09-11 . Consultado el 2017-05-06 .
- ^ ab Ravicher DB (28 de julio de 2010). "Sobre la lucha por la patente genérica de Gemzar". Seeking Alpha . Archivado desde el original el 9 de diciembre de 2012.
- ^ Wang MH, Alexandre D (2015). "Análisis de casos de infracción de patentes farmacéuticas en la Gran China". En Iimura T, Wang MH, Voit TJ, Rader RR (eds.). Derecho, política y extracción de ingresos en materia de propiedad intelectual . Cambridge Scholars Publishing. pág. 119. ISBN. 9781443879262. Archivado desde el original el 11 de septiembre de 2017.
- ^ Dyawanapelly S, Kumar A, Chourasia MK (2017). "Lecciones aprendidas de la gemcitabina: impacto de los sistemas de transporte terapéutico y los conjugados farmacológicos de la gemcitabina en la terapia contra el cáncer". Critical Reviews in Therapeutic Drug Carrier Systems . 34 (1): 63–96. doi :10.1615/CritRevTherDrugCarrierSyst.2017017912. PMID 28322141.
- ^ Birhanu G, Javar HA, Seyedjafari E, Zandi-Karimi A (abril de 2017). "Nanotecnología para la administración de gemcitabina para tratar el cáncer de páncreas". Biomedicina y farmacoterapia . 88 : 635–643. doi :10.1016/j.biopha.2017.01.071. PMID 28142120.
- ^ Dubey RD, Saneja A, Gupta PK, Gupta PN (octubre de 2016). "Avances recientes en estrategias de administración de fármacos para mejorar la eficacia terapéutica de la gemcitabina". Revista Europea de Ciencias Farmacéuticas . 93 : 147–162. doi :10.1016/j.ejps.2016.08.021. PMID 27531553.
- ^ Pishvaian MJ, Brody JR (marzo de 2017). "Implicaciones terapéuticas de la subtipificación molecular para el cáncer de páncreas". Oncología . 31 (3): 159–66, 168. PMID 28299752. Archivado desde el original el 3 de julio de 2017.
- ^ Krown SE (septiembre de 2011). "Estrategias de tratamiento para el sarcoma de Kaposi en África subsahariana: desafíos y oportunidades". Current Opinion in Oncology . 23 (5): 463–468. doi :10.1097/cco.0b013e328349428d. PMC 3465839 . PMID 21681092.

