Infección por anquilostomas
| Infección por anquilostomas | |
|---|---|
| Otros nombres | Enfermedad por anquilostomas |
 | |
| Anquilostomas | |
| Especialidad | Enfermedad infecciosa |
| Síntomas | Picor, erupción localizada, dolor abdominal, diarrea [1] |
| Complicaciones | Anemia , deficiencia de proteínas [2] |
| Causas | Ancylostoma duodenale (anquilostoma del viejo mundo), Necator americanus (anquilostoma del nuevo mundo) [1] |
| Factores de riesgo | Caminar descalzo en climas cálidos con malas condiciones sanitarias [1] |
| Método de diagnóstico | Muestra de heces [1] |
| Prevención | No caminar descalzo, dejar de defecar al aire libre [1] |
| Medicamento | Albendazol , mebendazol , suplementos de hierro [3] |
| Frecuencia | 428 millones (2015) [4] |
La anquilostomiasis es una infección causada por un tipo de parásito intestinal conocido como anquilostoma . [1] [5] Inicialmente, puede aparecer picazón y sarpullido en el lugar de la infección. Aquellos afectados solo por unos pocos gusanos pueden no mostrar síntomas. Aquellos infectados por muchos gusanos pueden experimentar dolor abdominal , diarrea, pérdida de peso y cansancio . El desarrollo mental y físico de los niños puede verse afectado. Puede producirse anemia . [1]
Dos infecciones comunes por anquilostomas en humanos son la anquilostomiasis y la necatoriasis , causadas por las especies Ancylostoma duodenale y Necator americanus respectivamente. Los huevos de anquilostomas se depositan en las heces de las personas infectadas. Si estos terminan en el medio ambiente, pueden eclosionar y convertirse en larvas (gusanos inmaduros), que luego pueden penetrar la piel. Un tipo también puede transmitirse a través de alimentos contaminados. Los factores de riesgo incluyen caminar descalzo en climas cálidos, donde las condiciones sanitarias son deficientes. El diagnóstico se realiza mediante el examen de una muestra de heces con un microscopio . [1]
El riesgo de infección se puede reducir a nivel individual al no caminar descalzo en áreas donde la enfermedad es común. A nivel poblacional, la disminución de la defecación al aire libre , no usar heces crudas como fertilizante y la desparasitación masiva son eficaces. [1] El tratamiento suele consistir en medicamentos como albendazol o mebendazol durante uno a tres días. Puede ser necesario administrar suplementos de hierro en personas con anemia. [3]
En 2015, los anquilostomas infectaron a unos 428 millones de personas. [4] Las infecciones graves pueden ocurrir tanto en niños como en adultos, pero son menos comunes en los adultos. [2] Rara vez son fatales. [6] La infección por anquilostomas es una helmintiasis transmitida por el suelo y está clasificada como una enfermedad tropical desatendida . [7]
Signos y síntomas
No existen síntomas ni signos específicos de la infección por anquilostomas, pero dan lugar a una combinación de inflamación intestinal y anemia progresiva por deficiencia de hierro y deficiencia de proteínas . La tos, el dolor en el pecho, las sibilancias y la fiebre a veces son consecuencia de una infección grave. También pueden presentarse dolores epigástricos, indigestión, náuseas, vómitos , estreñimiento y diarrea en etapas tempranas o posteriores, aunque los síntomas gastrointestinales tienden a mejorar con el tiempo. Los signos de una infección grave avanzada son los de anemia y deficiencia de proteínas, que incluyen emaciación , insuficiencia cardíaca y distensión abdominal con ascitis . [ cita requerida ]
La invasión larvaria de la piel (principalmente en las Américas) puede producir una enfermedad de la piel llamada larva migratoria cutánea, también conocida como erupción reptante. Los huéspedes de estos gusanos no son humanos y las larvas solo pueden penetrar las cinco capas superiores de la piel, donde dan lugar a una picazón intensa y local , generalmente en el pie o la parte inferior de la pierna, conocida como picazón del suelo . Esta infección se debe a las larvas del anquilostoma A. braziliense . Las larvas migran en túneles tortuosos entre el estrato basal y el estrato córneo de la piel, causando lesiones vesiculares serpiginosas . Con el avance del movimiento de las larvas, las porciones traseras de las lesiones se secan y forman costras. Las lesiones suelen picar intensamente. [8]
Período de incubación
El período de incubación puede variar entre unas pocas semanas y muchos meses, y depende en gran medida de la cantidad de parásitos de anquilostomas con los que esté infectado un individuo. [9]
Causa

Las infecciones por anquilostomas en humanos incluyen anquilostomiasis y necatoriasis . La anquilostomiasis es causada por Ancylostoma duodenale , que es el tipo más común que se encuentra en Oriente Medio , África del Norte , India y (anteriormente) en el sur de Europa . La necatoriasis es causada por Necator americanus , el tipo más común en América , África subsahariana , Sudeste Asiático , China e Indonesia . [ cita requerida ]
Otros animales como pájaros , perros y gatos también pueden verse afectados. A. tubaeforme infecta a los gatos, A. caninum infecta a los perros y A. braziliense y Uncinaria stenocephala infectan tanto a gatos como a perros. Algunas de estas infecciones pueden transmitirse a los humanos . [10]
Morfología
Los gusanos A. duodenale son de color blanco grisáceo o rosado y tienen la cabeza ligeramente inclinada en relación con el resto del cuerpo. Esta curvatura forma una forma de gancho definitiva en el extremo anterior, de ahí su nombre. Poseen bocas bien desarrolladas con dos pares de dientes. Mientras que los machos miden aproximadamente un centímetro por 0,5 milímetros, las hembras suelen ser más largas y robustas. Además, los machos se pueden distinguir de las hembras en función de la presencia de una bursa copuladora posterior prominente. [11]
N. americanus es muy similar en morfología a A. duodenale . N. americanus es generalmente más pequeño que A. duodenale ; los machos suelen medir de 5 a 9 mm de largo y las hembras de alrededor de 1 cm de largo. Mientras que A. duodenale posee dos pares de dientes, N. americanus posee un par de placas cortantes en la cápsula bucal. Además, la forma de gancho está mucho más definida en Necator que en Ancylostoma . [11]
Ciclo vital
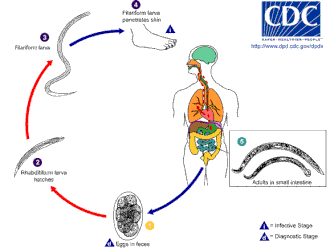
El anquilostoma prospera en suelos cálidos donde las temperaturas superan los 18 °C (64 °F). Viven principalmente en suelos arenosos o arcillosos y no pueden vivir en arcilla o lodo. Las precipitaciones medias deben ser superiores a los 1.000 mm (39 pulgadas) al año para que sobrevivan. Solo si se dan estas condiciones pueden eclosionar los huevos. Las larvas infecciosas de N. americanus pueden sobrevivir a temperaturas más altas, mientras que las de A. duodenale están mejor adaptadas a climas más fríos. Por lo general, viven solo unas pocas semanas como máximo en condiciones naturales y mueren casi inmediatamente por exposición a la luz solar directa o por desecación . [ cita requerida ]
La infección del huésped se produce por las larvas, no por los huevos. Aunque A. duodenale puede ingerirse, el método habitual de infección es a través de la piel; esto suele producirse al caminar descalzo por zonas contaminadas con materia fecal. Las larvas pueden penetrar la piel del pie y, una vez dentro del cuerpo, migran a través del sistema vascular hasta los pulmones y, desde allí, suben por la tráquea , donde son tragadas. Luego pasan por el esófago y entran en el sistema digestivo, terminando su viaje en el intestino , donde las larvas maduran y se convierten en gusanos adultos. [12] [13]
Una vez en el intestino del huésped, Necator tiende a causar una infección prolongada, generalmente de 1 a 5 años (muchos gusanos mueren dentro de un año o dos de infectar), aunque se ha registrado que algunos gusanos adultos viven 15 años o más. Los adultos de Ancylostoma tienen una vida corta, sobreviviendo en promedio solo unos 6 meses. Sin embargo, la infección puede prolongarse porque las larvas latentes pueden ser "reclutadas" secuencialmente de los "depósitos" de tejido durante muchos años, para reemplazar a los gusanos adultos vencidos. Esto puede dar lugar a fluctuaciones estacionales en la prevalencia e intensidad de la infección (aparte de las variaciones estacionales normales en la transmisión). [ cita requerida ]

Se aparean dentro del huésped, las hembras ponen entre 10.000 y 30.000 huevos al día y entre 15 y 56 millones de huevos durante su vida adulta, que se eliminan en las heces. Debido a que los gusanos adultos necesitan de 5 a 7 semanas para madurar, aparearse y producir huevos, en las primeras etapas de una infección muy grave, pueden aparecer síntomas agudos sin que se detecten huevos en las heces del paciente. Esto puede dificultar mucho el diagnóstico. [ cita requerida ]
Los huevos de N. americanus y A. duodenale se pueden encontrar en suelos cálidos y húmedos, donde finalmente eclosionan y se convierten en larvas de primera etapa, o L1. L1, la etapa rabditoforme no infecciosa que se alimenta, se alimentará de microbios del suelo y finalmente mudará a larvas de segunda etapa, L2, que también se encuentran en la etapa rabditoforme. Se alimentará durante aproximadamente 7 días y luego mudará a larvas de tercera etapa, o L3. Esta es la etapa filariforme del parásito, es decir, la forma infecciosa no alimentaria de las larvas. Las larvas L3 son extremadamente móviles y buscan terrenos más altos para aumentar sus posibilidades de penetrar la piel de un huésped humano. Las larvas L3 pueden sobrevivir hasta 2 semanas sin encontrar un huésped. Mientras que las larvas de N. americanus solo infectan a través de la penetración de la piel, A. duodenale puede infectar tanto a través de la penetración como por vía oral. Después de que las larvas L3 hayan ingresado con éxito al huésped, luego viajan a través de las vénulas subcutáneas y los vasos linfáticos del huésped humano. Finalmente, las larvas L3 entran en los pulmones a través de los capilares pulmonares y salen a los alvéolos. Luego viajan por la tráquea para ser tosidas y tragadas por el huésped. Después de ser tragadas, las larvas L3 se encuentran en el intestino delgado, donde mudan a la etapa L4, o gusano adulto. El proceso completo desde la penetración en la piel hasta el desarrollo adulto toma alrededor de 5 a 9 semanas. Los gusanos adultos hembra liberan huevos ( N. americanus alrededor de 9.000 a 10.000 huevos / día y A. duodenale 25.000 a 30.000 huevos / día), que se eliminan en las heces del huésped humano. Estos huevos eclosionan en el medio ambiente en varios días y el ciclo comienza de nuevo. [12] [14] [15]
Fisiopatología
La infección por anquilostomas se considera generalmente asintomática, pero como describió Norman Stoll en 1962, es una infección extremadamente peligrosa porque sus daños son "silenciosos e insidiosos". [16] Una persona puede experimentar síntomas generales poco después de la infección. La picazón en el suelo, que es una reacción alérgica en el sitio de penetración y entrada parasitaria, es común en pacientes infectados con N. americanus . [11] Además, puede producirse tos y neumonitis cuando las larvas comienzan a penetrar en los alvéolos y viajan hasta la tráquea. Luego, una vez que las larvas alcanzan el intestino delgado del huésped y comienzan a madurar, la persona infectada experimentará diarrea y otras molestias gastrointestinales. [11] Sin embargo, los síntomas "silenciosos e insidiosos" a los que se refiere Stoll están relacionados con infecciones crónicas y de alta intensidad por anquilostomas. La morbilidad importante asociada con la infección por anquilostomas es causada por pérdida de sangre intestinal, anemia por deficiencia de hierro y desnutrición proteica. [14] Son el resultado principalmente de anquilostomas adultos en el intestino delgado que ingieren sangre, rompen los eritrocitos y degradan la hemoglobina en el huésped. [12] Esta pérdida de sangre a largo plazo puede manifestarse físicamente a través de edema facial y periférico ; algunos pacientes infectados por anquilostomas también experimentan eosinofilia y pica/ geofagia causadas por anemia por deficiencia de hierro. [11] Recientemente, se ha prestado más atención a otros resultados importantes de la infección por anquilostomas que desempeñan un papel importante en la salud pública. Ahora se acepta ampliamente que los niños que tienen una infección crónica por anquilostomas pueden experimentar retraso del crecimiento, así como deterioro intelectual y cognitivo. [12] [17] Además, investigaciones recientes se han centrado en el potencial de resultados materno-fetales adversos cuando la madre se infecta con anquilostomas durante el embarazo. [ cita requerida ]
La enfermedad fue vinculada a gusanos nematodos ( Ankylostoma duodenalis ) de un tercio a media pulgada de largo en el intestino principalmente a través de los trabajos de Theodor Bilharz y Griesinger en Egipto (1854). [18]
Los síntomas pueden estar relacionados con la inflamación en el intestino estimulada por la alimentación con anquilostomas, como náuseas, dolor abdominal y diarrea intermitente, y con la anemia progresiva en la enfermedad prolongada: apetito caprichoso, pica / geofagia (o ingestión de tierra), estreñimiento obstinado seguido de diarrea , palpitaciones , pulso filiforme, frialdad de la piel, palidez de las mucosas, fatiga y debilidad, dificultad para respirar y en casos de curso fatal, disentería , hemorragias y edemas . [18] Los gusanos chupan sangre y dañan la mucosa . Sin embargo, la pérdida de sangre en las heces no es visiblemente evidente. [ cita requerida ]
Los análisis de sangre en las primeras etapas de la infección suelen mostrar un aumento de los eosinófilos, un tipo de glóbulo blanco que se estimula preferentemente en los tejidos por las infecciones por gusanos (también hay una gran cantidad de eosinófilos en la respuesta inflamatoria local). En los casos de infección prolongada con anemia, se observará una disminución de los niveles de hemoglobina en sangre. [ cita requerida ]
A diferencia de la mayoría de las helmintiasis intestinales , donde las mayores cargas parasitarias tienden a ocurrir en niños, la prevalencia e intensidad de la anquilostomiasis puede ser mayor entre los varones adultos. La explicación de esto es que la infección por anquilostomas tiende a ser ocupacional, de modo que los compañeros de trabajo y otros grupos cercanos mantienen una alta prevalencia de infección entre ellos al contaminar su entorno de trabajo. Sin embargo, en la mayoría de las áreas endémicas, las mujeres adultas son las más gravemente afectadas por la anemia, principalmente porque tienen necesidades fisiológicas mucho mayores de hierro (menstruación, embarazos repetidos). Una consecuencia interesante de esto en el caso de la infección por Ancylostoma duodenale es la transmisión translactal de la infección: las larvas invasoras de la piel de esta especie no pasan todas inmediatamente a través de los pulmones y al intestino, sino que se extienden por todo el cuerpo a través de la circulación, para quedar latentes dentro de las fibras musculares. En una mujer embarazada, después del parto, algunas o todas estas larvas son estimuladas a reingresar a la circulación (presumiblemente por cambios hormonales repentinos) y luego a pasar a las glándulas mamarias, de modo que el bebé recién nacido puede recibir una gran dosis de larvas infecciosas a través de la leche de su madre. Esto explica casos inexplicables de infecciones por anquilostomas muy graves, incluso fatales, en niños de un mes de edad aproximadamente, en lugares como China, India y el norte de Australia. Un fenómeno idéntico se observa mucho más comúnmente con las infecciones por Ancylostoma caninum en perros, donde las crías recién nacidas pueden incluso morir de hemorragias intestinales causadas por cantidades masivas de anquilostomas que se alimentan. Esto también refleja el estrecho vínculo evolutivo entre los parásitos humanos y caninos, que probablemente tienen un ancestro común que se remonta a cuando los humanos y los perros comenzaron a vivir juntos. Las larvas filariformes son la etapa infecciosa del parásito: la infección se produce cuando las larvas en el suelo penetran la piel, o cuando se ingieren a través de alimentos y agua contaminados después de la penetración en la piel. [ cita requerida ]
Diagnóstico

El diagnóstico depende de la detección de los huevos característicos del gusano en el examen microscópico de las heces, aunque esto no es posible en las primeras etapas de la infección. Los primeros signos de infección en la mayoría de los perros incluyen cojera limbular y picazón anal. Los huevos son ovalados o elípticos, miden 60 por 40 μm, son incoloros, no se tiñen de bilis y tienen una fina membrana hialina transparente . Cuando el gusano los libera en el intestino, el huevo contiene un óvulo no segmentado. Durante su paso por el intestino, el óvulo se desarrolla y, por lo tanto, los huevos que se expulsan en las heces tienen un óvulo segmentado, generalmente con 4 a 8 blastómeros . Como los huevos de Ancylostoma y Necator (y la mayoría de las otras especies de anquilostomas) son indistinguibles, para identificar el género, deben cultivarse en el laboratorio para permitir que las larvas eclosionen. Si la muestra fecal se deja durante un día o más en condiciones tropicales, las larvas habrán eclosionado, por lo que es posible que los huevos ya no sean evidentes. En tal caso, es esencial distinguir los anquilostomas de las larvas de Strongyloides , ya que la infección con estos últimos tiene implicaciones más graves y requiere un manejo diferente. Las larvas de las dos especies de anquilostomas también se pueden distinguir microscópicamente, aunque esto no se haría de manera rutinaria, sino generalmente con fines de investigación. Los gusanos adultos rara vez se ven (excepto por endoscopia, cirugía o autopsia), pero si se encuentran, permitirían la identificación definitiva de la especie. La clasificación se puede realizar en función de la longitud de la cavidad bucal, el espacio entre la abertura oral y el esófago: las larvas rabditoformes de anquilostomas tienen cavidades bucales largas, mientras que las larvas rabditoformes de Strongyloides tienen cavidades bucales cortas. [11]
Las investigaciones recientes se han centrado en el desarrollo de herramientas basadas en ADN para el diagnóstico de infecciones, la identificación específica de anquilostomas y el análisis de la variabilidad genética dentro de las poblaciones de anquilostomas. [19] Debido a que los huevos de anquilostomas a menudo son indistinguibles de los huevos de otros parásitos, los ensayos de PCR podrían servir como un enfoque molecular para el diagnóstico preciso de anquilostomas en las heces. [19] [20]
Prevención
Las larvas infectantes se desarrollan y sobreviven en un entorno de tierra húmeda, especialmente en suelos arenosos y arcillosos. No pueden sobrevivir en arcilla o lodo. Las principales precauciones que se deben tomar son las dictadas por las buenas conductas de higiene :
- No defecar al aire libre , sino en los sanitarios .
- No utilice excrementos humanos no tratados ni aguas residuales sin tratar como fertilizantes en la agricultura.
- No camine descalzo en áreas infectadas.
- Desparasitar perros y gatos domésticos. Los anquilostomas caninos y felinos rara vez se desarrollan hasta la edad adulta en humanos. Ancylostoma caninum , el anquilostoma canino común, ocasionalmente se desarrolla hasta convertirse en un adulto y causar enteritis eosinofílica en personas, pero sus larvas invasivas pueden causar una erupción cutánea con picazón llamada larva migratoria cutánea .
La moxidectina está disponible en los Estados Unidos como solución tópica ( imidacloprid + moxidectina) para perros y gatos. Utiliza moxidectina para el control y la prevención de lombrices intestinales, anquilostomas, dirofilariosis y tricocéfalos .
.jpg/440px-Medical_Civic_Action_Program_in_Shinile_Woreda,_Ethiopia,_2010_(5120478292).jpg)
Niños
La mayoría de estas preocupaciones de salud pública se han centrado en los niños infectados por anquilostomas. Este enfoque en los niños se debe en gran medida a la gran cantidad de evidencia que ha demostrado fuertes asociaciones entre la infección por anquilostomas y el deterioro del aprendizaje, el aumento de las ausencias escolares y la disminución de la productividad económica futura. [12] En 2001, la 54ª Asamblea Mundial de la Salud aprobó una resolución que exigía a los Estados miembros que alcanzaran un objetivo mínimo de desparasitación regular de al menos el 75% de todos los niños en edad escolar en riesgo para el año 2010. [21] Una publicación de la Organización Mundial de la Salud de 2008 informó sobre estos esfuerzos para tratar a los niños en edad escolar en riesgo. Algunas de las estadísticas interesantes fueron las siguientes: 1) solo 9 de los 130 países endémicos pudieron alcanzar la meta del 75%; y 2) menos de 77 millones de niños en edad escolar (del total de 878 millones en riesgo) fueron alcanzados, lo que significa que solo el 8,78% de los niños en edad escolar están siendo tratados por infección por anquilostomas. [22]
Desparasitación masiva en escuelas
Los programas de desparasitación masiva en las escuelas han sido la estrategia más popular para abordar el problema de la infección por anquilostomas en los niños. Los programas en las escuelas son sumamente rentables, ya que las escuelas ya cuentan con una infraestructura disponible, extensa y sostenida, con una fuerza laboral calificada que tiene una relación estrecha con la comunidad. [21] Con poca capacitación por parte de un sistema de salud local, los maestros pueden administrar fácilmente los medicamentos, que a menudo cuestan menos de US$0,50 por niño por año. [23]
Recientemente, muchas personas han comenzado a cuestionar si los programas escolares son necesariamente el enfoque más eficaz. Una preocupación importante con los programas escolares es que a menudo no llegan a los niños que no asisten a la escuela, ignorando así a un gran número de niños en riesgo. Un estudio de 2008 realizado por Massa et al. continuó el debate sobre los programas escolares. Examinaron los efectos de los tratamientos dirigidos por la comunidad frente a los tratamientos escolares en la región de Tanga en Tanzania. Una conclusión importante fue que la intensidad media de la infección por anquilostomas fue significativamente menor en las aldeas que emplearon el enfoque de tratamiento dirigido por la comunidad que en el enfoque basado en la escuela. El modelo de tratamiento dirigido por la comunidad utilizado en este estudio específico permitió a los aldeanos tomar el control del tratamiento del niño al hacer que los aldeanos seleccionaran a sus propios distribuidores comunitarios para administrar los medicamentos antihelmínticos. Además, los aldeanos organizaron e implementaron sus propios métodos para distribuir los medicamentos a todos los niños. [24] Los resultados positivos asociados con este nuevo modelo resaltan la necesidad de una participación comunitaria a gran escala en las campañas de desparasitación. [ cita requerida ]
Educación en salud pública
Muchos programas de desparasitación masiva también combinan sus esfuerzos con una educación de salud pública. Estos programas de educación de salud a menudo enfatizan técnicas preventivas importantes como: lavarse las manos antes de comer y mantenerse alejado del agua o áreas contaminadas por heces humanas. Estos programas también pueden enfatizar que se deben usar zapatos, sin embargo, estos conllevan sus propios riesgos para la salud y pueden no ser efectivos. [25] Los patrones de uso de zapatos en pueblos y ciudades de todo el mundo están determinados por creencias culturales y los niveles de educación dentro de esa sociedad. El uso de zapatos evitará la entrada de infecciones por anquilostomas de los suelos circundantes a las regiones sensibles de la piel; como las áreas entre los dedos de los pies. [26]
Saneamiento
Ejemplos históricos, como las campañas contra la anquilostomiasis en Mississippi y Florida de 1943 a 1947, han demostrado que la causa principal de la infección por anquilostomas es el saneamiento deficiente, que puede solucionarse mediante la construcción y el mantenimiento de retretes . Pero, si bien estas pueden parecer tareas sencillas, plantean importantes desafíos de salud pública. La mayoría de las poblaciones infectadas provienen de zonas pobres con un saneamiento muy deficiente. Por lo tanto, es muy probable que los niños en riesgo no tengan acceso a agua limpia para lavarse las manos y vivan en entornos sin una infraestructura de saneamiento adecuada. Por lo tanto, la educación para la salud debe abordar medidas preventivas de maneras que sean factibles y sostenibles en el contexto de entornos con recursos limitados. [ cita requerida ]
Enfoques integrados
La evaluación de numerosas intervenciones de salud pública ha demostrado en general que la mejora de cada componente individual que normalmente se atribuye a la pobreza (por ejemplo, el saneamiento, la educación sanitaria y el estado nutricional subyacente) a menudo tiene un impacto mínimo en la transmisión. Por ejemplo, un estudio encontró que la introducción de letrinas en una comunidad con recursos limitados solo redujo la prevalencia de la infección por anquilostomas en un cuatro por ciento. [27] Sin embargo, otro estudio en Salvador, Brasil, encontró que la mejora del drenaje y el alcantarillado tuvo un impacto significativo en la prevalencia de la infección por anquilostomas, pero ningún impacto en la intensidad de la infección por anquilostomas. [28] Esto parece sugerir que el control ambiental por sí solo tiene un efecto limitado pero incompleto en la transmisión de anquilostomas. Por lo tanto, es imperativo que se realicen más investigaciones para comprender la eficacia y la sostenibilidad de los programas integrados que combinan numerosos métodos preventivos, incluida la educación, el saneamiento y el tratamiento.
Tratamiento
Medicamentos antihelmínticos
El tratamiento más común para los anquilostomas son los benzimidazoles , específicamente albendazol y mebendazol . Los BZA matan a los gusanos adultos al unirse a la β- tubulina del nematodo y posteriormente inhibir la polimerización de microtúbulos dentro del parásito. [14] En ciertas circunstancias, se pueden utilizar levamisol y pamoato de pirantel . [12] Una revisión de 2008 encontró que la eficacia de los tratamientos de dosis única para las infecciones por anquilostomas fue la siguiente: 72% para albendazol, 15% para mebendazol y 31% para pamoato de pirantel. [29] Esto corrobora las afirmaciones anteriores de que el albendazol es mucho más eficaz que el mebendazol para las infecciones por anquilostomas. También es de destacar que la Organización Mundial de la Salud recomienda el tratamiento antihelmíntico en mujeres embarazadas después del primer trimestre. [14] También se recomienda que si el paciente también tiene anemia, se administre sulfato ferroso (200 mg) tres veces al día al mismo tiempo que el tratamiento antihelmíntico; esto debe continuarse hasta que los valores de hemoglobina vuelvan a la normalidad, lo que podría tardar hasta 3 meses. [11]
La infección por anquilostomas se puede tratar con crioterapia local cuando el anquilostoma todavía está en la piel. [30]
El albendazol es eficaz tanto en la fase intestinal como durante la etapa en la que el parásito todavía está migrando bajo la piel. [30]
En caso de anemia, la suplementación con hierro puede aliviar los síntomas de la anemia ferropénica . Sin embargo, a medida que se restablecen los niveles de glóbulos rojos, puede aparecer una escasez de otros elementos esenciales, como el ácido fólico o la vitamina B12 , por lo que también se pueden suplementar.
Durante la década de 1910, los tratamientos comunes para la anquilostomiasis incluían timol , 2-naftol , cloroformo , gasolina y aceite de eucalipto . [31] En la década de 1940, el tratamiento de elección utilizaba tetracloroetileno , [32] administrado en dosis de 3 a 4 cc en ayunas, seguido de 30 a 45 g de sulfato de sodio . Se informó que el tetracloroetileno tenía una tasa de curación del 80 por ciento para las infecciones por Necator, pero del 25 por ciento en las infecciones por Ancylostoma, y a menudo producía una intoxicación leve en el paciente.
Reinfección y resistencia a los fármacos
Otros temas importantes relacionados con el tratamiento de la anquilostomiasis son la reinfección y la resistencia a los medicamentos. Se ha demostrado que la reinfección después del tratamiento puede ser extremadamente alta. Algunos estudios incluso muestran que el 80% de las tasas de infección por anquilostomiasis previas al tratamiento se pueden observar en las comunidades tratadas en un plazo de 30 a 36 meses. [14] Si bien puede producirse una reinfección, se sigue recomendando que se realicen tratamientos regulares, ya que esto minimizará la aparición de resultados crónicos. También existe una creciente preocupación por el problema de la resistencia a los medicamentos. La resistencia a los medicamentos ha aparecido en antihelmínticos de primera línea utilizados para los nematodos del ganado. En general, los nematodos humanos tienen menos probabilidades de desarrollar resistencia debido a los tiempos de reproducción más prolongados, el tratamiento menos frecuente y el tratamiento más específico. No obstante, la comunidad mundial debe tener cuidado de mantener la eficacia de los antihelmínticos actuales, ya que no hay nuevos medicamentos antihelmínticos en la última etapa de desarrollo. [14]
Epidemiología
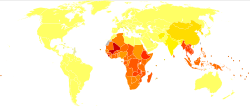
Se estima que entre 576 y 740 millones de personas están infectadas con anquilostomas. [33] [14] De estos individuos infectados, alrededor de 80 millones están gravemente afectados. [19] La principal causa de infección por anquilostomas es N. americanus que se encuentra en las Américas, África subsahariana y Asia. [12] A. duodenale se encuentra en entornos focales más dispersos, a saber, Europa y el Mediterráneo. La mayoría de los individuos infectados se concentran en África subsahariana y Asia Oriental/las Islas del Pacífico, con estimaciones de cada región de 198 millones y 149 millones de individuos infectados, respectivamente. Otras regiones afectadas incluyen: Asia meridional (50 millones), América Latina y el Caribe (50 millones), Asia meridional (59 millones), Oriente Medio/África del Norte (10 millones). [14] La mayoría de estos individuos infectados viven en áreas afectadas por la pobreza con saneamiento deficiente. La infección por anquilostomas se concentra más entre los más pobres del mundo que viven con menos de 2 dólares al día. [12]
Si bien la anquilostomiasis puede no ser una causa directa de mortalidad, sus efectos sobre la morbilidad exigen atención inmediata. Si se consideran los años de vida ajustados por discapacidad (AVAD), las enfermedades tropicales desatendidas, incluida la anquilostomiasis, se ubican junto con las enfermedades diarreicas, la cardiopatía isquémica , la malaria y la tuberculosis como uno de los problemas de salud más importantes del mundo en desarrollo.
Se ha estimado que se han perdido hasta 22,1 millones de AVAD debido a la infección por anquilostomas. Recientemente, ha habido un creciente interés por abordar los problemas de salud pública asociados con la infección por anquilostomas. Por ejemplo, la Fundación Bill y Melinda Gates donó recientemente 34 millones de dólares estadounidenses para luchar contra las enfermedades tropicales desatendidas, incluida la infección por anquilostomas. [34] El ex presidente de los EE. UU. Clinton también anunció un megacompromiso en la Reunión Anual de 2008 de la Iniciativa Global Clinton (CGI) para desparasitar a 10 millones de niños. [35]
Muchas de las cifras relativas a la prevalencia de la infección por anquilostomas son estimaciones, ya que actualmente no existe ningún mecanismo de vigilancia internacional para determinar la prevalencia y la distribución mundial. [12] Algunas tasas de prevalencia se han medido mediante datos de encuestas en regiones endémicas de todo el mundo. A continuación se presentan algunos de los hallazgos más recientes sobre las tasas de prevalencia en regiones endémicas de anquilostomas.
Darjeeling , distrito de Hooghly , Bengala Occidental , India (Pal et al. 2007) [36]
- Tasa de infección del 43% predominantemente por N. americanus, aunque con alguna infección por A. duodenale.
- Tanto la carga de infección por anquilostomas como el grado de anemia se encuentran en el rango leve.
Pueblo de Xiulongkan, provincia de Hainan , China (Gandhi et al. 2001) [37]
- Tasa de infección del 60% predominantemente de N. americanus
- Las tendencias importantes observadas fueron que la prevalencia aumentó con la edad (una meseta de alrededor de 41 años) y las mujeres tuvieron tasas de prevalencia más altas que los hombres.
Hòa Bình , noroeste de Vietnam (Verle et al. 2003) [38]
- El 52% de un total de 526 hogares examinados están infectados
- No se pudo identificar la especie, pero estudios previos en Vietnam del Norte informaron que N. americanus estaba presente en más del 95% de las larvas de anquilostomas.
Minas Gerais , Brasil (Fleming et al. 2006) [39]
- Tasa de infección del 63% predominantemente de N. americanus
KwaZulu-Natal , Sudáfrica (Mabaso et al. 2004) [40]
- Las zonas del interior tenían una tasa de prevalencia del 9% de N. americanus.
- Las zonas de llanura costera tuvieron una tasa de prevalencia del 63% de N. americanus
Condado de Lowndes, Alabama , Estados Unidos [41] [42]
- Tasa de infección del 35% predominantemente de N. americanus
También se han producido avances tecnológicos que pueden facilitar un mapeo más preciso de la prevalencia de anquilostomas. Algunos investigadores han comenzado a utilizar sistemas de información geográfica (SIG) y teledetección (RS) para examinar la ecología y la epidemiología de los helmintos. Brooker et al. utilizaron esta tecnología para crear mapas de distribución de helmintos en el África subsahariana. Al relacionar los datos ambientales obtenidos por satélite con los datos de prevalencia de las encuestas realizadas en las escuelas, pudieron crear mapas de prevalencia detallados. El estudio se centró en una amplia gama de helmintos, pero se llegaron a conclusiones interesantes sobre los anquilostomas en particular. En comparación con otros helmintos, los anquilostomas pueden sobrevivir en condiciones mucho más cálidas y tuvieron una alta prevalencia en todo el extremo superior del rango térmico. [43]
Las herramientas de diagnóstico molecular mejoradas son otro avance tecnológico que podría ayudar a mejorar las estadísticas de prevalencia existentes. Las investigaciones recientes se han centrado en el desarrollo de una herramienta basada en el ADN que se pueda utilizar para el diagnóstico de la infección, la identificación específica de anquilostomas y el análisis de la variabilidad genética en las poblaciones de anquilostomas. Nuevamente, esto puede servir como una herramienta importante para diferentes medidas de salud pública contra la infección por anquilostomas. La mayoría de las investigaciones relacionadas con las herramientas de diagnóstico se centran ahora en la creación de un ensayo rápido y rentable para el diagnóstico específico de la infección por anquilostomas. Muchos tienen la esperanza de que su desarrollo pueda lograrse en los próximos cinco años. [ ¿Cuándo? ] [19]
Historia
Descubrimiento
Los síntomas que ahora se atribuyen a la anquilostomiasis aparecen en papiros del antiguo Egipto ( c. 1500 a. C. ), descritos como un trastorno caracterizado por anemia. Avicena , un médico persa del siglo XI, descubrió el gusano en varios de sus pacientes y lo relacionó con su enfermedad. En épocas posteriores, la afección fue notablemente frecuente en la industria minera de Inglaterra , Francia , Alemania , Bélgica , el norte de Queensland y otros lugares. [18]
El médico italiano Angelo Dubini fue el descubridor moderno del gusano en 1838 después de una autopsia de una campesina. Dubini publicó detalles en 1843 e identificó la especie como A. duodenale . [44] Trabajando en el sistema médico egipcio en 1852, el médico alemán Theodor Bilharz , basándose en el trabajo de su colega Wilhelm Griesinger , encontró estos gusanos durante las autopsias y fue un paso más allá al vincularlos con ocurrencias endémicas locales de clorosis , que probablemente se llamaría anemia por deficiencia de hierro en la actualidad.
Un gran avance se produjo 25 años después tras una epidemia de diarrea y anemia que tuvo lugar entre los trabajadores italianos empleados en el túnel ferroviario de San Gotardo . [18] En un artículo de 1880, los médicos Camillo Bozzolo , Edoardo Perroncito y Luigi Pagliani plantearon correctamente la hipótesis de que el anquilostoma estaba relacionado con el hecho de que los trabajadores tenían que defecar dentro del túnel de 15 km y que muchos llevaban zapatos gastados. [45] El entorno de trabajo a menudo contenía agua estancada, a veces hasta las rodillas, y las larvas eran capaces de sobrevivir varias semanas en el agua, lo que les permitía infectar a muchos de los trabajadores. En 1897, se estableció que la piel era la principal vía de infección y se aclaró el ciclo de vida biológico del anquilostoma.
Programas de erradicación
En 1899, el zoólogo estadounidense Charles Wardell Stiles identificó la anemia perniciosa progresiva observada en el sur de los Estados Unidos como causada por el anquilostoma A. duodenale . Las pruebas realizadas en la década de 1900 revelaron infestaciones muy graves en niños en edad escolar. En Puerto Rico , el Dr. Bailey K. Ashford, un médico del ejército de los EE. UU., organizó y llevó a cabo una campaña de tratamiento de parásitos, que curó aproximadamente a 300.000 personas (un tercio de la población puertorriqueña) y redujo la tasa de mortalidad por esta anemia en un 90 por ciento durante los años 1903-04.

El 26 de octubre de 1909, se organizó la Comisión Sanitaria Rockefeller para la Erradicación de la Anquilostomiasis como resultado de una donación de US$1 millón de John D. Rockefeller , Sr. El programa de cinco años fue un éxito notable y una gran contribución a la salud pública de los Estados Unidos, inculcando educación pública, medicación, trabajo de campo y departamentos de salud gubernamentales modernos en once estados del sur. [46] La exhibición de anquilostomas fue una parte destacada de la feria estatal de Mississippi de 1910.
La comisión encontró que un promedio del 40% de los niños en edad escolar estaban infectados con anquilostomas. Las áreas con niveles más altos de infección por anquilostomas antes del programa de erradicación experimentaron mayores aumentos en la matrícula escolar, la asistencia y la alfabetización después de la intervención. Los estudios econométricos han demostrado que este efecto no puede explicarse por una variedad de factores alternativos, incluidas las tendencias diferenciales entre áreas, los cambios en los precios de los cultivos, los cambios en ciertas políticas educativas y de salud y el efecto de la erradicación de la malaria. [47] No se encontraron resultados contemporáneos significativos para los adultos que deberían haberse beneficiado menos de la intervención debido a sus tasas de infección (anteriores) sustancialmente más bajas. El programa casi erradicó los anquilostomas y prosperaría después con nueva financiación como la División de Salud Internacional de la Fundación Rockefeller . [48]
La campaña de la Fundación Rockefeller contra la anquilostomiasis en México demostró cómo la ciencia y la política desempeñan un papel en el desarrollo de políticas de salud. Reunió a funcionarios gubernamentales, funcionarios de salud, trabajadores de salud pública, funcionarios de Rockefeller y la comunidad. Esta campaña se lanzó para erradicar la anquilostomiasis en México. Aunque la campaña no se centró en tratamientos a largo plazo, sí estableció los términos de la relación entre México y la Fundación Rockefeller. El conocimiento científico detrás de esta campaña ayudó a dar forma a las políticas de salud pública, mejoró la salud pública y construyó una relación sólida entre Estados Unidos y México. [49]
En la década de 1920, la erradicación de la anquilostomiasis llegó al Caribe y América Latina, donde se informó de una gran mortalidad entre personas de las Indias Occidentales hacia fines del siglo XVIII, así como a través de descripciones enviadas desde Brasil y varias otras regiones tropicales y subtropicales. [18]
Tratos
El tratamiento a principios del siglo XX se basaba en el uso de sal de Epsom para reducir la mucosidad protectora, seguido de timol para matar a los gusanos. [50] [31] En la década de 1940, el tetracloroetileno era el método principal. [32] No fue hasta mediados del siglo XX cuando se desarrollaron nuevos compuestos farmacológicos orgánicos. [51]
Investigación
Anemia en el embarazo
Se estima que una tercera parte de todas las mujeres embarazadas en los países en desarrollo están infectadas con anquilostomas, el 56% de todas las mujeres embarazadas en los países en desarrollo sufren anemia, el 20% de todas las muertes maternas están relacionadas directa o indirectamente con la anemia. Cifras como estas han llevado a un creciente interés en el tema de la anemia relacionada con anquilostomas durante el embarazo. [52] Con el entendimiento de que la infección crónica por anquilostomas a menudo puede conducir a anemia, muchas personas ahora se preguntan si el tratamiento de la anquilostoma podría producir un cambio en las tasas de anemia grave y, por lo tanto, también en la salud materna e infantil. La mayoría de las evidencias sugieren que la contribución de la anquilostoma a la anemia materna amerita que todas las mujeres en edad fértil que viven en áreas endémicas sean sometidas a un tratamiento antihelmíntico periódico. La Organización Mundial de la Salud incluso recomienda que las mujeres embarazadas infectadas sean tratadas después del primer trimestre. [14] Independientemente de estas sugerencias, solo Madagascar, Nepal y Sri Lanka han agregado la desparasitación a sus programas de atención prenatal. [53]
Esta falta de desparasitación de las mujeres embarazadas se explica por el hecho de que la mayoría de las personas aún temen que el tratamiento antihelmíntico resulte en resultados adversos en el nacimiento. Pero un estudio de 2006 realizado por Gyorkos et al. encontró que al comparar un grupo de mujeres embarazadas tratadas con mebendazol con un grupo de control con placebo, ambos ilustraron tasas bastante similares en resultados adversos en el nacimiento. El grupo tratado mostró un 5,6% de resultados adversos en el nacimiento, mientras que el grupo de control tuvo un 6,25% de resultados adversos en el nacimiento. [52] Además, Larocque et al. ilustraron que el tratamiento para la infección por anquilostomas en realidad condujo a resultados positivos en la salud del bebé. Este estudio concluyó que el tratamiento con mebendazol más suplementos de hierro durante la atención prenatal redujo significativamente la proporción de bebés de muy bajo peso al nacer en comparación con un grupo de control con placebo. [54] Los estudios hasta el momento han validado las recomendaciones para tratar a las mujeres embarazadas infectadas por la infección por anquilostomas durante el embarazo.
Una revisión concluyó que una dosis única de antihelmínticos (medicamentos contra los gusanos) administrada en el segundo trimestre del embarazo “puede reducir la anemia materna y la prevalencia de gusanos cuando se utiliza en entornos con alta prevalencia de helmintiasis materna”. [55]
Aún no se ha estudiado la intensidad de la infección por anquilostomas ni las especies de anquilostomas en relación con la anemia relacionada con la anquilostomiasis durante el embarazo. Además, se deben realizar más investigaciones en diferentes regiones del mundo para ver si persisten las tendencias observadas en los estudios realizados. [ cita requerida ]
Coinfección con malaria
La coinfección con anquilostomas y Plasmodium falciparum es común en África. [56] Aunque se desconocen las cifras exactas, los análisis preliminares estiman que hasta una cuarta parte de los escolares africanos (17,8–32,1 millones de niños de 5 a 14 años) pueden estar en riesgo coincidente de contraer tanto P. falciparum como anquilostomas. [57] Si bien las hipótesis originales afirmaban que la coinfección con múltiples parásitos afectaría la respuesta inmunitaria del huésped a un solo parásito y aumentaría la susceptibilidad a la enfermedad clínica, los estudios han arrojado resultados contrastantes. Por ejemplo, un estudio en Senegal mostró que el riesgo de infección clínica de malaria era mayor en niños infectados con helmintos en comparación con niños libres de helmintos, mientras que otros estudios no han logrado reproducir tales resultados, [58] e incluso entre los experimentos con ratones de laboratorio el efecto de los helmintos en la malaria es variable. [59]
Algunas hipótesis y estudios sugieren que las infecciones por helmintos pueden proteger contra la malaria cerebral debido a la posible modulación de las respuestas de las citocinas proinflamatorias y antiinflamatorias. [60] Además, se desconocen los mecanismos subyacentes a esta supuesta mayor susceptibilidad a la enfermedad. Por ejemplo, las infecciones por helmintos causan una respuesta inmunitaria potente y altamente polarizada caracterizada por un aumento de la producción de citocinas de tipo 2 de las células T auxiliares ( Th2 ) e inmunoglobulina E (IgE). [61] Sin embargo, se desconoce el efecto de dichas respuestas en la respuesta inmunitaria humana. Además, tanto la malaria como la infección por helmintos pueden causar anemia, pero el efecto de la coinfección y el posible aumento de la anemia son poco conocidos. [51]
Hipótesis de higiene y anquilostomiasis como terapia
La hipótesis de la higiene afirma que los bebés y los niños que no están expuestos a agentes infecciosos son más susceptibles a las enfermedades alérgicas a través de la modulación del desarrollo del sistema inmunológico. La teoría fue propuesta por primera vez por David P. Strachan, quien observó que la fiebre del heno y el eczema eran menos comunes en los niños que pertenecían a familias numerosas. [62] Desde entonces, los estudios han observado el efecto de los gusanos gastrointestinales en el desarrollo de alergias en el mundo en desarrollo. Por ejemplo, un estudio en Gambia encontró que la erradicación de los gusanos en algunas aldeas provocó un aumento de las reacciones cutáneas a las alergias entre los niños. [63]
Vacunas
Si bien la administración masiva anual o semestral de antihelmínticos es un aspecto fundamental de cualquier intervención de salud pública, muchos han comenzado a darse cuenta de lo insostenible que es debido a aspectos como la pobreza, las altas tasas de reinfección y la menor eficacia de los medicamentos con el uso repetido. Por lo tanto, la investigación actual se ha centrado en el desarrollo de una vacuna que pueda integrarse en los programas de control existentes. El objetivo del desarrollo de vacunas no es necesariamente crear una vacuna con inmunidad esterilizante o protección completa contra la inmunidad. Una vacuna que reduzca la probabilidad de que las personas vacunadas desarrollen infecciones graves y, por lo tanto, reduzca los niveles de sangre y nutrientes, aún podría tener un impacto significativo en la alta carga de enfermedad en todo el mundo.
La investigación actual se centra en dos etapas del desarrollo del gusano: la etapa larvaria y la etapa adulta. La investigación sobre antígenos larvarios se ha centrado en proteínas que son miembros de la superfamilia de proteínas relacionadas con la patogénesis , las proteínas secretadas por Ancylostoma . [64] Aunque se describieron por primera vez en Anyclostoma , estas proteínas también se han aislado con éxito del producto secretado de N. americanus . N. americanus ASP-2 (Na-ASP-2) es actualmente el principal candidato a vacuna contra anquilostomas en etapa larvaria. Ya se ha realizado un estudio aleatorizado, doble ciego y controlado con placebo; 36 adultos sanos sin antecedentes de infección por anquilostomas recibieron tres inyecciones intramusculares de tres concentraciones diferentes de Na-ASP-2 y se observaron durante seis meses después de la vacunación final. [65] La vacuna indujo respuestas inmunitarias celulares e IgG anti-Na-ASP-2 significativas. Además, fue segura y no produjo efectos secundarios debilitantes. La vacuna se encuentra ahora en un ensayo de fase uno; A los voluntarios adultos sanos con evidencia documentada de infección previa en Brasil se les está administrando la misma concentración de dosis en el mismo esquema utilizado en el estudio inicial. [64] Si este estudio tiene éxito, el siguiente paso sería realizar un ensayo de fase dos para evaluar la tasa e intensidad de la infección por anquilostomas entre las personas vacunadas. Debido a que la vacuna Na-ASP-2 solo se dirige a la etapa larvaria, es fundamental que todos los sujetos inscritos en el estudio sean tratados con medicamentos antihelmínticos para eliminar los gusanos adultos antes de la vacunación.
Los antígenos de anquilostomas adultos también han sido identificados como candidatos potenciales para vacunas. Cuando los gusanos adultos se adhieren a la mucosa intestinal del huésped humano, los eritrocitos se rompen en el tracto digestivo del gusano, lo que provoca la liberación de hemoglobina libre que posteriormente se degrada por una cascada proteolítica. Varias de estas proteínas que son responsables de esta cascada proteolítica también son esenciales para la nutrición y supervivencia del gusano. [66] Por lo tanto, una vacuna que pudiera inducir anticuerpos para estos antígenos podría interferir con la vía digestiva del anquilostoma y perjudicar la supervivencia del gusano. Se han identificado tres proteínas: la proteasa aspártica-hemoglobinasa APR-1, la proteasa cisteína-hemoglobinasa CP-2 y una glutatión S-transferasa. [67] [68] [69] La vacunación con APR-1 y CP-2 condujo a una reducción de la pérdida de sangre del huésped y del recuento de huevos fecales en perros. [67] [68] Con APR-1, la vacunación incluso condujo a una reducción de la carga de gusanos. [67] La investigación está actualmente bloqueada en el desarrollo de al menos uno de estos antígenos como proteína recombinante para probar en ensayos clínicos.
Terminología
El término "anquilostoma" se utiliza a veces para referirse a la infección por anquilostomas. [12] Un anquilostoma es un tipo de gusano parásito ( helminto ).
Véase también
Referencias
- ^ abcdefghi «CDC - Anquilostomas - Información general - Preguntas frecuentes (FAQ)». www.cdc.gov . 16 de diciembre de 2014. Archivado desde el original el 22 de abril de 2017 . Consultado el 22 de abril de 2017 .
- ^ ab "CDC - Anquilostoma - Enfermedad". www.cdc.gov . 10 de enero de 2013. Archivado desde el original el 23 de abril de 2017 . Consultado el 22 de abril de 2017 .
- ^ ab "CDC - Anquilostomas - Tratamiento". www.cdc.gov . 10 de enero de 2013. Archivado desde el original el 23 de abril de 2017 . Consultado el 22 de abril de 2017 .
- ^ ab "Incidencia, prevalencia y años vividos con discapacidad a nivel mundial, regional y nacional para 310 enfermedades y lesiones, 1990-2015: un análisis sistemático para el Estudio de la Carga Global de Enfermedades 2015". Lancet . 388 (10053): 1545–1602. 8 de octubre de 2016. doi :10.1016/S0140-6736(16)31678-6. PMC 5055577 . PMID 27733282.
- ^ Prevención, CDC - Centros para el Control y Prevención de Enfermedades. "CDC - Anquilostoma - Biología". www.cdc.gov . Archivado desde el original el 21 de junio de 2017 . Consultado el 21 de junio de 2017 .
- ^ "Esperanza de vida global, regional y nacional, mortalidad por todas las causas y mortalidad por causas específicas para 249 causas de muerte, 1980-2015: un análisis sistemático para el Estudio de la Carga Global de Enfermedades 2015". Lancet . 388 (10053): 1459–1544. 8 de octubre de 2016. doi :10.1016/s0140-6736(16)31012-1. PMC 5388903 . PMID 27733281.
- ^ "Enfermedades tropicales desatendidas". cdc.gov . 6 de junio de 2011. Archivado desde el original el 4 de diciembre de 2014 . Consultado el 28 de noviembre de 2014 .
- ^ James, William D.; Berger, Timothy G.; et al. (2006). Enfermedades de la piel de Andrews: dermatología clínica . Saunders Elsevier. págs. 435. ISBN 978-0-7216-2921-6.
- ^ "Anquilostomas". Centro para la Seguridad Alimentaria y la Salud Pública. Mayo de 2005. Universidad Estatal de Iowa
- ^ "CDC - Anquilostomas zoonóticos - Información general" www.cdc.gov . 25 de abril de 2019 . Consultado el 27 de diciembre de 2019 .
- ^ abcdefg Markell, Edward K.; John, David C.; Petri, William H. (2006). Parasitología médica de Markell y Voge (novena edición). St. Louis, Mo: Elsevier Saunders. ISBN 978-0-7216-4793-7.
- ^ abcdefghij Hotez PJ, Bethony J, Bottazzi ME, Brooker S, Buss P (marzo de 2005). "Anquilostoma: "La gran infección de la humanidad"". PLOS Med . 2 (3): e67. doi : 10.1371/journal.pmed.0020067 . PMC 1069663 . PMID 15783256.
- ^ "Hoja informativa de los CDC: anquilostomas" Archivado el 4 de septiembre de 2010 en Wayback Machine , consultado el 29 de septiembre de 2008
- ^ abcdefghi Bethony J, Brooker S, Albonico M, Geiger SM, Loukas A, Diemert D, Hotez PJ (mayo de 2006). "Infecciones por helmintos transmitidas por el suelo: ascariasis, tricuriasis y anquilostomiasis". Lancet . 367 (9521): 1521–32. doi :10.1016/S0140-6736(06)68653-4. PMID 16679166. S2CID 8425278.
- ^ Hawdon JM, Hotez PJ (octubre de 1996). "Anquilostoma: biología del desarrollo del proceso infeccioso". Curr. Opin. Genet. Dev . 6 (5): 618–23. doi : 10.1016/S0959-437X(96)80092-X . PMID: 8939719.
- ^ Stoll NR (agosto de 1962). "¿En qué situación nos encontramos hoy en día en lo que respecta a la anquilostomiasis endémica?". Exp. Parasitol . 12 (4): 241–52. doi :10.1016/0014-4894(62)90072-3. PMID 13917420.
- ^ Hotez PJ, Pritchard DI (1995). "Infección por anquilostomas". Scientific American . Vol. 272, núm. 6. págs. 68–74. doi :10.1038/scientificamerican0695-68. PMID 7761817.
- ^ abcde Una o más de las oraciones anteriores incorporan texto de una publicación que ahora es de dominio público : Chisholm, Hugh , ed. (1911). "Anquilostomiasis". Encyclopædia Britannica . Vol. 2 (11.ª ed.). Cambridge University Press. pág. 58.
- ^ abcd Gasser RB, Cantacessi C, Campbell BE (enero de 2009). "Herramientas de diagnóstico molecular mejoradas para anquilostomas humanos". Expert Rev. Mol. Diagn . 9 (1): 17–21. doi :10.1586/14737159.9.1.17. PMID 19099345. S2CID 32970805.
- ^ Yong TS, Lee JH, Sim S, Lee J, Min DY, Chai JY, Eom KS, Sohn WM, Lee SH, Rim HJ (marzo de 2007). "Diagnóstico diferencial de huevos de Trichostrongylus y anquilostomas mediante PCR utilizando la secuencia ITS-1". Korean J. Parasitol . 45 (1): 69–74. doi :10.3347/kjp.2007.45.1.69. PMC 2526333 . PMID 17374982.
- ^ ab "Desparasitación escolar". Panorama de la salud pública . Banco Mundial. 2003.
- ^ "Helmintiasis transmitida por el suelo". Wkly. Epidemiol. Rec . 83 (27/28): 237–252. 4 de julio de 2008. Archivado desde el original el 5 de agosto de 2012.
- ^ "¿Cómo funciona la desparasitación?" Desparasitar al mundo. <dewormtheworld.org Archivado el 8 de febrero de 2009 en Wayback Machine >
- ^ Massa K, Magnussen P, Sheshe A, Ntakamulenga R, Ndawi B, Olsen A (2009). "El efecto del enfoque de tratamiento dirigido por la comunidad frente al enfoque de tratamiento basado en la escuela sobre la prevalencia e intensidad de la esquistosomiasis y la geohelmintiasis entre los escolares de Tanzania". Trans. R. Soc. Trop. Med. Hyg . 103 (1): 31–37. doi :10.1016/j.trstmh.2008.07.009. PMID 18771789.
- ^ Howell, Daniel (2010). El libro de los pies descalzos: 50 grandes razones para quitarse los zapatos . Hunter House. ISBN 978-0897935548.
- ^ Birn y Solórzano 1999, págs.1200, 1205
- ^ Huttly SR (1990). "El impacto de las condiciones sanitarias inadecuadas en la salud de los países en desarrollo". Estadísticas sanitarias mundiales . 43 (3): 118–26. PMID 2146815.
- ^ Moraes LR, Cancio JA, Cairncross S (abril de 2004). "Impacto del drenaje y el alcantarillado en las infecciones por nematodos intestinales en áreas urbanas pobres de Salvador, Brasil". Trans. R. Soc. Trop. Med. Hyg . 98 (4): 197–204. doi :10.1016/S0035-9203(03)00043-9. PMID 15049458.
- ^ Keiser J, Utzinger J (abril de 2008). "Eficacia de los fármacos actuales contra las infecciones por helmintos transmitidos por el suelo: revisión sistemática y metanálisis". J. Am. Med. Assoc . 299 (16): 1937–48. doi :10.1001/jama.299.16.1937. PMID 18430913.
- ^ ab Albanese G, Venturi C, Galbiati G (2001). "Tratamiento de la larva migratoria cutánea (erupción progresiva): una comparación entre el albendazol y la terapia tradicional". Int. J. Dermatol . 40 (1): 67–71. doi :10.1046/j.1365-4362.2001.01103.x. PMID 11277961. S2CID 40314184.
- ^ ab Milton, Joseph Rosenau (1913). Medicina preventiva e higiene. D. Appleton. pág. 119.
- ^ ab "Aspectos clínicos y tratamiento de los parásitos intestinales más comunes en el hombre (TB-33)". Boletín técnico de la Administración de Veteranos 1946 y 1947. 10 : 1–14. 1948.
- ^ Fenwick A (marzo de 2012). "La carga mundial de enfermedades tropicales desatendidas". Salud pública . 126 (3): 233–36. doi :10.1016/j.puhe.2011.11.015. PMID 22325616.
- ^ "Red mundial de enfermedades tropicales desatendidas recibe 34 millones de dólares de la Fundación Gates: el BID lidera campaña para reducir en gran medida la carga de la mayoría de las enfermedades desatendidas para 2020 en América Latina y el Caribe". Comunicado de prensa. Red mundial de enfermedades tropicales desatendidas. 30 de enero de 2009.
- ^ "Desparasitar al mundo en la reunión anual de 2008 de la Iniciativa Global Clinton: ¡hasta 10 millones de niños se beneficiarán de la desparasitación!" Comunicado de prensa. Desparasitar al mundo, 2008.
- ^ Pal D, Chattopadhyay UK, Sengupta G (abril de 2007). "Un estudio sobre la prevalencia de la infección por anquilostomas en cuatro distritos de Bengala Occidental y su relación con la anemia". Indian J. Pathol. Microbiol . 50 (2): 449–52. PMID 17883107.
- ^ Gandhi NS, Jizhang C, Khoshnood K, Fuying X, Shanwen L, Yaoruo L, Bin Z, Haechou X, Chongjin T, Yan W, Wensen W, Dungxing H, Chong C, Shuhua X, Hawdon JM, Hotez PJ (agosto de 2001). "Epidemiología de las infecciones por anquilostomas Necator americanus en la aldea de Xiulongkan, provincia de Hainan, China: alta prevalencia e intensidad entre los residentes de mediana edad y ancianos". J. Parasitol . 87 (4): 739–43. doi :10.1645/0022-3395(2001)087[0739:EONAHI]2.0.CO;2. PMID 11534635. S2CID 28630527.
- ^ Verle P, Kongs A, De NV, Thieu NQ, Depraetere K, Kim HT, Dorny P (octubre de 2003). "Prevalencia de infecciones parasitarias intestinales en el norte de Vietnam". Trop. Med. Int. Salud . 8 (10): 961–64. doi : 10.1046/j.1365-3156.2003.01123.x . hdl : 1854/LU-212965 . PMID 14516309.
- ^ Fleming FM, Brooker S, Geiger SM, Caldas IR, Correa-Oliveira R, Hotez PJ, Bethony JM (enero de 2006). "Asociaciones sinérgicas entre anquilostomas y otras especies de helmintos en una comunidad rural de Brasil". Trop. Med. Int. Salud . 11 (1): 56–64. doi :10.1111/j.1365-3156.2005.01541.x. PMID 16398756. S2CID 20407618.
- ^ Mabaso ML, Appleton CC, Hughes JC, Gouws E (abril de 2004). "Transmisión de anquilostoma (Necator americanus) en áreas interiores de suelos arenosos en KwaZulu-Natal, Sudáfrica". Trop. Med. Int. Health . 9 (4): 471–76. doi : 10.1111/j.1365-3156.2004.01216.x . PMID 15078265.
- ^ McKenna, Megan L.; McAtee, Shannon; Hotez, Peter J.; Bryan, Patricia E.; Jeun, Rebecca; Bottazzi, Maria E.; Flowers, Catherine C.; Ward, Tabitha; Kraus, Jacob; Mejia, Rojelio (8 de noviembre de 2017). "Carga parasitaria intestinal humana y saneamiento deficiente en la Alabama rural". Revista estadounidense de medicina tropical e higiene . 97 (5): 1623–28. doi :10.4269/ajtmh.17-0396. PMC 5817782. PMID 29016326 .
- ^ Pilkington, Ed (5 de septiembre de 2017). "La anquilostomiasis, una enfermedad de extrema pobreza, está prosperando en el sur de Estados Unidos. ¿Por qué?". The Guardian . Consultado el 4 de diciembre de 2017 en www.TheGuardian.com.
- ^ Brooker S, Clements AC, Bundy DA (2006). "Epidemiología global, ecología y control de las infecciones por helmintos transmitidas por el suelo". En Hay SI, Graham A, Rogers DJ (eds.). Mapeo global de enfermedades infecciosas: métodos, ejemplos y aplicaciones emergentes . Avances en parasitología. Vol. 62. págs. 221–261. doi :10.1016/S0065-308X(05)62007-6. ISBN 978-0120317622. PMC 1976253 . PMID 16647972.
- ^ Dubini, Angelo (1843). "Nuovo verme intestinale umano (Agchylostoma duodenale), costituente un sesto genere dei Nematoidei proprii dell'uomo" [Nuevo gusano intestinal humano ( Ancylostoma duodenale ), que constituye un sexto género de nematodos humanos]. Annali Universali di Medicina (en italiano). 106 : 5-13.
- ^ Peduzzi R, Piffaretti JC (1983). "Ancylostoma duodenale y la anemia de San Gotardo". Hno. Medicina. J. (Clin. Res. Ed.) . 287 (6409): 1942–45. doi :10.1136/bmj.287.6409.1942. PMC 1550193 . PMID 6418279.
- ^ Page, Walter H. (septiembre de 1912). "La anquilostomiasis y la civilización: el trabajo de la Comisión Sanitaria Rockefeller en los estados del sur". El trabajo del mundo: una historia de nuestro tiempo . Vol. XXIV. págs. 504–18 . Consultado el 10 de julio de 2009 .
- ^ Bleakley H (2007). "Enfermedad y desarrollo: evidencia de la erradicación de la anquilostomiasis en el sur de Estados Unidos". QJ Econ . 122 (1): 73–117. doi :10.1162/qjec.121.1.73. PMC 3800113 . PMID 24146438.
- ^ Wallace, Barbara; Kirkley, James; McGuire, Thomas; Austin, Diane; Goldfield, David (abril de 2001). Assessment of Historical, Social, and Economic Impacts of OCS Development on Gulf Coast Communities (PDF) (Informe). Nueva Orleans: Bureau of Ocean Energy Management (BOEM), Minerals Management Service, Gulf of Mexico OCS Region, U.S. Department of the Interior. págs. 35–36. Archivado desde el original (PDF) el 12 de diciembre de 2017. Consultado el 11 de diciembre de 2017.
Los servicios de salud pública inadecuados y la falta general de conocimientos básicos de los ciudadanos sobre salud e higiene reflejaban el débil sistema de educación pública. Los problemas de salud, especialmente en los estados de la costa del Golfo donde las heladas llegaban tarde, si es que llegaban, abundaban en una época en la que los departamentos de salud pública activos en otras partes del país estaban erradicando enfermedades nutricionales y bacterianas. El anquilostoma, un parásito intestinal, infectó y debilitó crónicamente a una gran cantidad de sureños, tal vez hasta 2 millones. En la década de 1930, un estudio conjunto de la Junta Estatal de Salud de Florida, la Fundación Rockefeller y la Universidad de Vanderbilt concluyó que los adolescentes de 15 a 18 años de edad eran el grupo más afectado (44,7 por ciento) y que el Panhandle era la zona más gravemente afectada, con casi la mitad de sus adolescentes (49,2 por ciento) infestados de anquilostomas (Eberson, 1980; y Link, 1988). A principios del siglo XX, John D. Rockefeller consideró que la situación era tan terrible que creó y financió la Comisión Sanitaria Rockefeller para la Erradicación de la Anquilostomiasis.
- ^ Birn, Anne-Emanuelle; Solórzano, Armando (noviembre de 1999). "Paradojas de la política de salud pública: ciencia y política en la campaña de la Fundación Rockefeller contra la anquilostomiasis en México en la década de 1920". Soc. Sci. Med . 49 (9): 1197–1213. doi :10.1016/S0277-9536(99)00160-4. PMID 10501641.
- ^ Ferrell, John A. (1914). La escuela rural y la anquilostomiasis. Imprenta del Gobierno de los Estados Unidos.
- ^ ab Brooker, Simon; Bethony, Jeffrey; Hotez, Peter J. (1 de enero de 2004). "Infección por anquilostomas en humanos en el siglo XXI". Advances in Parasitology . 58 : 197–288. doi :10.1016/S0065-308X(04)58004-1. ISBN 978-0120317585. ISSN 0065-308X. PMC 2268732. PMID 15603764 .
- ^ ab Gyorkos TW, Larocque R, Casapia M, Gotuzzo E (septiembre de 2006). "Ausencia de riesgo de resultados adversos en el nacimiento después de la desparasitación en mujeres embarazadas". Pediatr. Infect. Dis. J. 25 ( 9): 791–4. doi :10.1097/01.inf.0000234068.25760.97. PMID 16940835. S2CID 8637824.
- ^ Brooker S, Hotez PJ, Bundy DA (2008). Raso G (ed.). "Anemia relacionada con anquilostomas en mujeres embarazadas: una revisión sistemática". PLOS Negl. Trop. Dis . 2 (9): e291. doi : 10.1371/journal.pntd.0000291 . PMC 2553481. PMID 18820740 .
- ^ Larocque R, Casapia M, Gotuzzo E, MacLean JD, Soto JC, Rahme E, Gyorkos TW (octubre de 2006). "Un ensayo controlado aleatorio doble ciego de mebendazol prenatal para reducir el bajo peso al nacer en un área endémica de anquilostomas en Perú". Trop. Med. Int. Salud . 11 (10): 1485–95. doi : 10.1111/j.1365-3156.2006.01706.x . PMID 17002722. S2CID 46261382.
- ^ Salam, Rehana A.; Das, Jai K.; Bhutta, Zulfiqar A. (17 de mayo de 2021). "Efecto de la desparasitación masiva con antihelmínticos para helmintos transmitidos por el contacto con el suelo durante el embarazo". Base de Datos Cochrane de Revisiones Sistemáticas . 2021 (5): CD005547. doi :10.1002/14651858.CD005547.pub4. ISSN 1469-493X. PMC 8127571 . PMID 33998661.
- ^ Brooker S, Akhwale W, Pullan R, Estambale B, Clarke SE, Snow RW, Hotez PJ (diciembre de 2007). "Epidemiología de la coinfección por Plasmodium y helmintos en África: poblaciones en riesgo, posible impacto en la anemia y perspectivas de combinar el control". Am. J. Trop. Med. Hyg . 77 (6 Suppl): 88–98. doi :10.4269/ajtmh.2007.77.88. PMC 2637949. PMID 18165479 .
- ^ Brooker S, Clements AC, Hotez PJ, Hay SI, Tatem AJ, Bundy DA, Snow RW (2006). "La codistribución de Plasmodium falciparum y anquilostomas entre escolares africanos". Malar. J. 5 : 99. doi : 10.1186/1475-2875-5-99 . PMC 1635726. PMID 17083720 .
- ^ Spiegel A, Tall A, Raphenon G, Trape JF, Druilhe P (2003). "Aumento de la frecuencia de ataques de malaria en sujetos coinfectados por gusanos intestinales y malaria por Plasmodium falciparum ". Trans. R. Soc. Trop. Med. Hyg . 97 (2): 198–9. doi :10.1016/S0035-9203(03)90117-9. PMID 14584377.
- ^ Knowles SC (agosto de 2011). "El efecto de la coinfección por helmintos en la malaria en ratones". Int. J. Parasitol . 41 (10): 1041–51. doi :10.1016/j.ijpara.2011.05.009. PMID 21777589.
- ^ Mwangi TW, Bethony JM, Brooker S (octubre de 2006). "Interacciones entre malaria y helmintos en humanos: un punto de vista epidemiológico". Ann. Trop. Med. Parasitol . 100 (7): 551–70. doi :10.1179/136485906X118468. PMC 1858631 . PMID 16989681.
- ^ Hartgers FC, Yazdanbakhsh M (octubre de 2006). "Co-infección de helmintos y malaria: modulación de las respuestas inmunitarias a la malaria". Parasite Immunol . 28 (10): 497–506. doi :10.1111/j.1365-3024.2006.00901.x. PMID 16965285. S2CID 20956686.
- ^ Strachan DP (noviembre de 1989). "Fiebre del heno, higiene y tamaño del hogar". BMJ . 299 (6710): 1259–60. doi :10.1136/bmj.299.6710.1259. PMC 1838109 . PMID 2513902.
- ^ Cooper PJ (2004). "Gusanos intestinales y alergia humana". Parasite Immunol . 26 (11–12): 455–67. doi :10.1111/j.0141-9838.2004.00728.x. PMID 15771681. S2CID 23348293.
- ^ ab Diemert, David J.; Bethony, Jeffrey M.; Hotez, Peter J. (15 de enero de 2008). "Vacunas contra el anquilostoma". Clin. Infect. Dis. 46 (2): 282–8. doi : 10.1086/524070 . ISSN 1058-4838. JSTOR 40306890. PMID 18171264.
- ^ Bethony JM, Simon G, Diemert DJ, Parenti D, Desrosiers A, Schuck S, Fujiwara R, Santiago H, Hotez PJ (mayo de 2008). "Ensayo aleatorizado, controlado con placebo y doble ciego de la vacuna contra el anquilostoma Na-ASP-2 en adultos no expuestos". Vaccine . 26 (19): 2408–17. doi :10.1016/j.vaccine.2008.02.049. PMID 18396361.
- ^ Williamson AL, Lecchi P, Turk BE, Choe Y, Hotez PJ, McKerrow JH, Cantley LC, Sajid M, Craik CS, Loukas A (agosto de 2004). "Una cascada multienzimática de proteólisis de hemoglobina en el intestino de anquilostomas hematófagos". J. Biol. Chem . 279 (34): 35950–7. doi : 10.1074/jbc.M405842200 . PMID 15199048.
- ^ abc Loukas A, Bethony JM, Mendez S, Fujiwara RT, Goud GN, Ranjit N, Zhan B, Jones K, Bottazzi ME, Hotez PJ (octubre de 2005). "La vacunación con hemoglobinasa aspártica recombinante reduce la carga parasitaria y la pérdida de sangre después de una infección por anquilostomas en perros". PLOS Med . 2 (10): e295. doi : 10.1371/journal.pmed.0020295 . PMC 1240050 . PMID 16231975.
- ^ ab Loukas, Alex; Bethony, Jeffrey M.; Williamson, Angela L.; Goud, Gaddam N.; Mendez, Susana; Zhan, Bin; Hawdon, John M.; Bottazzi, Maria Elena; Brindley, Paul J.; Hotez, Peter J. (15 de mayo de 2004). "La vacunación de perros con una proteasa de cisteína recombinante del intestino de anquilostomas caninos disminuye la fecundidad y el crecimiento de los gusanos". J. Infect. Dis. 189 (10): 1952–61. doi : 10.1086/386346 . ISSN 0022-1899. JSTOR 30077095. PMID 15122534.
- ^ Zhan B, Liu S, Perally S, Xue J, Fujiwara R, Brophy P, Xiao S, Liu Y, Feng J, Williamson A, Wang Y, Bueno LL, Mendez S, Goud G, Bethony JM, Hawdon JM, Loukas A, Jones K, Hotez PJ (octubre de 2005). "Caracterización bioquímica y potencial vacunal de una glutatión transferasa de unión al hemo del anquilostoma adulto Ancylostoma caninum". Infect. Inmun . 73 (10): 6903–11. doi :10.1128 / IAI.73.10.6903-6911.2005. PMC 1230892. PMID 16177370.
Enlaces externos
- Imágenes del ciclo de vida del anquilostoma del Departamento de Enfermedades Parasitarias de los CDC
- Centros para el Control y la Prevención de Enfermedades
- Anquilostoma canino (Ancylostoma caninum) en MetaPathogen: datos, ciclo de vida, referencias
- Anquilostomas humanos (Ancylostoma duodenale y Necator americanus) en MetaPathogen: datos, ciclo de vida, referencias


