Recristalización (química)
Este artículo necesita citas adicionales para su verificación . ( octubre de 2009 ) |
En química , la recristalización es una técnica que se utiliza para purificar sustancias químicas. Al disolver una mezcla de un compuesto e impurezas en un disolvente adecuado, se puede eliminar el compuesto o las impurezas deseadas de la solución, dejando atrás el resto. El nombre se origina a partir de los cristales que se forman a menudo cuando el compuesto precipita. Alternativamente, la recristalización puede referirse al crecimiento natural de cristales de hielo más grandes a expensas de los más pequeños.
Química
En química , la recristalización [1] : 127–132 es un procedimiento para purificar compuestos . La situación más típica es que un "compuesto A" deseado esté contaminado por una pequeña cantidad de "impureza B". Existen varios métodos posibles de purificación (ver Proceso de separación ), siendo la recristalización uno de ellos. También existen diferentes técnicas de recristalización que se pueden utilizar, como:
Recristalización con un solo disolvente
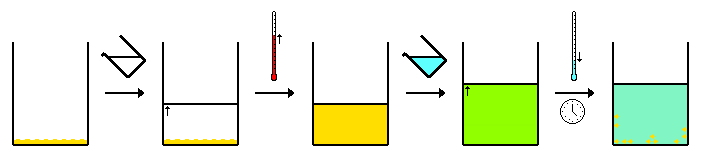
Por lo general, la mezcla de "compuesto A" e "impureza B" se disuelve en la menor cantidad de disolvente caliente posible para disolver por completo la mezcla, formando así una solución saturada . Luego, se deja enfriar la solución. A medida que la solución se enfría, la solubilidad de los compuestos en la solución disminuye. Esto hace que el compuesto deseado se desprenda (recristalice) de la solución. Cuanto más lenta sea la velocidad de enfriamiento, más grandes serán los cristales que se formen.


En una situación ideal, el producto de solubilidad de la impureza, B, no se excede a ninguna temperatura. En ese caso, los cristales sólidos consistirán en A puro y todas las impurezas permanecerán en la solución. Los cristales sólidos se recogen por filtración y el filtrado se descarta. Si se excede el producto de solubilidad de la impureza, algunas de las impurezas coprecipitarán. Sin embargo, debido a la concentración relativamente baja de la impureza, su concentración en los cristales precipitados será menor que su concentración en el sólido original. La recristalización repetida dará como resultado un precipitado cristalino aún más puro. La pureza se verifica después de cada recristalización midiendo el punto de fusión, ya que las impurezas reducen el punto de fusión . La espectroscopia RMN también se puede utilizar para verificar el nivel de impureza. La recristalización repetida da como resultado cierta pérdida de material debido a la solubilidad no nula del compuesto A.
El proceso de cristalización requiere un paso de iniciación, como la adición de un cristal "semilla". En el laboratorio, un minúsculo fragmento de vidrio, producido al raspar el costado del recipiente de recristalización de vidrio, puede proporcionar el núcleo sobre el cual pueden crecer los cristales. El éxito de la recristalización depende de encontrar el solvente adecuado. Esto suele ser una combinación de predicción/experiencia y ensayo/error. Los compuestos deben ser más solubles a temperaturas más altas que a temperaturas más bajas. Cualquier impureza insoluble se elimina mediante la técnica de filtración en caliente .
Recristalización con múltiples disolventes
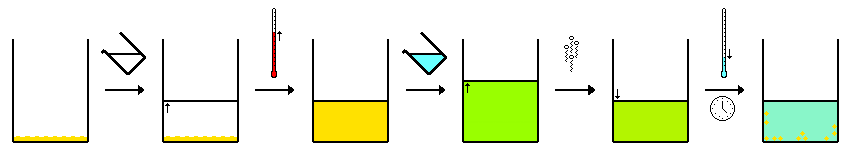
Este método es el mismo que el anterior, pero se utilizan dos (o más) disolventes. [1] Esto depende de que tanto el "compuesto A" como la "impureza B" sean solubles en un primer disolvente. Se añade lentamente un segundo disolvente. Tanto el "compuesto A" como la "impureza B" serán insolubles en este disolvente y precipitarán, mientras que el otro, el "compuesto A" o la "impureza B", permanecerá en solución. Por lo tanto, la proporción del primer y el segundo disolvente es crítica. Normalmente, el segundo disolvente se añade lentamente hasta que uno de los compuestos empieza a cristalizar en la solución y luego se enfría la solución. No se requiere calentamiento para esta técnica, pero se puede utilizar.
Se puede utilizar el método inverso, en el que una mezcla de disolventes disuelve tanto A como B. A continuación, uno de los disolventes se elimina por destilación o mediante la aplicación de vacío. Esto produce un cambio en las proporciones del disolvente, lo que hace que precipite el "compuesto A" o la "impureza B".
Filtración-recristalización en caliente
Filtración en caliente [1] : 74 se puede utilizar para separar el "compuesto A" tanto de la "impureza B" como de una "materia insoluble C". Esta técnica normalmente utiliza un sistema de un solo disolvente como se describió anteriormente. Cuando tanto el "compuesto A" como la "impureza B" se disuelven en la cantidad mínima de disolvente caliente, la solución se filtra para eliminar la "materia insoluble C". Esta materia puede ser cualquier cosa, desde un tercer compuesto de impureza hasta fragmentos de vidrio roto. Para que el procedimiento sea exitoso, uno debe asegurarse de que el aparato de filtración esté caliente para evitar que los compuestos disueltos cristalicen de la solución durante la filtración, formando así cristales en el papel de filtro o en el embudo.
Una forma de lograrlo es calentar un matraz cónico que contenga una pequeña cantidad de disolvente limpio en una placa calefactora. Se coloca un embudo de filtración sobre la boca y los vapores calientes del disolvente mantienen el vástago caliente. También se pueden utilizar embudos de filtración con camisa. El papel de filtro es preferiblemente acanalado, en lugar de doblado en cuatro; esto permite una filtración más rápida, por lo que hay menos posibilidades de que el compuesto deseado se enfríe y cristalice a partir de la solución.
A menudo es más sencillo realizar la filtración y la recristalización como dos pasos independientes y separados. Es decir, disolver el "compuesto A" y la "impureza B" en un disolvente adecuado a temperatura ambiente, filtrar (para eliminar el compuesto/vidrio insoluble), eliminar el disolvente y luego recristalizar utilizando cualquiera de los métodos enumerados anteriormente.

Siembra
La cristalización requiere un paso de iniciación. Este puede ser espontáneo o puede realizarse añadiendo una pequeña cantidad del compuesto puro (un cristal semilla ) [1] a la solución saturada, o puede realizarse simplemente raspando la superficie del vidrio para crear una superficie de siembra para el crecimiento del cristal . Se cree que incluso las partículas de polvo pueden actuar como simples semillas.
Cristales monocristalinos perfectos (para análisis de rayos X)
El crecimiento de cristales para la cristalografía de rayos X puede ser difícil. Para el análisis de rayos X, se requieren cristales perfectos individuales. Por lo general, se utiliza una pequeña cantidad (5 a 100 mg) de un compuesto puro y se deja que los cristales crezcan muy lentamente. Se pueden utilizar varias técnicas para hacer crecer estos cristales perfectos:
- Evaporación lenta de un solo disolvente: normalmente, el compuesto se disuelve en un disolvente adecuado y se deja que este se evapore lentamente. Una vez que la solución está saturada, se pueden formar cristales.
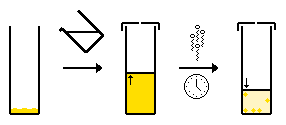
- Evaporación lenta de un sistema de múltiples solventes: lo mismo que antes, pero a medida que la composición del solvente cambia debido a la evaporación del solvente más volátil, el compuesto es más soluble en el solvente volátil y, por lo tanto, se vuelve cada vez más insoluble en la solución y cristaliza.

- Difusión lenta: similar a la anterior, pero se permite que un segundo disolvente se evapore de un recipiente a otro que contiene la solución del compuesto (difusión de gas). A medida que la composición del disolvente cambia debido a un aumento en la cantidad de disolvente que tiene gas difundido en la solución, el compuesto se vuelve cada vez más insoluble en la solución y cristaliza.
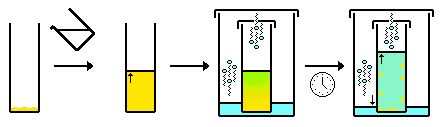
- Mezcla lenta/interfaz (que suele realizarse en un tubo de RMN ). Similar a la anterior, pero en lugar de que un disolvente se difunda en otro, los dos disolventes se mezclan (difunden) mediante difusión líquido-líquido. Normalmente, se coloca cuidadosamente un segundo disolvente sobre la solución que contiene el compuesto. Con el tiempo, las dos soluciones se mezclan. A medida que la composición del disolvente cambia debido a la difusión, el compuesto se vuelve cada vez más insoluble en la solución y cristaliza, normalmente en la interfase. Además, es mejor utilizar un disolvente más denso como capa inferior y/o un disolvente más caliente como capa superior porque esto da como resultado una mezcla más lenta de los disolventes.

- Se puede utilizar un equipo especializado en forma de "H" para realizar lo anterior, donde una de las líneas verticales de la "H" es un tubo que contiene una solución del compuesto, y la otra línea vertical de la "H" es un tubo que contiene un solvente en el cual el compuesto no es soluble, y la línea horizontal de la "H" es un tubo que une los dos tubos verticales, que también tiene un fino sinter de vidrio que restringe la mezcla de los dos solventes.

- Una vez obtenidos los cristales monocristalinos perfectos, se recomienda mantenerlos en un recipiente sellado con algo del líquido de cristalización para evitar que el cristal se "seque". Los cristales monocristalinos perfectos pueden contener disolvente de cristalización en la red cristalina . La pérdida de este disolvente interno de los cristales puede provocar la ruptura de la red cristalina y la conversión de los cristales en polvo.
Hielo
En el caso del hielo , la recristalización se refiere al crecimiento de cristales más grandes a expensas de los más pequeños. Se ha demostrado que algunas proteínas anticongelantes biológicas inhiben este proceso, y el efecto puede ser relevante en organismos tolerantes a la congelación. [2]
Véase también
- Tubo de Craig , un aparato para la recristalización a pequeña escala
- Estructura cristalina
- Cristalización
- Cristalización fraccionada (química)
- Crecimiento del pedestal calentado por láser
- Cristal semilla
- Cristal único
Referencias
- ^ abcd Harwood, Laurence M.; Moody, Christopher J. (1 de enero de 1990). Química orgánica experimental: principios y práctica (edición ilustrada). Blackwell Scientific Publications. ISBN 978-0-632-02016-4. LCCN 88007680. OCLC 18816225. OL 2032038M. Wikidata Q107313989 . Consultado el 22 de junio de 2021 a través de Internet Archive .
- ^ Kumar Verma, Ashok (2014). "Recristalización del hielo". Enciclopedia de nieve, hielo y glaciares . Serie Enciclopedia de Ciencias de la Tierra. pág. 932. doi :10.1007/978-90-481-2642-2_439. ISBN 978-90-481-2641-5.
Libros de referencia
- Laurence M. Harwood; Christopher J. Moody; Jonathan M. Percy (1999). Química orgánica experimental: escala estándar y microescalada. Wiley. ISBN 9780632048199.
- John Leonard; B. Lygo; Garry Procter (2 de junio de 1994). Química orgánica práctica avanzada. CRC Press. ISBN 9780748740710.

