Células linfoides innatas tipo 3
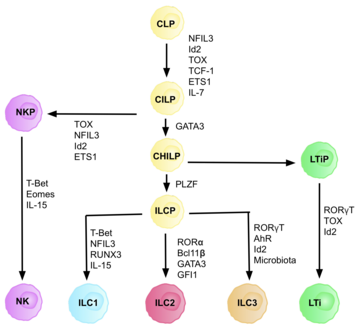
Las células linfoides innatas tipo 3 ( ILC3 ) son células inmunes del linaje linfoide que forman parte del sistema inmune innato . Estas células participan en mecanismos innatos en las membranas mucosas , contribuyendo a la homeostasis tisular, al mutualismo huésped-comensal y a la eliminación de patógenos. Forman parte de un grupo heterogéneo de células linfoides innatas , que tradicionalmente se divide en tres subconjuntos en función de su expresión de factores de transcripción maestros, así como de citocinas efectoras secretadas: ILC1, ILC2 e ILC3. [2]
Caracterización
La familia ILC 3 se puede dividir en dos subgrupos en función de su expresión de receptores de citotoxicidad natural (NCR), designados NCR + ILC3 y NCR − ILC3. Estos receptores se encuentran comúnmente en las células asesinas naturales y algunas subpoblaciones de células innatas y adaptativas. Están involucrados en la activación y actividad citotóxica de las células NK, incluida la lisis celular y la secreción de citocinas proinflamatorias. [3] Las células LTi (células inductoras de tejido linfoide) son una subpoblación importante en el desarrollo de órganos linfoides secundarios en la embriogénesis . Las células ILC3 producen citocinas típicas de la población de linfocitos auxiliares Th17 . El rasgo característico de ILC3 es la expresión del factor de transcripción RORγt , que es necesario para su desarrollo y expresión del receptor de quimiocinas CCR6 . [2] Este grupo de ILC produce IL-17 (especialmente IL-17A ) [4] e IL-22 . [5] Ambas citocinas pueden ser producidas por ILC 3 simultáneamente o por separado, siempre que cuando IL-22 se produzca sola sea una cuestión de NCR + ILC3. [5] Las ILC3 expresan IL-23R y la producción de IL-17 e IL-22 es estimulada por IL-23 e IL-1β . [6] Para ILC3, la expresión del factor de transcripción RORγt y parcialmente también el Ahr ( receptor de hidrocarburos arílicos ) es típica ya que las interacciones de estos dos factores de transcripción causan la acumulación de ILC 3 y la producción de IL-22 en los intestinos. [7] Existe una alta heterogeneidad en los marcadores de superficie de las células ILC3, con poblaciones específicas de tejido que pueden diferir en función según el contexto. [8] Las células ILC3 también tienen plasticidad fenotípica y se ha observado que adquieren un fenotipo similar al de ILC1 en determinadas circunstancias. [8] [9]
Función
Las ILC 3 representan una población heterogénea crucial para la defensa contra parásitos extracelulares y el mantenimiento de la homeostasis intestinal. [2] Participan en una defensa antimicrobiana eficaz a través de la producción de IL-17 e IL-22. El papel de la IL-22 en humanos y ratones es algo diferente. En el modelo murino, se encontró que la IL-22 desempeña un papel en la mejora del curso de la enfermedad inflamatoria intestinal y la restauración epitelial en la pérdida de la barrera protectora de mucina en el intestino grueso . [10] [11] Sin embargo, en humanos con enfermedad inflamatoria intestinal, la IL-22 tiene un efecto sobre la patología de la enfermedad. [12] La IL-22 es una citocina importante para mantener la homeostasis intestinal. La acción de la IL-22 ayuda a mejorar la defensa de la superficie de la mucosa intestinal al debilitar la capa de mucina [11] y su capacidad para producir agentes antimicrobianos, como las β-defensinas , es un mecanismo poderoso que ayuda a mantener la homeostasis intestinal. [13] Se ha descrito un aumento de los niveles de IL-22 junto con una mayor expresión de β-defensinas en enfermedades inflamatorias de la piel como la psoriasis . La IL-22, así como la IL-17, podrían estar implicadas en el desarrollo de estas enfermedades de la piel, ya que en humanos sin estos problemas no se registró la expresión de IL-22. [14] Los efectos de IL-17 e IL-22 pueden complementarse entre sí y estimular una mayor cantidad de péptidos antimicrobianos en el sitio de acción. [13] Al igual que las ILC2, las ILC 3 pueden expresar MHC II y apropiarse de la función de las células presentadoras de antígenos. [15] Sin embargo, las ILC carecen de los receptores coestimuladores que son necesarios para la activación e iniciación adecuadas de la respuesta inmune. Las ILC, por el contrario, pueden poner a los linfocitos T colaboradores en estado de anergia . En el caso de las ILC 3, la capacidad de expresar MHC II aparentemente sirve para mantener la tolerancia a las bacterias comensales en el intestino. Suprimen la respuesta de los linfocitos T CD4 + a bacterias intestinales inocuas y beneficiosas. Si no se mantiene esta tolerancia, puede haber un desarrollo de condiciones patológicas indeseables. [15] Por otro lado, la acción de IL-23 o IL-17 no siempre es beneficiosa. Provoca algunas enfermedades autoinmunes como la esclerosis múltiple [16] o la artritis reumatoide . [17] La IL-17A se dirige específicamente a los queratinocitos.y es la principal citocina que causa la patogénesis de la psoriasis cutánea. [18] Además, IL-17A también se expresa en un grado cada vez mayor en pacientes con enfermedad inflamatoria intestinal. [19] La ILC 3 puede desempeñar un papel ya en el entorno prenatal de la resistencia del cuerpo a las infecciones. Las células LTi son importantes en el origen y desarrollo de los órganos linfoides secundarios. Se ha descubierto que la diferenciación y la señalización de las células LTi dependen del ácido retinoico (un componente de la vitamina A). La absorción de ácido retinoico en la dieta por parte de la madre afecta directamente al desarrollo de las células LTi y al tamaño de los órganos linfoides secundarios del feto, lo que puede tener un efecto en su edad posterior. [20]
Células ILC3 en la enfermedad
Las células ILC3 actúan como centinelas del tracto gastrointestinal. Están involucradas en el mantenimiento de la homeostasis y la tolerancia a los comensales, pero también son importantes en la defensa contra patógenos invasores. [21] Su perfil transcripcional y de citocinas es muy similar al de las células Th17 y las ILC3 también pueden volverse patógenas en determinadas circunstancias, contribuyendo a la progresión de la enfermedad y la inflamación. Las ILC3 se han relacionado con la progresión de la enfermedad inflamatoria intestinal , que es un término general que describe las condiciones inflamatorias crónicas en el tracto gastrointestinal, que se han relacionado con una gran cantidad de factores que incluyen desregulación inmunológica y señales ambientales, así como predisposición genética. Los tipos más conocidos de EII son la enfermedad de Crohn y la colitis ulcerosa . Se han detectado mayores cantidades de células ILC3 en aislamientos colónicos de pacientes con EII. Se ha demostrado que las ILC3 NCR − son patógenas en el contexto de la EII, pero no las ILC3 NCR + . [22] [23] La contribución exacta de los subconjuntos de ILC3 a la progresión de la enfermedad no se entiende completamente. Algunos estudios muestran que los pacientes con enfermedad de Crohn tienen una cantidad reducida de ILC3 NCR + , que son productores clave de IL-22 . La IL-22 es fundamental para el mantenimiento y la integridad de la barrera epitelial intestinal, y su concentración reducida podría predisponer a alteraciones de las funciones de la barrera epitelial. [23] Sin embargo, otros estudios apuntan a una activación excesiva de ILC3 tanto en modelos de ratón de EII como en pacientes humanos, donde también se detectaron altos niveles de IL-22. [24] Se ha demostrado que los macrófagos intestinales aceleran la inflamación intestinal al inducir la producción de IL-22 por las ILC3 mucosas. [24] Se ha observado que las ILC3 se transdiferencian en células similares a ILC1 productoras de IFN-γ a través de la señalización de IL-23 e IL-12 en determinadas circunstancias, lo que conduce a una inflamación crónica. [24] En casos de invasión extensa de patógenos al epitelio intestinal, la sobreexpresión de IL-22 e IL-17 por ILC3 podría conducir a una afluencia excesiva de neutrófilos , mayor permeabilidad epitelial e inflamación. [24]
En los últimos años, las células ILC3 también se han relacionado con las respuestas inmunitarias al patógeno fúngico Candida albicans . [25] Este patógeno oportunista induce una respuesta inmunitaria Th17. Esto se ve respaldado por el hecho de que las células ILC3 reflejan el fenotipo de las células Th17, y también se ha observado recientemente que un subconjunto de células ILC3 tiene potentes propiedades de presentación de antígenos. [26] Las ILC3 contribuyen a la respuesta inmunitaria a este patógeno al mediar la respuesta inmunitaria a través de la secreción de citocinas como IL-17A . [25]
También se ha demostrado que desempeñan un papel en la salud pulmonar y la progresión de la enfermedad pulmonar, ya que el eje IL-17/IL-22 es crucial para el funcionamiento adecuado de los pulmones y su desequilibrio puede conducir a una patología. [27] El grupo ILC2 ha sido ampliamente estudiado en relación con la salud pulmonar, ya que la desregulación en las respuestas Th2 está relacionada con el asma y otras patologías. Este subconjunto también es importante para la reparación de tejidos. Sin embargo, las ILC3 son las poblaciones de células linfoides innatas más prevalentes en el tejido pulmonar. Equilibrar la homeostasis de la mucosa pulmonar y las respuestas inmunitarias adecuadas en las infecciones es crucial. Se cree que las células ILC3 desempeñan un papel importante en las infecciones pulmonares virales. En las infecciones por influenza , se han detectado altos niveles de IL-17A poco después de la infección, lo que resulta en una lesión pulmonar causada por un reclutamiento extenso de neutrófilos en el tejido. La IL-22 derivada de ILC3 contrarrestó estos efectos, protegiendo los tejidos del huésped. La deficiencia de IL-22 conduce a un daño tisular extenso. Por otra parte, los niveles insuficientes de IL-17A en la coinfección por influenza y bacterias dieron lugar a neumonía bacteriana secundaria . Las células ILC3 probablemente desempeñan un papel importante en el equilibrio de la respuesta inmunitaria y la protección contra infecciones secundarias en epitelios mucosos alterados, pero en casos de desregulación su actividad puede provocar daño tisular. [27]
En las infecciones bacterianas de los pulmones, las ILC3 son una de las poblaciones de origen de la IL-17, una citocina clave para la eliminación bacteriana. Se ha observado que los monocitos reclutados en los pulmones en respuesta al daño tisular y a los PAMP producen TNF , lo que aumenta la cantidad de ILC3 secretoras de IL-17, lo que posteriormente conduce a la afluencia de neutrófilos. La IL-22 derivada de las ILC3 promueve la proliferación epitelial y la producción de moléculas antimicrobianas. [27]
Las ILC3 también han sido implicadas en el desempeño de un papel importante en la esclerosis múltiple y el eje intestino-cerebro. La esclerosis múltiple es un trastorno autoinmune impulsado por células T autorreactivas , principalmente células Th1 y Th17. La alteración de la homeostasis intestinal se estudia en relación con el desarrollo de la esclerosis múltiple, ya que la homeostasis intestinal parece ser esencial para la prevención de esta enfermedad. Las células ILC3 han sido implicadas en el desempeño de un papel importante en la patogénesis de esta enfermedad, ya que son una población clave para la homeostasis intestinal y la tolerancia. Las células ILC3 expresan varios receptores de superficie para compuestos basados en la dieta y productos microbianos por igual, como los receptores SCFA . En pacientes con esclerosis múltiple o modelos de ratón de EAE , los niveles de SCFA en la materia fecal se reducen, lo que establece un posible vínculo entre el contenido del lumen intestinal y la homeostasis mediada por ILC3. Se ha demostrado que la administración oral de SCFA tiene efectos beneficiosos en la EAE al promover la actividad de Treg . [28]
Referencias
- ^ Vivier E, Artis D, Colonna M, Diefenbach A, Di Santo JP, Eberl G, et al. (Agosto de 2018). "Células linfoides innatas: 10 años después". Celúla . 174 (5): 1054-1066. doi : 10.1016/j.cell.2018.07.017 . PMID 30142344.
- ^ abc Spits H, Artis D, Colonna M, Diefenbach A, Di Santo JP, Eberl G, et al. (febrero de 2013). "Células linfoides innatas: una propuesta para una nomenclatura uniforme". Nature Reviews. Inmunología . 13 (2): 145–149. doi : 10.1038/nri3365 . PMID 23348417. S2CID 2228459.
- ^ Barrow AD, Martin CJ, Colonna M (7 de mayo de 2019). "Los receptores naturales de citotoxicidad en la salud y la enfermedad". Frontiers in Immunology . 10 : 909. doi : 10.3389/fimmu.2019.00909 . PMC 6514059 . PMID 31134055.
- ^ Takatori H, Kanno Y, Watford WT, Tato CM, Weiss G, Ivanov II, Littman DR, O'Shea JJ (enero de 2009). "Las células similares a inductoras de tejido linfoide son una fuente innata de IL-17 e IL-22". La Revista de Medicina Experimental . 206 (1): 35–41. doi :10.1084/jem.20072713. PMC 2626689 . PMID 19114665.
- ^ ab Cella M, Fuchs A, Vermi W, Facchetti F, Otero K, Lennerz JK, Doherty JM, Mills JC, Colonna M (febrero de 2009). "Un subconjunto de células asesinas naturales humanas proporciona una fuente innata de IL-22 para la inmunidad de las mucosas". Nature . 457 (7230): 722–5. Bibcode :2009Natur.457..722C. doi :10.1038/nature07537. PMC 3772687 . PMID 18978771.
- ^ Cella M, Otero K, Colonna M (junio de 2010). "La expansión de células NK-22 humanas con IL-7, IL-2 e IL-1beta revela plasticidad funcional intrínseca". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 107 (24): 10961–6. Bibcode :2010PNAS..10710961C. doi : 10.1073/pnas.1005641107 . PMC 2890739 . PMID 20534450.
- ^ Qiu J, Heller JJ, Guo X, Chen ZM, Fish K, Fu YX, Zhou L (enero de 2012). "El receptor de hidrocarburos arílicos regula la inmunidad intestinal a través de la modulación de las células linfoides innatas". Inmunidad . 36 (1): 92–104. doi :10.1016/j.immuni.2011.11.011. PMC 3268875 . PMID 22177117.
- ^ ab Meininger I, Carrasco A, Rao A, Soini T, Kokkinou E, Mjösberg J (octubre de 2020). "Características específicas de tejido de las células linfoides innatas". Tendencias en inmunología . 41 (10): 902–917. doi : 10.1016/j.it.2020.08.009 . PMID 32917510.
- ^ Tizian C, Lahmann A, Hölsken O, Cosovanu C, Kofoed-Branzk M, Heinrich F, et al. (febrero de 2020). Rath S, Withers D (eds.). "c-Maf restringe la programación impulsada por T-bet de las células linfoides innatas del grupo 3 negativas para CCR6". eLife . 9 : e52549. doi : 10.7554/eLife.52549 . PMC 7025824 . PMID 32039762.
- ^ Sugimoto K, Ogawa A, Mizoguchi E, Shimomura Y, Andoh A, Bhan AK, et al. (febrero de 2008). "IL-22 mejora la inflamación intestinal en un modelo murino de colitis ulcerosa". The Journal of Clinical Investigation . 118 (2): 534–544. doi :10.1172/JCI33194. PMC 2157567 . PMID 18172556.
- ^ ab Sovran B, Loonen LM, Lu P, Hugenholtz F, Belzer C, Stolte EH, et al. (marzo de 2015). "La vía IL-22-STAT3 desempeña un papel clave en el mantenimiento de la homeostasis ileal en ratones que carecen de barrera de moco secretado". Enfermedades inflamatorias del intestino . 21 (3): 531–542. doi : 10.1097/MIB.0000000000000319 . PMID 25636123. S2CID 5998736.
- ^ Andoh A, Zhang Z, Inatomi O, Fujino S, Deguchi Y, Araki Y, et al. (Septiembre de 2005). "La interleucina-22, un miembro de la subfamilia IL-10, induce respuestas inflamatorias en miofibroblastos subepiteliales del colon". Gastroenterología . 129 (3): 969–984. doi : 10.1053/j.gastro.2005.06.071 . PMID 16143135.
- ^ ab Liang SC, Tan XY, Luxenberg DP, Karim R, Dunussi-Joannopoulos K, Collins M, Fouser LA (octubre de 2006). "La interleucina (IL)-22 y la IL-17 se coexpresan en las células Th17 y mejoran de forma cooperativa la expresión de péptidos antimicrobianos". The Journal of Experimental Medicine . 203 (10): 2271–2279. doi :10.1084/jem.20061308. PMC 2118116 . PMID 16982811.
- ^ Wolk K, Kunz S, Witte E, Friedrich M, Asadullah K, Sabat R (agosto de 2004). "IL-22 aumenta la inmunidad innata de los tejidos". Inmunidad . 21 (2): 241–54. doi : 10.1016/j.immuni.2004.07.007 . PMID 15308104.
- ^ ab Hepworth MR, Monticelli LA, Fung TC, Ziegler CG, Grunberg S, Sinha R, et al. (junio de 2013). "Las células linfoides innatas regulan las respuestas de las células T CD4+ a las bacterias comensales intestinales". Nature . 498 (7452): 113–117. Bibcode :2013Natur.498..113H. doi :10.1038/nature12240. PMC 3699860 . PMID 23698371.
- ^ Matusevicius D, Kivisäkk P, He B, Kostulas N, Ozenci V, Fredrikson S, Link H (abril de 1999). "La expresión de ARNm de interleucina-17 en células mononucleares de sangre y LCR aumenta en la esclerosis múltiple". Multiple Sclerosis (Houndmills, Basingstoke, Inglaterra) . 5 (2): 101–4. doi :10.1177/135245859900500206. PMID 10335518. S2CID 45449835.
- ^ Ziolkowska M, Koc A, Luszczykiewicz G, Ksiezopolska-Pietrzak K, Klimczak E, Chwalinska-Sadowska H, Maslinski W (marzo de 2000). "Altos niveles de IL-17 en pacientes con artritis reumatoide: la IL-15 desencadena la producción in vitro de IL-17 a través de un mecanismo sensible a la ciclosporina A". Revista de Inmunología . 164 (5): 2832–2838. doi : 10.4049/jimmunol.164.5.2832 . PMID 10679127. S2CID 2861840.
- ^ Lynde CW, Poulin Y, Vender R, Bourcier M, Khalil S (julio de 2014). "Interleucina 17A: hacia una nueva comprensión de la patogénesis de la psoriasis". Revista de la Academia Estadounidense de Dermatología . 71 (1): 141–50. doi :10.1016/j.jaad.2013.12.036. PMID 24655820.
- ^ Fujino S, Andoh A, Bamba S, Ogawa A, Hata K, Araki Y, Bamba T, Fujiyama Y (enero de 2003). "Aumento de la expresión de interleucina 17 en la enfermedad inflamatoria intestinal". Gut . 52 (1): 65–70. doi :10.1136/gut.52.1.65. PMC 1773503 . PMID 12477762.
- ^ van de Pavert SA, Ferreira M, Domingues RG, Ribeiro H, Molenaar R, Moreira-Santos L, et al. (abril de 2014). "Los retinoides maternos controlan las células linfoides innatas de tipo 3 y establecen la inmunidad de la descendencia". Nature . 508 (7494): 123–127. Bibcode :2014Natur.508..123V. doi :10.1038/nature13158. PMC 4932833 . PMID 24670648.
- ^ Jarade A, Di Santo JP, Serafini N (octubre de 2021). "Las células linfoides innatas del grupo 3 median la defensa del huésped contra los patógenos que se adhieren y eliminan". Current Opinion in Microbiology . 63 : 83–91. doi : 10.1016/j.mib.2021.06.005 . PMID 34274597.
- ^ Saez A, Gomez-Bris R, Herrero-Fernandez B, Mingorance C, Rius C, Gonzalez-Granado JM (julio 2021). "Células linfoides innatas en la homeostasis intestinal y la enfermedad inflamatoria intestinal". Revista Internacional de Ciencias Moleculares . 22 (14): 7618. doi : 10.3390/ijms22147618 . PMC 8307624 . PMID 34299236.
- ^ ab Buela KA, Omenetti S, Pizarro TT (noviembre de 2015). "Interacción entre las células linfoides innatas tipo 3 y la microbiota intestinal en la enfermedad inflamatoria intestinal". Current Opinion in Gastroenterology . 31 (6): 449–455. doi :10.1097/MOG.0000000000000217. PMC 4682364 . PMID 26398682.
- ^ abcd Zeng B, Shi S, Ashworth G, Dong C, Liu J, Xing F (abril de 2019). "La función de ILC3 como arma de doble filo en las enfermedades inflamatorias del intestino". Muerte celular y enfermedad . 10 (4): 315. doi :10.1038/s41419-019-1540-2. PMC 6453898. PMID 30962426 .
- ^ ab Pavlova A, Sharafutdinov I (septiembre de 2020). "Reconocimiento de Candida albicans y papel de la inmunidad innata tipo 17 en la candidiasis oral". Microorganismos . 8 (9): 1340. doi : 10.3390/microorganisms8091340 . PMC 7563233 . PMID 32887412.
- ^ Yamano T, Dobeš J, Vobořil M, Steinert M, Brabec T, Ziętara N, et al. (mayo de 2019). "Las células similares a ILC3 que expresan Aire en el ganglio linfático muestran potentes características de APC". The Journal of Experimental Medicine . 216 (5): 1027–1037. doi :10.1084/jem.20181430. PMC 6504225 . PMID 30918005.
- ^ abc Ardain A, Porterfield JZ, Kløverpris HN, Leslie A (2019). "Células linfáticas intersticiales de tipo 3 en enfermedades pulmonares". Frontiers in Immunology . 10 : 92. doi : 10.3389/fimmu.2019.00092 . PMC 6361816 . PMID 30761149.
- ^ Miljković Đ, Jevtić B, Stojanović I, Dimitrijević M (2021). "ILC3, un componente inmunológico innato central del eje intestino-cerebro en la esclerosis múltiple". Fronteras en Inmunología . 12 : 657622. doi : 10.3389/fimmu.2021.657622 . PMC 8071931 . PMID 33912185.