Idebenona
 | |
| Datos clínicos | |
|---|---|
| Nombres comerciales | Cadena, Raxone, Sovrima |
| AHFS / Drogas.com | Nombres internacionales de medicamentos |
| Vías de administración | Por la boca |
| Código ATC |
|
| Estatus legal | |
| Estatus legal |
|
| Datos farmacocinéticos | |
| Biodisponibilidad | <1% (alto efecto de primer paso ) |
| Unión de proteínas | >99% |
| Vida media de eliminación | 18 horas |
| Excreción | Orina (80%) y heces |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Araña química | |
| UNIVERSIDAD |
|
| BARRIL | |
| EBICh |
|
| Química biológica | |
| Panel de control CompTox ( EPA ) |
|
| Datos químicos y físicos | |
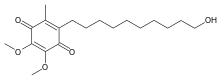
| Fórmula | C19H30O5 |
| Masa molar | 338,444 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
| (verificar) | |
La idebenona , comercializada bajo la marca Raxone, entre otras, es un medicamento desarrollado inicialmente por la compañía farmacéutica Takeda para el tratamiento de la enfermedad de Alzheimer y otros defectos cognitivos . [2] Esto ha tenido un éxito limitado. La compañía suiza Santhera Pharmaceuticals ha comenzado a investigarlo para el tratamiento de enfermedades neuromusculares . En 2010, se completaron los primeros ensayos clínicos para el tratamiento de la ataxia de Friedreich [3] y la distrofia muscular de Duchenne [4] . A diciembre de 2013, [actualizar]el fármaco no está aprobado para estas indicaciones en América del Norte o Europa. Está aprobado por la Agencia Europea de Medicamentos (EMA) para su uso en la neuropatía óptica hereditaria de Leber (LHON) y fue designado medicamento huérfano en 2007. [5]
Químicamente, la idebenona es un compuesto orgánico de la familia de las quinonas . También se promociona comercialmente como un análogo sintético de la coenzima Q 10 (CoQ 10 ).
Usos
Indicaciones que están o fueron aprobadas en algunos territorios
Efectos nootrópicos y enfermedad de Alzheimer
La idebenona mejoró el aprendizaje y la memoria en experimentos con ratones. [6] En humanos, la evaluación de criterios de valoración sustitutos como la electrorretinografía , los potenciales evocados auditivos y las escalas analógicas visuales también sugirieron efectos nootrópicos positivos , [7] pero faltan estudios más amplios con criterios de valoración concretos.
Las investigaciones sobre la idebenona como posible terapia para la enfermedad de Alzheimer han sido inconsistentes, pero puede haber una tendencia a un ligero beneficio. [8] [9] En mayo de 1998, la aprobación para esta indicación fue cancelada en Japón debido a la falta de efectos comprobados. En algunos países europeos, el fármaco está disponible para el tratamiento de pacientes individuales en casos especiales. [2]
Ataxia de Friedreich (Sovrima)
Se han realizado pruebas preliminares en humanos y se ha descubierto que la idebenona es un tratamiento seguro para la ataxia de Friedreich (AF), mostrando un efecto positivo sobre la hipertrofia cardíaca y la función neurológica. [10] Esta última solo mejoró significativamente en pacientes jóvenes. [11] En un experimento diferente, una prueba de un año en ocho pacientes, la idebenona redujo la tasa de deterioro de la función cardíaca, pero sin detener la progresión de la ataxia . [12]
El fármaco fue aprobado para la ataxia de Friedreich en Canadá en 2008 bajo condiciones que incluían la prueba de eficacia en ensayos clínicos adicionales. [13] Sin embargo, en febrero de 2013, Health Canada anunció que la idebenona sería retirada voluntariamente del mercado a partir de abril de 2013 por su fabricante canadiense, Santhera Pharmaceuticals, debido a que el fármaco no demostró eficacia en los ensayos clínicos adicionales que se llevaron a cabo. [14] En 2008, la Agencia Europea de Medicamentos (EMA) rechazó una autorización de comercialización para esta indicación. [2] A partir de 2013, el fármaco no fue aprobado para la ataxia de Friedreich en Europa [15] ni en los EE. UU., donde, a partir de febrero de 2023, solo hay un tratamiento aprobado. [16]
Neuropatía óptica hereditaria de Leber (Raxone)
La neuropatía óptica hereditaria de Leber (LHON) es una degeneración de las células ganglionares de la retina (RGC) y sus axones que se hereda mitocondrialmente (de madre a todos los hijos) y que conduce a una pérdida aguda o subaguda de la visión central; afecta predominantemente a varones adultos jóvenes. Santhera completó un ensayo clínico de fase III en esta indicación en Europa con resultados positivos, [17] y presentó una solicitud para comercializar el fármaco a los reguladores europeos en julio de 2011. [18] Está aprobado por la EMA para esta indicación y fue designado fármaco huérfano en 2007. [5]
Indicaciones que se están explorando
Distrofia muscular de Duchenne (Catena)
Después de experimentos en ratones [19] y estudios preliminares en humanos, la idebenona entró en ensayos clínicos de fase II en 2005 [4] y en ensayos de fase III en 2009. [20]
Otras enfermedades neuromusculares
Se llevó a cabo un ensayo clínico de fase I y II para el tratamiento de MELAS (encefalomiopatía mitocondrial, acidosis láctica y episodios similares a accidentes cerebrovasculares). [21] El ensayo de fase I/II para la esclerosis múltiple progresiva primaria concluyó que la idebenona no inhibe la progresión de la discapacidad. [22] [23]
A partir de 2022, se está llevando a cabo un ensayo clínico de fase III para el tratamiento de la enfermedad de Parkinson . [24]
Estilo de vida
Se afirma que la idebenona tiene propiedades antioxidantes similares a las de la CoQ 10 , por lo que se ha utilizado en el tratamiento del envejecimiento basándose en la teoría de los radicales libres . No hay evidencia clínica de este uso. Se ha utilizado en aplicaciones tópicas para tratar las arrugas . [25]
Farmacología
En modelos celulares y tisulares, la idebenona actúa como transportador en la cadena de transporte de electrones de las mitocondrias y, por lo tanto, aumenta la producción de trifosfato de adenosina (ATP), que es la principal fuente de energía de las células, y también inhibe la formación de lipoperóxido . También se han observado efectos positivos en la cadena de energía de las mitocondrias en modelos animales. [2] [26] No se ha establecido la relevancia clínica de estos hallazgos.
Farmacocinética
La idebenona se absorbe bien en el intestino, pero sufre un metabolismo excesivo de primer paso en el hígado, de modo que menos del 1% llega a la circulación. Esta tasa se puede mejorar con formulaciones especiales ( suspensiones ) de idebenona y administrándola junto con alimentos grasos; pero incluso tomando estas medidas, la biodisponibilidad parece ser considerablemente inferior al 14% en humanos. Más del 99% del fármaco circulante se une a las proteínas plasmáticas . Los metabolitos de la idebenona incluyen glucurónidos y sulfatos , que se excretan principalmente (~80%) a través de la orina. [2]
Referencias
- ^ "Raxone EPAR". Agencia Europea de Medicamentos (EMA) . 15 de febrero de 2007. Consultado el 26 de agosto de 2024 .
- ^ abcde Informe de evaluación del CHMP para Sovrima (PDF) (Informe). Agencia Europea de Medicamentos . 20 de noviembre de 2008. págs. 6, 9–11, 67 y siguientes. Archivado desde el original (PDF) el 20 de junio de 2018. Consultado el 30 de diciembre de 2013 .
- ^ Número de ensayo clínico NCT00229632 para "Idebenona para tratar la ataxia de Friedreich" en ClinicalTrials.gov
- ^ Número de ensayo clínico ab NCT00654784 para "Eficacia y tolerabilidad de la idebenona en niños con disfunción cardíaca asociada con distrofia muscular de Duchenne (DELPHI)" en ClinicalTrials.gov
- ^ ab "Raxone". www.ema.europa.eu . 17 de septiembre de 2018 . Consultado el 12 de julio de 2019 .
- ^ Liu XJ, Wu WT (noviembre de 1999). "Efectos de la ligustrazina, la tanshinona II A, la ubiquinona y la idebenona en el rendimiento de los ratones en el laberinto acuático". Zhongguo Yao Li Xue Bao = Acta Pharmacologica Sinica . 20 (11): 987–990. PMID 11270979.
- ^ Schaffler K, Hadler D, Stark M (julio de 1998). "Relación dosis-efecto de la idebenona en un modelo experimental de déficit cerebral. Estudio piloto en voluntarios jóvenes sanos con piracetam como fármaco de referencia". Arzneimittel-Forschung . 48 (7): 720–726. PMID 9706371.
- ^ Gutzmann H, Kühl KP, Hadler D, Rapp MA (enero de 2002). "Seguridad y eficacia de la idebenona frente a la tacrina en pacientes con enfermedad de Alzheimer: resultados de un estudio multicéntrico, aleatorizado, doble ciego y de grupos paralelos". Farmacopsiquiatría . 35 (1): 12–18. doi :10.1055/s-2002-19833. PMID 11819153.
- ^ Parnetti L, Senin U, Mecocci P (mayo de 1997). "Terapia de mejora cognitiva para la enfermedad de Alzheimer. El camino a seguir". Drugs . 53 (5): 752–768. doi :10.2165/00003495-199753050-00003. PMID 9129864. S2CID 46987059.
- ^ Di Prospero NA, Baker A, Jeffries N, Fischbeck KH (octubre de 2007). "Efectos neurológicos de la idebenona en dosis altas en pacientes con ataxia de Friedreich: un ensayo aleatorizado, controlado con placebo". The Lancet. Neurología . 6 (10): 878–886. doi :10.1016/S1474-4422(07)70220-X. PMID 17826341. S2CID 24749816.
- ^ Tonon C, Lodi R (septiembre de 2008). "Idebenona en la ataxia de Friedreich". Opinión de expertos sobre farmacoterapia . 9 (13): 2327–2337. doi :10.1517/14656566.9.13.2327. PMID 18710357. S2CID 73285881.
- ^ Buyse G, Mertens L, Di Salvo G, Matthijs I, Weidemann F, Eyskens B, et al. (mayo de 2003). "Tratamiento con idebenona en la ataxia de Friedreich: monitorización neurológica, cardíaca y bioquímica". Neurología . 60 (10): 1679–1681. doi :10.1212/01.wnl.0000068549.52812.0f. PMID 12771265. S2CID 36556782.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ "Hoja informativa sobre salud de Canadá - Catena". Archivado desde el original el 19 de junio de 2014.
- ^ Retirada voluntaria de Catena del mercado canadiense
- ^ Margaret Wahl para Quest Magazine, 28 de mayo de 2010. FA Research: Idebenone Strikes Out Again Archivado el 27 de septiembre de 2017 en Wayback Machine.
- ^ La FDA aprueba el primer tratamiento para la ataxia de Friedreich
- ^ Klopstock T, Yu-Wai-Man P, Dimitriadis K, Rouleau J, Heck S, Bailie M, et al. (septiembre de 2011). "Un ensayo aleatorizado y controlado con placebo de idebenona en la neuropatía óptica hereditaria de Leber". Cerebro . 134 (Pt 9): 2677–2686. doi :10.1093/brain/awr170. PMC 3170530 . PMID 21788663.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Staff (26 de julio de 2011). «Santhera publica los resultados de un ensayo fundamental sobre idebenona y solicita la aprobación de la UE». European Biotechnology News . Archivado desde el original el 17 de febrero de 2013.
- ^ Buyse GM, Van der Mieren G, Erb M, D'hooge J, Herijgers P, Verbeken E, et al. (Enero de 2009). "Estudio ciego a largo plazo controlado con placebo de SNT-MC17 / idebenona en el ratón mdx con deficiencia de distrofina: protección cardíaca y mejora del rendimiento en el ejercicio". Revista europea del corazón . 30 (1): 116-124. doi :10.1093/eurheartj/ehn406. PMC 2639086 . PMID 18784063.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Número de ensayo clínico NCT01027884 para el "Estudio de fase III de idebenona en la distrofia muscular de Duchenne (DMD) (DELOS)" en ClinicalTrials.gov
- ^ Número de ensayo clínico NCT00887562 para "Estudio de idebenona en el tratamiento de la acidosis láctica y episodios similares a accidentes cerebrovasculares (MELAS) en la encefalopatía mitocondrial" en ClinicalTrials.gov
- ^ Número de ensayo clínico NCT00950248 para "Ensayo clínico de fase I/II, doble ciego, controlado con placebo sobre idebenona en pacientes con esclerosis múltiple progresiva primaria (IPPoMS)" en ClinicalTrials.gov
- ^ Kosa P, Wu T, Phillips J, Leinonen M, Masvekar R, Komori M, et al. (octubre de 2020). "La idebenona no inhibe la progresión de la discapacidad en la EM progresiva primaria". Esclerosis múltiple y trastornos relacionados . 45 : 102434. doi :10.1016/j.msard.2020.102434. PMC 9386688. PMID 32784117 .
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ McFarthing K, Rafaloff G, Baptista M, Mursaleen L, Fuest R, Wyse RK, et al. (2022). "Terapias farmacológicas para la enfermedad de Parkinson en la fase de ensayos clínicos: actualización de 2022". Journal of Parkinson's Disease . 12 (4): 1073–1082. doi :10.3233/JPD-229002. PMC 9198738 . PMID 35527571.
- ^ McDaniel DH, Neudecker BA, DiNardo JC, Lewis JA, Maibach HI (septiembre de 2005). "Evaluación de la eficacia clínica en piel fotodañada de idebenona al 0,5% y al 1,0%". Journal of Cosmetic Dermatology . 4 (3): 167–173. doi :10.1111/j.1473-2165.2005.00305.x. PMID 17129261. S2CID 2394666.
- ^ Suno M, Nagaoka A (mayo de 1988). "[Efecto de la idebenona y varios fármacos nootrópicos sobre la peroxidación lipídica en homogeneizado de cerebro de rata en presencia de succinato]". Nihon Yakurigaku Zasshi. Folia Pharmacologica Japonica (en japonés). 91 (5): 295–299. doi : 10.1254/fpj.91.295 . PMID 3410376.

