Fases del hielo
La introducción de este artículo puede ser demasiado breve para resumir adecuadamente los puntos clave . ( Mayo de 2024 ) |
Las fases del hielo son todos los estados posibles de la materia para el agua en estado sólido. Las variaciones de presión y temperatura dan lugar a diferentes fases, que tienen propiedades y geometrías moleculares diferentes. En la actualidad, se han observado veintiún fases, incluidos hielos tanto cristalinos como amorfos . En la historia moderna, las fases se han descubierto mediante la investigación científica con diversas técnicas, entre ellas la presurización, la aplicación de fuerza, los agentes de nucleación y otras.
En la Tierra, la mayor parte del hielo se encuentra en la fase hexagonal Ice I h . Se pueden encontrar fases menos comunes en la atmósfera y bajo tierra debido a presiones y temperaturas más extremas. Algunas fases son fabricadas por humanos para usos a escala nanométrica debido a sus propiedades. En el espacio, el hielo amorfo es la forma más común, como lo confirma la observación. Por lo tanto, se teoriza que es la fase más común en el universo. Se podrían encontrar varias otras fases de forma natural en los objetos astronómicos.
Teoría
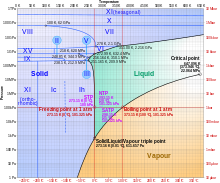
La mayoría de los líquidos sometidos a mayor presión se congelan a temperaturas más altas porque la presión ayuda a mantener unidas las moléculas. Sin embargo, los fuertes enlaces de hidrógeno del agua lo hacen diferente: para algunas presiones superiores a 1 atm (0,10 MPa), el agua se congela a una temperatura inferior a 0 °C. Sometido a presiones más altas y temperaturas variables, el hielo puede formarse en diecinueve fases cristalinas conocidas separadas. Con cuidado, al menos quince de estas fases (una de las excepciones conocidas es el hielo X) se pueden recuperar a presión ambiente y baja temperatura en forma metaestable . [1] [2] Los tipos se diferencian por su estructura cristalina, ordenamiento de protones, [3] y densidad. También hay dos fases metaestables de hielo bajo presión, ambas completamente desordenadas por hidrógeno; estas son el Hielo IV y el Hielo XII.
Estructura cristalina


La estructura cristalina aceptada del hielo ordinario fue propuesta por primera vez por Linus Pauling en 1935. La estructura del hielo I h es la red de wurtzita , aproximadamente una de planos arrugados compuestos de anillos hexagonales teselados , con un átomo de oxígeno en cada vértice, y los bordes de los anillos formados por enlaces de hidrógeno . Los planos se alternan en un patrón ABAB, con los planos B siendo reflejos de los planos A a lo largo de los mismos ejes que los planos mismos. [4] La distancia entre los átomos de oxígeno a lo largo de cada enlace es de aproximadamente 275 pm y es la misma entre dos átomos de oxígeno enlazados en la red. El ángulo entre los enlaces en la red cristalina es muy cercano al ángulo tetraédrico de 109,5°, que también es bastante cercano al ángulo entre los átomos de hidrógeno en la molécula de agua (en la fase gaseosa), que es de 105°.
Este ángulo de enlace tetraédrico de la molécula de agua explica esencialmente la densidad inusualmente baja de la red cristalina: es beneficioso que la red esté dispuesta con ángulos tetraédricos, aunque exista una penalización energética en el aumento del volumen de la red cristalina. Como resultado, los grandes anillos hexagonales dejan casi suficiente espacio para que exista otra molécula de agua en el interior. Esto le da al hielo natural su rara propiedad de ser menos denso que su forma líquida. Los anillos hexagonales con enlaces de hidrógeno en ángulo tetraédrico también son el mecanismo que hace que el agua líquida sea más densa a 4 °C. Cerca de 0 °C, se forman diminutas redes hexagonales de hielo tipo I h en el agua líquida, con mayor frecuencia cerca de 0 °C. Este efecto disminuye la densidad del agua, haciendo que sea más densa a 4 °C, cuando las estructuras se forman con poca frecuencia.
En la forma más conocida de hielo, el hielo I h , la estructura cristalina se caracteriza por la formación de simetría hexagonal de los átomos de oxígeno con ángulos de enlace casi tetraédricos . Esta estructura es estable hasta -268 °C (5 K; -450 °F), como se evidencia mediante difracción de rayos X [5] y mediciones de expansión térmica de resolución extremadamente alta. [6] El hielo I h también es estable bajo presiones aplicadas de hasta aproximadamente 210 megapascales (2100 atm) donde pasa a hielo III o hielo II. [7]
Hielo amorfo
Aunque la mayoría de las formas de hielo son cristalinas, también existen varias formas amorfas (o "vítreas") de hielo. Este tipo de hielo es una forma sólida amorfa de agua, que carece de orden de largo alcance en su disposición molecular. El hielo amorfo se produce ya sea por enfriamiento rápido del agua líquida a su temperatura de transición vítrea (alrededor de 136 K o −137 °C) en milisegundos (por lo que las moléculas no tienen tiempo suficiente para formar una red cristalina ), o por compresión de hielo ordinario a bajas temperaturas. La forma más común en la Tierra, el hielo de baja densidad, generalmente se forma en el laboratorio por una acumulación lenta de moléculas de vapor de agua ( deposición física de vapor ) sobre una superficie de cristal de metal muy lisa a 120 K. En el espacio exterior se espera que se forme de manera similar en una variedad de sustratos fríos, como partículas de polvo. [8] Por el contrario, el agua vítrea hiperextinguida (HGW) se forma rociando una fina niebla de gotas de agua en un líquido como el propano a alrededor de 80 K, o hiperextinguiendo gotas finas de tamaño micrométrico en un portamuestras mantenido a la temperatura del nitrógeno líquido , 77 K, en vacío. Se requieren velocidades de enfriamiento superiores a 10 4 K/s para evitar la cristalización de las gotas. A la temperatura del nitrógeno líquido, 77 K, el HGW es cinéticamente estable y se puede almacenar durante muchos años.
Los hielos amorfos tienen la propiedad de suprimir las fluctuaciones de densidad de largo alcance y, por lo tanto, son casi hiperuniformes . [9] El análisis de clasificación sugiere que los hielos amorfos de baja y alta densidad son vidrios . [10]
Estados dependientes de la presión

El hielo de un agua superiónica teóricamente puede poseer dos estructuras cristalinas. A presiones superiores a 50 GPa (7.300.000 psi), dicho hielo superiónico adoptaría una estructura cúbica centrada en el cuerpo . Sin embargo, a presiones superiores a 100 GPa (15.000.000 psi), la estructura puede cambiar a una red cúbica centrada en las caras más estable . Algunas estimaciones sugieren que a una presión extremadamente alta de alrededor de 1,55 TPa (225.000.000 psi), el hielo desarrollaría propiedades metálicas . [12]
Calor y entropía

El hielo, el agua y el vapor de agua pueden coexistir en el punto triple , que es exactamente 273,16 K (0,01 °C) a una presión de 611,657 Pa . [14] [15] El kelvin se definió como 1/273,16 de la diferencia entre este punto triple y el cero absoluto , [16] aunque esta definición cambió en mayo de 2019. [17] A diferencia de la mayoría de los otros sólidos, el hielo es difícil de sobrecalentar . En un experimento, el hielo a −3 °C se sobrecalentó a aproximadamente 17 °C durante aproximadamente 250 picosegundos . [18]

El calor latente de fusión es5987 J/mol , y su calor latente de sublimación es50 911 J/mol . El alto calor latente de sublimación es principalmente indicativo de la fuerza de los enlaces de hidrógeno en la red cristalina. El calor latente de fusión es mucho menor, en parte porque el agua líquida cerca de 0 °C también contiene una cantidad significativa de enlaces de hidrógeno. Por el contrario, la estructura del hielo II está ordenada por hidrógeno, lo que ayuda a explicar el cambio de entropía de 3,22 J/mol cuando la estructura cristalina cambia a la del hielo I. Además, el hielo XI, una forma ortorrómbica, ordenada por hidrógeno del hielo I h , se considera la forma más estable a bajas temperaturas.
Se estima que la entropía de transición del hielo XIV al hielo XII es el 60% de la entropía de Pauling según las mediciones de DSC. [19] La formación de hielo XIV a partir de hielo XII es más favorecida a alta presión. [20]
Cuando el hielo amorfo de densidad media se comprime, se libera y luego se calienta, libera una gran cantidad de energía térmica, a diferencia de otros hielos de agua que vuelven a su forma normal después de recibir un tratamiento similar. [21]
Trastorno del hidrógeno

Los átomos de hidrógeno en la red cristalina se encuentran muy cerca de los enlaces de hidrógeno, y de tal manera que cada molécula de agua se conserva. Esto significa que cada átomo de oxígeno en la red tiene dos hidrógenos adyacentes a él: aproximadamente a 101 pm a lo largo de la longitud de 275 pm del enlace para el hielo Ih. La red cristalina permite una cantidad sustancial de desorden en las posiciones de los átomos de hidrógeno congelados en la estructura a medida que se enfría hasta el cero absoluto. Como resultado, la estructura cristalina contiene cierta entropía residual inherente a la red y determinada por el número de posibles configuraciones de posiciones de hidrógeno que se pueden formar mientras se mantiene el requisito de que cada átomo de oxígeno tenga solo dos hidrógenos en la proximidad más cercana, y cada enlace de hidrógeno que une dos átomos de oxígeno tenga solo un átomo de hidrógeno. [22] Esta entropía residual S 0 es igual a 3,4 ± 0,1 J mol −1 K −1 . [23]
Cálculos
Existen varias formas de aproximar este número a partir de los primeros principios. La siguiente es la utilizada por Linus Pauling . [24] [25]
Supongamos que hay una cantidad dada de moléculas de agua en una red de hielo. Para calcular su entropía residual, necesitamos contar la cantidad de configuraciones que puede adoptar la red. Los átomos de oxígeno están fijos en los puntos de la red, pero los átomos de hidrógeno están ubicados en los bordes de la red. El problema es elegir un extremo de cada borde de la red para que el hidrógeno se una, de manera que aún se asegure de que cada átomo de oxígeno esté unido a dos átomos de hidrógeno.
Los átomos de oxígeno se pueden dividir en dos conjuntos en un patrón de tablero de ajedrez, que se muestra en la imagen como bolas blancas y negras. Concentre la atención en los átomos de oxígeno en un conjunto: hay N /2 de ellos. Cada uno tiene cuatro enlaces de hidrógeno, con dos hidrógenos cerca y dos lejos. Esto significa que hay configuraciones permitidas de hidrógenos para este átomo de oxígeno (ver Coeficiente binomial ). Por lo tanto, hay 6 N /2 configuraciones que satisfacen estos N /2 átomos. Pero ahora, considere los N /2 átomos de oxígeno restantes : en general, no se cumplirán (es decir, no tendrán precisamente dos átomos de hidrógeno cerca de ellos). Para cada uno de ellos, hay 2 4 = 16 posibles ubicaciones de los átomos de hidrógeno a lo largo de sus enlaces de hidrógeno, de los cuales 6 están permitidos. Entonces, ingenuamente, esperaríamos que el número total de configuraciones sea
Utilizando la fórmula de entropía de Boltzmann , concluimos que donde k es la constante de Boltzmann y R es la constante molar de los gases . Por lo tanto, la entropía residual molar es .
La misma respuesta se puede encontrar de otra manera. Primero, orientamos cada molécula de agua al azar en cada una de las 6 configuraciones posibles, luego verificamos que cada borde de la red contenga exactamente un átomo de hidrógeno. Suponiendo que los bordes de la red son independientes, entonces la probabilidad de que un solo borde contenga exactamente un átomo de hidrógeno es 1/2, y como hay 2N bordes en total, obtenemos un recuento total de configuraciones , como antes.
Refinamientos

Esta estimación es "ingenua", ya que supone que seis de las dieciséis configuraciones de hidrógeno para los átomos de oxígeno en el segundo conjunto se pueden elegir de forma independiente, lo que es falso. Se pueden emplear métodos más complejos para aproximar mejor el número exacto de configuraciones posibles y lograr resultados más cercanos a los valores medidos. Nagle (1966) utilizó una suma de series para obtener . [26]
Como ejemplo ilustrativo de refinamiento, considere la siguiente manera de refinar el segundo método de estimación dado anteriormente. Según él, seis moléculas de agua en un anillo hexagonal permitirían configuraciones. Sin embargo, por enumeración explícita, hay en realidad 730 configuraciones. Ahora bien, en la red, cada átomo de oxígeno participa en 12 anillos hexagonales, por lo que hay 2N anillos en total para N átomos de oxígeno, o 2 anillos para cada átomo de oxígeno, lo que da un resultado refinado de . [27]
Fases conocidas
Estas fases se denominan según la nomenclatura de Bridgman . La mayoría se han creado únicamente en el laboratorio a diferentes temperaturas y presiones. [28]
| Fase | Año del descubrimiento | Umbrales de temperatura | Umbrales de presión | Densidad | Forma cristalina | Otras características |
|---|---|---|---|---|---|---|
| Hielo yo h | hielo natural | 273,15 K (0 °C ) (congelación) | NA (atmosférico) | 0,917 g/ cm3 | Hexagonal | Prácticamente todo el hielo de la biosfera es hielo I h , con excepción de una pequeña cantidad de hielo I c . Tiene un índice de refracción de 1,31. |
| Hielo yo c | 1943/2020 [29] [30] | 130 y 220 K (−143 y −53 °C) (formación); 240 K (−33 °C) (conversión a hielo I h ) [31] [32] | NA (atmosférico) | Similar a Ice Ih | Diamante [33] | Una variante cristalina cúbica metaestable del hielo. |
| Hielo amorfo de baja densidad (LDA) | Década de 1930 [34] | NA (atmosférica o inferior) | 0,94 g/cm3 [ 35] | NA (amorfo) | Probablemente la fase más común en el universo. [34] Más viscosa que el agua normal. [35] [36] [37] | |
| Hielo amorfo de densidad media (MDA) | 2023 [21] [38] | 73,15 K (−200 °C) (congelación) | NA (requiere fuerza de corte ) | 1,06 ± 0,06 g cm3 [ 39] | NA (amorfo) | El procedimiento experimental genera una fuerza de corte triturando hielo hasta convertirlo en polvo con bolas de acero inoxidable de un centímetro de ancho añadidas a su recipiente. |
| Hielo amorfo de alta densidad (HDA) | 1984 [40] | <140 K (−133 °C) (formación normal); <30 K (−243,2 °C) (deposición de vapor); [35] [41] 77 K (−196,2 °C) (punto de estabilidad) [40] | A 77 K (−196,2 °C): 1,6 GPa (formación a partir de Ih); [40] 0,5 GPa (formación a partir de LDA) [42] | 1,17 g/cm 3 (presión ambiente) [40] | NA (amorfo) | |
| Hielo amorfo de muy alta densidad (VHDA) | 1996 [43] | 160 K (−113 °C) (formación a partir de HDA); 77 K (−196,2 °C) (punto de estabilidad) | 1 y 2 GPa (formación a 160 K (−113 °C)); ambiente (a 77 K (−196,2 °C)) | 1,26 g/cm 3 (77 K (−196,2 °C); presión ambiente) [44] | NA (amorfo) | |
| Hielo II | 1900 [45] | 190 K (−83 °C) - 210 K (−63 °C) (formación a partir de hielo I h ); 77 K (−196,2 °C) (punto de estabilidad) [45] | 300 MPa [46] | Romboédrico | ||
| Hielo III | 1900 [45] | 250 K (−23 °C) (formación a partir de agua líquida); 77 K (−196,2 °C) (punto de estabilidad) [45] | 300 MPa (formación a partir de agua líquida) [46] | 1,16 g/cm 3 (a 350 MPa) [47] | Tetragonal | Permitividad relativa muy alta a 117. Una gravedad específica de 1,16 con respecto al agua. |
| Hielo IV | 1900 [45] | 190 K (−83 °C) – 210 K (−63 °C) (formación a partir de HDA); 77 K (−196,2 °C) (punto de estabilidad) | 810 MPa (formación a partir de HDA) | Romboédrico | Generalmente requiere un agente nucleante para su formación. [48] | |
| Hielo V | Década de 1900 [49] | 253 K (−20 °C) (formación a partir de agua líquida); | 500 MPa (formación a partir de agua líquida) [50] | 1,24 g cm 3 (a 350 MPa). [51] | Monoclínico | La estructura más complicada de todas las fases. Incluye anillos de 4, 5, 6 y 8 miembros y un total de 28 moléculas en la celda unitaria. [52] [53] |
| Hielo VI | 1912 [54] | 270 K (−3 °C) (formación a partir de agua líquida); 130 K (−143 °C) - 355 K (82 °C) (rango de estabilidad) | 1,1 GPa (formación a partir de agua líquida) [50] | 1,31 g/cm3 [ 55] | Tetragonal | Muestra relajación de Debye . [56] |
| Hielo VII | 1937 [57] [58] | 355 K (82 °C) (formación a partir de hielo VI) | 2,2 GPa (formación a partir de hielo VI) | 1,65 g/cm3 [ 59] | Cúbico | Las posiciones de los átomos de hidrógeno están desordenadas. Presenta relajación de Debye. Los enlaces de hidrógeno forman dos redes interpenetrantes. Forma tetragonal (disputada) conocida como Ice VII t . [60] |
| Hielo VIII | 1966 [61] | <278 K (5 °C) (formación a partir de hielo VII) | 2,1 GPa (formación a partir del hielo VII) | Tetragonal | Equivalente ordenado por protones a Ice VII. | |
| Hielo IX | 1968 [62] | 165 K (−108 °C) (formación a partir de hielo III); <140 K (−133 °C) (punto de estabilidad) | 200 MPa-400 MPa (rango de estabilidad) | 1,16 g/ cm3 | Tetragonal | Equivalente ordenado por protones a Ice III. [63] Antiferroeléctrico. [62] |
| Hielo X | 2022 (controvertido) [64] | 165 K (−108 °C) (formación a partir de hielo III); <140 K (−133 °C) (punto de estabilidad) | 30-70 GPa (del hielo VII) [65] [60] | Cúbico | Tiene enlaces de hidrógeno simetrizados: un átomo de hidrógeno se encuentra en el centro de dos átomos de oxígeno. | |
| Hielo XI | 1972 [66] | 72 K (−201,2 °C) (formación a partir de hielo I c ) | Ortorrómbico | Ferroeléctrico . La configuración más estable del hielo I h . [67] | ||
| Hielo XII | 1996 [68] | 260 K (−13 °C) (formación a partir de agua líquida); 77 K (−196,2 °C) (formación a partir de hielo I h ); 183 K (−90 °C) (formación a partir de hielo HDA) | 0,55 gigapascales (5400 atm) (formación a partir de agua líquida); 0,81–1,00 GPa/min (a partir de hielo I h ); 810 MPa (formación a partir de hielo HDA) | 1,3 g·cm −3 (a 127 K (−146 °C)) | Tetragonal | Metaestable. Observado en el espacio de fases del hielo V y el hielo VI. Una mezcla topológica de anillos de siete y ocho miembros, una red de 4 conexiones ( empaquetamiento de esferas de 4 coordenadas ), la disposición más densa posible sin interpenetración de enlaces de hidrógeno. |
| Hielo XIII | 2006 [69] | 130 K (−143 °C) (formación a partir de agua líquida) [70] | 500 MPa (formación a partir de agua líquida) [70] | Monoclínico | La forma ordenada por protones del hielo V. [70] | |
| Hielo XIV | 2006 [69] | <118 K (−155 °C) (formación a partir del hielo XII); <140 K (−133 °C) (punto de estabilidad) | 1,2 GPa (formación a partir del hielo XII) [70] | Ortorrómbico | La forma de hielo ordenada por protones XII. [70] La formación requiere dopaje con HCl . [71] | |
| Hielo XV | 2009 [72] | 80 K (−193,2 °C) – 108 K (−165 °C) (formación a partir de agua líquida) | 1,1 GPa (formación a partir de agua líquida) | Una forma de hielo VI ordenada por protones formada al enfriar agua a alrededor de 80–108 K a 1,1 GPa. | ||
| Hielo XVI | 2014 [73] | <118 K (−155 °C) (formación a partir de hielo III); <140 K (−133 °C) (punto de estabilidad) | 1,2 GPa (del hielo VII) [70] | 0,81 g/cm3 [ 73] | La forma cristalina menos densa del agua, topológicamente equivalente a la estructura vacía de los hidratos de clatrato sII . Se transforma en hielo defectuoso por apilamiento I c y luego en hielo ordinario I h cuando la temperatura supera los 145–147 K a presiones positivas. Los estudios teóricos predicen que el hielo XVI es termodinámicamente estable a presiones negativas (es decir, bajo tensión ). [11] [74] | |
| Hielo cuadrado | 2014 [75] | Temperatura ambiente (en presencia de grafeno ) | 10 GPa [76] | Cuadrado | La formación probablemente es impulsada por la fuerza de van der Waals , que permite que el vapor de agua y el agua líquida pasen a través de láminas laminadas de óxido de grafeno , a diferencia de moléculas más pequeñas como el helio . [76] | |
| Hielo XVII | 2016 [77] | <118 K (−155 °C) (formación a partir de hielo III); <140 K (−133 °C) (punto de estabilidad) | 1,2 GPa (de hielo III) | Cerca del hielo XVI. [77] [78] | Hexagonal | Fase cristalina porosa con canales helicoidales. Se forma colocando hielo lleno de hidrógeno en el vacío y aumentando la temperatura hasta que las moléculas de hidrógeno escapen. [77] |
| Hielo XVIII | 2019 [79] | <118 K (−155 °C) (formación a partir de hielo III);<140 K (−133 °C) (punto de estabilidad) | 1,2 GPa (del hielo VII) [70] | Una forma de agua también conocida como agua superiónica o hielo superiónico en la que los iones de oxígeno desarrollan una estructura cristalina mientras que los iones de hidrógeno se mueven libremente. | ||
| Hielo XIX | 2018 [80] | <100 K (−173 °C) (formación a partir de hielo VI h ); [81] | 2GPa (formación a partir de hielo VI h ) [81] | La formación requiere dopaje con HCl. [80] [81] [82] |
Historia de la investigación

Hielo II
Las propiedades del hielo II fueron descritas y registradas por primera vez por Gustav Heinrich Johann Apollon Tammann en 1900 durante sus experimentos con hielo bajo alta presión y bajas temperaturas. Después de producir hielo III, Tammann intentó condensar el hielo a una temperatura entre −70 y −80 °C (203 y 193 K; −94 y −112 °F) bajo 200 MPa (2000 atm) de presión. Tammann notó que en este estado el hielo II era más denso de lo que había observado que era el hielo III. También descubrió que ambos tipos de hielo pueden mantenerse a presión atmosférica normal en una condición estable siempre que la temperatura se mantenga a la del aire líquido , lo que ralentiza el cambio de conformación de regreso al hielo I h . [45]
En experimentos posteriores realizados por Bridgman en 1912, se demostró que la diferencia de volumen entre el hielo II y el hielo III estaba en el rango de 0,0001 m 3 /kg (2,8 pulgadas cúbicas/lb). Esta diferencia no había sido descubierta por Tammann debido al pequeño cambio y fue la razón por la que no había podido determinar una curva de equilibrio entre los dos. La curva mostró que el cambio estructural del hielo III al hielo II era más probable que sucediera si el medio había estado previamente en la conformación estructural del hielo II. Sin embargo, si se obtenía una muestra de hielo III que nunca había estado en el estado de hielo II, podría sobreenfriarse incluso por debajo de los −70 °C sin que cambiara a hielo II. Sin embargo, a la inversa, cualquier sobrecalentamiento del hielo II no era posible en lo que respecta a la retención de la misma forma. Bridgman descubrió que la curva de equilibrio entre el hielo II y el hielo IV era muy similar a la del hielo III, teniendo las mismas propiedades de estabilidad y un pequeño cambio de volumen. Sin embargo, la curva entre el hielo II y el hielo V era extremadamente diferente, ya que la burbuja de la curva era esencialmente una línea recta y la diferencia de volumen era casi siempre de 0,000 0545 m 3 /kg (1,51 pulgadas cúbicas/lb). [45]
Búsqueda de una contraparte con hidrógeno desordenado
Como el hielo II está completamente ordenado por hidrógeno, la presencia de su contraparte desordenada es un asunto de gran interés. Shephard et al. [83] investigaron los límites de fase de los hielos dopados con NH 4 F porque se ha informado que el NH 4 F es un reactivo desordenador del hidrógeno. Sin embargo, agregar 2,5 mol % de NH 4 F resultó en la desaparición del hielo II en lugar de la formación de un hielo II desordenado. Según el cálculo DFC de Nakamura et al., [84] se estima que el límite de fase entre el hielo II y su contraparte desordenada está en la región de estabilidad del agua líquida.
Hielo IV
En 1981, una investigación de Engelhardt y Kamb dilucidó la estructura cristalina del hielo IV mediante una difracción de rayos X de un solo cristal a baja temperatura, describiéndola como una celda unitaria romboédrica con un grupo espacial de R-3c. [85] Esta investigación mencionó que la estructura del hielo IV podría derivarse de la estructura del hielo Ic cortando y formando algunos enlaces de hidrógeno y agregando distorsiones estructurales sutiles. Shephard et al. [86] comprimieron la fase ambiental de NH 4 F, un material isoestructural del hielo, para obtener NH 4 F II, cuya red de enlaces de hidrógeno es similar al hielo IV. Como la compresión del hielo Ih da como resultado la formación de hielo amorfo de alta densidad (HDA), no hielo IV, afirmaron que la conversión inducida por la compresión del hielo I en hielo IV es importante, y lo denominaron "colapso de Engelhardt-Kamb" (EKC). Sugirieron que la razón por la cual no podemos obtener hielo IV directamente a partir de hielo Ih es que el hielo Ih está desordenado en hidrógeno; si los átomos de oxígeno están dispuestos en la estructura del hielo IV, es posible que no se formen enlaces de hidrógeno debido al desajuste donante-aceptor. [87] y Raman [88]
La naturaleza desordenada del hielo IV fue confirmada por estudios de difracción de neutrones en polvo realizados por Lobban (1998) [89] y Klotz et al. (2003). [90] Además, la diferencia de entropía entre el hielo VI (fase desordenada) y el hielo IV es muy pequeña, según la medición de Bridgman. [91]
Se han propuesto varios reactivos nucleantes orgánicos para cristalizar selectivamente el hielo IV a partir de agua líquida, [92] pero incluso con dichos reactivos, la cristalización del hielo IV a partir de agua líquida era muy difícil y parecía ser un evento aleatorio. En 2001, Salzmann y sus colaboradores informaron un método completamente nuevo para preparar hielo IV de manera reproducible ; [93] cuando el hielo amorfo de alta densidad (HDA) se calienta a una velocidad de 0,4 K/min y una presión de 0,81 GPa, el hielo IV se cristaliza a aproximadamente 165 K. Lo que gobierna los productos de cristalización es la velocidad de calentamiento; el calentamiento rápido (más de 10 K/min) da como resultado la formación de hielo monofásico XII.
Búsqueda de un homólogo ordenado por hidrógeno
La contraparte ordenada del hielo IV nunca ha sido reportada todavía. La investigación de 2011 del grupo de Salzmann reportó datos DSC más detallados donde la característica endotérmica se hace más grande a medida que la muestra se recupera por enfriamiento a mayor presión. Propusieron tres escenarios para explicar los resultados experimentales: ordenamiento de hidrógeno débil, transición vítrea orientacional y distorsiones mecánicas. [94] reportaron los termogramas DSC del hielo IV dopado con HCl que encontraron una característica endotérmica a aproximadamente 120 K. Diez años después, Rosu-Finsen y Salzmann (2021) reportaron datos DSC más detallados donde la característica endotérmica se hace más grande a medida que la muestra se recupera por enfriamiento a mayor presión. Propusieron tres escenarios para explicar los resultados experimentales: ordenamiento de hidrógeno débil, transición vítrea orientacional y distorsiones mecánicas. [95]
Hielo VII
El hielo VII es la única fase desordenada del hielo que se puede ordenar mediante un simple enfriamiento. (Mientras que el hielo Ih teóricamente se transforma en hielo XI ordenado por protones en escalas de tiempo geológicas, en la práctica es necesario agregar pequeñas cantidades de catalizador KOH). Forma hielo VIII (ordenado) por debajo de 273 K hasta ~8 GPa. Por encima de esta presión, la temperatura de transición VII-VIII cae rápidamente, alcanzando 0 K a ~60 GPa. [96] Por lo tanto, el hielo VII tiene el campo de estabilidad más grande de todas las fases moleculares del hielo. Las subredes cúbicas de oxígeno que forman la columna vertebral de la estructura del hielo VII persisten a presiones de al menos 128 GPa; [97] esta presión es sustancialmente más alta que aquella a la que el agua pierde su carácter molecular por completo, formando hielo X. En hielos de alta presión, la difusión protónica (movimiento de protones alrededor de la red de oxígeno) domina la difusión molecular, un efecto que se ha medido directamente. [98]
Hielo XI


El hielo XI es la forma ordenada por hidrógeno de la forma ordinaria del hielo. La energía interna total del hielo XI es aproximadamente un sexto menor que la del hielo I h , por lo que en principio debería formarse naturalmente cuando el hielo I h se enfría por debajo de los 72 K . La baja temperatura requerida para lograr esta transición está correlacionada con la diferencia de energía relativamente baja entre las dos estructuras. [99] Ya en 1964 se habían observado indicios de ordenamiento por hidrógeno en el hielo, cuando Dengel et al. atribuyeron un pico en la corriente de despolarización termoestimulada (TSD) a la existencia de una fase ferroeléctrica ordenada por protones. [100] Sin embargo, no pudieron probar de manera concluyente que se había producido una transición de fase, y Onsager señaló que el pico también podría surgir del movimiento de defectos e imperfecciones de la red. Onsager sugirió que los experimentalistas buscaran un cambio drástico en la capacidad térmica realizando un experimento calorimétrico cuidadoso. Una transición de fase al hielo XI fue identificada por primera vez experimentalmente en 1972 por Shuji Kawada y otros. [101] [102] [103]
Las moléculas de agua en el hielo I h están rodeadas por cuatro enlaces de hidrógeno dirigidos de forma semialeatoria . Estas disposiciones deberían cambiar a la disposición más ordenada de enlaces de hidrógeno que se encuentra en el hielo XI a bajas temperaturas, siempre que se permita suficientemente el salto localizado de protones; un proceso que se vuelve más fácil con el aumento de la presión. [104] En consecuencia, se cree que el hielo XI tiene un punto triple con hielo hexagonal y agua gaseosa a (~72 K, ~0 Pa). El hielo I h que se ha transformado en hielo XI y luego de nuevo en hielo I h , al aumentar la temperatura, conserva algunos dominios ordenados por hidrógeno y se transforma más fácilmente de nuevo en hielo XI. [105] Un estudio de difracción de polvo de neutrones encontró que pueden existir pequeños dominios ordenados por hidrógeno hasta 111 K. [106]
Existen diferencias claras en los espectros Raman entre los hielos I h y XI, y el hielo XI muestra picos mucho más fuertes en las regiones de traslación (~230 cm −1 ), libración (~630 cm −1 ) y estiramiento asimétrico en fase (~3200 cm −1 ). [107] [108]
El hielo I c también tiene una forma ordenada por protones. Se predijo que la energía interna total del hielo XI c sería similar a la del hielo XI h . [109]
Propiedades ferroeléctricas
El hielo XI es ferroeléctrico , lo que significa que tiene una polarización intrínseca. Para calificar como ferroeléctrico, también debe exhibir cambio de polarización bajo un campo eléctrico, lo que no se ha demostrado de manera concluyente pero que se asume implícitamente como posible. [110] El hielo cúbico también tiene una fase ferroeléctrica y en este caso las propiedades ferroeléctricas del hielo se han demostrado experimentalmente en películas delgadas monocapa. [111] En un experimento similar, se cultivaron capas ferroeléctricas de hielo hexagonal en una superficie de platino (111). El material tenía una polarización que tenía una longitud de desintegración de 30 monocapas, lo que sugiere que se pueden cultivar capas delgadas de hielo XI en sustratos a baja temperatura sin el uso de dopantes. [112] El hielo ferroeléctrico unidimensional nanoconfinado XI se creó en 2010. [113]
Hielo XV
Aunque la fase parental hielo VI fue descubierta en 1935, las formas ordenadas por protones correspondientes (hielo XV) no se habían observado hasta 2009. Teóricamente, el ordenamiento de protones en el hielo VI se predijo varias veces; por ejemplo, los cálculos de la teoría funcional de la densidad predijeron que la temperatura de transición de fase es 108 K y la estructura ordenada más estable es antiferroeléctrica en el grupo espacial Cc , mientras que se encontró una estructura antiferroeléctrica P 2 1 2 1 2 1 4 K más alta en energía por molécula de agua. [114]
El 14 de junio de 2009, Christoph Salzmann y sus colegas de la Universidad de Oxford informaron que habían descubierto experimentalmente una fase ordenada del hielo VI, denominada hielo XV, y afirman que sus propiedades difieren significativamente de las predichas. En particular, el hielo XV es antiferroeléctrico en lugar de ferroeléctrico, como se había predicho. [115] [116]
En detalle, el hielo XV tiene una densidad menor (mayor volumen de celda unitaria) que el hielo VI. Esto hace que la transición de desorden a orden de VI a XV sea mucho más favorecida a bajas presiones. De hecho, la calorimetría diferencial de barrido de Shephard y Salzmann reveló que recalentar el hielo XV dopado con HCl recuperado por enfriamiento a presión ambiente incluso produce exotermas originadas por ordenamiento transitorio, es decir, se obtiene hielo XV más ordenado a presión ambiente. Siendo consistente con esto, la transición de hielo VI-XV es reversible a presión ambiente. [117] También se demostró que el dopaje con HCl es selectivamente efectivo en la producción de hielo XV mientras que otros ácidos y bases (HF, LiOH, HClO 4 , HBr) no mejoran significativamente las formaciones de hielo XV. [118]
La estructura cristalina del hielo XV se ha investigado en detalle a partir de la difracción de neutrones en polvo. Algunos investigadores sugirieron que, en combinación con los cálculos de la teoría funcional de la densidad, ninguna de las posibles configuraciones de orientación perfectamente ordenadas está favorecida energéticamente. Esto implica que existen varias configuraciones energéticamente cercanas que coexisten en el hielo XV. Propusieron el grupo espacial ortorrómbico Pmmn como un grupo espacial plausible para describir la estructura promediada espacio-temporal del hielo XV. [119] Otros investigadores argumentaron que el modelo P -1 sigue siendo el mejor (con el segundo mejor candidato de P 2 1 ), mientras que el refinamiento de Rietveld utilizando el grupo espacial Pmmn solo funciona bien para muestras mal ordenadas. Los parámetros de red, en particular b y c , son buenos indicadores de la formación del hielo XV. Combinando los cálculos de la teoría funcional de la densidad, construyeron con éxito un modelo completamente ordenado en P -1 y demostraron que los datos de difracción experimentales deberían analizarse utilizando grupos espaciales que permitan un orden completo del hidrógeno mientras que el modelo Pmmn solo acepta estructuras parcialmente ordenadas. [120] -->
Hielo XVII

En 2016, se anunció el descubrimiento de una nueva forma de hielo. [77] Caracterizada como un "hielo de agua poroso metaestable a temperaturas atmosféricas", esta nueva forma se descubrió tomando un hielo lleno y eliminando los componentes no acuosos, dejando atrás la estructura cristalina, de manera similar a cómo se sintetizó el hielo XVI, otra forma porosa de hielo, a partir de un hidrato de clatrato . [121] [122]
Para crear el hielo XVII, los investigadores primero produjeron hielo relleno en una fase estable llamada C0 a partir de una mezcla de hidrógeno (H2 ) y agua (H2O ) , usando temperaturas de 100 a 270 K (−173 a −3 °C; −280 a 26 °F) y presiones de 360 a 700 MPa (52.000 a 102.000 psi; 3.600 a 6.900 atm), y C2 son todas fases sólidas estables de una mezcla de moléculas de H2 y H2O , formadas a altas presiones. [121] [78] Aunque a veces se les denomina hidratos de clatrato (o clatratos), carecen de la estructura similar a una jaula que generalmente se encuentra en los hidratos de clatrato, y se les denomina más apropiadamente hielos rellenos. [121] Luego, el hielo lleno se coloca al vacío y la temperatura aumenta gradualmente hasta que el hidrógeno se libera de la estructura cristalina. [78] Si se mantiene a un rango de temperatura entre 110 y 120 K (−163 y −153 °C; −262 y −244 °F), después de aproximadamente dos horas, la estructura se habrá vaciado de cualquier molécula de hidrógeno detectable. [77] La forma resultante es metaestable a presión ambiente mientras está por debajo de 120 K (−153 °C; −244 °F), pero colapsa en hielo I h (hielo ordinario) cuando se lleva por encima de 130 K (−143 °C; −226 °F). [78] La estructura cristalina es de naturaleza hexagonal y los poros son canales helicoidales con un diámetro de aproximadamente 6,10 Å (6,10 × 10 −10 m; 2,40 × 10 −8 pulgadas). [77] [78]
Hielo cúbico
En 2020 se informó que se puede formar hielo cúbico a base de agua pesada (D2O ) a partir de hielo XVII. [29] Esto se hizo calentando polvo de hielo D2O XVII específicamente preparado . [ 29] El resultado estuvo libre de deformidades estructurales en comparación con el hielo cúbico estándar, o hielo I sd . [29] Este descubrimiento se informó casi al mismo tiempo que otro grupo de investigación anunció que pudieron obtener hielo cúbico D2O puro sintetizando primero hielo relleno en la fase C2 y luego descomprimiéndolo. [123]
Hielo XVIII (agua superiónica)
En 1988, se hicieron predicciones del llamado estado de agua superiónica. [124] En el agua superiónica, las moléculas de agua se rompen y los iones de oxígeno cristalizan en una red espaciada uniformemente mientras que los iones de hidrógeno flotan libremente dentro de la red de oxígeno. [125] Los iones de hidrógeno libremente móviles hacen que el agua superiónica sea casi tan conductora como los metales típicos, lo que la convierte en un conductor superiónico . [79] El hielo aparece de color negro. [126] [127] Es distinto del agua iónica , que es un estado líquido hipotético caracterizado por una sopa desordenada de iones de hidrógeno y oxígeno.
La evidencia inicial provino de mediciones ópticas de agua calentada por láser en una celda de yunque de diamante , [128] y de mediciones ópticas de agua impactada por láseres extremadamente potentes. [126] La primera evidencia definitiva de la estructura cristalina de la red de oxígeno en agua superiónica provino de mediciones de rayos X en agua impactada por láser que se informaron en 2019. [79] En 2005, Laurence Fried dirigió un equipo en el Laboratorio Nacional Lawrence Livermore (LLNL) para recrear las condiciones formativas del agua superiónica. Usando una técnica que implicaba aplastar moléculas de agua entre diamantes y sobrecalentarlas con láseres, observaron cambios de frecuencia que indicaban que se había producido una transición de fase . El equipo también creó modelos de computadora que indicaban que efectivamente habían creado agua superiónica. [129] En 2013, Hugh F. Wilson, Michael L. Wong y Burkhard Militzer en la Universidad de California, Berkeley publicaron un artículo que predecía la estructura reticular cúbica centrada en las caras que surgiría a presiones más altas. [130] Marius Millot y sus colegas encontraron evidencia experimental adicional en 2018 al inducir alta presión en el agua entre diamantes y luego aplicarle un pulso láser. [126] [127]
A partir de 2013 [actualizar], se teoriza que el hielo superiónico puede poseer dos estructuras cristalinas. A presiones superiores a 50 GPa (7.300.000 psi), se predice que el hielo superiónico adoptaría una estructura cúbica centrada en el cuerpo . Sin embargo, a presiones superiores a 100 GPa y temperaturas superiores a 2000 K, se predice que la estructura cambiaría a una red cúbica centrada en las caras más estable . [130]
En 2018, se confirmó la existencia de hielo superiónico en un entorno de laboratorio. Para crear la presión necesaria, los investigadores del LLNL comprimieron pequeñas cantidades de agua entre piezas de diamante. A 2500 MPa (360 000 psi), el agua se convirtió en hielo VII, una forma que es sólida a temperatura ambiente. Este hielo, atrapado dentro de las celdas de yunque de diamante , se llevó a la Universidad de Rochester para ser atacado con un láser. Durante menos de una milmillonésima de segundo, el hielo se sometió a condiciones similares a las del manto de un gigante de hielo . La temperatura en las celdas de diamante aumentó miles de grados y la presión aumentó a más de un millón de veces la de la atmósfera de la Tierra. [131] [132] El experimento concluyó que la corriente en el agua conductora era efectivamente transportada por iones en lugar de electrones y, por lo tanto, señaló que el agua era superiónica. [131] Experimentos más recientes del mismo equipo del LLNL utilizaron cristalografía de rayos X en gotas de agua impactadas con láser para determinar que los iones de oxígeno entran en una fase cúbica centrada en la cara, que se denominó hielo XVIII y se informó en la revista Nature en mayo de 2019. [79]
Hielo XIX
El primer informe sobre el hielo XIX fue publicado en 2018 por el grupo de Thomas Loerting de Austria. [80] Enfriaron el hielo VI dopado con HCl a 77 K a diferentes presiones entre 1,0 y 1,8 GPa para recopilar termogramas de calorimetría diferencial de barrido (DSC), espectro dieléctrico , espectro Raman y patrones de difracción de rayos X. En las señales de DSC, había una característica endotérmica a aproximadamente 110 K además de la endoterma correspondiente a la transición del hielo XV-VI. Además, los espectros Raman, las propiedades dieléctricas y la relación de los parámetros de red diferían de los del hielo XV. Con base en estas observaciones, propusieron la existencia de una segunda fase ordenada por hidrógeno del hielo VI, denominándola hielo beta-XV.
En 2019, Alexander Rosu-Finsen y Christoph Salzman argumentaron que no había necesidad de considerar que se trataba de una nueva fase del hielo, y propusieron un escenario de estado "vítreo profundo". [133] Según sus datos de DSC, el tamaño de la característica endotérmica depende no solo de la presión de recuperación del enfriamiento, sino también de la velocidad de calentamiento y la duración del recocido a 93 K. También recopilaron perfiles de difracción de neutrones de hielo VI/XV dopado con cloruro de deuterio recuperado por enfriamiento , D2O , preparado a diferentes presiones de 1,0, 1,4 y 1,8 GPa, para demostrar que no había diferencias significativas entre ellos. Concluyeron que la endoterma de baja temperatura se originó a partir de características cinéticas relacionadas con las transiciones vítreas de estados vítreos profundos de hielo desordenado VI.
La distinción entre los dos escenarios (nueva fase ordenada por hidrógeno vs. hielo VI desordenado vítreo profundo) se convirtió en una cuestión abierta y el debate entre los dos grupos ha continuado. Thoeny et al. (grupo de Loerting) [134] recopiló otra serie de espectros Raman de hielo beta-XV, e informó que (i) el hielo XV preparado por el protocolo informado previamente contiene dominios de hielo XV y beta-XV; (ii) al calentar, los espectros Raman del hielo beta-XV mostraron pérdida de orden H. En contraste, el grupo de Salzmann nuevamente argumentó a favor de la plausibilidad de un escenario de "estado vítreo profundo" basado en experimentos de difracción de neutrones y dispersión inelástica de neutrones. [135] Con base en sus resultados experimentales, el hielo VI y el hielo VI vítreo profundo comparten características muy similares basadas tanto en experimentos de dispersión elástica (difracción) como de dispersión inelástica, y son diferentes de las propiedades del hielo XV.
En 2021, tres grupos informaron individualmente de más evidencia cristalográfica de una nueva fase (hielo XIX): Yamane et al. (grupo de Hiroyuki Kagi y Kazuki Komatsu de Japón), Gasser et al. (grupo de Loerting) y el grupo de Salzmann. Yamane et al. [82] recopilaron perfiles de difracción de neutrones in situ ( es decir , a alta presión) y encontraron nuevas características de Bragg completamente diferentes tanto del hielo VI como del hielo XV. Realizaron un refinamiento de Rietveld de los perfiles basándose en la supercelda del hielo XV y propusieron algunos candidatos principales para el grupo espacial del hielo XIX: P-4, Pca21, Pcc2, P21/a y P21/c. También midieron los espectros dieléctricos in situ y determinaron los límites de fase de los hielos VI/XV/XIX. Encontraron que el signo de la pendiente del límite cambia de positivo a negativo a 1,6 GPa, lo que indica la existencia de dos fases diferentes mediante la relación de Clausius-Clapeyron .
Gasser et al. [136] también recogieron difractogramas de neutrones en polvo de hielos recuperados por enfriamiento rápido VI, XV y XIX y encontraron características cristalográficas similares a las informadas por Yamane et al., concluyendo que P-4 y Pcc2 son los candidatos plausibles para el grupo espacial. Tanto los resultados de Yamane et al. como los de Gasser et al. sugirieron una estructura parcialmente ordenada por hidrógeno. Gasser et al. también encontraron un efecto isotópico utilizando DSC; la endoterma de baja temperatura para el hielo XIX de D 2 O dopado con DCl fue significativamente menor que la del hielo XIX de H 2 O dopado con HCl, y que el dopaje de 0,5 % de H 2 O en D 2 O es suficiente para la transición de ordenamiento.
Varios meses después, Salzmann et al. publicaron un artículo basado en experimentos de difracción de neutrones en polvo in situ del hielo XIX. [137] En un cambio con respecto a sus informes anteriores, aceptaron la idea de la nueva fase (hielo XIX) ya que observaron características similares a los dos informes anteriores. Sin embargo, refinaron sus perfiles de difracción basándose en un modelo estructural desordenado (Pbcn) y argumentaron que las nuevas reflexiones de Bragg pueden explicarse por distorsiones del hielo VI, por lo que el hielo XIX todavía puede considerarse como un estado vítreo profundo del hielo VI. La estructura cristalina del hielo XIX, incluido el orden/desorden del hidrógeno, todavía está en debate a partir de 2022.
Implicaciones prácticas
El medio ambiente natural de la Tierra


Prácticamente todo el hielo de la biosfera es hielo I h (pronunciado: ice one h , también conocido como ice-phase-one ). El hielo I h exhibe muchas propiedades peculiares que son relevantes para la existencia de vida y la regulación del clima global . [138] Por ejemplo, su densidad es menor que la del agua líquida . Esto se atribuye a la presencia de enlaces de hidrógeno que hacen que los átomos se acerquen más en la fase líquida. [139] Debido a esto, el hielo I h flota en el agua, lo cual es muy inusual en comparación con otros materiales. La fase sólida de los materiales suele estar más compacta y ordenada y tiene una densidad mayor que la fase líquida. Cuando los lagos se congelan, lo hacen solo en la superficie, mientras que el fondo del lago permanece cerca de 4 °C (277 K; 39 °F) porque el agua es más densa a esta temperatura. Este comportamiento anómalo del agua y el hielo es lo que permite a los peces sobrevivir a los duros inviernos. La densidad del hielo I h aumenta cuando se enfría, hasta aproximadamente -211 °C (62 K; -348 °F); por debajo de esa temperatura, el hielo se expande nuevamente ( expansión térmica negativa ). [5] [6]
Además del hielo I h , ocasionalmente puede estar presente una pequeña cantidad de hielo I c en las nubes de la atmósfera superior. [140] Se cree que es responsable de la observación del halo de Scheiner , un anillo raro que se produce cerca de los 28 grados del Sol o la Luna. [141] Sin embargo, muchas muestras atmosféricas que anteriormente se describieron como hielo cúbico luego demostraron ser hielo desordenado apilado con simetría trigonal, [142] [143] [144] y se lo ha denominado la ″fase de hielo más facetada en un sentido literal y más general″. [145] Las primeras muestras verdaderas de hielo cúbico solo se informaron en 2020. [30] [123]
El agua de mar de baja densidad (LDA), también conocida como agua vítrea hiperextinguida, puede ser responsable de las nubes noctilucentes en la Tierra y generalmente se forma por deposición de vapor de agua en condiciones de frío o vacío. Las nubes de hielo se forman en y por debajo de la mesopausia de alta latitud de la Tierra (~90 km) donde se ha observado que las temperaturas caen por debajo de los 100 K. [146] Se ha sugerido que la nucleación homogénea de partículas de hielo da como resultado hielo amorfo de baja densidad. [147] Es probable que el hielo amorfo esté confinado a las partes más frías de las nubes y se cree que el hielo desordenado apilado I domina en otras partes de estas nubes mesosféricas polares . [148]
En 2018, se identificó el hielo VII entre las inclusiones encontradas en diamantes naturales . [149] Debido a esta demostración de que el hielo VII existe en la naturaleza, la Asociación Mineralógica Internacional clasificó debidamente al hielo VII como un mineral distinto . [150] El hielo VII se formó presumiblemente cuando el agua atrapada dentro de los diamantes retuvo la alta presión del manto profundo debido a la fuerza y rigidez de la red de diamantes, pero se enfrió a temperaturas superficiales, produciendo el entorno requerido de alta presión sin alta temperatura. [151]
Se cree que el hielo XI tiene una conformación más estable que el hielo I h , por lo que puede formarse en la Tierra. Sin embargo, la transformación es muy lenta. Según un informe, en condiciones antárticas se estima que tarda al menos 100.000 años en formarse sin la ayuda de catalizadores. [ cita requerida ] El hielo XI se buscó y se encontró en hielo antártico que tenía unos 100 años en 1998. [152] Sin embargo, un estudio posterior en 2004 no pudo reproducir este hallazgo después de estudiar el hielo antártico que tenía alrededor de 3000 años. [153] El estudio antártico de 1998 también afirmó que la temperatura de transformación (hielo XI => hielo I h ) es de −36 °C (237 K), que es mucho más alta que la temperatura del punto triple esperado mencionado anteriormente (72 K, ~0 Pa). El hielo XI también se encontró en experimentos con agua pura a muy baja temperatura (~10 K) y baja presión, condiciones que se cree que están presentes en la atmósfera superior. [154] Recientemente, [ ¿ cuándo? ] se descubrió que se formaban pequeños dominios de hielo XI en agua pura; su transición de fase de nuevo a hielo I h ocurrió a 72 K mientras se encontraba en condiciones de presión hidrostática de hasta 70 MPa. [155]
Industria humana
El hielo amorfo se utiliza en algunos experimentos científicos, especialmente en la microscopía crioelectrónica de biomoléculas. [156] Las moléculas individuales se pueden conservar para la obtención de imágenes en un estado cercano al que tienen en el agua líquida.
El hielo XVII puede adsorber y liberar repetidamente moléculas de hidrógeno sin degradar su estructura. [77] La cantidad total de hidrógeno que el hielo XVII puede adsorber depende de la cantidad de presión aplicada, pero las moléculas de hidrógeno pueden ser adsorbidas por el hielo XVII incluso a presiones tan bajas como unos pocos milibares [a] si la temperatura es inferior a 40 K (−233,2 °C; −387,7 °F). [77] Las moléculas de hidrógeno adsorbidas pueden luego liberarse, o desorberse , mediante la aplicación de calor. [157] Esta fue una propiedad inesperada del hielo XVII, y podría permitir su uso para el almacenamiento de hidrógeno , un problema que se menciona a menudo en la tecnología ambiental . [157]
Además de almacenar hidrógeno mediante compresión o licuefacción , también se puede almacenar dentro de una sustancia sólida, ya sea mediante un proceso químico reversible ( quimisorción ) o haciendo que las moléculas de hidrógeno se adhieran a la sustancia mediante la fuerza de van der Waals ( fisisorción ). Este último proceso puede ocurrir dentro del hielo XVII. [157] En la fisisorción, no hay reacción química y el enlace químico entre los dos átomos dentro de una molécula de hidrógeno permanece intacto. Debido a esto, el número de ciclos de adsorción-desorción que puede soportar el hielo XVII es "teóricamente infinito". [157]
Una ventaja significativa de usar hielo XVII como medio de almacenamiento de hidrógeno es el bajo costo de los únicos dos productos químicos involucrados: hidrógeno y agua. [157] Además, el hielo XVII ha demostrado la capacidad de almacenar hidrógeno en una relación molar de H2 a H2O superior al 40 %, más alta que la relación máxima teórica para los hidratos de clatrato sII , otro medio de almacenamiento potencial. [77] Sin embargo, si se usa hielo XVII como medio de almacenamiento, debe mantenerse a una temperatura de 130 K (−143 °C; −226 °F) o corre el riesgo de desestabilizarse. [157]
Espacio exterior
En el espacio exterior, el hielo cristalino hexagonal (la forma predominante que se encuentra en la Tierra) es extremadamente raro. Los ejemplos conocidos suelen estar asociados con la actividad volcánica. [158] En cambio, el agua en el medio interestelar está dominada por el hielo amorfo, lo que la convierte probablemente en la forma más común de agua en el universo. [159] [34]
El hielo amorfo se puede separar del hielo cristalino en función de su espectro infrarrojo cercano e infrarrojo. En longitudes de onda del infrarrojo cercano, las características de las líneas de absorción de agua de 1,65, 3,1 y 4,53 μm dependen de la temperatura del hielo y del orden de los cristales. [160] La intensidad máxima de la banda de 1,65 μm, así como la estructura de la banda de 3,1 μm, son particularmente útiles para identificar la cristalinidad del hielo de agua. [161] [162]
En longitudes de onda IR más largas, el hielo amorfo y cristalino tienen bandas de absorción característicamente diferentes en 44 y 62 μm, ya que el hielo cristalino tiene una absorción significativa en 62 μm, mientras que el hielo amorfo no la tiene. [163] Además, estas bandas se pueden utilizar como un indicador de temperatura a temperaturas muy bajas donde otros indicadores (como las bandas de 3,1 y 12 μm) fallan. [164] Esto es útil para estudiar el hielo en el medio interestelar y los discos circunestelares. Sin embargo, observar estas características es difícil porque la atmósfera es opaca en estas longitudes de onda, lo que requiere el uso de observatorios infrarrojos basados en el espacio.
Propiedades del hielo amorfo en el Sistema Solar
En general, el hielo amorfo puede formarse por debajo de ~130 K. [165] A esta temperatura, las moléculas de agua no pueden formar la estructura cristalina que se encuentra comúnmente en la Tierra. El hielo amorfo también puede formarse en la región más fría de la atmósfera terrestre, la mesosfera polar de verano, donde existen nubes noctilucentes . [166] Estas bajas temperaturas se alcanzan fácilmente en entornos astrofísicos como nubes moleculares, discos circunestelares y las superficies de objetos en el Sistema Solar exterior. En el laboratorio, el hielo amorfo se transforma en hielo cristalino si se calienta por encima de 130 K, aunque la temperatura exacta de esta conversión depende del entorno y de las condiciones de crecimiento del hielo. [167] La reacción es irreversible y exotérmica, liberando 1,26–1,6 kJ/mol. [167]
Un factor adicional para determinar la estructura del hielo de agua es la velocidad de deposición. Incluso si hace suficiente frío para formar hielo amorfo, se formará hielo cristalino si el flujo de vapor de agua sobre el sustrato es menor que un flujo crítico dependiente de la temperatura. [168] Es importante tener en cuenta este efecto en entornos astrofísicos donde el flujo de agua puede ser bajo. Por el contrario, el hielo amorfo puede formarse a temperaturas más altas de lo esperado si el flujo de agua es alto, como en los eventos de congelación repentina asociados con el criovulcanismo .
A temperaturas inferiores a 77 K, la irradiación de fotones ultravioleta, así como de electrones e iones de alta energía, puede dañar la estructura del hielo cristalino, transformándolo en hielo amorfo. [169] [163] El hielo amorfo no parece verse afectado significativamente por la radiación a temperaturas inferiores a 110 K, aunque algunos experimentos sugieren que la radiación podría reducir la temperatura a la que el hielo amorfo comienza a cristalizar. [163]
En 1994, Peter Jenniskens y David F. Blake demostraron que también se crea una forma de hielo amorfo de alta densidad durante la deposición de vapor de agua en superficies de baja temperatura (<30 K), como los granos interestelares. Las moléculas de agua no se alinean completamente para crear la estructura de jaula abierta del hielo amorfo de baja densidad. Muchas moléculas de agua terminan en posiciones intersticiales. Cuando se calienta por encima de los 30 K, la estructura se realinea y se transforma en la forma de baja densidad. [35] [41]
Nubes moleculares, discos circunestelares y la nebulosa solar primordial
Las nubes moleculares tienen temperaturas extremadamente bajas (~10 K), lo que las sitúa dentro del régimen de hielo amorfo. La presencia de hielo amorfo en las nubes moleculares ha sido confirmada mediante observaciones. [170] Cuando las nubes moleculares colapsan para formar estrellas, no se espera que la temperatura del disco circunestelar resultante supere los 120 K, lo que indica que la mayor parte del hielo debería permanecer en un estado amorfo. [168] Sin embargo, si la temperatura aumenta lo suficiente como para sublimar el hielo, este puede volver a condensarse en una forma cristalina, ya que la tasa de flujo de agua es muy baja. Se espera que este sea el caso en el disco circunestelar de IRAS 09371+1212, donde se observaron señales de hielo cristalizado a pesar de una temperatura baja de 30–70 K. [171]
En el caso de la nebulosa solar primordial, existe mucha incertidumbre en cuanto a la cristalinidad del hielo de agua durante las fases de formación del disco circunestelar y de los planetas. Si el hielo amorfo original sobrevivió al colapso de la nube molecular, entonces debería haberse conservado a distancias heliocéntricas más allá de la órbita de Saturno (~12 UA). [168]
Cometas
La posibilidad de la presencia de hielo de agua amorfo en los cometas y la liberación de energía durante la transición de fase a un estado cristalino fue propuesta por primera vez como un mecanismo para las explosiones de cometas. [172] La evidencia de hielo amorfo en los cometas se encuentra en los altos niveles de actividad observados en los cometas de período largo, Centauro y la familia Júpiter a distancias heliocéntricas más allá de ~6 UA. [173] Estos objetos son demasiado fríos para que la sublimación del hielo de agua, que impulsa la actividad de los cometas más cerca del Sol, tenga mucho efecto. Los modelos termodinámicos muestran que las temperaturas de la superficie de esos cometas están cerca de la temperatura de transición del hielo amorfo/cristalino de ~130 K, lo que respalda esta como una fuente probable de la actividad. [174] La cristalización descontrolada del hielo amorfo puede producir la energía necesaria para impulsar explosiones como las observadas en el cometa Centauro 29P/Schwassmann–Wachmann 1. [175] [176]
Objetos del cinturón de Kuiper
Con temperaturas de equilibrio de radiación de 40–50 K, [177] se espera que los objetos en el Cinturón de Kuiper tengan hielo de agua amorfo. Si bien se ha observado hielo de agua en varios objetos, [178] [179] la extrema debilidad de estos objetos hace que sea difícil determinar la estructura de los hielos. Las firmas de hielo de agua cristalino se observaron en 50000 Quaoar , tal vez debido a eventos de resurgimiento como impactos o criovulcanismo. [180]
Lunas heladas
El espectrómetro de mapeo de infrarrojo cercano (NIMS) en la nave espacial Galileo de la NASA mapeó espectroscópicamente el hielo de la superficie de los satélites joviales Europa , Ganimedes y Calisto . Las temperaturas de estas lunas varían de 90 a 160 K, [181] lo suficientemente cálidas como para que se espere que el hielo amorfo cristalice en escalas de tiempo relativamente cortas. Sin embargo, se encontró que Europa tiene principalmente hielo amorfo, Ganimedes tiene hielo amorfo y cristalino, y Calisto es principalmente cristalino. [182] Se cree que esto es el resultado de fuerzas en competencia: la cristalización térmica del hielo amorfo versus la conversión de hielo cristalino a amorfo por el flujo de partículas cargadas de Júpiter. Más cerca de Júpiter que las otras tres lunas, Europa recibe el nivel más alto de radiación y, por lo tanto, a través de la irradiación tiene el hielo más amorfo. Calisto es la más alejada de Júpiter, recibe el flujo de radiación más bajo y, por lo tanto, mantiene su hielo cristalino. Ganimedes, que se encuentra entre los dos, exhibe hielo amorfo en latitudes altas y hielo cristalino en latitudes más bajas. Se cree que esto es el resultado del campo magnético intrínseco de la luna, que canalizaría las partículas cargadas hacia latitudes más altas y protegería a las latitudes más bajas de la radiación. [182] El interior de Ganimedes probablemente incluye un océano de agua líquida con decenas a cientos de kilómetros de hielo en su base. [183]
El hielo superficial de la luna Encélado de Saturno fue cartografiado por el Espectrómetro de Cartografía Visual e Infrarroja (VIMS) de la sonda espacial Cassini de la NASA/ESA/ASI. La sonda encontró tanto hielo cristalino como amorfo, con un mayor grado de cristalinidad en las grietas en forma de " rayas de tigre " de la superficie y más hielo amorfo entre estas regiones. [160] El hielo cristalino cerca de las "rayas de tigre" podría explicarse por las temperaturas más altas causadas por la actividad geológica que es la presunta causa de las grietas. El hielo amorfo podría explicarse por la congelación repentina del criovulcanismo, la condensación rápida de moléculas de los géiseres de agua o la irradiación de partículas de alta energía de Saturno. [160] De manera similar, se cree que una de las capas internas de Titán contiene hielo VI. [184]
Es posible que en Europa exista hielo amorfo de densidad media, ya que se espera que allí también se den las condiciones experimentales de su formación. Es posible que la propiedad única del hielo amorfo de densidad media de liberar una gran cantidad de energía térmica después de liberarse de la compresión pueda ser responsable de los "terremotos de hielo" dentro de las capas de hielo gruesas. [21]
Planetas
Debido a que el hielo XI puede formarse teóricamente a bajas presiones a temperaturas entre 50 y 70 K (temperaturas presentes en entornos astrofísicos del sistema solar exterior y dentro de cráteres polares permanentemente sombreados en la Luna y Mercurio), el hielo XI se forma más fácilmente alrededor de 70 K (paradójicamente, tarda más en formarse a temperaturas más bajas). Extrapolando a partir de mediciones experimentales, se estima que tarda unos 50 años en formarse a 70 K y unos 300 millones de años a 50 K. [185] Se teoriza que está presente en lugares como las atmósferas superiores de Urano y Neptuno [106] y en Plutón y Caronte . [185]
El hielo VII puede comprender el fondo oceánico de Europa, así como planetas extrasolares (como Awohali y Enaiposha ) que están compuestos en gran parte de agua. [186] [187]
También podrían existir pequeños dominios de hielo XI en las atmósferas de Júpiter y Saturno. [106] El hecho de que puedan existir pequeños dominios de hielo XI a temperaturas de hasta 111 K ha hecho que algunos científicos especulen que puede ser bastante común en el espacio interestelar, con pequeñas "semillas de nucleación" que se extienden por el espacio y convierten el hielo regular, de forma muy similar al legendario hielo-nueve mencionado en La cuna del gato de Vonnegut . [106] [188] Los posibles roles del hielo XI en el espacio interestelar [185] [189] y la formación de planetas [190] han sido objeto de varios artículos de investigación. Hasta que se realice una confirmación observacional del hielo XI en el espacio exterior, la presencia de hielo XI en el espacio sigue siendo controvertida debido a la crítica antes mencionada planteada por Iitaka. [191] Los espectros de absorción infrarroja del hielo XI se estudiaron en 2009 en preparación para las búsquedas de hielo XI en el espacio. [192]
Se teoriza que los planetas gigantes helados Urano y Neptuno contienen una capa de agua superiónica. [193] [129] [194] [130] El aprendizaje automático y los métodos de energía libre predicen que las fases superiónicas compactas son estables en un amplio rango de temperatura y presión, y que una fase superiónica cúbica centrada en el cuerpo es cinéticamente favorecida, pero estable en una pequeña ventana de parámetros. [195] Por otro lado, también hay estudios que sugieren que otros elementos presentes en el interior de estos planetas, particularmente el carbono , pueden prevenir la formación de agua superiónica. [196] [197]
Notas
- ^ Un milibar equivale a 100 Pa (0,015 psi; 0,00099 atm).
Referencias
- ^ La Placa, SJ; Hamilton, WC; Kamb, B.; Prakash, A. (1972). "Sobre una estructura casi ordenada por protones para el hielo IX". Journal of Chemical Physics . 58 (2): 567–580. Bibcode :1973JChPh..58..567L. doi :10.1063/1.1679238.
- ^ Klotz, S.; Besson, JM; Hamel, G.; Nelmes, RJ; Loveday, JS; Marshall, WG (1999). "Hielo metaestable VII a baja temperatura y presión ambiental". Nature . 398 (6729): 681–684. Bibcode :1999Natur.398..681K. doi :10.1038/19480. S2CID 4382067.
- ^ Dutch, Stephen. «Estructura del hielo». Universidad de Wisconsin Green Bay. Archivado desde el original el 16 de octubre de 2016. Consultado el 12 de julio de 2017 .
- ^ Bjerrum, N (11 de abril de 1952). "Estructura y propiedades del hielo". Science . 115 (2989): 385–390. Bibcode :1952Sci...115..385B. doi :10.1126/science.115.2989.385. PMID 17741864.
- ^ ab Rottger, K.; Endriss, A.; Ihringer, J.; Doyle, S.; Kuhs, WF (1994). "Constantes de red y expansión térmica del hielo de H 2 O y D 2 O I h entre 10 y 265 K". Acta Crystallogr . B50 (6): 644–648. Código Bibliográfico :1994AcCrB..50..644R. doi :10.1107/S0108768194004933.
- ^ ab David TW Buckingham, JJ Neumeier, SH Masunaga y Yi-Kuo Yu (2018). "Expansión térmica de hielo monocristalino de H2O y D2O Ih". Physical Review Letters . 121 (18): 185505. Bibcode :2018PhRvL.121r5505B. doi : 10.1103/PhysRevLett.121.185505 . PMID 30444387.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ PW Bridgman (1912). "Agua, en forma líquida y en cinco formas sólidas, bajo presión". Actas de la Academia Estadounidense de Artes y Ciencias . 47 (13): 441–558. doi :10.2307/20022754. JSTOR 20022754.
- ^ Velikov, V.; Borick, S; Angell, CA (2001). "Estimación de la temperatura de transición del agua al vidrio basada en experimentos de agua vítrea hiperextinguida". Science . 294 (5550): 2335–8. Bibcode :2001Sci...294.2335V. doi :10.1126/science.1061757. PMID 11743196. S2CID 43859537.
- ^ Martelli, Fausto; Torquato, Salvatore; Giovambattista, Nicolas; Car, Roberto (2017-09-29). "Estructura a gran escala e hiperuniformidad de hielos amorfos". Physical Review Letters . 119 (13): 136002. arXiv : 1705.09961 . Código Bibliográfico :2017PhRvL.119m6002M. doi :10.1103/PhysRevLett.119.136002. PMID 29341697. S2CID 44864111.
- ^ Martelli, Fausto; Leoni, Fabio; Sciortino, Francesco; Russo, John (14 de septiembre de 2020). "Conexión entre fases líquidas y sólidas no cristalinas en agua". The Journal of Chemical Physics . 153 (10): 104503. Bibcode :2020JChPh.153j4503M. doi :10.1063/5.0018923. hdl : 11573/1440448 . ISSN 0021-9606. PMID 32933306. S2CID 221746507.
- ^ ab Conde, MM; Vega, C.; Tribello, GA; Slater, B. (2009). "El diagrama de fases del agua a presiones negativas: hielos virtuales". The Journal of Chemical Physics . 131 (34510): 034510. Bibcode :2009JChPh.131c4510C. doi :10.1063/1.3182727. PMID 19624212.

- ^ Militzer, Burkhard; Wilson, Hugh F. (2 de noviembre de 2010). "Se predicen nuevas fases del hielo de agua a presiones de megabar". Physical Review Letters . 105 (19): 195701. arXiv : 1009.4722 . Bibcode :2010PhRvL.105s5701M. doi :10.1103/PhysRevLett.105.195701. PMID 21231184. S2CID 15761164.
- ^ David, Carl (8 de agosto de 2016). "El diagrama de fases del hielo en '3-D' de Verwiebe reelaborado". Materiales educativos de química .
- ^ Wagner, Wolfgang; Saul, A.; Pruss, A. (mayo de 1994). "Ecuaciones internacionales para la presión a lo largo de la curva de fusión y a lo largo de la curva de sublimación de sustancias de agua ordinaria". Journal of Physical and Chemical Reference Data . 23 (3): 515–527. Bibcode :1994JPCRD..23..515W. doi :10.1063/1.555947.
- ^ Murphy, DM (2005). "Revisión de las presiones de vapor del hielo y el agua superenfriada para aplicaciones atmosféricas". Quarterly Journal of the Royal Meteorological Society . 131 (608): 1539–1565. Bibcode :2005QJRMS.131.1539M. doi : 10.1256/qj.04.94 . S2CID 122365938.
- ^ "Unidades básicas del SI". Bureau International des Poids et Mesures. Archivado desde el original el 16 de julio de 2012. Consultado el 31 de agosto de 2012 .
- ^ "Información para los usuarios sobre la propuesta de revisión del SI" (PDF) . Bureau International des Poids et Mesures. Archivado desde el original (PDF) el 21 de enero de 2018. Consultado el 6 de enero de 2019 .
- ^ Iglev, H.; Schmeisser, M.; Simeonidis, K.; Thaller, A.; Laubereau, A. (2006). "Sobrecalentamiento y fusión ultrarrápidos de hielo a granel". Nature . 439 (7073): 183–186. Bibcode :2006Natur.439..183I. doi :10.1038/nature04415. PMID 16407948. S2CID 4404036.
- ^ Köster KW, Fuentes-Landete V, Raidt A, Seidl M, Gainaru C, Loerting T; et al. (2018). "Corrección del autor: la dinámica mejorada por el dopaje con HCl desencadena una liberación de entropía de Pauling del 60 % en la transición del hielo XII-XIV". Nat Commun . 9 : 16189. Bibcode :2018NatCo...916189K. doi :10.1038/ncomms16189. PMC 6026910 . PMID 29923547.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Fuentes-Landete V; Köster KW; Böhmer R; Loerting T (2018). "Efectos isotópicos termodinámicos y cinéticos en la transición de orden-desorden del hielo XIV al hielo XII". Phys Chem Chem Phys . 20 (33): 21607–21616. Bibcode :2018PCCP...2021607F. doi : 10.1039/c8cp03786h . PMID 30101255. S2CID 51969440.
- ^ a b C Rosu-Finsen, Alejandro; Davies, Michael B.; Amón, Alfred; Wu, Han; Sella, Andrea; Michaelides, Angelos; Salzmann, Christoph G. (3 de febrero de 2023). "Hielo amorfo de densidad media". Ciencia . 379 (6631): 474–478. Código Bib : 2023 Ciencia... 379..474R. doi : 10.1126/science.abq2105. ISSN 0036-8075. PMID 36730416. S2CID 256504172.
- ^ Bernal, JD; Fowler, RH (1 de enero de 1933). "Una teoría del agua y la solución iónica, con especial referencia a los iones hidrógeno e hidroxilo". The Journal of Chemical Physics . 1 (8): 515. Bibcode :1933JChPh...1..515B. doi :10.1063/1.1749327.
- ^ Berg, Bernd A.; Muguruma, Chizuru; Okamoto, Yuko (21 de marzo de 2007). "Entropía residual de hielo ordinario a partir de simulaciones multicanónicas". Physical Review B . 75 (9): 092202. arXiv : cond-mat/0609211 . Bibcode :2007PhRvB..75i2202B. doi :10.1103/PhysRevB.75.092202. ISSN 1098-0121.
- ^ Pauling, Linus (1 de diciembre de 1935). "La estructura y la entropía del hielo y de otros cristales con cierta aleatoriedad en la disposición atómica". Revista de la Sociedad Química Americana . 57 (12): 2680–2684. doi :10.1021/ja01315a102.
- ^ Petrenko, Victor F.; Whitworth, Robert W. (17 de enero de 2002). "2. Hielo Ih". Física del hielo. Oxford University Press. doi :10.1093/acprof:oso/9780198518945.003.0002. ISBN 978-0-19-851894-5.
- ^ Nagle, JF (1966-08-01). "Estadísticas reticulares de cristales unidos por enlaces de hidrógeno. I. La entropía residual del hielo". Journal of Mathematical Physics . 7 (8): 1484–1491. Bibcode :1966JMP.....7.1484N. doi :10.1063/1.1705058. ISSN 0022-2488.
- ^ Hollins, GT (diciembre de 1964). "Estadísticas configuracionales y la constante dieléctrica del hielo". Actas de la Physical Society . 84 (6): 1001–1016. Bibcode :1964PPS....84.1001H. doi :10.1088/0370-1328/84/6/318. ISSN 0370-1328.
- ^ Flatz, cristiano; Hohenwarter, Stefan (18 de febrero de 2021). "Neue kristalline Eisform aus Innsbruck". Universität Innsbruck (en alemán) . Consultado el 18 de febrero de 2021 .
- ^ abcd del Rosso, Leonardo; Celli, Milva; Grazzi, Francesco; Catti, Michele; Hansen, Thomas C.; Fortes, A. Domingo; Ulivi, Lorenzo (junio de 2020). "Hielo cúbico Ic sin defectos de apilamiento obtenido del hielo XVII". Materiales de la naturaleza . 19 (6): 663–668. arXiv : 1907.02915 . Código Bib : 2020NatMa..19..663D. doi :10.1038/s41563-020-0606-y. PMID 32015533. S2CID 195820566.
- ^ ab Salzmann, Christoph G.; Murray, Benjamin J. (junio de 2020). "El hielo se vuelve completamente cúbico". Nature Materials . 19 (6): 586–587. Bibcode :2020NatMa..19..586S. doi :10.1038/s41563-020-0696-6. PMID 32461682. S2CID 218913209.
- ^ Murray, BJ; Bertram, AK (2006). "Formación y estabilidad del hielo cúbico en gotas de agua". Phys. Chem. Chem. Phys . 8 (1): 186–192. Bibcode :2006PCCP....8..186M. doi :10.1039/b513480c. hdl : 2429/33770 . PMID 16482260.
- ^ Murray, BJ (2008). "La formación mejorada de hielo cúbico en gotas acuosas de ácido orgánico". Env. Res. Lett . 3 (2): 025008. Bibcode :2008ERL.....3b5008M. doi : 10.1088/1748-9326/3/2/025008 .
- ^ Dowell, LG; Rinfret, AP (diciembre de 1960). "Formas de hielo a baja temperatura estudiadas por difracción de rayos X". Nature . 188 (4757): 1144–1148. Bibcode :1960Natur.188.1144D. doi :10.1038/1881144a0. ISSN 0028-0836. S2CID 4180631.
- ^ abc Pappas, Stephanie (2 de febrero de 2023). "Los científicos crearon un nuevo y extraño tipo de hielo que es casi exactamente tan denso como el agua". Live Science .
- ^ abcd Jenniskens, Peter; Blake, David F. (1994). "Transiciones estructurales en hielo de agua amorfo e implicaciones astrofísicas". Science . 265 (5173): 753–6. Bibcode :1994Sci...265..753J. doi :10.1126/science.11539186. PMID 11539186.
- ^ Jenniskens P.; Blake DF (1996). "Cristalización de hielo de agua amorfo en el sistema solar". Astrophysical Journal . 473 (2): 1104–13. Bibcode :1996ApJ...473.1104J. doi : 10.1086/178220 . PMID 11539415. S2CID 33622340.
- ^ Jenniskens P.; Banham SF; Blake DF; McCoustra MR (julio de 1997). "Agua líquida en el dominio del hielo cristalino cúbico Ic". Journal of Chemical Physics . 107 (4): 1232–41. Bibcode :1997JChPh.107.1232J. doi :10.1063/1.474468. PMID 11542399.
- ^ "Los científicos crearon un nuevo tipo de hielo que podría existir en lunas distantes". Nature . 4 de febrero de 2023.
- ^ Sullivan, Will (3 de febrero de 2023). «Los científicos han creado un nuevo tipo de hielo: parece un polvo blanco y tiene casi la misma densidad que el agua líquida». Revista Smithsonian . Consultado el 4 de febrero de 2023 .
- ^ abcd Mishima O.; Calvert LD; Whalley E. (1984). "'Fusión de hielo' a 77 K y 10 kbar: un nuevo método para fabricar sólidos amorfos". Nature . 310 (5976): 393–395. Bibcode :1984Natur.310..393M. doi :10.1038/310393a0. S2CID 4265281.
- ^ ab Jenniskens P.; Blake DF; Wilson MA; Pohorille A. (1995). "Hielo amorfo de alta densidad, la escarcha sobre granos interestelares". Astrophysical Journal . 455 : 389. Bibcode :1995ApJ...455..389J. doi :10.1086/176585. hdl : 2060/19980018148 . S2CID 122950585.
- ^ Mishima, O.; Calvert, LD; Whalley, E. (1985). "Una transición aparentemente de primer orden entre dos fases amorfas de hielo inducida por la presión". Nature . 314 (6006): 76–78. Bibcode :1985Natur.314...76M. doi :10.1038/314076a0. S2CID 4241205.
- ^ O. Mishima (1996). "Relación entre la fusión y la amorfización del hielo". Nature . 384 (6609): 546–549. Código Bibliográfico :1996Natur.384..546M. doi :10.1038/384546a0. S2CID 4274283.
- ^ Loerting, Thomas ; Salzmann, Christoph; Kohl, Ingrid; Mayer, Erwin; Hallbrucker, Andreas (2001). "Un segundo "estado" estructural distinto de hielo amorfo de alta densidad a 77 K y 1 bar". Química física Física química . 3 (24): 5355–5357. Bibcode :2001PCCP....3.5355L. doi :10.1039/b108676f. S2CID 59485355.
- ^ abcdefg Hobbs, Peter V. (6 de mayo de 2010). Física del hielo. Oxford University Press . pp. 61–70. ISBN 9780199587711. Recuperado el 6 de diciembre de 2014 .
- ^ ab Chaplin, Martin. "Hielo-dos (Hielo II)". Estructura y ciencia del agua . Universidad South Bank de Londres .
- ^ Chaplin, Martin. "Hielo-tres (Hielo III)". Estructura y ciencia del agua . Universidad South Bank de Londres .
- ^ Chaplin, Martin. "Hielo cuatro (Hielo IV)". Estructura y ciencia del agua . Universidad South Bank de Londres .
- ^ Salzmann, Christoph G.; Rosu-Finsen, Alexander; Sharif, Zainab; Radaelli, Paolo G.; Finney, John L. (1 de abril de 2021). "Análisis cristalográfico detallado de la transición de fase de ordenamiento de hidrógeno del hielo V al hielo XIII". The Journal of Chemical Physics . 154 (13). AIP Publishing. Código Bibliográfico :2021JChPh.154m4504S. doi :10.1063/5.0045443. ISSN 0021-9606. PMID 33832256.
- ^ ab Chaplin, Martin. "Hielo cinco (Hielo V)". Estructura y ciencia del agua . Universidad South Bank de Londres .
- ^ Drost-Hansen, W. (14 de noviembre de 1969). "La estructura y las propiedades del agua". D. Eisenberg y W. Kauzmann. Oxford University Press, Nueva York, 1969. xiv + 300 pp., illus. Tela, $10; papel, $4.50. Science . 166 (3907): 861. doi :10.1126/science.166.3907.861. ISSN 0036-8075.
- ^ Chaplin, Martin. "Hielo cinco (Hielo V)". Estructura y ciencia del agua . Universidad South Bank de Londres .
- ^ Kamb, B.; Prakash, A.; Knobler, C. (mayo de 1967). "Estructura del hielo. V". Acta Crystallographica . 22 (5): 706–715. Código Bibliográfico :1967AcCry..22..706K. doi :10.1107/S0365110X67001409.
- ^ Bridgman, PW (1912). "Agua, en forma líquida y en cinco formas sólidas, bajo presión". Actas de la Academia Estadounidense de Artes y Ciencias . 47 (13): 441–558. doi :10.2307/20022754. JSTOR 20022754.
- ^ Informes: Estructura del hielo VI science.sciencemag.org, B. Kamb, 8 de octubre de 1965.
- ^ Chaplin, Martin. "Estructura del hielo seis (hielo VI)". Estructura y ciencia del agua . Universidad South Bank de Londres .
- ^ Yao, Shu-Kai; Zhang, Peng; Zhang, Ying; Lu, Ying-Bo; Yang, Tian-Lin; Suna, Bai-Gong; Yuan, Zhen-Yu; Luo, Hui-Wen (21 de junio de 2017). "Análisis informático de las vibraciones de la red del hielo VIII". Real Sociedad de Avances en Química . 7 (51): 31789–31794. Código Bib : 2017RSCAD...731789Y. doi : 10.1039/C7RA05563C .
- ^ Kamb, Barclay; Davis, Briant L. (1 de diciembre de 1964). "Ice Vii, the Densest Form of Ice" (Hielo VII, la forma más densa del hielo). Actas de la Academia Nacional de Ciencias . 52 (6): 1433–1439. Bibcode :1964PNAS...52.1433K. doi : 10.1073/pnas.52.6.1433 . PMC 300465 . PMID 16591242.
- ^ "Hielo VII (hielo-siete)".
- ^ ab Grande, Zachary M.; et al. (2022). "Transiciones de simetría impulsadas por la presión en hielo denso de H2O". APS Physics . 105 (10): 104109. Bibcode :2022PhRvB.105j4109G. doi :10.1103/PhysRevB.105.104109. OSTI 1989084. S2CID 247530544.
- ^ Whalley, E.; Davidson, DW; Heath, JBR (1 de diciembre de 1966). "Propiedades dieléctricas del hielo VII. Hielo VIII: una nueva fase del hielo". The Journal of Chemical Physics . 45 (11): 3976–3982. Bibcode :1966JChPh..45.3976W. doi :10.1063/1.1727447.
- ^ ab Whalley, E.; Heath, JBR; Davidson, DW (1 de marzo de 1968). "Hielo IX: una fase antiferroeléctrica relacionada con el hielo III". The Journal of Chemical Physics . 48 (5): 2362–2370. Código Bibliográfico :1968JChPh..48.2362W. doi :10.1063/1.1669438.
- ^ La Placa, Sam J.; Hamilton, Walter C.; Kamb, Barclay; Prakash, Anand (15 de enero de 1973). "Sobre una estructura casi ordenada por protones para el hielo IX". The Journal of Chemical Physics . 58 (2): 567–580. Bibcode :1973JChPh..58..567L. doi :10.1063/1.1679238. ISSN 0021-9606.
- ^ Kim, Shi En (24 de marzo de 2022). "Dentro de la controvertida creación de 'ice X'". Popular Science .
- ^ Chaplin, Martinwork=Estructura del agua y ciencia. "Hielo-siete (Hielo VII)". Universidad South Bank de Londres .
- ^ Hansen, Thomas C. (26 de mayo de 2021). "La eterna búsqueda de nuevas fases de hielo". Nature Communications . 12 (1): 3161. Bibcode :2021NatCo..12.3161H. doi : 10.1038/s41467-021-23403-6 . PMC 8154907 . PMID 34039991.
- ^ Chaplin, Martin. "Hielo once (hielo XI)". Estructura y ciencia del agua . Universidad South Bank de Londres .
- ^ C. Lobban, JL Finney y WF Kuhs, La estructura de una nueva fase del hielo, Nature 391, 268–270, 1998
- ^ ab Salzmann, Christoph G.; Radaelli, Paolo G.; Hallbrucker, Andreas; Mayer, Erwin; Finney, John L. (24 de marzo de 2006). "La preparación y las estructuras de las fases de hielo ordenadas por hidrógeno". Science . 311 (5768): 1758–1761. Bibcode :2006Sci...311.1758S. doi :10.1126/science.1123896. PMID 16556840. S2CID 44522271.
- ^ abcdefg Chaplin, Martin. "Hielo doce (Hielo XII)". Estructura y ciencia del agua . Universidad South Bank de Londres .
- ^ Salzmann CG, Radaelli PG, Hallbrucker A, Mayer E, Finney JL (2006). "La preparación y las estructuras de las fases de hielo ordenadas por hidrógeno". Science . 311 (5768): 1758–61. Bibcode :2006Sci...311.1758S. doi :10.1126/science.1123896. PMID 16556840. S2CID 44522271.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Sanders, Laura (11 de septiembre de 2009). "Una bola de nieve muy especial". Science News . Archivado desde el original el 14 de septiembre de 2009 . Consultado el 11 de septiembre de 2009 .
- ^ ab Falenty, A.; Hansen, TC; Kuhs, WF (2014). "Formación y propiedades del hielo XVI obtenido mediante el vaciado de un hidrato de clatrato de tipo sII". Nature . 516 (7530): 231–233. Bibcode :2014Natur.516..231F. doi :10.1038/nature14014. PMID 25503235. S2CID 4464711.

- ^ Jacobson, Liam C.; Hujo, Waldemar; Molinero, Valeria (2009). "Estabilidad termodinámica y crecimiento de hidratos de clatrato libres de huésped: una fase cristalina de baja densidad del agua". Journal of Physical Chemistry B . 113 (30): 10298–10307. doi : 10.1021/jp903439a . PMID 19585976.

- ^ Algara-Siller, G.; Lehtinen, O.; Wang, FC; Nair, RR; Kaiser, U.; Wu, HA; Geim, AK; Grigorieva, IV (26 de marzo de 2015). "Hielo cuadrado en nanocapilares de grafeno". Nature . 519 (7544): 443–445. arXiv : 1412.7498 . Código Bibliográfico :2015Natur.519..443A. doi :10.1038/nature14295. PMID 25810206. S2CID 4462633.
- ^ ab "A temperatura ambiente, al intercalar agua entre grafeno se forman cristales de hielo cuadrados". ZME Science . 2015-03-27 . Consultado el 2018-05-02 .
- ^ abcdefghi del Rosso, Leonardo; Celli, Milva; Ulivi, Lorenzo (7 de noviembre de 2016). "Nuevo hielo de agua poroso metaestable a presión atmosférica obtenido vaciando un hielo lleno de hidrógeno". Nature Communications . 7 (1): 13394. arXiv : 1607.07617 . Bibcode :2016NatCo...713394D. doi :10.1038/ncomms13394. PMC 5103070 . PMID 27819265.
- ^ abcde Chaplin, Martin. "Hielo diecisiete (Hielo XVII)". Estructura y ciencia del agua . Universidad South Bank de Londres .
- ^ abcd Millot, Marius; Coppari, Federica; Rygg, J. Ryan; Correa Barrios, Antonio; Hamel, Sebastien; Swift, Damian C.; Eggert, Jon H. (8 de mayo de 2019). "Difracción de rayos X de nanosegundos de hielo de agua superiónico comprimido por choque". Nature . 569 (7755): 251–255. Bibcode :2019Natur.569..251M. doi :10.1038/s41586-019-1114-6. OSTI 1568026. PMID 31068720. S2CID 256768272.
- ^ abc Gasser, TM; Thoeny, AV; Plaga, LJ; Köster, KW; Etter, M; Böhmer, R; et al. (2018). "Experimentos que indican una segunda fase de hielo VI ordenada por hidrógeno". Chem Sci . 9 (18): 4224–4234. doi :10.1039/c8sc00135a. PMC 5942039 . PMID 29780552.
- ^ abc Metcalfe, Tom (9 de marzo de 2021). "Descubiertos cristales exóticos de 'hielo 19'". Live Science .
- ^ ab Yamane R, Komatsu K, Gouchi J, Uwatoko Y, Machida S, Hattori T, Kagi H; et al. (2021). "Evidencia experimental de la existencia de una segunda fase parcialmente ordenada del hielo VI". Comuna Nacional . 12 (1): 1129. Bibcode : 2021NatCo..12.1129Y. doi :10.1038/s41467-021-21351-9. PMC 7893076 . PMID 33602936.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Shephard, JJ, Slater, B., Harvey, P., Hart, M., Bull, CL, Bramwell, ST, Salzmann, CG (2018), "Desaparición inducida por dopaje del hielo II del diagrama de fases del agua", Nature Physics , 14 (6), Springer Science and Business Media LLC: 569–572, Bibcode :2018NatPh..14..569S, doi :10.1038/s41567-018-0094-z, S2CID 54544973
- ^ Nakamura, T., Matsumoto, M., Yagasaki, T., Tanaka, H. (2015), "Estabilidad termodinámica del hielo II y su contraparte desordenada por hidrógeno: papel de la energía del punto cero", The Journal of Physical Chemistry B , 120 (8), American Chemical Society (ACS): 1843–1848, doi :10.1021/acs.jpcb.5b09544, PMID 26595233
- ^ Engelhardt, H., Kamb, B. (1981), "Estructura del hielo IV, una fase metaestable de alta presión", The Journal of Chemical Physics , 75 (12), AIP Publishing: 5887–5899, Bibcode :1981JChPh..75.5887E, doi :10.1063/1.442040
- ^ Shephard, JJ, Ling, S., Sosso, GC, Michaelides, A., Slater, B., Salzmann, CG (2017), "¿Es el hielo amorfo de alta densidad simplemente un estado "descarrilado" a lo largo de la ruta del hielo I al hielo IV?", The Journal of Physical Chemistry Letters , 8 (7), American Chemical Society (ACS): 1645–1650, arXiv : 1701.05398 , doi : 10.1021/acs.jpclett.7b00492, PMID 28323429, S2CID 13662778
- ^ Engelhardt, H., Whalley, E. (1979), "El espectro infrarrojo del hielo IV en el rango 4000–400 cm−1", The Journal of Chemical Physics , 71 (10), AIP Publishing: 4050–4051, doi :10.1063/1.438173
- ^ Salzmann, CG, Kohl, I., Loerting, T., Mayer, E., Hallbrucker, A. (2003), "Estudio espectroscópico Raman sobre enlaces de hidrógeno en hielo recuperado IV", The Journal of Physical Chemistry B , 107 (12), American Chemical Society (ACS): 2802–2807, doi :10.1021/jp021534k
- ^ Colin Lobban (1998), Estudios de difracción de neutrones en hielos, University College London, ProQuest 1752797359
- ^ Klotz, S., Hamel, G., Loveday, JS, Nelmes, RJ, Guthrie, M. (2003), "Recristalización de hielo HDA bajo presión mediante difracción de neutrones in situ a 3,9 GPa", Zeitschrift für Kristallographie - Crystalline Materiales , 218 (2), Walter de Gruyter GmbH: 117–122, Bibcode :2003ZK....218..117K, doi :10.1524/zkri.218.2.117.20669, S2CID 96109290
- ^ Bridgman, PW (1935), "Las relaciones presión-volumen-temperatura del líquido y el diagrama de fases del agua pesada", The Journal of Chemical Physics , 3 (10), AIP Publishing: 597–605, Bibcode :1935JChPh...3..597B, doi :10.1063/1.1749561
- ^ Evans, LF (1967), "Nucleación selectiva de los hielos de alta presión", Journal of Applied Physics , 38 (12), AIP Publishing: 4930–4932, Bibcode :1967JAP....38.4930E, doi :10.1063/1.1709255
- ^ Salzmann, CG, Loerting, T. , Kohl, I., Mayer, E., Hallbrucker, A. (2002), "Hielo puro IV a partir de hielo amorfo de alta densidad", The Journal of Physical Chemistry B , 106 (22), American Chemical Society (ACS): 5587–5590, doi :10.1021/jp014391v
- ^ Salzmann, CG; Radaelli, PG; Slater, B; Finney, JL (2011), "El polimorfismo del hielo: cinco preguntas sin resolver.", Phys Chem Chem Phys , 13 (41): 18468–80, Bibcode :2011PCCP...1318468S, doi :10.1039/c1cp21712g, PMID 21946782
- ^ Rosu-Finsen, A., Salzmann, CG (2022), "¿Es la presión la clave para ordenar el hidrógeno en el hielo IV?", Chemical Physics Letters , 789 , Elsevier BV: 139325, Bibcode :2022CPL...78939325R, doi :10.1016/j.cplett.2021.139325, S2CID 245597764
- ^ Pruzan, Ph.; Chervin, JC y Canny, B. (1993). "Dominio de estabilidad de la fase de hielo VIII ordenada por protones a muy alta presión y baja temperatura". Journal of Chemical Physics . 99 (12): 9842–9846. Bibcode :1993JChPh..99.9842P. doi :10.1063/1.465467..
- ^ Hemley, RJ; Jephcoat, AP; Mao, HK; et al. (1987), "Compresión estática de hielo de H2O a 128 GPa (1,28 Mbar)", Nature , 330 (6150): 737–740, Bibcode :1987Natur.330..737H, doi :10.1038/330737a0, S2CID 4265919.
- ^ Katoh, E. (15 de febrero de 2002). "Difusión protónica en hielo de alta presión VII". Science . 29=5558 (5558): 1264–1266. Bibcode :2002Sci...295.1264K. doi :10.1126/science.1067746. PMID 11847334. S2CID 38999963.
- ^ Fan, Xiaofeng; Bing, Dan; Zhang, Jingyun; Shen, Zexiang; Kuo, Jer-Lai (1 de octubre de 2010). "Predicción de las estructuras ordenadas por enlaces de hidrógeno del hielo Ih, II, III, VI y el hielo VII: métodos DFT con un conjunto basado en la localización" (PDF) . Ciencia de materiales computacionales . 49 (4): S170–S175. doi :10.1016/j.commatsci.2010.04.004. Archivado desde el original (PDF) el 14 de julio de 2014 . Consultado el 24 de abril de 2012 .
- ^ Dengel, O.; Eckener, U.; Plitz, H.; Riehl, N. (1 de mayo de 1964). "Comportamiento ferroeléctrico del hielo". Physics Letters . 9 (4): 291–292. Bibcode :1964PhL.....9..291D. doi :10.1016/0031-9163(64)90366-X.
- ^ Kawada, Shuji (1 de mayo de 1972). "Dispersión dieléctrica y transición de fase de hielo dopado con KOH". Revista de la Sociedad de Física de Japón . 32 (5): 1442. Código Bibliográfico :1972JPSJ...32.1442K. doi :10.1143/JPSJ.32.1442.
- ^ Tajima, Yoshimitsu; Matsuo, Takasuke; Suga, Hiroshi (1984). "Estudio calorimétrico de la transición de fase en hielo hexagonal dopado con hidróxidos alcalinos". Revista de Física y Química de Sólidos . 45 (11–12): 1135–1144. Código Bibliográfico :1984JPCS...45.1135T. doi :10.1016/0022-3697(84)90008-8.
- ^ Matsuo, Takasuke; Tajima, Yoshimitsu; Suga, Hiroshi (1986). "Estudio calorimétrico de una transición de fase en hielo D 2 O I h dopado con KOD: Ice XI". Revista de Física y Química de Sólidos . 47 (2): 165–173. Código Bibliográfico :1986JPCS...47..165M. doi :10.1016/0022-3697(86)90126-5.
- ^ Castro Neto, A.; Pujol, P.; Fradkin, E. (2006). "Hielo: Un sistema de protones fuertemente correlacionado". Physical Review B . 74 (2): 024302. arXiv : cond-mat/0511092 . Código Bibliográfico :2006PhRvB..74b4302C. doi :10.1103/PhysRevB.74.024302. S2CID 102581583.
- ^ Arakawa, Masashi; Kagi, Hiroyuki; Fukazawa, Hiroshi (2010). "Efectos del recocido en el ordenamiento del hidrógeno en hielo dopado con KOD observados mediante difracción de neutrones". Journal of Molecular Structure . 972 (1–3): 111–114. Bibcode :2010JMoSt.972..111A. doi :10.1016/j.molstruc.2010.02.016.
- ^ abcd Arakawa, Masashi; Kagi, Hiroyuki; Fernandez-Baca, Jaime A.; Chakoumakos, Bryan C.; Fukazawa, Hiroshi (17 de agosto de 2011). "La existencia del efecto de memoria en el ordenamiento del hidrógeno en el hielo: el efecto hace que el hielo sea atractivo". Geophysical Research Letters . 38 (16): n/a. Bibcode :2011GeoRL..3816101A. doi : 10.1029/2011GL048217 .
- ^ K. Abe, Y. Ootake y T. Shigenari, Estudio de dispersión Raman de un monocristal de hielo XI ordenado por protones , en Física y química del hielo, ed. W. Kuhs (Royal Society of Chemistry, Cambridge, 2007) pp 101–108
- ^ Abe, K.; Shigenari, T. (2011). "Espectros Raman de la fase XI ordenada por protones de ICE I. Vibraciones traslacionales por debajo de 350 cm-1, J". The Journal of Chemical Physics . 134 (10): 104506. Bibcode :2011JChPh.134j4506A. doi :10.1063/1.3551620. PMID 21405174.
- ^ Raza, Zamaan; Alfè, Dario (28 de noviembre de 2011). "Ordenamiento de protones en hielo cúbico y hielo hexagonal; una posible nueva fase de hielo—XIc". Química física Física química . 13 (44): 19788–95. Bibcode :2011PCCP...1319788R. doi :10.1039/c1cp22506e. PMID 22009223. S2CID 31673433.
- ^ Bramwell, Steven T. (21 de enero de 1999). «Hielo ferroeléctrico». Nature . 397 (6716): 212–213. Bibcode :1999Natur.397..212B. doi : 10.1038/16594 . S2CID 204990667.
- ^ Iedema, MJ; Dresser, MJ; Doering, DL; Rowland, JB; Hess, WP; Tsekouras, AA; Cowin, JP (1 de noviembre de 1998). "Ferroelectricidad en hielo de agua". The Journal of Physical Chemistry B . 102 (46): 9203–9214. doi :10.1021/jp982549e. S2CID 97894870.
- ^ Su, Xingcai; Lianos, L.; Shen, Y.; Somorjai, Gabor (1998). "Hielo ferroeléctrico inducido por la superficie en Pt(111)". Physical Review Letters . 80 (7): 1533–1536. Código Bibliográfico :1998PhRvL..80.1533S. doi :10.1103/PhysRevLett.80.1533. S2CID 121266617.
- ^ Zhao, H.-X.; Kong, X.-J.; Li, H.; Jin, Y.-C.; Long, L.-S.; Zeng, XC; Huang, R.-B.; Zheng, L.-S. (14 de febrero de 2011). "Transición del agua unidimensional al hielo ferroeléctrico dentro de una arquitectura supramolecular". Actas de la Academia Nacional de Ciencias . 108 (9): 3481–3486. Bibcode :2011PNAS..108.3481Z. doi : 10.1073/pnas.1010310108 . PMC 3048133 . PMID 21321232.
- ^ Knight, Chris; Singer, Sherwin J. (19 de octubre de 2005). "Predicción de una transición de fase a una forma ordenada de enlace de hidrógeno de hielo VI". The Journal of Physical Chemistry B . 109 (44). American Chemical Society (ACS): 21040–21046. doi :10.1021/jp0540609. ISSN 1520-6106. PMID 16853726.
- ^ Sanders, Laura (11 de septiembre de 2009). «Super-Dense Frozen Water Breaks Final Ice Frontier». Wired . Condé Nast . Consultado el 13 de septiembre de 2009 .
- ^ Salzmann, Christoph G.; Radaelli, Paolo G.; Mayer, Erwin; Finney, John L. (2009). "Hielo XV: una nueva fase termodinámicamente estable del hielo". Physical Review Letters . 103 (10): 105701. arXiv : 0906.2489 . Código Bibliográfico :2009PhRvL.103j5701S. doi :10.1103/PhysRevLett.103.105701. PMID 19792330. S2CID 13999983.
- ^ Shephard, Jacob J.; Salzmann, Christoph G. (2015). "La cinética compleja de la transición de fase de ordenamiento del hidrógeno del hielo VI al hielo XV". Chemical Physics Letters . 637 . Elsevier BV: 63–66. arXiv : 1507.02665 . Bibcode :2015CPL...637...63S. doi :10.1016/j.cplett.2015.07.064. ISSN 0009-2614.
- ^ Rosu-Finsen, Alexander; Salzmann, Christoph G. (28 de junio de 2018). "Evaluación comparativa de dopantes ácidos y básicos con respecto a la habilitación de las transiciones de fase de ordenamiento de hidrógeno de hielo V a XIII y de hielo VI a XV". The Journal of Chemical Physics . 148 (24). AIP Publishing: 244507. arXiv : 1801.03812 . Bibcode :2018JChPh.148x4507R. doi :10.1063/1.5022159. ISSN 0021-9606. PMID 29960300.
- ^ Komatsu, K.; Noritake, F.; Machida, S.; Sano-Furukawa, A.; Hattori, T.; Yamane, R.; Kagi, H. (4 de julio de 2016). "Estado del hielo parcialmente ordenado XV". Informes científicos . 6 (1). Springer Science and Business Media LLC: 28920. Bibcode : 2016NatSR...628920K. doi :10.1038/srep28920. ISSN 2045-2322. PMC 4931510 . PMID 27375120.
- ^ Salzmann, Christoph G.; Slater, Ben; Radaelli, Paolo G.; Finney, John L.; Shephard, Jacob J.; Rosillo-Lopez, Martin; Hindley, James (22 de noviembre de 2016). "Análisis cristalográfico detallado de la transición de fase de ordenamiento del hidrógeno del hielo VI al hielo XV". The Journal of Chemical Physics . 145 (20). AIP Publishing. arXiv : 1607.04794 . Bibcode :2016JChPh.145t4501S. doi :10.1063/1.4967167. ISSN 0021-9606. PMID 27908115.
- ^ abc Liu, Yuan; Huang, Yingying; Zhu, Chongqin; Li, Hui; Zhao, Jijun; Wang, Lu; Ojamäe, Lars; Francisco, Joseph S.; Zeng, Xiao Cheng (25 de junio de 2019). "Un hielo poroso de densidad ultrabaja con la cavidad interna más grande identificada en el diagrama de fases del agua". Actas de la Academia Nacional de Ciencias . 116 (26): 12684–12691. Bibcode :2019PNAS..11612684L. doi : 10.1073/pnas.1900739116 . PMC 6600908 . PMID 31182582.
- ^ Chaplin, Martin. «Ice-seventeen (Ice XVII)». Archivado desde el original el 2022-09-11 . Consultado el 2022-09-11 .
{{cite web}}: CS1 maint: bot: estado de URL original desconocido ( enlace )[ ¿ Fuente autopublicada? ] - ^ ab Komatsu, Kazuki; Machida, Shinichi; Noritake, Fumiya; Hattori, Takanori; Sano-Furukawa, Asami; Yamane, Ryo; Yamashita, Keishiro; Kagi, Hiroyuki (3 de febrero de 2020). "Ice Ic sin desorden de apilamiento evacuando hidrógeno del hidrato de hidrógeno". Comunicaciones de la naturaleza . 11 (1): 464. arXiv : 1909.03400 . Código Bib : 2020NatCo..11..464K. doi :10.1038/s41467-020-14346-5. PMC 6997176 . PMID 32015342.
- ^ Demontis, P.; et al. (1988). "Nuevas fases de alta presión del hielo" (PDF) . Phys. Rev. Lett . 60 (22): 2284–2287. Bibcode :1988PhRvL..60.2284D. doi :10.1103/PhysRevLett.60.2284. PMID 10038311.
- ^ Agua extraña acecha en el interior de planetas gigantes, New Scientist, 1 de septiembre de 2010, número de revista 2776.
- ^ abc Millot, Marius; et al. (5 de febrero de 2018). "Evidencia experimental de hielo de agua superiónico mediante compresión por choque". Nature Physics . 14 (3): 297–302. Bibcode :2018NatPh..14..297M. doi :10.1038/s41567-017-0017-4. OSTI 1542614. S2CID 256703104.
- ^ ab Sokol, Joshua (12 de mayo de 2019). "Una extraña forma de agua podría existir en todo el universo". Wired . ISSN 1059-1028 . Consultado el 13 de mayo de 2019 .
- ^ Goncharov, Alexander F.; et al. (2005). "Ionización dinámica del agua en condiciones extremas" (PDF) . Phys. Rev. Lett . 94 (12): 125508. Bibcode :2005PhRvL..94l5508G. doi :10.1103/PhysRevLett.94.125508. PMID 15903935.
- ^ ab Marris, Emma (22 de marzo de 2005). "Los planetas gigantes pueden albergar agua superiónica". Nature . doi :10.1038/news050321-4.
- ^ abc Zyga, Lisa (25 de abril de 2013). «Una nueva fase del agua podría dominar el interior de Urano y Neptuno». Phys.org .
- ^ ab Chang, Kenneth (5 de febrero de 2018). «Una nueva forma de agua, tanto líquida como sólida, es 'realmente extraña'». The New York Times . ISSN 0362-4331 . Consultado el 13 de febrero de 2018 .
- ^ Langin, Katie. "Los científicos crean una nueva forma de materia: hielo de agua superiónico". Science . Consultado el 17 de mayo de 2024 .
- ^ Rosu-Finsen, A; Salzmann, CG (2019). "Origen de la endoterma de baja temperatura del hielo dopado con ácido VI: ¿nueva fase de hielo ordenada por hidrógeno o estados vítreos profundos?". Chem Sci . 10 (2): 515–523. doi :10.1039/c8sc03647k. PMC 6334492 . PMID 30713649.
- ^ Thoeny AV; Gasser TM; Loerting T (2019). "Distinguir el hielo β-XV del hielo vítreo profundo VI: espectroscopia Raman". Phys Chem Chem Phys . 21 (28): 15452–15462. Bibcode :2019PCCP...2115452T. doi : 10.1039/c9cp02147g . PMID 31257365. S2CID 195764029.
- ^ Rosu-Finsen A, Amon A, Armstrong J, Fernandez-Alonso F, Salzmann CG (2020). "Hielo vítreo profundo VI revelado con una combinación de espectroscopia de neutrones y difracción". J Phys Chem Lett . 11 (3): 1106–1111. doi :10.1021/acs.jpclett.0c00125. PMC 7008458 . PMID 31972078.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Gasser TM, Thoeny AV, Fortes AD, Loerting T (2021). "Caracterización estructural del hielo XIX como el segundo polimorfo relacionado con el hielo VI". Nat Commun . 12 (1): 1128. Bibcode :2021NatCo..12.1128G. doi :10.1038/s41467-021-21161-z. PMC 7892819 . PMID 33602946.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Salzmann CG, Loveday JS, Rosu-Finsen A, Bull CL (2021). "Estructura y naturaleza del hielo XIX". Nat Commun . 12 (1): 3162. Bibcode :2021NatCo..12.3162S. doi :10.1038/s41467-021-23399-z. PMC 8155070 . PMID 34039987.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Norman Anderson. "Las múltiples fases del hielo" (PDF) (artículo de Física 511). Universidad Estatal de Iowa. Archivado desde el original (PDF) el 7 de octubre de 2009.
- ^ Atkins, Peter; de Paula, Julio (2010). Química física (9.ª ed.). Nueva York: WH Freeman and Co. p. 144. ISBN 978-1429218122.
- ^ Murray, Benjamin J.; Knopf, Daniel A.; Bertram, Allan K. (2005). "La formación de hielo cúbico en condiciones relevantes para la atmósfera de la Tierra". Nature . 434 (7030): 202–205. Bibcode :2005Natur.434..202M. doi :10.1038/nature03403. PMID 15758996. S2CID 4427815.
- ^ Whalley, E. (1981). "Halo de Scheiner: evidencia de hielo I c en la atmósfera". Science . 211 (4480): 389–390. Bibcode :1981Sci...211..389W. doi :10.1126/science.211.4480.389. PMID 17748273.
- ^ Murray, Benjamin J.; Salzmann, Christoph G.; Heymsfield, Andrew J.; Dobbie, Steven; Neely, Ryan R.; Cox, Christopher J. (2015). "Cristales de hielo trigonales en la atmósfera terrestre" (PDF) . Boletín de la Sociedad Meteorológica Estadounidense . 96 (9): 1519–1531. Código Bibliográfico :2015BAMS...96.1519M. doi :10.1175/BAMS-D-13-00128.1.
- ^ Chaplin, Martin. "Apilamiento de hielo desordenado; Ice Isd". Estructura y ciencia del agua . Universidad South Bank de Londres .
- ^ Malkin, Tamsin L.; Murray, Benjamin J.; Salzmann, Christoph G.; Molinero, Valeria; Pickering, Steven J.; Whale, Thomas F. (2015). "Desorden de apilamiento en hielo I". Química física Física química . 17 (1): 60–76. doi : 10.1039/c4cp02893g . PMID 25380218.
- ^ Kuhs, WF; Sippel, C.; Falenty, A.; Hansen, TC (2012). "Extensión y relevancia del desorden de apilamiento en "ice Ic"". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 109 (52): 21259–21264. Bibcode :2012PNAS..10921259K. doi : 10.1073/pnas.1210331110 . PMC 3535660 . PMID 23236184.
- ^ Lübken, F.-J.; Lautenbach, J.; Höffner, J.; Rapp, M.; Zecha, M. (marzo de 2009). "Primeras mediciones continuas de temperatura en ecos de verano de la mesosfera polar". Journal of Atmospheric and Solar-Terrestrial Physics . 71 (3–4): 453–463. Bibcode :2009JASTP..71..453L. doi :10.1016/j.jastp.2008.06.001.
- ^ Murray, Benjamin J.; Jensen, Eric J. (enero de 2010). "Nucleación homogénea de partículas sólidas de agua amorfa en la mesosfera superior". Journal of Atmospheric and Solar-Terrestrial Physics . 72 (1): 51–61. Bibcode :2010JASTP..72...51M. doi :10.1016/j.jastp.2009.10.007.
- ^ Murray, Benjamin J.; Malkin, Tamsin L.; Salzmann, Christoph G. (mayo de 2015). "La estructura cristalina del hielo en condiciones mesosféricas". Journal of Atmospheric and Solar-Terrestrial Physics . 127 : 78–82. Bibcode :2015JASTP.127...78M. doi : 10.1016/j.jastp.2014.12.005 .
- ^ O. Tschauner; S. Huang; E. Greenberg; VB Prakapenka; C. Ma; GR Rossman; AH Shen; D. Zhang; M. Newville; A. Lanzirotti; K. Tait (2018). "Inclusiones de hielo VII en diamantes: evidencia de fluido acuoso en el manto profundo de la Tierra". Science . 359 (6380): 1136–1139. Bibcode :2018Sci...359.1136T. doi : 10.1126/science.aao3030 . PMID 29590042. S2CID 206662912.
- ^ Sid Perkins (8 de marzo de 2018). «Es posible que existan bolsas de agua en las profundidades de la superficie de la Tierra». Science . Archivado desde el original el 8 de marzo de 2018. Consultado el 8 de marzo de 2018 .
- ^ Netburn, Deborah. «Lo que los científicos encontraron atrapado en un diamante: un tipo de hielo no conocido en la Tierra». Los Angeles Times . Archivado desde el original el 12 de marzo de 2018. Consultado el 12 de marzo de 2018 .
- ^ Fukazawa, Hiroshi; Mae, Shinji; Ikeda, Susumu; Watanabe, Okitsugu (1998). "Ordenamiento de protones en el hielo antártico observado mediante dispersión Raman y de neutrones". Chemical Physics Letters . 294 (6): 554–558. Bibcode :1998CPL...294..554F. doi :10.1016/S0009-2614(98)00908-7.
- ^ Fortes, AD; Wood, IG; Grigoriev, D.; Alfredsson, M.; Kipfstuhl, S.; Knight, KS; Smith, RI (1 de enero de 2004). "No evidence for large-scale proton ordering in Antarctic ice from powder neutron difraction" (No hay evidencia de ordenamiento de protones a gran escala en el hielo antártico a partir de la difracción de neutrones en polvo). The Journal of Chemical Physics . 120 (24): 11376–9. Bibcode :2004JChPh.12011376F. doi :10.1063/1.1765099. PMID 15268170. Archivado desde el original el 29 de julio de 2012 . Consultado el 22 de abril de 2012 .
- ^ Furić, K.; Volovšek, V. (2010). "Hielo de agua a bajas temperaturas y presiones; nuevos resultados Raman". J. Mol. Structure . 976 (1–3): 174–180. Bibcode :2010JMoSt.976..174F. doi :10.1016/j.molstruc.2010.03.024.
- ^ Yen, Fei; Chi, Zhenhua (16 de abril de 2015). "Dinámica de ordenamiento de protones del hielo de H2O". Química física Física química . 17 (19): 12458–12461. arXiv : 1503.01830 . Código Bibliográfico :2015PCCP...1712458Y. doi :10.1039/C5CP01529D. PMID 25912948. S2CID 7736338.
- ^ Dubochet, J.; Adrian, M.; Chang, J. .J; Homo, JC; Lepault, J-; McDowall, AW; Schultz, P. (1988). "Microscopía crioelectrónica de especímenes vitrificados" (PDF) . Quarterly Reviews of Biophysics . 21 (2): 129–228. doi :10.1017/S0033583500004297. PMID 3043536. S2CID 2741633.
- ^ abcdef Del Rosso, Leonardo; Celli, Milva; Ulivi, Lorenzo (junio de 2017). "El hielo XVII como material novedoso para el almacenamiento de hidrógeno". Desafíos . 8 (1): 3. doi : 10.3390/challe8010003 .
- ^ Chang, Kenneth (9 de diciembre de 2004). «Los astrónomos contemplan volcanes helados en lugares lejanos». The New York Times . Archivado desde el original el 9 de mayo de 2015. Consultado el 30 de julio de 2012 .
- ^ Debennetti, Pablo G.; Stanley, H. Eugene (2003). "Supercooled and Glassy Water" (PDF) . Physics Today . 56 (6): 40–46. Bibcode :2003PhT....56f..40D. doi :10.1063/1.1595053 . Consultado el 19 de septiembre de 2012 .
- ^ abc Newman, Sarah F.; Buratti, BJ; Marrón, derecho; Jaumann, R.; Bauer, J.; Mamá, T. (2008). "Análisis fotométrico y espectral de la distribución de hielos cristalinos y amorfos en Encelado visto por Cassini" (PDF) . Ícaro . 193 (2): 397–406. Código Bib : 2008Icar..193..397N. doi :10.1016/j.icarus.2007.04.019. hdl : 1721.1/114323 .
- ^ Grundy, WM; Schmitt, B. (1998). "El espectro de absorción del infrarrojo cercano dependiente de la temperatura del hielo de H 2 O hexagonal". Journal of Geophysical Research . 103 (E11): 25809. Bibcode :1998JGR...10325809G. doi :10.1029/98je00738.
- ^ Hagen, W.; ielens, AGGM; Greenberg, JM (1981). "Los espectros infrarrojos del agua sólida amorfo y del hielo entre 10 y 140 K". Química Física . 56 (3): 367–379. Bibcode :1981CP.....56..367H. doi :10.1016/0301-0104(81)80158-9.
- ^ abc Moore, Marla H.; Hudson, Reggie L. (1992). "Estudios espectrales en el infrarrojo lejano de los cambios de fase en el hielo de agua inducidos por la irradiación de protones". Astrophysical Journal . 401 : 353. Bibcode :1992ApJ...401..353M. doi :10.1086/172065.
- ^ Smith, RG; Robinson, G.; Hyland, AR; Carpenter, GL (1994). "Hielos moleculares como indicadores de temperatura para el polvo interestelar: las características reticulares de 44 y 62 μm del hielo de H2O". Monthly Notices of the Royal Astronomical Society . 271 (2): 481–489. Bibcode :1994MNRAS.271..481S. doi : 10.1093/mnras/271.2.481 .
- ^ Seki, J.; Hasegawa, H. (1983). "La condensación heterogénea de los granos de hielo interestelar". Astrofísica y ciencia espacial . 94 (1): 177–189. Bibcode :1983Ap&SS..94..177S. doi :10.1007/BF00651770. S2CID 121008219.
- ^ Murray, BJ; Jensen, EJ (2010). "Nucleación homogénea de partículas sólidas de agua amorfa en la mesosfera superior". J. Atmos. Sol.-Terr. Phys . 72 (1): 51–61. Bibcode :2010JASTP..72...51M. doi :10.1016/j.jastp.2009.10.007.
- ^ de Jenniskens; Blake; Kouchi (1998). Hielos del sistema solar . Dordrecht Kluwer Academic Publishers. págs. 139-155.
- ^ abc Kouchi, A.; Yamamoto, T.; Kozasa, T.; Kuroda, T.; Greenberg, JM (1994). "Condiciones para la condensación y conservación del hielo amorfo y la cristalinidad de los hielos astrofísicos" (PDF) . Astronomía y Astrofísica . 290 : 1009. Bibcode :1994A&A...290.1009K. Archivado (PDF) desde el original el 22 de marzo de 2020.
- ^ Kouchi, Akira; Kuroda, Toshio (1990). "Amorfización del hielo cúbico por irradiación ultravioleta". Nature . 344 (6262): 134–135. Código Bibliográfico :1990Natur.344..134K. doi :10.1038/344134a0. S2CID 4306842.
- ^ Jenniskens, P.; Blake, DF; Wilson, MA; Pohorille, A. (1995). "Hielo amorfo de alta densidad, la escarcha en los granos interestelares". Astrophysical Journal . 401 : 389. Bibcode :1995ApJ...455..389J. doi :10.1086/176585. hdl : 2060/19980018148 . S2CID 122950585.
- ^ Omont, Alain; Forveille, Thierry; Moseley, S. Harvey; Glaccum, William J.; Harvey, Paul M.; Likkel, Lauren Jones; Loewenstein, Robert F.; Lisse, Casey M. (20 de mayo de 1990), "Observaciones de bandas de hielo de 40 a 70 micrones en IRAS 09371 + 1212 y otras estrellas", Astrophysical Journal Letters , 355 : L27–L30, Bibcode :1990ApJ...355L..27O, doi : 10.1086/185730 , ISSN 0004-637X
- ^ Patashnick, et al., Nature Vol.250, No. 5464, julio de 1974, págs.
- ^ Meech, KJ; Pittichová, J.; Bar-Nun, A.; Notesco, G.; Laufer, D.; Hainaut, OR; Lowry, SC; Yeomans, DK; Pitts, M. (2009). "Actividad de los cometas a grandes distancias heliocéntricas antes del perihelio". Icarus . 201 (2): 719–739. Bibcode :2009Icar..201..719M. doi :10.1016/j.icarus.2008.12.045.
- ^ Tancredi, G.; Rickman, H.; Greenberg, JM (1994). "Termoquímica de los núcleos cometarios 1: el caso de la familia Júpiter". Astronomía y Astrofísica . 286 : 659. Bibcode :1994A&A...286..659T.
- ^ Gronkowski, P. (2007). "La búsqueda de un mecanismo para los estallidos cometarios: una comparación de varias teorías". Astronomische Nachrichten . 328 (2): 126–136. Bibcode :2007AN....328..126G. doi : 10.1002/asna.200510657 .
- ^ Hosek, Matthew W. Jr.; Blaauw, Rhiannon C.; Cooke, William J.; Suggs, Robert M. (2013). "Producción de polvo por explosión del cometa 29P/Schwassmann-Wachmann 1". The Astronomical Journal . 145 (5): 122. Bibcode :2013AJ....145..122H. doi : 10.1088/0004-6256/145/5/122 .
- ^ Jewitt, David C.; Luu, Jane X. (2001). "Colores y espectros de los objetos del cinturón de Kuiper". The Astronomical Journal . 122 (4): 2099–2114. arXiv : astro-ph/0107277 . Código Bibliográfico :2001AJ....122.2099J. doi :10.1086/323304. S2CID 35561353.
- ^ Brown, Robert H.; Cruikshank, Dale P.; Pendleton, Yvonne (1999). "Hielo de agua en el objeto 1996 TO_66 del cinturón de Kuiper". The Astrophysical Journal . 519 (1): L101. Código Bibliográfico :1999ApJ...519L.101B. doi : 10.1086/312098 .
- ^ Fornasier, S.; Dotto, E.; Barucci, MA; Barbieri, C. (2004). "Hielo de agua en la superficie del gran TNO 2004 DW". Astronomía y Astrofísica . 422 (2): L43. Bibcode :2004A&A...422L..43F. doi : 10.1051/0004-6361:20048004 .
- ^ Jewitt, David C.; Luu, Jane (2004). "Hielo de agua cristalino en el objeto del cinturón de Kuiper (50000) Quaoar". Nature . 432 (7018): 731–3. Bibcode :2004Natur.432..731J. doi :10.1038/nature03111. PMID 15592406. S2CID 4334385.
- ^ Spencer, John R.; Tamppari, Leslie K.; Martin, Terry Z.; Travis, Larry D. (1999). "Temperaturas en Europa según el fotopolarímetro-radiómetro de Galileo: anomalías térmicas nocturnas". Science . 284 (5419): 1514–1516. Bibcode :1999Sci...284.1514S. doi :10.1126/science.284.5419.1514. PMID 10348736.
- ^ ab Hansen, Gary B.; McCord, Thomas B. (2004). "Hielo amorfo y cristalino en los satélites galileanos: un equilibrio entre los procesos térmicos y radiolíticos". Journal of Geophysical Research . 109 (E1): E01012. Bibcode :2004JGRE..109.1012H. doi :10.1029/2003JE002149. S2CID 140162310.
- ^ Showman, A. (1997). "Evolución orbital y térmica acoplada de Ganimedes" (PDF) . Icarus . 129 (2): 367–383. Bibcode :1997Icar..129..367S. doi :10.1006/icar.1997.5778.
- ^ "Titán: datos – NASA Science". science.nasa.gov . Consultado el 25 de abril de 2024 .
- ^ abc McKinnon, WB; Hofmeister, AM (agosto de 2005). "¿Hielo XI en Plutón y Caronte?". Boletín de la Sociedad Astronómica Estadounidense . 37 (49.02). Reunión de la División de Ciencias Planetarias, Sociedad Astronómica Estadounidense: 732. Código Bibliográfico :2005DPS....37.4902M.
- ^ Universidad de Lieja (16 de mayo de 2007). Los astrónomos detectan la sombra de un mundo acuático frente a una estrella cercana. ScienceDaily. Consultado el 3 de enero de 2010, de "Los astrónomos detectan la sombra de un mundo acuático frente a una estrella cercana". Archivado desde el original el 21 de agosto de 2017. Consultado el 22 de abril de 2018 .
- ^ David A. Aguilar (16 de diciembre de 2009). "Astrónomos encuentran una supertierra usando tecnología amateur disponible en el mercado". Centro de Astrofísica Harvard-Smithsonian. Archivado desde el original el 7 de abril de 2012. Consultado el 23 de enero de 2010 .
- ^ Grossman, Lisa (25 de agosto de 2011). «El hielo eléctrico es un shock para el sistema solar». New Scientist . Consultado el 7 de abril de 2012 .
- ^ Fukazawa, H.; Hoshikawa, A.; Ishii, Y.; Chakoumakos, antes de Cristo; Fernández-Baca, JA (20 de noviembre de 2006). "Existencia de hielo ferroeléctrico en el universo". La revista astrofísica . 652 (1): L57-L60. Código Bib : 2006ApJ...652L..57F. doi : 10.1086/510017 .
- ^ Iedema, MJ; Dresser, MJ; Doering, DL; Rowland, JB; Hess, WP; Tsekouras, AA; Cowin, JP (1998). "Ferroelectricidad en hielo de agua". The Journal of Physical Chemistry B . 102 (46). Sociedad Química Estadounidense (ACS): 9203–9214. doi :10.1021/jp982549e. ISSN 1520-6106.
- ^ Iitaka, Toshiaki (13 de julio de 2010). "Estabilidad del hielo ferroeléctrico". arXiv : 1007.1792 [cond-mat.mtrl-sci].
- ^ Arakawa, M.; Kagi, H.; Fukazawa, H. (1 de octubre de 2009). "Medidas de laboratorio de espectros de absorción infrarroja de hielo ordenado por hidrógeno: un paso hacia la exploración del hielo XI en el espacio". The Astrophysical Journal Supplement Series . 184 (2): 361–365. Bibcode :2009ApJS..184..361A. doi : 10.1088/0067-0049/184/2/361 .
- ^ Chang, Kenneth (5 de febrero de 2018). «Una forma de hielo de agua recién descubierta es 'realmente extraña': se ha teorizado durante mucho tiempo que se encuentra en los mantos de Urano y Neptuno; la confirmación de la existencia de hielo superiónico podría conducir al desarrollo de nuevos materiales». The New York Times . Consultado el 5 de febrero de 2018 .
- ^ Charlie Osolin. "Oficina de Asuntos Públicos: Recreando el extraño estado del agua hallada en planetas gigantes". Llnl.gov . Consultado el 24 de diciembre de 2010 .
- ^ Cheng, Bingqing; Bethkenhagen, Mandy; Pickard, Chris J.; Hamel, Sebastien (2021). "Comportamientos de fase del agua superiónica en condiciones planetarias". Nature Physics . 17 (11): 1228–1232. arXiv : 2103.09035 . Código Bibliográfico :2021NatPh..17.1228C. doi :10.1038/s41567-021-01334-9. S2CID 232240463.
- ^ Chau, Ricky; Hamel, Sebastien; Nellis, William J. (2011). "Procesos químicos en el interior profundo de Urano". Nature Communications . 2 . Número de artículo: 203. Bibcode :2011NatCo...2..203C. doi : 10.1038/ncomms1198 . PMID 21343921.
- ^ Wang, Yanchao (29 de noviembre de 2011). "Fase parcialmente iónica de alta presión del hielo de agua". Nature Communications . 2 : 563. Bibcode :2011NatCo...2..563W. doi : 10.1038/ncomms1566 . PMID 22127059.
Lectura adicional
- Fases del hielo (www.idc-online.com)
- Fletcher, NH (4 de junio de 2009). La física química del hielo. Cambridge University Press. ISBN 9780521112307.
- Petrenko, Victor F.; Whitworth, Robert W. (19 de agosto de 1999). Física del hielo. OUP Oxford. ISBN 9780191581342.
- Chaplin, Martin. "Estructura hexagonal del hielo". Estructura del agua y ciencia . Universidad South Bank de Londres .
- Informe de la Universidad de South Bank de Londres
- Physik des Eises (PDF en alemán, iktp.tu-dresden.de)
Enlaces externos
- Hunsberger, Maren (21 de septiembre de 2018). «Un nuevo estado del agua revela un océano oculto en el manto de la Tierra». Seeker . Archivado desde el original el 2021-12-21 – vía YouTube .
- Woo, Marcus (11 de julio de 2018). "La búsqueda de los océanos profundos y ocultos de la Tierra". Revista Quanta .
- Discusión sobre hielo amorfo en el sitio web de LSBU .
- Transición vítrea en agua hiperextinguida de la Naturaleza (requiere registro)
- Agua vidriosa de Science , sobre diagramas de fases del agua (requiere registro)
- Descubrimiento de contabilidad AIP de VHDA
- HDA en el espacio
- Ilustraciones computarizadas de la estructura molecular de HDA











