Ácido nitroso
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Ácido nitroso [1] | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| 3DMet |
|
| EBICh | |
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.029.057 |
| Número CE |
|
| 983 | |
| BARRIL | |
| Malla | Ácido nitroso+ |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| Propiedades | |
| HNO2 | |
| Masa molar | 47,013 g/mol |
| Apariencia | Solución azul pálido |
| Densidad | Aprox. 1 g/ml |
| Punto de fusión | Sólo se conoce en solución o como gas. |
| Acidez (p K a ) | 3.15 [2] |
| Base conjugada | Nitrito |
| Peligros | |
| NFPA 704 (rombo cortafuegos) | |
| punto de inflamabilidad | Ininflamable |
| Compuestos relacionados | |
Otros aniones | Ácido nítrico |
Otros cationes | Nitrito de sodio Nitrito de potasio Nitrito de amonio |
Compuestos relacionados | Trióxido de dinitrógeno |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
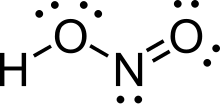
Ácido nitroso (fórmula molecular H N O
2) es un ácido débil y monoprótico conocido sólo en solución , en fase gaseosa y en forma de nitrito ( NO−
2) sales. [3] Fue descubierto por Carl Wilhelm Scheele , quien lo llamó " ácido flogistizado del nitro". El ácido nitroso se utiliza para fabricar sales de diazonio a partir de aminas. Las sales de diazonio resultantes son reactivos en reacciones de acoplamiento azoico para dar colorantes azoicos .
Estructura
En la fase gaseosa, la molécula de ácido nitroso plana puede adoptar tanto la forma syn como la anti . La forma anti predomina a temperatura ambiente y las mediciones IR indican que es más estable en alrededor de 2,3 kJ/mol. [3]
- Dimensiones de la antiforma
(del espectro de microondas ) - Modelo de la antiforma
- forma sin
Preparación y descomposición
El ácido nitroso libre y gaseoso es inestable y se desproporciona rápidamente en óxidos nítricos :
- 2HNO2 → NO2 + NO + H2O
En solución acuosa, el dióxido de nitrógeno también se desproporciona, produciendo una reacción neta de óxido nítrico y ácido nítrico : [4] : 1 [5]
- 3 HNO 2 → 2 NO + HNO 3 + H 2 O
Por lo tanto, las aplicaciones del ácido nitroso suelen comenzar con la acidificación del nitrito de sodio con un ácido mineral . La acidificación suele realizarse a temperaturas de hielo y el HNO2 se consume in situ . [6] [7]
El ácido nitroso se equilibra con el trióxido de dinitrógeno en agua, de modo que las soluciones concentradas son visiblemente azules: [4] : 2
- N2O3 + H2O⇌2HNO2
La adición de trióxido de dinitrógeno al agua es, pues, otra técnica preparatoria.
Aplicaciones químicas
El ácido nitroso es el quimioforo principal del reactivo de Liebermann , que se utiliza para realizar pruebas puntuales de alcaloides.
A altas acideces ( p H ≪ 2 ), el ácido nitroso se protona para dar cationes agua y nitrosonio . [4] : 2
Reducción
Con los iones I − y Fe 2+ se forma NO: [8]
- 2HNO2 + 2KI + 2H2SO4 → I2 + 2NO + 2H2O + 2K2SO4
- 2HNO2 + 2FeSO4 + 2H2SO4 → Fe2 ( SO4 ) 3 + 2NO + 2H2O + K2SO4
Con iones Sn 2+ se forma N 2 O:
- 2 HNO 2 + 6 HCl + 2 SnCl 2 → 2 SnCl 4 + N 2 O + 3 H 2 O + 2 KCl
Con gas SO 2 se forma NH 2 OH:
- 2HNO2 + 6H2O + 4SO2 → 3H2SO4 + K2SO4 + 2NH2OH
Con Zn en solución alcalina se forma NH3 :
- 5H2O +KNO2 + 3Zn →NH3 + KOH+3Zn(OH ) 2
Con N
2yo+
5Se forman tanto gas HN3 como (posteriormente) N2 :
- HNO 2 + [N 2 H 5 ] + → HN 3 + H 2 O + H 3 O +
- HNO 2 + HN 3 → N 2 O + N 2 + H 2 O
La oxidación por ácido nitroso tiene un control cinético sobre el control termodinámico ; esto se ilustra mejor cuando el ácido nitroso diluido puede oxidar I − a I 2 , pero el ácido nítrico diluido no puede.
- Yo 2 + 2 mi − ⇌ 2 Yo − mi o = +0,54 V
- NO−
3+ 3 H + + 2 mi − ⇌ HNO 2 + H 2 O E o = +0,93 V
- HNO 2 + H + + e − ⇌ NO + H 2 O E o = +0,98 V
Se puede observar que los valores de Eo
célulaEstas reacciones son similares, pero el ácido nítrico es un agente oxidante más potente. Teniendo en cuenta que el ácido nitroso diluido puede oxidar el yoduro a yodo , se puede deducir que el nitroso es un agente oxidante más rápido, en lugar de más potente, que el ácido nítrico diluido. [8]
Química orgánica
El ácido nitroso se utiliza para preparar sales de diazonio :
- HNO2 + ArNH2 + H + → ArN+
2 + 2H2O
donde Ar es un grupo arilo .
Estas sales se utilizan ampliamente en síntesis orgánica , por ejemplo, para la reacción de Sandmeyer y en la preparación de colorantes azoicos , compuestos de colores brillantes que son la base de una prueba cualitativa para anilinas . [9] El ácido nitroso se utiliza para destruir la azida sódica tóxica y potencialmente explosiva . Para la mayoría de los propósitos, el ácido nitroso generalmente se forma in situ por la acción del ácido mineral sobre el nitrito de sodio : [10] Es principalmente de color azul.
- NaNO2 + HCl → HNO2 + NaCl
- 2 NaN 3 + 2 HNO 2 → 3 N 2 + 2 NO + 2 NaOH
La reacción con dos átomos de hidrógeno α en cetonas crea oximas , que pueden oxidarse aún más para formar un ácido carboxílico o reducirse para formar aminas. Este proceso se utiliza en la producción comercial de ácido adípico .
El ácido nitroso reacciona rápidamente con los alcoholes alifáticos para producir nitritos de alquilo , que son potentes vasodilatadores :
- (CH 3 ) 2 CHCH 2 CH 2 OH + HNO 2 → (CH 3 ) 2 CHCH 2 CH 2 ONO + H 2 O
Los carcinógenos llamados nitrosaminas se producen, generalmente de forma no intencionada, por la reacción del ácido nitroso con aminas secundarias :
- HNO2 + R2NH → R2N - NO + H2O
Atmósfera de la Tierra
El ácido nitroso participa en el balance de ozono de la atmósfera inferior , la troposfera . La reacción heterogénea del óxido nítrico (NO) y el agua produce ácido nitroso. Cuando esta reacción tiene lugar en la superficie de los aerosoles atmosféricos, el producto se fotoliza fácilmente en radicales hidroxilo . [11] [12]
Daño y mutación del ADN
El tratamiento de células de Escherichia coli con ácido nitroso provoca daños en el ADN de la célula, incluida la desaminación de la citosina a uracilo , y estos daños pueden ser reparados por enzimas específicas. [13] Además, el ácido nitroso provoca mutaciones de sustitución de bases en organismos con ADN de doble cadena. [14]
Véase también
- Reordenamiento de Demjanov
- Ácido nítrico ( H N O 3 )
- Nitrosil- O -hidróxido
- Reordenamiento de Tiffeneau-Demjanov
Referencias
- ^ "Ácido nitroso".
- ^ Perrin, D. D., ed. (1982) [1969]. Constantes de ionización de ácidos y bases inorgánicos en solución acuosa . Datos químicos de la IUPAC (2.ª ed.). Oxford: Pergamon (publicado en 1984). Entrada 156. ISBN 0-08-029214-3. Número de serie LCCN 82-16524.
- ^ ab Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.pág. 462.
- ^ abc Williams, D. L. H. (1988). Nitrosación . Cambridge, Reino Unido: Cambridge University . ISBN 0-521-26796-X.
- ^ Kameoka, Yohji; Pigford, Robert (febrero de 1977). "Absorción de dióxido de nitrógeno en agua, ácido sulfúrico, hidróxido de sodio y sulfito de sodio alcalino acuoso". Ind. Eng. Chem. Fundamen . 16 (1): 163–169. doi :10.1021/i160061a031.
- ^ Pequeño, Y.; Larchevêque, M. (1998). "Glicidato de etilo de (S) -serina: (R) - (+) -2,3-epoxipropanoato de etilo". Org. Sintetizador . 75 : 37. doi : 10.15227/orgsyn.075.0037 .
- ^ Smith, Adam P.; Savage, Scott A.; Love, J. Christopher; Fraser, Cassandra L. (2002). "Síntesis de 4-, 5- y 6-metil-2,2'-bipiridina mediante una estrategia de acoplamiento cruzado de Negishi: 5-metil-2,2'-bipiridina". Org. Synth . 78 : 51. doi : 10.15227/orgsyn.078.0051 .
- ^ ab Housecroft, Catherine E.; Sharpe, Alan G. (2008). "Capítulo 15: Los elementos del grupo 15". Química inorgánica, 3.ª edición . Pearson. pág. 449. ISBN 978-0-13-175553-6.
- ^ Clarke, HT; Kirner, WR (1922). "Metil rojo". Síntesis orgánicas . 2 : 47. doi : 10.15227/orgsyn.002.0047 .
- ^ Prácticas prudentes en el laboratorio: manipulación y eliminación de sustancias químicas. Washington, DC: National Academy Press . 1995. doi :10.17226/4911. ISBN 978-0-309-05229-0.
- ^ Spataro, F; Ianniello, A (noviembre de 2014). "Fuentes de ácido nitroso atmosférico: estado de la ciencia, necesidades de investigación actuales y perspectivas futuras". Journal of the Air & Waste Management Association . 64 (11): 1232–1250. Bibcode :2014JAWMA..64.1232S. doi : 10.1080/10962247.2014.952846 . PMID 25509545.
- ^ Anglada, Josef M.; Solé, Albert (noviembre de 2017). "La oxidación atmosférica de HONO por radicales OH, Cl y ClO". The Journal of Physical Chemistry A . 121 (51): 9698–9707. Bibcode :2017JPCA..121.9698A. doi :10.1021/acs.jpca.7b10715. PMID 29182863.
- ^ Da Roza, R.; Friedberg, EC; Duncan, BK; Warner, HR (1977-11-01). "Reparación del daño causado por el ácido nitroso al ADN en Escherichia coli". Bioquímica . 16 (22): 4934–4939. doi :10.1021/bi00641a030. ISSN 0006-2960. PMID 334252.
- ^ Hartman, Z.; Henrikson, EN; Hartman, PE; Cebula, TA (1994). "Modelos moleculares que pueden explicar la mutagénesis por ácido nitroso en organismos que contienen ADN de doble cadena". Mutagénesis ambiental y molecular . 24 (3): 168–175. Bibcode :1994EnvMM..24..168H. doi :10.1002/em.2850240305. ISSN 0893-6692. PMID 7957120.