Historia de la teoría atómica

La teoría atómica es la teoría científica que sostiene que la materia está compuesta de partículas llamadas átomos . La definición de la palabra "átomo" ha cambiado a lo largo de los años en respuesta a los descubrimientos científicos. Inicialmente, se refería a un concepto hipotético de que existía una partícula fundamental de materia, demasiado pequeña para ser vista a simple vista, que no podía dividirse. Luego, la definición se refinó para incluir las partículas básicas de los elementos químicos, cuando los químicos observaron que los elementos parecían combinarse entre sí en proporciones de números enteros pequeños. Luego, los físicos descubrieron que estas partículas tenían una estructura interna propia y, por lo tanto, tal vez no merecieran ser llamadas "átomos", pero cambiar el nombre de los átomos habría sido poco práctico en ese momento.
La teoría atómica es uno de los avances científicos más importantes de la historia, crucial para todas las ciencias físicas. Al comienzo de las Conferencias Feynman sobre Física , el físico y premio Nobel Richard Feynman propone la hipótesis atómica como el concepto científico más prolífico. [1]
Atomismo filosófico
La idea básica de que la materia está formada por pequeñas partículas indivisibles es una idea antigua que apareció en muchas culturas antiguas. La palabra átomo se deriva de la antigua palabra griega atomos , [a] que significa "imposible de cortar". Esta antigua idea se basaba en el razonamiento filosófico más que en el razonamiento científico. La teoría atómica moderna no se basa en estos viejos conceptos. [2] [3] A principios del siglo XIX, el científico John Dalton se dio cuenta de que las sustancias químicas parecían combinarse entre sí mediante unidades de peso discretas y consistentes, y decidió utilizar la palabra átomo para referirse a estas unidades. [4]
Trabajo preparatorio
A finales del siglo XVIII, surgieron varios avances importantes en química sin hacer referencia a la noción de una teoría atómica. El primero fue la redefinición de un elemento por parte de Antoine Lavoisier como una sustancia que los científicos no podían descomponer en sustancias más simples mediante experimentación. Esto puso fin a la antigua idea de que los elementos de la materia eran el fuego, la tierra, el aire y el agua, que no tenía respaldo experimental. Lavoisier demostró que el agua se puede descomponer en hidrógeno y oxígeno , que a su vez no podía descomponer en nada más simple, demostrando así que estos son elementos. [5] Lavoisier también definió la ley de conservación de la masa , que establece que en una reacción química, la materia no aparece ni desaparece en el aire; la masa total permanece igual incluso si las sustancias involucradas se transforman. Por último, estaba la ley de proporciones definidas , establecida por el químico francés Joseph Proust en 1797, que establece que si un compuesto se descompone en sus elementos químicos constituyentes, entonces las masas de esos constituyentes siempre tendrán las mismas proporciones en peso, independientemente de la cantidad o fuente del compuesto original. Esta definición distinguía a los compuestos de las mezclas. [6]
Ley de proporciones múltiples de Dalton

John Dalton estudió datos recopilados por él mismo y por otros científicos. Observó un patrón que más tarde se conocería como la ley de las proporciones múltiples : en compuestos que contienen dos elementos particulares, la cantidad de Elemento A por medida de Elemento B diferirá en estos compuestos en proporciones de números enteros pequeños. Esto sugería que cada elemento se combina con otros elementos en múltiplos de una cantidad básica. [ cita requerida ]
En 1804, Dalton explicó su teoría atómica a su amigo y colega químico Thomas Thomson , quien publicó una explicación de la teoría de Dalton en su libro A System of Chemistry en 1807. Según Thomson, la idea de Dalton se le ocurrió por primera vez cuando experimentaba con "gas olefiante" ( etileno ) y "gas hidrógeno carburado" ( metano ). Dalton descubrió que el "gas hidrógeno carburado" contiene el doble de hidrógeno por medida de carbono que el "gas olefiante", y concluyó que una molécula de "gas olefiante" es un átomo de carbono y un átomo de hidrógeno, y una molécula de "gas hidrógeno carburado" es un átomo de carbono y dos átomos de hidrógeno. [7] En realidad, una molécula de etileno tiene dos átomos de carbono y cuatro átomos de hidrógeno (C 2 H 4 ), y una molécula de metano tiene un átomo de carbono y cuatro átomos de hidrógeno (CH 4 ). En este caso en particular, Dalton se equivocó en las fórmulas de estos compuestos, y no fue su único error. Pero en otros casos, acertó con las fórmulas. [ cita requerida ] Los siguientes ejemplos proceden de los propios libros de Dalton, Un nuevo sistema de filosofía química (en dos volúmenes, 1808 y 1817):
Ejemplo 1: óxidos de estaño: Dalton identificó dos tipos de óxido de estaño . Uno es un polvo gris al que Dalton se refirió como "el protóxido de estaño", que es 88,1% de estaño y 11,9% de oxígeno. El otro es un polvo blanco al que Dalton se refirió como "el deutóxido de estaño", que es 78,7% de estaño y 21,3% de oxígeno. Ajustando estas cifras, en el polvo gris hay alrededor de 13,5 g de oxígeno por cada 100 g de estaño, y en el polvo blanco hay alrededor de 27 g de oxígeno por cada 100 g de estaño. 13,5 y 27 forman una proporción de 1:2. Estos compuestos se conocen hoy en día como óxido de estaño (II) (SnO) y óxido de estaño (IV) (SnO 2 ). En la terminología de Dalton, un "protóxido" es una molécula que contiene un solo átomo de oxígeno, y una molécula de "deutóxido" tiene dos. [8] [9] Los equivalentes modernos de sus términos serían monóxido y dióxido , pero estos no se utilizan para los óxidos de estaño ya que en realidad son cristales; no existen en forma molecular. [ cita requerida ]
Ejemplo 2: óxidos de hierro: Dalton identificó dos óxidos de hierro. Hay un tipo de óxido de hierro que es un polvo negro al que Dalton se refirió como "el protóxido de hierro", que es 78,1% de hierro y 21,9% de oxígeno. El otro óxido de hierro es un polvo rojo, al que Dalton se refirió como "el óxido intermedio o rojo de hierro", que es 70,4% de hierro y 29,6% de oxígeno. Ajustando estas cifras, en el polvo negro hay alrededor de 28 g de oxígeno por cada 100 g de hierro, y en el polvo rojo hay alrededor de 42 g de oxígeno por cada 100 g de hierro. 28 y 42 forman una proporción de 2:3. Estos compuestos son óxido de hierro (II) y óxido de hierro (III) y sus fórmulas son Fe 2 O 2 y Fe 2 O 3 respectivamente (la fórmula del óxido de hierro (II) normalmente se escribe como FeO, pero aquí se escribe como Fe 2 O 2 para contrastarlo con el otro óxido). Dalton describió el "óxido intermedio" como "2 átomos de protóxido y 1 de oxígeno", lo que suma dos átomos de hierro y tres de oxígeno. Eso da un promedio de un átomo y medio de oxígeno por cada átomo de hierro, lo que lo coloca a medio camino entre un "protóxido" y un "deutóxido". [10] [11]
Ejemplo 3: óxidos de nitrógeno: Dalton conocía tres óxidos de nitrógeno: "óxido nitroso", "gas nitroso" y "ácido nítrico". [12] Estos compuestos se conocen hoy como óxido nitroso , óxido nítrico y dióxido de nitrógeno respectivamente. El "óxido nitroso" es 63,3% nitrógeno y 36,7% oxígeno, lo que significa que tiene 80 g de oxígeno por cada 140 g de nitrógeno. El "gas nitroso" es 44,05% nitrógeno y 55,95% oxígeno, lo que significa que hay 160 g de oxígeno por cada 140 g de nitrógeno. El "ácido nítrico" es 29,5% nitrógeno y 70,5% oxígeno, lo que significa que tiene 320 g de oxígeno por cada 140 g de nitrógeno. 80 g, 160 g y 320 g forman una proporción de 1:2:4. Las fórmulas de estos compuestos son N 2 O, NO y NO 2 . [13] [14]
Dalton definió el átomo como la "partícula última" de una sustancia química y utilizó el término "átomo compuesto" para referirse a las "partículas últimas" que contienen dos o más elementos. Esto es incoherente con la definición moderna, según la cual un átomo es la partícula básica de un elemento químico y una molécula es una aglomeración de átomos. El término "átomo compuesto" resultaba confuso para algunos de los contemporáneos de Dalton, ya que la palabra "átomo" implica indivisibilidad, pero él respondió que si un "átomo" de dióxido de carbono se divide, deja de ser dióxido de carbono. El "átomo" de dióxido de carbono es indivisible en el sentido de que no se puede dividir en partículas de dióxido de carbono más pequeñas. [4] [15]
Dalton hizo las siguientes suposiciones sobre cómo los "átomos elementales" se combinaban para formar "átomos compuestos" (lo que hoy llamamos moléculas ). Cuando dos elementos solo pueden formar un compuesto, asumió que era un átomo de cada uno, al que llamó "compuesto binario". Si dos elementos pueden formar dos compuestos, el primer compuesto es un compuesto binario y el segundo es un "compuesto ternario" que consiste en un átomo del primer elemento y dos del segundo. Si dos elementos pueden formar tres compuestos entre ellos, entonces el tercer compuesto es un compuesto "cuaternario" que contiene un átomo del primer elemento y tres del segundo. [16] Dalton pensó que el agua era un "compuesto binario", es decir, un átomo de hidrógeno y un átomo de oxígeno. Dalton no sabía que en su estado gaseoso natural, las partículas finales de oxígeno, nitrógeno e hidrógeno existen en pares (O 2 , N 2 y H 2 ). Tampoco era consciente de las valencias. Estas propiedades de los átomos se descubrieron más tarde en el siglo XIX. [ cita requerida ]
Como los átomos eran demasiado pequeños para ser pesados directamente utilizando los métodos del siglo XIX, Dalton expresó en cambio los pesos de la miríada de átomos como múltiplos del peso del átomo de hidrógeno, que Dalton sabía que era el elemento más ligero. Según sus mediciones, 7 gramos de oxígeno se combinarán con 1 gramo de hidrógeno para formar 8 gramos de agua sin que quede nada, y suponiendo que una molécula de agua está formada por un átomo de oxígeno y un átomo de hidrógeno, concluyó que el peso atómico del oxígeno es 7. En realidad es 16. Aparte de la rudeza de las herramientas de medición de principios del siglo XIX, la razón principal de este error fue que Dalton no sabía que la molécula de agua, de hecho, tiene dos átomos de hidrógeno, no uno. Si lo hubiera sabido, habría duplicado su estimación a un 14 más preciso. Este error fue corregido en 1811 por Amedeo Avogadro . Avogadro propuso que volúmenes iguales de dos gases cualesquiera, a igual temperatura y presión, contienen igual número de moléculas (en otras palabras, la masa de las partículas de un gas no afecta el volumen que ocupa). [17] La hipótesis de Avogadro, ahora llamada habitualmente ley de Avogadro , proporcionó un método para deducir los pesos relativos de las moléculas de los elementos gaseosos, ya que si la hipótesis es correcta, las densidades relativas de los gases indican directamente los pesos relativos de las partículas que componen los gases. Esta forma de pensar condujo directamente a una segunda hipótesis: las partículas de ciertos gases elementales eran pares de átomos, y cuando reaccionaban químicamente estas moléculas a menudo se dividían en dos. Por ejemplo, el hecho de que dos litros de hidrógeno reaccionaran con un solo litro de oxígeno para producir dos litros de vapor de agua (a presión y temperatura constantes) sugería que una sola molécula de oxígeno se divide en dos para formar dos moléculas de agua. La fórmula del agua es H 2 O, no HO. Avogadro midió el peso atómico del oxígeno como 15,074. [18]
Oposición a la teoría atómica
La teoría atómica de Dalton despertó un gran interés, pero no todos la aceptaron al principio. Se demostró que la ley de proporciones múltiples no era una ley universal cuando se trataba de sustancias orgánicas, cuyas moléculas pueden ser bastante grandes. Por ejemplo, en el ácido oleico hay 34 g de hidrógeno por cada 216 g de carbono, y en el metano hay 72 g de hidrógeno por cada 216 g de carbono. 34 y 72 forman una proporción de 17:36, que no es una proporción de números enteros pequeños. Ahora sabemos que las sustancias basadas en el carbono pueden tener moléculas muy grandes, más grandes que las que pueden formar los otros elementos. La fórmula del ácido oleico es C 18 H 34 O 2 y la del metano es CH 4 . [19] La ley de proporciones múltiples por sí sola no era una prueba completa, y la teoría atómica no fue aceptada universalmente hasta finales del siglo XIX. [ cita requerida ]
Un problema era la falta de una nomenclatura uniforme. La palabra "átomo" implicaba indivisibilidad, pero Dalton definía un átomo como la partícula última de cualquier sustancia química , no solo los elementos o incluso la materia en sí. Esto significaba que los "átomos compuestos" como el dióxido de carbono podían dividirse, a diferencia de los "átomos elementales". A Dalton no le gustaba la palabra "molécula", considerándola "diminutiva". [4] [20] Amedeo Avogadro hizo lo contrario: utilizó exclusivamente la palabra "molécula" en sus escritos, evitando la palabra "átomo", utilizando en su lugar el término "molécula elemental". [21] Jöns Jacob Berzelius utilizó el término "átomos orgánicos" para referirse a partículas que contenían tres o más elementos, porque pensaba que esto solo existía en compuestos orgánicos. Jean-Baptiste Dumas utilizó los términos "átomos físicos" y "átomos químicos"; Un "átomo físico" era una partícula que no podía dividirse por medios físicos como la temperatura y la presión, y un "átomo químico" era una partícula que no podía dividirse mediante reacciones químicas. [22]
Las definiciones modernas de átomo y molécula (un átomo es la partícula básica de un elemento y una molécula es una aglomeración de átomos) se establecieron a finales de la mitad del siglo XIX. Un evento clave fue el Congreso de Karlsruhe en Alemania en 1860. Como primer congreso internacional de químicos, su objetivo era establecer algunos estándares en la comunidad. Un importante defensor de la distinción moderna entre átomos y moléculas fue Stanislao Cannizzaro .
Las diversas cantidades de un elemento particular que intervienen en la constitución de diferentes moléculas son múltiplos enteros de una cantidad fundamental que se manifiesta siempre como una entidad indivisible y que debe llamarse propiamente átomo.
— Estanislao Cannizzaro , 1860 [23]
Cannizzaro criticó a químicos del pasado como Berzelius por no aceptar que las partículas de ciertos elementos gaseosos son en realidad pares de átomos, lo que llevó a errores en la formulación de ciertos compuestos. Berzelius creía que las partículas de gas hidrógeno y gas cloro son átomos solitarios. Pero observó que cuando un litro de hidrógeno reacciona con un litro de cloro, forman dos litros de cloruro de hidrógeno en lugar de uno. Berzelius decidió que la ley de Avogadro no se aplica a los compuestos. Cannizzaro predicó que si los científicos simplemente aceptaran la existencia de moléculas de un solo elemento, tales discrepancias en sus hallazgos se resolverían fácilmente. Pero Berzelius ni siquiera tenía una palabra para eso. Berzelius usó el término "átomo elemental" para una partícula de gas que contenía solo un elemento y "átomo compuesto" para partículas que contenían dos o más elementos, pero no había nada que distinguiera al H 2 del H ya que Berzelius no creía en el H 2 . Por eso Cannizzaro pidió una redefinición para que los científicos pudieran entender que una molécula de hidrógeno puede dividirse en dos átomos en el curso de una reacción química. [24]
Una segunda objeción a la teoría atómica era filosófica. Los científicos del siglo XIX no tenían forma de observar directamente los átomos. Inferían la existencia de los átomos a través de observaciones indirectas, como la ley de proporciones múltiples de Dalton. Algunos científicos, en particular los que se adhirieron a la escuela del positivismo , argumentaban que los científicos no deberían intentar deducir la realidad más profunda del universo, sino solo sistematizar los patrones que pudieran observar directamente. Los antiatomistas argumentaban que, si bien los átomos podrían ser una abstracción útil para predecir cómo reaccionan los elementos, no reflejan la realidad concreta. [ cita requerida ]
A estos científicos se los conocía a veces como "equivalentes", porque preferían la teoría de los pesos equivalentes , que es una generalización de la ley de proporciones definidas de Proust. Por ejemplo, 1 gramo de hidrógeno se combinará con 8 gramos de oxígeno para formar 9 gramos de agua, por lo tanto, el "peso equivalente" del oxígeno es de 8 gramos. Esta posición fue finalmente revocada por dos avances importantes que ocurrieron más tarde en el siglo XIX: el desarrollo de la tabla periódica y el descubrimiento de que las moléculas tienen una arquitectura interna que determina sus propiedades. [25]
Isomería
Los científicos descubrieron que algunas sustancias tienen exactamente el mismo contenido químico pero diferentes propiedades. Por ejemplo, en 1827, Friedrich Wöhler descubrió que el fulminato de plata y el cianato de plata están compuestos por 107 partes de plata, 12 partes de carbono, 14 partes de nitrógeno y 16 partes de oxígeno (hoy conocemos sus fórmulas como AgCNO). En 1830, Jöns Jacob Berzelius introdujo el término isomería para describir el fenómeno. En 1860, Louis Pasteur planteó la hipótesis de que las moléculas de isómeros podrían tener el mismo conjunto de átomos pero en diferentes disposiciones. [26]
En 1874, Jacobus Henricus van 't Hoff propuso que el átomo de carbono se une a otros átomos en una disposición tetraédrica. A partir de esto, explicó las estructuras de las moléculas orgánicas de tal manera que podía predecir cuántos isómeros podría tener un compuesto. Consideremos, por ejemplo, el pentano (C 5 H 12 ). En la forma en que van 't Hoff modelaba las moléculas, existen tres configuraciones posibles para el pentano, y los científicos descubrieron tres y sólo tres isómeros del pentano. [27] [28]
La isomería no era algo que pudiera explicarse completamente mediante teorías alternativas a la teoría atómica, como la teoría radical y la teoría de tipos. [29] [30]
Tabla periódica de Mendeleev
Dmitrii Mendeleev notó que cuando organizaba los elementos en una fila según sus pesos atómicos, había una cierta periodicidad para ellos. [31] : 117 Por ejemplo, el segundo elemento, litio , tenía propiedades similares al noveno elemento, sodio , y al decimosexto elemento, potasio : un período de siete. Del mismo modo, berilio , magnesio y calcio eran similares y todos estaban separados por siete lugares en la tabla de Mendeleev. Usando estos patrones, Mendeleev predijo la existencia y propiedades de nuevos elementos, que luego fueron descubiertos en la naturaleza: escandio , galio y germanio . [31] : 118 Además, la tabla periódica podía predecir cuántos átomos de otros elementos podrían unirse con un átomo: por ejemplo, germanio y carbono están en el mismo grupo en la tabla y sus átomos se combinan con dos átomos de oxígeno cada uno (GeO 2 y CO 2 ). Mendeleev descubrió que estos patrones validaban la teoría atómica porque demostraban que los elementos podían clasificarse por su peso atómico. Insertar un nuevo elemento en medio de un período rompería el paralelismo entre ese período y el siguiente, y también violaría la ley de proporciones múltiples de Dalton. [32]
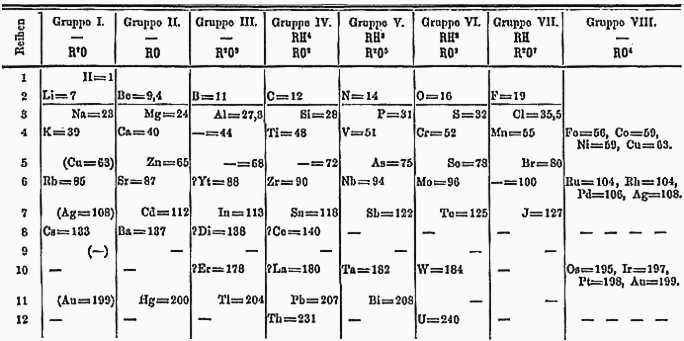
En la tabla periódica moderna, la periodicidad de los elementos mencionados anteriormente es ocho en lugar de siete, porque los gases nobles no se conocían cuando Mendeleev diseñó su tabla. Las filas también tienen ahora longitudes diferentes (2, 8, 18 y 32), lo que encaja con la teoría cuántica. [ cita requerida ]
Los elementos de la tabla periódica se organizaban generalmente en orden de peso atómico creciente. Sin embargo, en varios lugares los químicos decidieron intercambiar las posiciones de ciertos elementos adyacentes para que aparecieran en un grupo con otros elementos con propiedades similares. Por ejemplo, el telurio se coloca antes del yodo a pesar de que el telurio es más pesado (127,6 frente a 126,9) para que el yodo pueda estar en la misma columna que los otros halógenos . En 1913, Henry Moseley descubrió que los átomos de cada elemento, cuando se excitan , emiten rayos X a una frecuencia proporcional a la posición del elemento en la tabla periódica ajustada, lo que validó estos ajustes. [ cita requerida ]
Mecánica estadística
Para introducir la ley de los gases ideales y las formas estadísticas de la física, fue necesario postular la existencia de átomos. En 1738, el físico y matemático suizo Daniel Bernoulli postuló que la presión de los gases y el calor eran causados por el movimiento subyacente de las moléculas. [ cita requerida ]
En 1860, James Clerk Maxwell , un defensor acérrimo del atomismo, fue el primero en utilizar la mecánica estadística en física. [33] Ludwig Boltzmann y Rudolf Clausius ampliaron su trabajo sobre los gases y las leyes de la termodinámica, especialmente la segunda ley relacionada con la entropía. En la década de 1870, Josiah Willard Gibbs amplió las leyes de la entropía y la termodinámica y acuñó el término "mecánica estadística". [ cita requerida ]
Boltzmann defendió la hipótesis atomista frente a grandes detractores de la época como Ernst Mach o energeticistas como Wilhelm Ostwald , que consideraban que la energía era la cantidad elemental de la realidad. [34]
A principios del siglo XX, Albert Einstein reinventó de forma independiente las leyes de Gibbs, porque sólo habían sido publicadas en una oscura revista estadounidense. [35] Einstein comentó más tarde que si hubiera sabido del trabajo de Gibbs, "no habría publicado esos artículos en absoluto, sino que me habría limitado al tratamiento de algunos puntos [que eran distintos]". [36] Toda la mecánica estadística y las leyes del calor, los gases y la entropía tomaron la existencia de átomos como un postulado necesario. [ cita requerida ]
Movimiento browniano
En 1827, el botánico británico Robert Brown observó que las partículas de polvo dentro de los granos de polen que flotaban en el agua se movían constantemente sin razón aparente. En 1905, Einstein teorizó que este movimiento browniano era causado por las moléculas de agua que golpeaban continuamente los granos, y desarrolló un modelo matemático para describirlo. Este modelo fue validado experimentalmente en 1908 por el físico francés Jean Perrin , quien utilizó las ecuaciones de Einstein para medir el tamaño de los átomos. [37]
| Molécula | Medidas de Perrin [38] | Medidas modernas |
|---|---|---|
| Helio | 1,7 × 10 −10 m | 2,6 × 10 −10 m |
| Argón | 2,7 × 10 −10 m | 3,4 × 10 −10 m |
| Mercurio | 2,8 × 10 −10 m | 3 × 10 −10 m |
| Hidrógeno | 2 × 10 −10 m | 2,89 × 10 −10 m |
| Oxígeno | 2,6 × 10 −10 m | 3,46 × 10 −10 m |
| Nitrógeno | 2,7 × 10 −10 m | 3,64 × 10 −10 m |
| Cloro | 4 × 10 −10 m | 3,20 × 10 −10 m |
| Molécula | Medidas de Perrin [39] | Medidas modernas |
|---|---|---|
| Hidrógeno | 1,43 × 10 −27 kg | 1,66 × 10 −27 kg |
| Oxígeno | 22,7 × 10 −27 kg | 22,8 × 10 −27 kg |
Descubrimiento del electrón
Se creía que los átomos eran la división más pequeña posible de la materia hasta 1897, cuando JJ Thomson descubrió el electrón a través de su trabajo sobre rayos catódicos . [ cita requerida ]
Un tubo de Crookes es un recipiente de vidrio sellado en el que dos electrodos están separados por un vacío. Cuando se aplica un voltaje a través de los electrodos, se generan rayos catódicos, creando una mancha brillante donde golpean el vidrio en el extremo opuesto del tubo. A través de la experimentación, Thomson descubrió que los rayos podían ser desviados por campos eléctricos y magnéticos , lo que significaba que estos rayos no eran una forma de luz, sino que estaban compuestos de partículas cargadas muy ligeras, y su carga era negativa. Thomson llamó a estas partículas "corpúsculos". Midió que su relación masa-carga era varios órdenes de magnitud menor que la del átomo de hidrógeno, el átomo más pequeño. Esta relación era la misma independientemente de lo que estuvieran hechos los electrodos y cuál fuera el gas traza en el tubo. [40]
A diferencia de esos corpúsculos, los iones positivos creados por electrólisis o radiación de rayos X tenían relaciones masa-carga que variaban dependiendo del material de los electrodos y del tipo de gas en la cámara de reacción, lo que indicaba que eran diferentes tipos de partículas. [ cita requerida ]
En 1898, Thomson midió la carga de los iones en aproximadamente 6 × 10 -10 unidades electrostáticas (2 × 10 -19 culombios). [41] : 85 [42] En 1899, demostró que la electricidad negativa creada por la luz ultravioleta que incide sobre un metal (conocida ahora como efecto fotoeléctrico ) tiene la misma relación masa-carga que los rayos catódicos; luego aplicó su método anterior para determinar la carga de los iones a las partículas eléctricas negativas creadas por la luz ultravioleta. [41] : 86 Mediante esta combinación, demostró que la masa del electrón era 0,0014 veces la de los iones de hidrógeno. [43] Estos "corpúsculos" eran tan ligeros pero tenían tanta carga que Thomson concluyó que debían ser las partículas básicas de la electricidad, y por esa razón otros científicos decidieron que estos "corpúsculos" deberían llamarse electrones siguiendo una sugerencia de 1894 de George Johnstone Stoney para nombrar la unidad básica de carga eléctrica. [44]
En 1904, Thomson publicó un artículo en el que describía un nuevo modelo del átomo. [45] Los electrones residen en el interior de los átomos y se trasplantan de un átomo al siguiente en una cadena gracias a la acción de una corriente eléctrica. Cuando los electrones no fluyen, su carga negativa debe ser equilibrada lógicamente por alguna fuente de carga positiva dentro del átomo para que éste sea eléctricamente neutro. Al no tener ni idea de la fuente de esta carga positiva, Thomson propuso tentativamente que la carga positiva estaba en todas partes del átomo, y que el átomo tenía forma de esfera: este era el modelo matemáticamente más simple que se ajustaba a la evidencia disponible (o a la falta de ella). [46] El equilibrio de las fuerzas electrostáticas distribuiría los electrones por toda esta esfera de una manera más o menos uniforme. Thomson explicó además que los iones son átomos que tienen un exceso o una escasez de electrones. [47]
El modelo de Thomson es conocido popularmente como el modelo del pudín de pasas , basado en la idea de que los electrones están distribuidos por toda la esfera de carga positiva con la misma densidad que las pasas en un pudín de pasas . Ni Thomson ni sus colegas utilizaron nunca esta analogía. Parece haber sido una idea de los escritores de divulgación científica. [48] La analogía sugiere que la esfera positiva es como un sólido, pero Thomson la comparó con un líquido, ya que propuso que los electrones se movían en ella en patrones gobernados por las fuerzas electrostáticas. [49] Más concretamente, la electrificación positiva en el modelo de Thomson era una abstracción, no proponía nada concreto como una partícula. El modelo de Thomson estaba incompleto, no podía predecir ninguna de las propiedades conocidas del átomo, como los espectros de emisión o las valencias.
En 1906, Robert A. Millikan y Harvey Fletcher realizaron el experimento de la gota de aceite , en el que midieron que la carga de un electrón era de aproximadamente -1,6 × 10 -19 , un valor que ahora se define como -1 e . Como se sabía que el ion hidrógeno y el electrón eran indivisibles y que un átomo de hidrógeno tiene carga neutra, se dedujo que la carga positiva del hidrógeno era igual a este valor, es decir, 1 e . [ cita requerida ]
Descubrimiento del núcleo
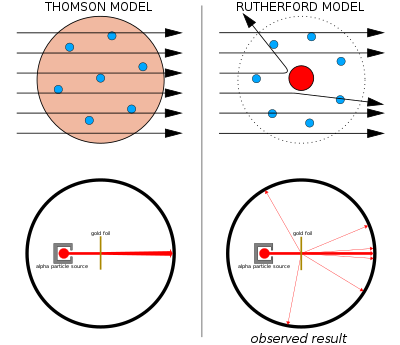
Izquierda: Resultados esperados: partículas alfa que pasan a través del modelo de budín de pasas del átomo con una desviación insignificante.
Derecha: Resultados observados: una pequeña porción de las partículas fueron desviadas por la carga positiva concentrada del núcleo.
El modelo del pudín de pasas de Thomson fue cuestionado en 1911 por uno de sus antiguos alumnos, Ernest Rutherford , quien presentó un nuevo modelo para explicar nuevos datos experimentales. El nuevo modelo proponía un centro concentrado de carga y masa que más tarde se denominó núcleo atómico . [50] : 296
Ernest Rutherford y sus colegas Hans Geiger y Ernest Marsden comenzaron a tener dudas sobre el modelo de Thomson después de que encontraron dificultades cuando intentaron construir un instrumento para medir la relación carga-masa de las partículas alfa (éstas son partículas con carga positiva emitidas por ciertas sustancias radiactivas como el radio ). Las partículas alfa se dispersaban por el aire en la cámara de detección, lo que hacía que las mediciones no fueran confiables. Thomson había encontrado un problema similar en su trabajo sobre rayos catódicos, que resolvió creando un vacío casi perfecto en sus instrumentos. Rutherford no pensó que se encontraría con este mismo problema porque las partículas alfa generalmente tienen mucho más momento que los electrones. Según el modelo de Thomson del átomo, la carga positiva en el átomo no está lo suficientemente concentrada como para producir un campo eléctrico lo suficientemente fuerte como para desviar una partícula alfa. Sin embargo, había dispersión, por lo que Rutherford y sus colegas decidieron investigar esta dispersión con cuidado. [51]
Entre 1908 y 1913, Rutherford y sus colegas realizaron una serie de experimentos en los que bombardearon láminas delgadas de metal con un haz de partículas alfa. Observaron que las partículas alfa se desviaban en ángulos superiores a 90°. Según el modelo de Thomson, todas las partículas alfa deberían haber pasado con una desviación insignificante. Rutherford dedujo que la carga positiva del átomo no está distribuida por todo el volumen del átomo como creía Thomson, sino que está concentrada en un núcleo diminuto en el centro. Este núcleo también contiene la mayor parte de la masa del átomo. Sólo una concentración de carga tan intensa, basada en su alta masa, podría producir un campo eléctrico lo suficientemente fuerte como para desviar las partículas alfa como se observó. [51] El modelo de Rutherford, que se sustentaba principalmente en datos de dispersión desconocidos para muchos científicos, no se popularizó hasta que Niels Bohr se unió al laboratorio de Rutherford y desarrolló un nuevo modelo para los electrones. [50] : 304
Modelo de Bohr
Rutherford dedujo la existencia del núcleo atómico a través de sus experimentos, pero no tenía nada que decir sobre cómo se organizaban los electrones a su alrededor, y esto presentó algunos problemas. El primero es que los electrones son partículas cargadas. Se sabe que una carga eléctrica acelerada emite ondas electromagnéticas según la fórmula de Larmor en el electromagnetismo clásico . Aunque Rutherford no sugirió explícitamente que los electrones orbitan el núcleo como planetas, deben tener algún movimiento circular, y el movimiento circular es aceleración. Por lo tanto, los electrones deberían seguir perdiendo energía hasta que caen en espiral hacia el núcleo. Esto obviamente no estaba sucediendo. Un segundo problema era encontrar algo que pudiera explicar los espectros de emisión y absorción de los átomos. [ cita requerida ]

La teoría cuántica revolucionó la física a principios del siglo XX, cuando Max Planck y Albert Einstein postularon que la energía luminosa se emite o absorbe en cantidades discretas conocidas como cuantos (singular, quantum ). Esto condujo a una serie de modelos atómicos cuánticos como el modelo cuántico de Arthur Erich Haas en 1910 y el modelo atómico cuántico de John William Nicholson de 1912 que cuantizó el momento angular como h /2 π . [52] [53] En 1913, Niels Bohr incorporó esta idea en su modelo de Bohr del átomo, en el que un electrón solo podía orbitar el núcleo en órbitas circulares particulares con momento angular y energía fijos, siendo su distancia al núcleo (es decir, sus radios) proporcional a su energía. [54] Bajo este modelo un electrón no podría entrar en espiral en el núcleo porque no podría perder energía de manera continua; en cambio, solo podría hacer " saltos cuánticos " instantáneos entre los niveles de energía fijos . [54] Cuando esto ocurría, la luz se emitía o absorbía a una frecuencia proporcional al cambio de energía (de ahí la absorción y emisión de luz en espectros discretos). [54]
El modelo de Bohr no era perfecto. Sólo podía predecir las líneas espectrales del hidrógeno, no las de los átomos multielectrónicos. [55] Peor aún, ni siquiera podía explicar todas las características del espectro del hidrógeno: a medida que la tecnología espectrográfica mejoraba, se descubrió que la aplicación de un campo magnético hacía que las líneas espectrales se multiplicaran de una manera que el modelo de Bohr no podía explicar. En 1916, Arnold Sommerfeld añadió órbitas elípticas al modelo de Bohr para explicar las líneas de emisión adicionales, pero esto hizo que el modelo fuera muy difícil de usar y aún así no podía explicar átomos más complejos. [56] [57]
Descubrimiento de isótopos
Mientras experimentaba con los productos de la desintegración radiactiva , en 1913 el radioquímico Frederick Soddy descubrió que parecía haber más de una variedad de algunos elementos. [58] El término isótopo fue acuñado por Margaret Todd como un nombre adecuado para estas variedades. [59]
Ese mismo año, JJ Thomson realizó un experimento en el que canalizó una corriente de iones de neón a través de campos magnéticos y eléctricos, golpeando una placa fotográfica en el otro extremo. Observó dos manchas brillantes en la placa, lo que sugería dos trayectorias de deflexión diferentes. Thomson concluyó que esto se debía a que algunos de los iones de neón tenían una masa diferente. [60] La naturaleza de esta masa diferente se explicaría más tarde con el descubrimiento de los neutrones en 1932: todos los átomos del mismo elemento contienen el mismo número de protones, mientras que los diferentes isótopos tienen diferentes números de neutrones. [61]
Descubrimiento del protón
En 1815, William Prout observó que los pesos atómicos de los elementos conocidos eran múltiplos del peso atómico del hidrógeno, por lo que planteó la hipótesis de que todos los átomos son aglomeraciones de hidrógeno, una partícula a la que denominó "el protilo". La hipótesis de Prout se puso en duda cuando se descubrió que algunos elementos se desviaban de este patrón (por ejemplo, los átomos de cloro pesan en promedio 35,45 daltons ), pero cuando se descubrieron los isótopos en 1913, la observación de Prout ganó renovada atención. [ cita requerida ]
En 1898, JJ Thomson descubrió que la carga positiva de un ion de hidrógeno era igual a la carga negativa de un solo electrón. [62]
En un artículo de abril de 1911 sobre sus estudios sobre la dispersión de partículas alfa , Ernest Rutherford estimó que la carga de un núcleo atómico, expresada como un multiplicador de la carga nuclear del hidrógeno ( q e ), es aproximadamente la mitad del peso atómico del átomo . [63]
En junio de 1911, el físico holandés Antonius van den Broek observó que en la tabla periódica , cada elemento químico sucesivo aumentaba su peso atómico en promedio en 2, lo que a su vez sugería que la carga nuclear de cada elemento sucesivo aumentaba en 1 q e . [64]
En 1913, Henry Moseley midió las emisiones de rayos X de todos los elementos de la tabla periódica y descubrió que la frecuencia de las emisiones de rayos X era una función matemática del número atómico del elemento y la carga del núcleo de hidrógeno (véase la ley de Moseley ). [ cita requerida ]
En 1917, Rutherford bombardeó el gas nitrógeno con partículas alfa y observó que el gas emitía iones de hidrógeno . Rutherford concluyó que las partículas alfa chocaban con los núcleos de los átomos de nitrógeno, lo que hacía que los iones de hidrógeno se desprendieran. [65] [66]
Estas observaciones llevaron a Rutherford a concluir que el núcleo del hidrógeno era una partícula singular con una carga positiva igual a la carga negativa del electrón. El nombre "protón" fue sugerido por Rutherford en una reunión informal de colegas físicos en Cardiff en 1920. [67] Todos los núcleos atómicos contienen un número de protones igual al número atómico del elemento respectivo. Hasta ese momento, el número atómico se había definido como la posición de un elemento en la tabla periódica . [ cita requerida ]
Descubrimiento del neutrón
Los físicos de la década de 1920 creían que el núcleo atómico contenía protones más una serie de "electrones nucleares" que reducían la carga total. Estos "electrones nucleares" eran distintos de los electrones que orbitaban el núcleo. Esta hipótesis incorrecta habría explicado por qué los números atómicos de los elementos eran menores que sus pesos atómicos y por qué los elementos radiactivos emiten electrones ( radiación beta ) en el proceso de desintegración nuclear. Rutherford incluso planteó la hipótesis de que un protón y un electrón podrían unirse estrechamente para formar un "doblete neutro". Rutherford escribió que la existencia de tales "dobletes neutros" moviéndose libremente por el espacio proporcionaría una explicación más plausible de cómo los elementos más pesados podrían haberse formado en la génesis del Universo, dado que es difícil que un protón solitario se fusione con un núcleo atómico grande debido al campo eléctrico repulsivo. [68]
En 1928, Walter Bothe observó que el berilio emitía una radiación eléctricamente neutra y muy penetrante cuando se bombardeaba con partículas alfa. Más tarde se descubrió que esta radiación podía arrancar átomos de hidrógeno de la cera de parafina . Inicialmente se pensó que se trataba de radiación gamma de alta energía , ya que la radiación gamma tenía un efecto similar sobre los electrones de los metales, pero James Chadwick descubrió que el efecto de ionización era demasiado fuerte para que se debiera a la radiación electromagnética, siempre que se conservaran la energía y el momento en la interacción. En 1932, Chadwick expuso varios elementos, como el hidrógeno y el nitrógeno, a la misteriosa "radiación del berilio" y, al medir las energías de las partículas cargadas que retrocedían, dedujo que la radiación estaba compuesta en realidad de partículas eléctricamente neutras que no podían carecer de masa como los rayos gamma, sino que debían tener una masa similar a la de un protón. Chadwick llamó a esta nueva partícula "el neutrón" y creyó que era un protón y un electrón fusionados porque el neutrón tenía aproximadamente la misma masa que un protón y la masa de un electrón es insignificante en comparación. [69] Los neutrones no son, de hecho, una fusión de un protón y un electrón.
Modelos mecánicos cuánticos modernos

En 1924, Louis de Broglie propuso que todas las partículas, en particular las partículas subatómicas como los electrones, tienen una onda asociada. Erwin Schrödinger , fascinado por esta idea, desarrolló una ecuación [70] que describe un electrón como una función de onda en lugar de un punto. Este enfoque predijo muchos de los fenómenos espectrales que el modelo de Bohr no pudo explicar, pero era difícil de visualizar y enfrentó oposición. [71] Uno de sus críticos, Max Born , propuso en cambio que la función de onda de Schrödinger no describía la extensión física de un electrón (como una distribución de carga en el electromagnetismo clásico), sino que daba la probabilidad de que un electrón, al medirse, se encontrara en un punto particular. [72] Esto reconcilió las ideas de electrones similares a ondas y a partículas: el comportamiento de un electrón, o de cualquier otra entidad subatómica, tiene aspectos tanto de onda como de partículas , y si se observa un aspecto u otro depende del experimento. [73]
Una consecuencia de describir las partículas como formas de onda en lugar de puntos es que es matemáticamente imposible calcular con precisión tanto la posición como el momento de una partícula en un punto dado en el tiempo. Esto se conoció como el principio de incertidumbre , un concepto introducido por primera vez por Werner Heisenberg en 1927. [ cita requerida ]
El modelo de onda de Schrödinger para el hidrógeno reemplazó al modelo de Bohr, con sus órbitas circulares claras y definidas. El modelo moderno del átomo describe las posiciones de los electrones en un átomo en términos de probabilidades. Un electrón puede encontrarse potencialmente a cualquier distancia del núcleo, pero, dependiendo de su nivel de energía y momento angular , existe con mayor frecuencia en ciertas regiones alrededor del núcleo que en otras; este patrón se conoce como su orbital atómico . Los orbitales vienen en una variedad de formas: esfera , mancuerna , toro , etc., con el núcleo en el medio. [74] Las formas de los orbitales atómicos se encuentran resolviendo la ecuación de Schrödinger. [75] Se conocen soluciones analíticas de la ecuación de Schrödinger para muy pocos hamiltonianos modelo relativamente simples, incluido el átomo de hidrógeno y el ion molecular de hidrógeno . [76] Comenzando con el átomo de helio , que contiene solo dos electrones, se utilizan métodos numéricos para resolver la ecuación de Schrödinger. [77]
Cualitativamente, la forma de los orbitales atómicos de los átomos multielectrónicos se asemeja a los estados del átomo de hidrógeno. El principio de Pauli requiere la distribución de estos electrones dentro de los orbitales atómicos de tal manera que no se asignen más de dos electrones a cada orbital; este requisito afecta profundamente las propiedades atómicas y, en última instancia, la unión de los átomos para formar moléculas. [78] : 182
Véase también
Notas al pie
- ^ una combinación del término negativo "a-" y "τομή", el término para "cortar"
- ^ Feynman, Leighton & Sands 1963, p. I-2 "Si, en algún cataclismo, todo [] el conocimiento científico fuera destruido [salvo] una frase [...] ¿qué afirmación contendría la mayor cantidad de información en la menor cantidad de palabras? Creo que es [...] que todas las cosas están hechas de átomos –pequeñas partículas que se mueven en perpetuo movimiento, atrayéndose entre sí cuando están a poca distancia, pero repeliéndose al ser apretadas unas contra otras …"
- ^ Pullman, Bernard (1998). El átomo en la historia del pensamiento humano. Oxford, Inglaterra: Oxford University Press. pp. 31–33. ISBN 978-0-19-515040-7Archivado del original el 5 de febrero de 2021 . Consultado el 25 de octubre de 2020 .
- ^ Melsen (1952). De átomos a átomos, págs. 18-19
- ^ abc Pullman (1998). El átomo en la historia del pensamiento humano, pág. 201
- ^ Pullman (1998). El átomo en la historia del pensamiento humano . p. 197.
- ^ "Ley de proporciones definidas | química". Enciclopedia Británica . Consultado el 3 de septiembre de 2020 .
- ^ Thomas Thomson (1831). Historia de la química, volumen 2 , pág. 291
- ^ Dalton (1817). Un nuevo sistema de filosofía química, vol. 2, pág. 36
- ^ Melsen (1952). De átomo a átomo. p. 137
- ^ Dalton (1817). Un nuevo sistema de filosofía química vol. 2, págs. 28-34: "el intermedio u óxido rojo son 2 átomos de protóxido y 1 de oxígeno"
- ^ Millington (1906). John Dalton, pág. 113
- ^ Dalton (1808). Un nuevo sistema de filosofía química, vol. 1, págs. 316-319
- ^ Dalton (1808). Un nuevo sistema de filosofía química, vol. 1, págs. 316-319
- ^ Holbrow y otros (2010). Introducción a la física moderna, págs. 65-66
- ^ Dalton, citado en Freund (1904). El estudio de la composición química . p. 288: "He elegido la palabra átomo para significar estas partículas últimas en lugar de partícula, molécula o cualquier otro término diminutivo, porque creo que es mucho más expresivo; incluye en sí mismo la noción de indivisible, que los otros términos no tienen. Tal vez se pueda decir que extiendo demasiado su aplicación cuando hablo de átomos compuestos; por ejemplo, llamo átomo compuesto a una partícula última de ácido carbónico. Ahora bien, aunque este átomo pueda dividirse, deja de convertirse en ácido carbónico, al resolverse mediante dicha división en carbón y oxígeno. Por lo tanto, creo que no hay ninguna inconsistencia en hablar de átomos compuestos y que mi significado no puede ser malinterpretado".
- ^ Dalton (1817). Un nuevo sistema de filosofía química, vol. 1, págs. 213-214
- ^ Avogadro, Amedeo (1811). "Ensayo sobre una manera de determinar las masas relativas de las moléculas elementales de los cuerpos y las proporciones en que entran en estos compuestos". Journal de Physique . 73 : 58–76.
- ^ Avogadro, Amadeo (1811). "Ensayo de una manera de determinar las masas relativas de las moléculas élémentaires des corps, et les proporciones selon lesquelles elles entrent dans ces combinaisons". Revista de físico . 73 : 58–76.Traducción al inglés
- ^ Trusted (1999). El misterio de la materia, pág. 73
- ^ Freund (1904). El estudio de la composición química . pág. 288.
- ^ Pullman (1998). El átomo en la historia del pensamiento humano, pág. 202
- ^ Jean-Baptiste Dumas (1836). Leçons sur la philosophie chimique [ Lecciones de filosofía química ]. 285–287
- ^ Pullman (1998). El átomo en la historia del pensamiento humano . p. 207
- ^ Cannizzaro (1858). Bosquejo de un curso de filosofía química. pp. 2–4
- ^ Pullman (1998). El átomo en la historia del pensamiento humano, p. 226: "El primer avance es el establecimiento de la clasificación periódica de los elementos, que marca el clímax exitoso de los esfuerzos concertados para ordenar las propiedades químicas de los elementos según su peso atómico. El segundo es el surgimiento de la química estructural, que desbancó lo que era una descripción verbal simple y primitiva de la composición elemental, ya sea atómica o equivalente, de las sustancias y la reemplazó con una determinación sistemática de su arquitectura interna".
- ^ Pullman (1998). El átomo en la historia del pensamiento humano, pág. 230
- ^ Melsen (1952). De átomos a átomos, págs. 147-148
- ^ Henry Enfield Roscoe, Carl Schorlemmer (1895). Tratado de química, volumen 3, parte 1, págs. 121-122
- ^ Henry Enfield Roscoe, Carl Schorlemmer (1895). Tratado de química, volumen 3, parte 1, págs. 121: "La teoría radical y la teoría de tipos son capaces de explicar muchos casos de isomería, pero no fue hasta que se estableció la doctrina de la unión de los átomos que se arrojó una luz clara sobre este tema".
- ^ Adolphe Wurtz (1880). La teoría atómica, p. 291: "Es de esta manera como la teoría de la atomicidad predice, interpreta y limita el número de isómeros; ha proporcionado los elementos de uno de los mayores avances que la ciencia ha logrado en los últimos veinte años. [...] La teoría de la atomicidad ha atacado con éxito el problema introduciendo en la discusión datos exactos, que han sido confirmados experimentalmente en un gran número de casos".
- ^ ab Scerri, Eric R. (2020). La tabla periódica, su historia y su importancia (2.ª ed.). Nueva York: Oxford University Press. ISBN 978-0-190-91436-3.
- ^ Brito, Angmary; Rodríguez, María A.; Niaz, Mansoor (2005). "Una reconstrucción del desarrollo de la tabla periódica basada en la historia y la filosofía de la ciencia y sus implicaciones para los libros de texto de química general". Revista de investigación en enseñanza de las ciencias . 42 (1): 84–111. Código Bibliográfico :2005JRScT..42...84B. doi :10.1002/tea.20044.
- ^ Ver:
- Maxwell, JC (1860) "Ilustraciones de la teoría dinámica de los gases. Parte I. Sobre los movimientos y colisiones de esferas perfectamente elásticas", Philosophical Magazine , 4.ª serie, 19 : 19–32.
- Maxwell, JC (1860) "Ilustraciones de la teoría dinámica de los gases. Parte II. Sobre el proceso de difusión de dos o más tipos de partículas en movimiento entre sí", Philosophical Magazine , 4.ª serie, 20 : 21–37.
- ^ Deltete, Robert (1 de abril de 1999). "Helm y Boltzmann: Energética en Lübeck Naturforscherversammlung". Síntesis . 119 (1): 45–68. doi :10.1023/A:1005287003138. ISSN 1573-0964.
- ^ Navarro, Luis. "Gibbs, Einstein y los fundamentos de la mecánica estadística". Archivo de Historia de las Ciencias Exactas, vol. 53, núm. 2, Springer, 1998, pp. 147–80, http://www.jstor.org/stable/41134058.
- ^ Stone, A. Douglas, Einstein y lo cuántico: la búsqueda del valiente suabo, Princeton University Press, (2013). ISBN 978-0-691-13968-5 citado de Folsing, Albert Einstein, 110.
- ^ "El Premio Nobel de Física de 1926". NobelPrize.org . Consultado el 8 de febrero de 2023 .
- ^ Perrin (1909). Movimiento browniano y realidad molecular, pág. 50
- ^ Perrin (1909). Movimiento browniano y realidad molecular, pág. 50
- ^ JJ Thomson (1897). "Rayos catódicos" (PDF) . Revista filosófica . 44 (269): 293–316. doi :10.1080/14786449708621070.
"De estas determinaciones vemos que el valor de m/e es independiente de la naturaleza del gas, y que su valor 10 -7 es muy pequeño comparado con el valor 10 -4 , que es el valor más pequeño de esta cantidad conocido hasta ahora, y que es el valor del ion hidrógeno en la electrólisis." - ^ ab Pais, Abraham (2002). Inward bound: de materia y fuerzas en el mundo físico (edición reimpresa). Oxford: Clarendon Press [ua] ISBN 978-0-19-851997-3.
- ^ JJ Thomson (1898). "Sobre la carga de electricidad transportada por los iones producidos por los rayos Röntgen". The London, Edinburgh and Dublin Philosophical Magazine and Journal of Science . 5. 46 (283): 528–545.
- ^ JJ Thomson (1899). "Sobre las masas de los iones en gases a bajas presiones". Philosophical Magazine . 5. 48 (295): 547–567.
"...la magnitud de esta carga negativa es de aproximadamente 6 × 10 -10 unidades electrostáticas, y es igual a la carga positiva que lleva el átomo de hidrógeno en la electrólisis de las soluciones. [...] En los gases a bajas presiones, estas unidades de carga eléctrica negativa están siempre asociadas a portadores de una masa definida. Esta masa es extremadamente pequeña, siendo sólo alrededor de 1,4 × 10 -3 de la del ion hidrógeno, la masa más pequeña hasta ahora reconocida como capaz de una existencia separada. La producción de electrificación negativa implica, por tanto, la división de un átomo, como de un conjunto de átomos se desprende algo cuya masa es menor que la de un átomo individual." - ^ Olenick, Richard P.; Apostol, Tom M.; Goodstein, David L. (26 de diciembre de 1986). Más allá del universo mecánico: de la electricidad a la física moderna . Cambridge University Press. pág. 435. ISBN. 978-0-521-30430-6.
- ^ JJ Thomson (marzo de 1904). "Sobre la estructura del átomo: una investigación de la estabilidad y los períodos de oscilación de varios corpúsculos dispuestos a intervalos iguales alrededor de la circunferencia de un círculo; con aplicación de los resultados a la teoría de la estructura atómica". Revista filosófica . Sexta serie. 7 (39): 237–265. doi :10.1080/14786440409463107. Archivado (PDF) desde el original el 2022-10-09.
- ^ JJ Thomson (1907). La teoría corpuscular de la materia , pág. 103: "A falta de un conocimiento exacto de la naturaleza de la forma en que se produce la electricidad positiva en el átomo, consideraremos un caso en el que la electricidad positiva se distribuye de la forma más adecuada para el cálculo matemático, es decir, cuando se presenta como una esfera de densidad uniforme, a lo largo de la cual se distribuyen los corpúsculos".
- ^ JJ Thomson (1907). On the Corpuscular Theory of Matter , p. 26: "La interpretación más simple de estos resultados es que los iones positivos son los átomos o grupos de átomos de varios elementos de los cuales se han eliminado uno o más corpúsculos. Que, de hecho, los corpúsculos son los vehículos por los cuales la electricidad es transportada de un cuerpo a otro, un cuerpo electrificado positivamente se diferencia del mismo cuerpo cuando no está electrificado en que ha perdido algunos de sus corpúsculos, mientras que el cuerpo electrificado negativamente es uno con más corpúsculos que el no electrificado".
- ^ Giora Hon; Bernard R. Goldstein (2013). "El modelo atómico del budín de pasas de JJ Thomson: la creación de un mito científico". Annalen der Physik . 525 (8–9): A129–A133. Bibcode :2013AnP...525A.129H. doi :10.1002/andp.201300732.
- ^ JJ Thomson, en una carta a Oliver Lodge fechada el 11 de abril de 1904, citada en Davis & Falconer (1997):
"Con respecto a la electrificación positiva, he tenido la costumbre de utilizar la analogía burda de un líquido con una cierta cantidad de cohesión, suficiente para evitar que vuele en pedazos por su propia repulsión. Sin embargo, siempre he tratado de mantener la concepción física de la electricidad positiva en un segundo plano porque siempre he tenido esperanzas (aún no realizadas) de poder prescindir de la electrificación positiva como una entidad separada y reemplazarla por alguna propiedad de los corpúsculos". - ^ ab Heilbron, John L. (1968). "La dispersión de partículas α y β y el átomo de Rutherford". Archivo de Historia de las Ciencias Exactas . 4 (4): 247–307. doi :10.1007/BF00411591. ISSN 0003-9519. JSTOR 41133273.
- ^ ab Heilbron (2003). Ernest Rutherford y la explosión de átomos, págs. 64-68
- ^ JW Nicholson, Mes. No. Roy. Astro. Soc. lxxii. págs. 49,130, 677, 693, 729 (1912).
- ^ La teoría atómica de John William Nicholson, Russell McCormmach, Archivo de Historia de las Ciencias Exactas, Vol. 3, No. 2 (25.8.1966), pp. 160–184 (25 páginas), Springer.
- ^ abc Bohr, Niels (1913). "Sobre la constitución de átomos y moléculas" (PDF) . Revista filosófica . 26 (153): 476–502. Código bibliográfico :1913PMag...26..476B. doi :10.1080/14786441308634993. Archivado (PDF) desde el original el 2022-10-09.
- ^ Kragh, Helge (1979). "Segunda teoría atómica de Niels Bohr". Estudios históricos en las ciencias físicas . 10 : 123–186. doi :10.2307/27757389. ISSN 0073-2672. JSTOR 27757389.
- ^ Hentschel, Klaus (2009). "Efecto Zeeman". En Greenberger, Daniel; Hentschel, Klaus; Weinert, Friedel (eds.). Compendio de Física Cuántica . Berlín, Heidelberg: Springer Berlín Heidelberg. págs. 862–864. doi :10.1007/978-3-540-70626-7_241. ISBN 978-3-540-70622-9. Consultado el 8 de febrero de 2023 .
- ^ Eckert, Michael (abril de 2014). "Cómo Sommerfeld extendió el modelo atómico de Bohr (1913-1916)". The European Physical Journal H . 39 (2): 141–156. Bibcode :2014EPJH...39..141E. doi :10.1140/epjh/e2013-40052-4. ISSN 2102-6459. S2CID 256006474.
- ^ "Frederick Soddy, Premio Nobel de Química 1921". Fundación Nobel . Consultado el 18 de enero de 2008 .
- ^ Fleck, Alexander (1957). "Frederick Soddy". Memorias biográficas de miembros de la Royal Society . 3 : 203–216. doi : 10.1098/rsbm.1957.0014 .
p. 208: Hasta 1913 utilizamos la frase 'elementos radioactivos químicamente no separables' y en ese momento la palabra isótopo fue sugerida en una discusión de salón con la Dra. Margaret Todd en la casa del suegro de Soddy, Sir
George Beilby
.
- ^ Thomson, JJ (1913). "Rayos de electricidad positiva". Actas de la Royal Society . A 89 (607): 1–20. Bibcode :1913RSPSA..89....1T. doi :10.1098/rspa.1913.0057. S2CID 124295244.[según extracto de Henry A. Boorse y Lloyd Motz, The World of the Atom , vol. 1 (Nueva York: Basic Books, 1966)]. Recuperado el 29 de agosto de 2007.
- ^ Flowers, Paul; et al. (2022). Química 2.ª edición. OpenStax. págs. 70–71. ISBN 978-1-947172-61-6.
- ^ JJ Thomson (1898). "Sobre la carga de electricidad transportada por los iones producidos por los rayos Röntgen". Revista filosófica y revista científica de Londres, Edimburgo y Dublín . 5. 46 (283): 528–545. doi :10.1080/14786449808621229.
- ^ Ernest Rutherford (1911). "La dispersión de partículas α y β por la materia y la estructura del átomo". Revista filosófica . Serie 6. 21 (125): 669–688. doi :10.1080/14786440508637080.
- ↑ Antonius van den Broek (23 de junio de 1911). «El número de elementos posibles y el sistema periódico «cúbico» de Mendeléeff». Nature . 87 (2177): 78. Bibcode :1911Natur..87...78V. doi :10.1038/087078b0.
"Por lo tanto, si este sistema periódico cúbico resultara ser correcto, entonces el número de elementos posibles es igual al número de posibles cargas permanentes de cada signo por átomo, o a cada posible carga permanente (de ambos signos) por átomo pertenece un posible elemento." - ^ Rutherford, Ernest (1919). "Colisiones de partículas alfa con átomos ligeros. IV. Un efecto anómalo en el nitrógeno". Revista filosófica . 37 (222): 581. doi :10.1080/14786440608635919.
- ^ El desarrollo de la teoría de la estructura atómica (Rutherford 1936). Reimpreso en Antecedentes de la ciencia moderna: diez conferencias en Cambridge organizadas por el Comité de Historia de la Ciencia en 1936 :
"En 1919 demostré que cuando los átomos ligeros eran bombardeados por partículas α podían desintegrarse con la emisión de un protón o núcleo de hidrógeno. Por lo tanto, supusimos que un protón debía ser una de las unidades de las que estaban compuestos los núcleos de otros átomos..." - ^ Orme Masson (1921). "La constitución de los átomos". Revista filosófica y revista científica de Londres, Edimburgo y Dublín . 41 (242): 281–285. doi :10.1080/14786442108636219.
Nota de Ernest Rutherford: 'En el momento de escribir este artículo en Australia, el profesor Orme Masson no sabía que el nombre "protón" ya había sido sugerido como un nombre adecuado para la unidad de masa cercana a 1, en términos de oxígeno 16, que parece entrar en la estructura nuclear de los átomos. La cuestión de un nombre adecuado para esta unidad se discutió en una reunión informal de varios miembros de la Sección A de la Asociación Británica [para el Avance de la Ciencia] en Cardiff este año. Se mencionó el nombre "barón" sugerido por el profesor Masson, pero se consideró inadecuado debido a la variedad existente de significados. Finalmente, el nombre "protón" recibió la aprobación general, particularmente porque sugiere el término original "protilo" dado por Prout en su conocida hipótesis de que todos los átomos están formados por hidrógeno. Sir Oliver Lodge llamó la atención sobre la necesidad de un nombre especial para la unidad nuclear de masa 1 en la reunión de la Sección, y el autor sugirió entonces el nombre "protón".' - ^ Sir E. Rutherford (1920). "Bakerian Lecture: Nuclear Constitution of Atoms". Actas de la Royal Society de Londres. Serie A. 97 : 374–400.:"Sin embargo, en determinadas condiciones, puede ser posible que un electrón se combine mucho más estrechamente con el núcleo H, formando una especie de doblete neutro. [...] La existencia de tales átomos parece casi necesaria para explicar la formación de los núcleos de los elementos pesados; pues, a menos que supongamos la producción de partículas cargadas de velocidades muy altas, es difícil ver cómo una partícula cargada positivamente puede alcanzar el núcleo de un átomo pesado en contra de su intenso campo repulsivo".
- ^ Chadwick, James (1932). "Posible existencia de un neutrón" (PDF) . Nature . 129 (3252): 312. Bibcode :1932Natur.129Q.312C. doi : 10.1038/129312a0 . S2CID 4076465. Archivado (PDF) desde el original el 2022-10-09.
- ^ Schrödinger, Erwin (1926). "La cuantización como problema de valores propios". Annalen der Physik . 81 (18): 109-139. Código bibliográfico : 1926AnP...386..109S. doi : 10.1002/andp.19263861802.
- ^ Mahanti, Subodh. «Erwin Schrödinger: el fundador de la mecánica ondulatoria cuántica». Archivado desde el original el 17 de abril de 2009. Consultado el 1 de agosto de 2009 .
- ^ Mahanti, Subodh. "Max Born: fundador de Lattice Dynamics". Archivado desde el original el 22 de enero de 2009. Consultado el 1 de agosto de 2009 .
- ^ Greiner, Walter (4 de octubre de 2000). "Mecánica cuántica: una introducción". Springer. ISBN 9783540674580. Consultado el 14 de junio de 2010 .
- ^ Milton Orchin; Roger Macomber; Allan Pinhas; R. Wilson. "El vocabulario y los conceptos de la química orgánica, segunda edición" (PDF) . Archivado (PDF) desde el original el 2022-10-09 . Consultado el 2010-06-14 .
- ^ Zwiebach, Barton (2022). Dominio de la mecánica cuántica: fundamentos, teoría y aplicaciones. Cambridge: MIT Press. págs. 281–305. ISBN 978-0-262-36689-2.OCLC 1306066387 .
- ^ Grivet, Jean-Philippe (enero de 2002). "El ion molecular de hidrógeno revisitado". Revista de educación química . 79 (1): 127. Bibcode :2002JChEd..79..127G. doi :10.1021/ed079p127. ISSN 0021-9584.
- ^ Levin, FS; Shertzer, J. (1985-12-01). "Solución de elementos finitos de la ecuación de Schrödinger para el estado fundamental del helio". Physical Review A . 32 (6): 3285–3290. Bibcode :1985PhRvA..32.3285L. doi :10.1103/PhysRevA.32.3285. ISSN 0556-2791. PMID 9896495.
- ^ Karplus, Martin y Richard Needham Porter. "Átomos y moléculas: una introducción para estudiantes de química física". Átomos y moléculas: una introducción para estudiantes de química física (1970).
Bibliografía
- Feynman, RP ; Leighton, RB; Sands, M. (1963). Las conferencias de Feynman sobre física . Vol. 1. ISBN 978-0-201-02116-5.
- Andrew G. van Melsen (1960) [Publicado por primera vez en 1952]. De átomos a átomo: la historia del concepto de átomo . Traducido por Henry J. Koren. Dover Publications. ISBN 0-486-49584-1.
- JP Millington (1906). John Dalton. JM Dent & Co. (Londres); EP Dutton & Co. (Nueva York).
- Jaume Navarro (2012). Una historia del electrón: JJ y GP Thomson . Cambridge University Press. ISBN 978-1-107-00522-8.
- Trusted, Jennifer (1999). El misterio de la materia . MacMillan. ISBN 0-333-76002-6.
- Bernard Pullman (1998). El átomo en la historia del pensamiento humano . Traducido por Axel Reisinger. Oxford University Press. ISBN 0-19-511447-7.
- Jean Perrin (1910) [1909]. Movimiento browniano y realidad molecular. Traducido por F. Soddy. Taylor y Francis.
- Ida Freund (1904). El estudio de la composición química . Cambridge University Press.
- Thomas Thomson (1807). Un sistema de química: en cinco volúmenes, volumen 3. John Brown.
- Thomas Thomson (1831). Historia de la química, volumen 2. H. Colburn y R. Bentley.
- John Dalton (1808). Un nuevo sistema de filosofía química vol. 1.
- John Dalton (1817). Un nuevo sistema de filosofía química vol. 2.
- Stanislao Cannizzaro (1858). Bosquejo de un curso de filosofía química. The Alembic Club.
Lectura adicional
- Charles Adolphe Wurtz (1881) La teoría atómica , D. Appleton and Company, Nueva York.
- Alan J. Rocke (1984) Atomismo químico en el siglo XIX: de Dalton a Cannizzaro , Ohio State University Press, Columbus (texto completo de acceso abierto en http://digital.case.edu/islandora/object/ksl%3Ax633gj985).
Enlaces externos
- Atomismo de S. Mark Cohen.
- Teoría Atómica: información detallada sobre la teoría atómica con respecto a los electrones y la electricidad.
- Las conferencias de física de Feynman, vol. I, cap. 1: Átomos en movimiento

