Cloruro de hierro (II)
| |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombres IUPAC Cloruro de hierro (II) Dicloruro de hierro | |||
| Otros nombres Cloruro ferroso Rokühnita | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.028.949 | ||
| Número CE |
| ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| FeCl2 | |||
| Masa molar | 126,751 g/mol (anhidro) 198,8102 g/mol (tetrahidrato) | ||
| Apariencia | Sólido de color canela (anhidro) Sólido de color verde pálido (di-tetrahidrato) | ||
| Densidad | 3,16 g/cm 3 (anhidro) 2,39 g/cm 3 (dihidrato) 1,93 g/cm 3 (tetrahidrato) | ||
| Punto de fusión | 677 °C (1251 °F; 950 K) (anhidro) 120 °C (dihidrato) 105 °C (tetrahidrato) | ||
| Punto de ebullición | 1023 °C (1873 °F; 1296 K) (anhidro) | ||
| 64,4 g/100 ml (10 °C), 68,5 g/100 ml (20 °C), 105,7 g/100 ml (100 °C) | |||
| Solubilidad en THF | Soluble | ||
| registro P | -0,15 | ||
| +14 750 ·10 −6 cm3 / mol | |||
| Estructura | |||
| Monoclínico | |||
| Octaédrico en Fe | |||
| Farmacología | |||
| B03AA05 ( OMS ) | |||
| Peligros | |||
| NFPA 704 (rombo cortafuegos) | |||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
REL (recomendado) | TWA 1 mg/m3 [ 1] | ||
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad del cloruro de hierro (II) | ||
| Compuestos relacionados | |||
Otros aniones | Fluoruro de hierro (II ) Bromuro de hierro (II) Yoduro de hierro (II) | ||
Otros cationes | Cloruro de cobalto (II) Cloruro de manganeso (II) Cloruro de cobre (II) | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El cloruro de hierro (II) , también conocido como cloruro ferroso , es un compuesto químico de fórmula FeCl 2 . Es un sólido paramagnético con un alto punto de fusión. El compuesto es blanco, pero las muestras típicas suelen ser de color blanquecino. El FeCl 2 cristaliza en agua como tetrahidrato verdoso , que es la forma que se encuentra más comúnmente en el comercio y en el laboratorio. También existe un dihidrato. El compuesto es muy soluble en agua, lo que da lugar a soluciones de color verde pálido.
Producción

Las formas hidratadas de cloruro ferroso se generan mediante el tratamiento de los desechos de la producción de acero con ácido clorhídrico . Estas soluciones se denominan "ácido gastado" o "licor de decapado", especialmente cuando el ácido clorhídrico no se consume por completo:
- Fe + 2 HCl → FeCl2 + H2
La producción de cloruro férrico implica el uso de cloruro ferroso. El cloruro ferroso también es un subproducto de la producción de titanio, ya que algunos minerales de titanio contienen hierro. [3]
FeCl anhidro2
El cloruro ferroso se prepara añadiendo polvo de hierro a una solución de ácido clorhídrico en metanol. Esta reacción produce el solvato metanólico del dicloruro, que al calentarlo al vacío a unos 160 °C se convierte en FeCl 2 anhidro . [4] La reacción neta se muestra:
- Fe + 2 HCl → FeCl2 + H2
FeBr2 y FeI2 se pueden preparar de forma análoga.
Una síntesis alternativa de cloruro ferroso anhidro es la reducción de FeCl 3 con clorobenceno : [5]
- 2FeCl3 + C6H5Cl → 2FeCl2 + C6H4Cl2 + HCl
Para la preparación del ferroceno, se genera cloruro ferroso in situ mediante la proporción de FeCl3 con polvo de hierro en tetrahidrofurano (THF). [6] El cloruro férrico se descompone en cloruro ferroso a altas temperaturas.
Hidratos
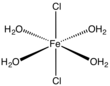
El dihidrato, FeCl2 ( H2O ) 2 , cristaliza a partir de ácido clorhídrico concentrado. [7] El dihidrato es un polímero de coordinación . Cada centro de Fe está coordinado con cuatro ligandos de cloruro doblemente puenteados . El octaedro se completa con un par de ligandos aquo mutuamente trans . [8]

Reacciones

El FeCl 2 y sus hidratos forman complejos con muchos ligandos. Por ejemplo, las soluciones de los hidratos reaccionan con dos equivalentes molares de [(C 2 H 5 ) 4 N]Cl para dar la sal [(C 2 H 5 ) 4 N] 2 [FeCl 4 ]. [10]
El FeCl2 anhidro , soluble en THF, [2] es un precursor estándar en la síntesis organometálica. El FeCl2 se utiliza para generar complejos NHC in situ para reacciones de acoplamiento cruzado . [11]
Aplicaciones
A diferencia del sulfato ferroso y el cloruro férrico relacionados , el cloruro ferroso tiene pocas aplicaciones comerciales. Aparte de su uso en la síntesis de complejos de hierro en el laboratorio, el cloruro ferroso sirve como agente de coagulación y floculación en el tratamiento de aguas residuales , especialmente para desechos que contienen cromato o sulfuros . [12] Se utiliza para el control de olores en el tratamiento de aguas residuales. Se utiliza como precursor para fabricar varios grados de hematita que se pueden utilizar en una variedad de pigmentos. Es el precursor de los óxidos de hierro (III) hidratados que son pigmentos magnéticos. [3] El FeCl2 encuentra algún uso como reactivo en la síntesis orgánica . [13]
Ocurrencia natural
La lawrencita, (Fe,Ni)Cl 2 , es la contraparte natural y un mineral meteorítico típico (aunque de aparición rara). [14] La forma natural del dihidrato es la rokühnita, un mineral muy raro. [15] Los minerales relacionados, pero más complejos (en particular, básicos o hidratados) son la hibbingita , la droninoita y la kuliginita.
Referencias
- ^ Guía de bolsillo del NIOSH sobre peligros químicos. "#0346". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ ab Cotton, FA; Luck, RL; Son, K.-A. (1991). "Nuevos compuestos polinucleares de cloruro de hierro (II) con ligandos donantes de oxígeno Parte I. Fe 4 Cl 8 (THF) 6 : síntesis y determinación de la estructura de un monocristal mediante rayos X". Inorganica Chimica Acta . 179 : 11–15. doi :10.1016/S0020-1693(00)85366-9.
- ^ por Egon Wildermuth, Hans Stark, Gabriele Friedrich, Franz Ludwig Ebenhöch, Brigitte Kühborth, Jack Silver, Rafael Rituper "Compuestos de hierro" en Ullmann's Encyclopedia of Industrial Chemistry . Wiley-VCH, Viena, 2005.
- ^ G. Winter; Thompson, DW; Loehe, JR (1973). "Haluros de hierro (II)". Síntesis inorgánica . Vol. 14. págs. 99-104. doi :10.1002/9780470132456.ch20. ISBN . 978-0-470-13245-6.
{{cite book}}:|journal=ignorado ( ayuda ) - ^ P. Kovacic y NO Brace (1960). "Cloruro de hierro (II)". Síntesis inorgánica . Vol. 6. págs. 172-173. doi :10.1002/9780470132371.ch54. ISBN . 978-0-470-13237-1.
{{cite book}}:|journal=ignorado ( ayuda ) - ^ Wilkinson, G. (1956). "Ferroceno". Síntesis orgánicas . 36 : 31. doi :10.15227/orgsyn.036.0031.
- ^ KH. Gayer; L. Woontner (1957). "Cloruro de hierro (II) 2-hidrato". Síntesis inorgánica . Vol. 5. págs. 179-181. doi :10.1002/9780470132364.ch48. ISBN . 978-0-470-13236-4.
{{cite book}}:|journal=ignorado ( ayuda ) - ^ Morosin, B.; Graeber, EJ (1965). "Estructuras cristalinas del cloruro de manganeso(II) y hierro(II) dihidrato". Journal of Chemical Physics . 42 (3): 898–901. Código Bibliográfico :1965JChPh..42..898M. doi :10.1063/1.1696078.
- ^ Baudisch, Oskar; Hartung, Walter H. (1939). "Cloruro ferroso tetrapiridino (sal amarilla)". Síntesis inorgánica . Vol. 1. págs. 184-185. doi :10.1002/9780470132326.ch64. ISBN . 978-0-470-13232-6.
- ^ NS Gill, FB Taylor (1967). "Tetrahalo Complexes of Dipositive Metals in the First Transition Series" (Complejos tetrahalo de metales dipositivos en la primera serie de transición). Inorganic Syntheses (Síntesis inorgánica ) . Vol. 9. págs. 136-142. doi :10.1002/9780470132401.ch37. ISBN. 978-0-470-13240-1.
{{cite book}}:|journal=ignorado ( ayuda ) - ^ Bi-Jie Li; Xi-Sha Zhang; Zhang-Jie Shi (2014). "Acoplamiento cruzado de carboxilatos de alquenilo/arilo con reactivos de Grignard mediante activación de enlaces CO catalizada por Fe". Org. Synth . 91 : 83–92. doi : 10.15227/orgsyn.091.0083 .
- ^ Jameel, Pervez (1989). "El uso de cloruro ferroso para controlar los sulfuros disueltos en las alcantarillas interceptoras". Revista (Water Pollution Control Federation) . 61 (2): 230–236. JSTOR 25046917.
- ^ Andrew D. White; David G. Hilmey (2009). "Cloruro de hierro (II)". Enciclopedia de reactivos para síntesis orgánica . doi :10.1002/047084289X.ri055.pub2. ISBN 978-0-471-93623-7.
- ^ "Lawrencita".
- ^ "Rokühnita".
_chloride_anhydrate.jpg/440px-Iron(II)_chloride_anhydrate.jpg)