Ácido fórmico
| |||
 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Ácido fórmico [1] | |||
| Nombre sistemático de la IUPAC Ácido metanoico [1] | |||
Otros nombres
| |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 1209246 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Banco de medicamentos | |||
| Tarjeta informativa de la ECHA | 100.000.527 | ||
| Número CE |
| ||
| Número E | E236 (conservantes) | ||
| 1008 | |||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| CH2O2 | |||
| Masa molar | 46,025 g·mol −1 | ||
| Apariencia | Líquido fumante incoloro | ||
| Olor | Picante, penetrante | ||
| Densidad | 1,220 g/ml | ||
| Punto de fusión | 8,4 °C (47,1 °F; 281,5 K) | ||
| Punto de ebullición | 100,8 °C (213,4 °F; 373,9 K) | ||
| Miscible | |||
| Solubilidad | Miscible con éter , acetona , acetato de etilo , glicerol , metanol , etanol . Parcialmente soluble en benceno , tolueno , xilenos . | ||
| registro P | -0,54 | ||
| Presión de vapor | 35 mmHg (20 °C) [2] | ||
| Acidez (p K a ) | 3.745 [3] | ||
| Base conjugada | Formato | ||
| −19,90 × 10 −6 cm3 / mol | |||
Índice de refracción ( n D ) | 1.3714 (20 °C) | ||
| Viscosidad | 1,57 cP a 268 ° C | ||
| Estructura | |||
| Planar | |||
| 1,41 D (gasolina) | |||
| Termoquímica | |||
Entropía molar estándar ( S ⦵ 298 ) | 131,8 J/mol·K | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −425,0 kJ/mol | ||
Entalpía estándar de combustión (Δ c H ⦵ 298 ) | −254,6 kJ/mol | ||
| Farmacología | |||
| QP53AG01 ( OMS ) | |||
| Peligros | |||
| Seguridad y salud en el trabajo (SST/OHS): | |||
Principales peligros | Corrosivo; irritante; sensibilizante | ||
| Etiquetado SGA : | |||
  | |||
| Peligro | |||
| H314 | |||
| P260 , P264 , P280 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P321 , P363 , P405 , P501 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | 69 °C (156 °F; 342 K) | ||
| 601 °C (1114 °F; 874 K) | |||
| Límites de explosividad | 14–34% [ cita requerida ] 18–57% (solución al 90%) [2] | ||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 700 mg/kg (ratón, oral), 1100 mg/kg (rata, oral), 4000 mg/kg (perro, oral) [4] | ||
LC 50 ( concentración media ) | 7853 ppm (rata, 15 min) 3246 ppm (ratón, 15 min) [4] | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | TWA 5 ppm (9 mg/m3 ) [ 2] | ||
REL (recomendado) | TWA 5 ppm (9 mg/m3 ) [ 2] | ||
IDLH (Peligro inmediato) | 30 ppm [2] | ||
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad de JT Baker | ||
| Compuestos relacionados | |||
Ácidos carboxílicos relacionados | Ácido acético Ácido propiónico | ||
Compuestos relacionados | Formaldehído Metanol | ||
| Página de datos complementarios | |||
| Ácido fórmico (página de datos) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El ácido fórmico (del latín formica ' hormiga '), denominado sistemáticamente ácido metanoico , es el ácido carboxílico más simple , y tiene la fórmula química HCOOH y la estructura H−C(=O)−O−H . Es un intermediario importante en la síntesis química y se produce de forma natural, sobre todo en algunas hormigas. Los ésteres , las sales y el anión derivado del ácido fórmico se denominan formiatos . Industrialmente, el ácido fórmico se produce a partir del metanol . [5]
Ocurrencia natural
El ácido fórmico se encuentra de forma natural en insectos, malas hierbas, frutas y verduras, y en las emisiones forestales. Aparece en la mayoría de las hormigas y en las abejas sin aguijón del género Oxytrigona . [6] [7] Las hormigas de la madera del género Formica pueden rociar ácido fórmico sobre sus presas o para defender el nido. La oruga de la polilla ( Cerura vinula ) también lo rociará cuando se sienta amenazada por depredadores. También se encuentra en los tricomas de la ortiga ( Urtica dioica ). Aparte de eso, este ácido se incorpora en muchas frutas como la piña (0,21 mg por 100 g), la manzana (2 mg por 100 g) y el kiwi (1 mg por 100 g), así como en muchas verduras, en concreto la cebolla (45 mg por 100 g), la berenjena (1,34 mg por 100 g) y, en concentraciones extremadamente bajas, el pepino (0,11 mg por 100 g). [8] El ácido fórmico es un componente natural de la atmósfera debido principalmente a las emisiones forestales. [9]
Historia
Ya en el siglo XV, algunos alquimistas y naturalistas sabían que los hormigueros desprendían un vapor ácido. La primera persona que describió el aislamiento de esta sustancia (mediante la destilación de un gran número de hormigas) fue el naturalista inglés John Ray , en 1671. [10] [11] Las hormigas secretan el ácido fórmico con fines de ataque y defensa. El ácido fórmico fue sintetizado por primera vez a partir del ácido cianhídrico por el químico francés Joseph Gay-Lussac . En 1855, otro químico francés, Marcellin Berthelot , desarrolló una síntesis a partir del monóxido de carbono similar al proceso que se utiliza en la actualidad. [ cita requerida ]
Durante mucho tiempo se consideró que el ácido fórmico era un compuesto químico de interés menor en la industria química. A fines de la década de 1960, se empezaron a obtener cantidades significativas como subproducto de la producción de ácido acético . En la actualidad, se utiliza cada vez más como conservante y antibacteriano en los alimentos para el ganado . [ cita requerida ]
Propiedades

El ácido fórmico es un líquido incoloro que a temperatura ambiente tiene un olor penetrante y acre [12] , comparable al del ácido acético . El ácido fórmico es aproximadamente diez veces más fuerte que el ácido acético . [ cita requerida ]
Es miscible con agua y la mayoría de los disolventes orgánicos polares , y es algo soluble en hidrocarburos . En hidrocarburos y en la fase de vapor, consiste en dímeros unidos por enlaces de hidrógeno en lugar de moléculas individuales. [13] [14] Debido a su tendencia a formar enlaces de hidrógeno, el ácido fórmico gaseoso no obedece la ley de los gases ideales . [14] El ácido fórmico sólido, que puede existir en cualquiera de los dos polimorfos , consiste en una red prácticamente infinita de moléculas de ácido fórmico unidas por enlaces de hidrógeno. El ácido fórmico forma un azeótropo de alto punto de ebullición con agua (107,3 °C; 77,5 % de ácido fórmico). El ácido fórmico líquido tiende a sobreenfriarse .
Reacciones químicas
Descomposición
El ácido fórmico se descompone fácilmente por deshidratación en presencia de ácido sulfúrico concentrado para formar monóxido de carbono y agua:
- HCO2H → H2O + CO
El tratamiento del ácido fórmico con ácido sulfúrico es una fuente conveniente de CO en el laboratorio. [15] [16]
En presencia de platino , se descompone con liberación de hidrógeno y dióxido de carbono .
- HCO2H → H2 + CO2
Los catalizadores de rutenio soluble también son eficaces para producir hidrógeno libre de monóxido de carbono. [17]
Reactivo
El ácido fórmico comparte la mayoría de las propiedades químicas de otros ácidos carboxílicos . Debido a su alta acidez, las soluciones en alcoholes forman ésteres espontáneamente; en las esterificaciones de Fischer del ácido fórmico, autocataliza la reacción y no se necesita ningún catalizador ácido adicional. [18] El ácido fórmico comparte algunas de las propiedades reductoras de los aldehídos , reduciendo las soluciones de óxidos metálicos a su metal respectivo. [19]
El ácido fórmico es una fuente de un grupo formilo , por ejemplo, en la formilación de N -metilanilina a N -metilformanilida en tolueno . [20]
En la química orgánica sintética , el ácido fórmico se utiliza a menudo como fuente de iones hidruro , como en la reacción de Eschweiler-Clarke :
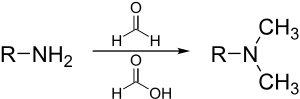
Se utiliza como fuente de hidrógeno en la hidrogenación por transferencia , como en la reacción de Leuckart para producir aminas , y (en solución acuosa o en su azeótropo con trietilamina ) para la hidrogenación de cetonas . [21]
Adición a alquenos
El ácido fórmico es único entre los ácidos carboxílicos por su capacidad de participar en reacciones de adición con alquenos . Los ácidos fórmicos y los alquenos reaccionan fácilmente para formar ésteres de formato . Sin embargo, en presencia de ciertos ácidos, incluidos los ácidos sulfúrico y fluorhídrico , se produce una variante de la reacción de Koch , y el ácido fórmico se añade al alqueno para producir un ácido carboxílico más grande. [22]
Anhídrido de ácido fórmico
Se puede obtener un anhídrido fórmico inestable, H(C=O)−O−(C=O)H, mediante la deshidratación del ácido fórmico con N , N′ - diciclohexilcarbodiimida en éter a baja temperatura. [23]
Producción
En 2009, la capacidad mundial para producir ácido fórmico fue de 720 mil toneladas (1.6 mil millones de libras) por año, dividida aproximadamente en partes iguales entre Europa (350 mil toneladas o 770 millones de libras, principalmente en Alemania) y Asia (370 mil toneladas u 820 millones de libras, principalmente en China), mientras que la producción fue inferior a mil toneladas o 2,2 millones de libras por año en todos los demás continentes. [24] Está disponible comercialmente en soluciones de varias concentraciones entre 85 y 99 p/p %. [13] En 2009 [actualizar], los mayores productores fueron BASF , Eastman Chemical Company , LC Industrial y Feicheng Acid Chemicals , con las mayores instalaciones de producción en Ludwigshafen (200 mil toneladas o 440 millones de libras por año, BASF, Alemania), Oulu (105 mil toneladas o 230 millones de libras, Eastman, Finlandia), Nakhon Pathom (n/a, LC Industrial) y Feicheng (100 mil toneladas o 220 millones de libras, Feicheng, China). Los precios de 2010 oscilaron entre alrededor de 650 €/tonelada (equivalente a alrededor de 800 $/tonelada) en Europa Occidental y 1250 $/tonelada en los Estados Unidos. [24]
A partir de formiato de metilo y formamida
Cuando el metanol y el monóxido de carbono se combinan en presencia de una base fuerte , el resultado es formiato de metilo , según la ecuación química : [13]
- CH3OH + CO → HCO2CH3
En la industria, esta reacción se lleva a cabo en fase líquida a presión elevada. Las condiciones de reacción típicas son 80 °C y 40 atm. La base más utilizada es el metóxido de sodio . La hidrólisis del formiato de metilo produce ácido fórmico:
- HCO 2 CH 3 + H 2 O → HCOOH + CH 3 OH
La hidrólisis eficaz del formiato de metilo requiere un gran exceso de agua. Algunas rutas proceden de forma indirecta, tratando primero el formiato de metilo con amoníaco para dar formamida , que luego se hidroliza con ácido sulfúrico :
- HCO2CH3 + NH3 → HC ( O ) NH2 + CH3OH
- 2HC ( O ) NH2 + 2H2O + H2SO4 → 2HCO2H + ( NH4 ) 2SO4
Una desventaja de este enfoque es la necesidad de eliminar el subproducto de sulfato de amonio . Este problema ha llevado a algunos fabricantes a desarrollar métodos energéticamente eficientes para separar el ácido fórmico del exceso de agua utilizada en la hidrólisis directa. En uno de estos procesos, utilizado por BASF , el ácido fórmico se elimina del agua mediante extracción líquido-líquido con una base orgánica. [ cita requerida ]
Rutas químicas de nicho y obsoletas
Subproducto de la producción de ácido acético.
Una cantidad significativa de ácido fórmico se produce como subproducto en la fabricación de otros productos químicos. En un tiempo, el ácido acético se producía a gran escala mediante la oxidación de alcanos , mediante un proceso que cogenera una cantidad significativa de ácido fórmico. [13] Esta ruta oxidativa para el ácido acético ha perdido importancia, de modo que las rutas antes mencionadas para el ácido fórmico han adquirido mayor importancia. [ cita requerida ]
Hidrogenación del dióxido de carbono
La hidrogenación catalítica del CO2 a ácido fórmico ha sido estudiada durante mucho tiempo y puede llevarse a cabo de manera homogénea. [25] [26] [27]
Oxidación de biomasa
El ácido fórmico también se puede obtener mediante oxidación parcial catalítica acuosa de biomasa húmeda mediante el proceso OxFA . [28] [29] Se utiliza un polioxometalato de tipo Keggin (H 5 PV 2 Mo 10 O 40 ) como catalizador homogéneo para convertir azúcares, madera, papel usado o cianobacterias en ácido fórmico y CO 2 como único subproducto. Se pueden lograr rendimientos de hasta 53% de ácido fórmico. [ cita requerida ]
Métodos de laboratorio
En el laboratorio, el ácido fórmico se puede obtener calentando ácido oxálico en glicerol y luego destilándolo con vapor. [30] El glicerol actúa como catalizador, ya que la reacción se lleva a cabo a través de un intermedio de oxalato de glicerilo. Si la mezcla de reacción se calienta a temperaturas más altas, se obtiene alcohol alílico . La reacción neta es, por lo tanto:
- C 2 O 4 H 2 → HCO 2 H + CO 2
Otro método ilustrativo implica la reacción entre el formato de plomo y el sulfuro de hidrógeno , impulsada por la formación de sulfuro de plomo . [31]
- Pb(HCOO) 2 + H2S → 2HCOOH+PbS
Producción electroquímica
El formato se forma por la reducción electroquímica de CO 2 (en forma de bicarbonato ) en un cátodo de plomo a pH 8,6: [32]
- OHC−
3+ H
2O + 2e − → HCO−
2+ 2OH−
o
- CO
2+ H
2O + 2e − → HCO−
2+ OH−
Si el alimento es CO
2y se desprende oxígeno en el ánodo, la reacción total es:
Biosíntesis
El ácido fórmico recibe su nombre de las hormigas que tienen altas concentraciones de este compuesto en su veneno, derivado de la serina a través de un intermediario llamado 5,10-meteniltetrahidrofolato . [33] La base conjugada del ácido fórmico, el formato, también se encuentra ampliamente presente en la naturaleza. Un ensayo para detectar ácido fórmico en fluidos corporales, diseñado para la determinación del formato después de una intoxicación por metanol, se basa en la reacción del formato con la deshidrogenasa bacteriana del formato . [34]
Usos
Agricultura
Uno de los principales usos del ácido fórmico es como conservante y agente antibacteriano en los alimentos para el ganado. Detiene ciertos procesos de descomposición y hace que el alimento conserve su valor nutritivo durante más tiempo.
En Europa, se aplica en ensilaje , incluido heno fresco, para promover la fermentación del ácido láctico y suprimir la formación de ácido butírico ; también permite que la fermentación se produzca rápidamente y a una temperatura más baja, reduciendo la pérdida de valor nutricional. [13] Se utiliza ampliamente para conservar el alimento de invierno para el ganado , [35] y a veces se agrega al alimento de las aves de corral para matar la bacteria E. coli . [36] [37] El uso como conservante para ensilaje y otros alimentos para animales constituyó el 30% del consumo mundial en 2009. [24]
Los apicultores utilizan ácido fórmico como acaricida contra el ácaro traqueal ( Acarapis woodi ) y el ácaro Varroa destructor y el ácaro Varroa jacobsoni . [38]
Energía
El ácido fórmico se puede utilizar directamente en pilas de combustible de ácido fórmico o indirectamente en pilas de combustible de hidrógeno . [39] [40]
Varios grupos han propuesto la conversión electrolítica de energía eléctrica en combustible químico como una fuente a gran escala de formato. [41] El formato podría usarse como alimento para bacterias E. coli modificadas para producir biomasa . [42] [43] Los microbios metilotrofos naturales pueden alimentarse de ácido fórmico o formato.
El ácido fórmico se ha considerado como un medio de almacenamiento de hidrógeno . [44] El coproducto de esta descomposición, el dióxido de carbono, se puede rehidrogenar de nuevo a ácido fórmico en un segundo paso. El ácido fórmico contiene 53 g/L de hidrógeno a temperatura ambiente y presión atmosférica, que es tres veces y media más de lo que el gas hidrógeno comprimido puede alcanzar a una presión de 350 bar (14,7 g/L). El ácido fórmico puro es un líquido con un punto de inflamación de 69 °C, mucho más alto que el de la gasolina (−40 °C) o el etanol (13 °C). [ cita requerida ]
Es posible utilizar ácido fórmico como intermediario para producir isobutanol a partir de CO2 utilizando microbios. [45] [46]
Soldadura
El ácido fórmico tiene una aplicación potencial en la soldadura . Debido a su capacidad para reducir las capas de óxido, se puede aplicar ácido fórmico gaseoso sobre una superficie de óxido para aumentar la humectabilidad de la soldadura . [ cita requerida ]
Cromatografía
El ácido fórmico se utiliza como modificador de pH volátil en la cromatografía líquida de alto rendimiento (HPLC) y la electroforesis capilar. El ácido fórmico se utiliza a menudo como componente de la fase móvil en el análisis de cromatografía líquida de alto rendimiento en fase inversa ( RP -HPLC) y en las técnicas de separación para la separación de macromoléculas hidrófobas, como péptidos, proteínas y estructuras más complejas, incluidos los virus intactos. Especialmente cuando se combina con la detección por espectrometría de masas , el ácido fórmico ofrece varias ventajas sobre el ácido fosfórico, que se utiliza de forma más tradicional . [47] [48]
Otros usos
El ácido fórmico también se utiliza de forma significativa en la producción de cuero, incluido el curtido (23% del consumo mundial en 2009 [24] ), y en el teñido y acabado de textiles (9% del consumo mundial en 2009 [24] ) debido a su naturaleza ácida. Su uso como coagulante en la producción de caucho [13] consumió el 6% de la producción mundial en 2009. [24]
El ácido fórmico también se utiliza en lugar de ácidos minerales para diversos productos de limpieza, [13] como desincrustantes y limpiadores de inodoros . Algunos ésteres de formato son aromatizantes y perfumes artificiales.
Se ha informado que la aplicación de ácido fórmico es un tratamiento eficaz para las verrugas . [49]
Seguridad
El ácido fórmico tiene una baja toxicidad (de ahí su uso como aditivo alimentario), con una DL50 de 1,8 g/kg (probada por vía oral en ratones). El ácido concentrado es corrosivo para la piel. [ 13]
El ácido fórmico se metaboliza y elimina fácilmente por el cuerpo. No obstante, tiene efectos tóxicos específicos ; el ácido fórmico y el formaldehído producidos como metabolitos del metanol son responsables del daño al nervio óptico , causando ceguera, que se observa en la intoxicación por metanol . [50] Se han documentado algunos efectos crónicos de la exposición al ácido fórmico. Algunos experimentos con especies bacterianas han demostrado que es un mutágeno . [51] La exposición crónica en humanos puede causar daño renal. [51] Otro posible efecto de la exposición crónica es el desarrollo de una alergia cutánea que se manifiesta tras la reexposición a la sustancia química.
El ácido fórmico concentrado se descompone lentamente en monóxido de carbono y agua, lo que genera una acumulación de presión en el recipiente que lo contiene. Por este motivo, el ácido fórmico al 98 % se envía en botellas de plástico con tapas autoventiladas. [ cita requerida ]
Los peligros de las soluciones de ácido fórmico dependen de la concentración. En la siguiente tabla se enumera el Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos para las soluciones de ácido fórmico: [ cita requerida ]
| Concentración ( porcentaje en peso ) | Pictograma | Frases con H |
|---|---|---|
| 2–10% |  | H315 |
| 10–90% |  | H313 |
| >90% |  | H314 |
El ácido fórmico en una concentración del 85 % es inflamable y el ácido fórmico diluido se encuentra en la lista de aditivos alimentarios de la Administración de Alimentos y Medicamentos de los Estados Unidos. [52] El principal peligro del ácido fórmico es el contacto de la piel o los ojos con el líquido o los vapores concentrados. El nivel de exposición permisible ( PEL ) de la OSHA de los Estados Unidos al vapor de ácido fórmico en el entorno de trabajo es de 5 partes por millón (ppm) de aire. [ cita requerida ]
Véase también
Referencias
- ^ ab Favre, Henri A.; Powell, Warren H. (2014). Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 (Libro azul) . Cambridge: The Royal Society of Chemistry . pág. 745. doi :10.1039/9781849733069. ISBN . 978-0-85404-182-4.
- ^ abcde Guía de bolsillo del NIOSH sobre peligros químicos. "#0296". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Smith, Robert M.; Martell, Arthur E. (1989). Constantes de estabilidad crítica, volumen 6: segundo suplemento . Nueva York: Plenum Press. pág. 299. ISBN 0-306-43104-1.
- ^ ab "Ácido fórmico". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional. 4 de diciembre de 2014. Consultado el 26 de marzo de 2015 .
- ^ "Ácido fórmico". Sociedad Química Estadounidense . Consultado el 21 de noviembre de 2023 .
- ^ Hoffman, Donald R (2010). "Venenos de hormigas". Current Opinion in Allergy and Clinical Immunology . 10 (4): 342–6. doi :10.1097/ACI.0b013e328339f325. PMID 20445444. S2CID 4999650.
- ^ Roubik, DW; Smith, BH; Carlson, RG (1987). "Ácido fórmico en secreciones cefálicas cáusticas de abejas sin aguijón, Oxytrigona (Hymenoptera: Apidae)". J Chem Ecol . 13 (5): 1079–86. doi :10.1007/BF01020539. PMID 24302133. S2CID 30511107.
- ^ Otles, S; Yalcin, B (2012). "Análisis de compuestos fenólicos de la raíz, el tallo y las hojas de la ortiga". ScientificWorldJournal . 2012 : 564367. doi : 10.1100/2012/564367 . PMC 3349212 . PMID 22593694.
- ^ Sanhueza, Eugenio; Andreae, Meinrat O (1991). "Emisión de ácidos fórmico y acético de suelos de sabana tropical". Geophysical Research Letters . 18 (9): 1707–10. Código Bibliográfico :1991GeoRL..18.1707S. doi :10.1029/91GL01565.
- ^ Wray, J (1670). "Extracto de una carta escrita por el señor John Wray al editor el 13 de enero de 1670. Sobre algunas observaciones y experimentos poco comunes realizados con un jugo ácido que se encuentra en las hormigas". Philosophical Transactions of the Royal Society of London . 5 (57–68): 2063–2066. Bibcode :1670RSPT....5.2063W. doi : 10.1098/rstl.1670.0052 .
- ^ Johnson, WB (1803). Historia del proceso y estado actual de la química animal.
- ^ "Base de datos de sustancias químicas ocupacionales de la OSHA – Administración de Seguridad y Salud Ocupacional". osha.gov . Archivado desde el original el 29 de abril de 2021 . Consultado el 17 de abril de 2015 .
- ^ abcdefghReutemann, Werner; Kieczka, Heinz (2000). "Ácido fórmico". Enciclopedia de química industrial de Ullmann . doi :10.1002/14356007.a12_013. ISBN 978-3-527-30673-2.
- ^ ab Roman M. Balabin (2009). "Isómero polar (acíclico) del dímero de ácido fórmico: estudio de espectroscopia Raman en fase gaseosa y parámetros termodinámicos". The Journal of Physical Chemistry A . 113 (17): 4910–8. Bibcode :2009JPCA..113.4910B. doi :10.1021/jp9002643. PMID 19344174.
- ^ Koch, H.; Haaf, W. (1964). "Ácido 1-adamantanocarboxílico". Síntesis orgánicas . 44 : 1. doi : 10.15227/orgsyn.044.0001.
- ^ Coleman, GH; Craig, David (1932). " p -Tolualdehído". Síntesis orgánicas . 12 : 80. doi :10.15227/orgsyn.012.0080.
- ^ Fellay, Céline; Dyson, Paul J.; Laurenczy, Gábor (2008). "Un sistema viable de almacenamiento de hidrógeno basado en la descomposición selectiva del ácido fórmico con un catalizador de rutenio". Angewandte Chemie International Edition . 47 (21): 3966–8. doi :10.1002/anie.200800320. PMID 18393267.
- ^ Furniss, Brian S.; Hannaford, Antony, J.; Smith, Peter WG; Tatchell, Austin S. (1989). Libro de texto de química orgánica práctica de Vogel (quinta edición). Longman Scientific & Technical. pág. 696, 701. ISBN 978-0582462366.
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Ozawa, Naoto; Okubo, Tatsuo; Matsuda, Jun; Sakai, Tatsuo (octubre de 2016). "Observación y análisis de la reducción de óxido de metal mediante ácido fórmico para soldadura". 2016 11th International Microsystems, Packaging, Assembly and Circuits Technology Conference (IMPACT) . págs. 148–151. doi :10.1109/IMPACT.2016.7799990. ISBN 978-1-5090-4769-7.S2CID32545113 .
- ^ LF Fieser ; JE Jones (1955). "N-Metilformanilida". Síntesis orgánicas; Volúmenes recopilados , vol. 3, pág. 590.
- ^ Zhou, Xiaowei; et al. (2012). "La variación de la proporción de ácido fórmico a trietilamina afecta la hidrogenación por transferencia asimétrica de cetonas". Journal of Molecular Catalysis A: Chemical . 357 : 133–140. doi :10.1016/j.molcata.2012.02.002. ISSN 1381-1169.
- ^ Haaf, Wolfgang (1966). "Die Synthese sekundärer Carbonsäuren nach der Ameisensäure-Methode". Chemische Berichte . 99 (4): 1149–52. doi :10.1002/cber.19660990410.
- ^ Wu, G; Shlykov, S; Van Alseny, F. S; Geise, H. J; Sluyts, E; Van Der Veken, B. J (1995). "Anhídrido fórmico en fase gaseosa, estudiado por difracción de electrones y espectroscopia de microondas e infrarrojos, complementado con cálculos ab-initio de geometrías y campos de fuerza". The Journal of Physical Chemistry . 99 (21): 8589–98. doi :10.1021/j100021a022.
- ^ abcdef SN Bizzari; M. Blagoev (junio de 2010). "Informe de investigación de marketing de la CEH: ÁCIDO FÓRMICO". Manual de economía química . Consultoría de ISR. Archivado desde el original el 14 de septiembre de 2011.
- ^ PG Jessop (2007). JG de Vries, CJ Elsevier (ed.). Manual de hidrogenación homogénea . Weinheim, Alemania: Wiley-VCH. págs. 489–511.
- ^ Jessop, Philip G; Joó, Ferenc; Tai, Chih-Cheng (2004). "Avances recientes en la hidrogenación homogénea de dióxido de carbono". Coordination Chemistry Reviews . 248 (21–24): 2425. doi :10.1016/j.ccr.2004.05.019.
- ^ Sampson, Joanna (2 de agosto de 2020). «Un dispositivo inalámbrico produce combustible limpio a partir de luz solar, CO2 y agua». Gasworld . Consultado el 26 de agosto de 2020 .
- ^ Wölfel, Rene; Taccardi, Nicola; Bösmann, Andreas; Wasserscheid, Peter (2011). "Conversión catalítica selectiva de carbohidratos de origen biológico en ácido fórmico utilizando oxígeno molecular". Química verde . 13 (10): 2759. doi :10.1039/C1GC15434F. S2CID 97572039.
- ^ Albert, Jakob; Wölfel, Rene; Bösmann, Andreas; Wasserscheid, Peter (2012). "Oxidación selectiva de biomasa compleja insoluble en agua a ácido fórmico utilizando aditivos como aceleradores de reacción". Energy & Environmental Science . 5 (7): 7956. doi :10.1039/C2EE21428H. S2CID 93224286.
- ^ Chattaway, Frederick Daniel (1914). «XX. Interacción del glicerol y el ácido oxálico». Journal of the Chemical Society, Transactions . 105 : 151–6. doi :10.1039/CT9140500151. hdl :2027/mdp.39015067135775.
- ^ Arthur Sutcliffe (1930). Química práctica para estudiantes avanzados (edición de 1949). Londres: John Murray.
- ^ B. Innocent; et al. (febrero de 2009). "Electro-reducción de dióxido de carbono a formato sobre electrodo de plomo en medio acuoso". Journal of Applied Electrochemistry . 39 (2): 227–232. doi :10.1007/s10800-008-9658-4. S2CID 98437382.
- ^ Hefetz, Abraham; Blum, Murray (1 de noviembre de 1978). "Biosíntesis de ácido fórmico por las glándulas venenosas de las hormigas formicinas". Biochimica et Biophysica Acta (BBA) - Temas generales . 543 (4): 484–496. doi :10.1016/0304-4165(78)90303-3. PMID 718985.
- ^ Makar, AB; McMartin, KE; Palese, M; Tephly, TR (1975). "Ensayo de formato en fluidos corporales: aplicación en intoxicación por metanol". Medicina bioquímica . 13 (2): 117–26. doi :10.1016/0006-2944(75)90147-7. PMID 1.
- ^ Ácidos orgánicos y conservación de alimentos, Maria M. Theron, JF Rykers Lues
- ^ Griggs, J. P; Jacob, J. P (2005). "Alternativas a los antibióticos para la producción avícola orgánica". The Journal of Applied Poultry Research . 14 (4): 750. doi : 10.1093/japr/14.4.750 .
- ^ Garcia, V; Catala-Gregori, P; Hernandez, F; Megias, M. D; Madrid, J (2007). "Efecto del ácido fórmico y extractos de plantas en el crecimiento, digestibilidad de nutrientes, morfología de la mucosa intestinal y rendimiento de carne de pollos de engorde". The Journal of Applied Poultry Research . 16 (4): 555. doi : 10.3382/japr.2006-00116 .
- ^ Hoppe, H.; Ritter, W.; Stephen, EWC (1989). "El control de los ácaros parásitos de las abejas: Varroa jacobsoni, Acarapis woodi y Tropilaelaps clareae con ácido fórmico". American Bee Journal .
- ^ Ha, S; Larsen, R; Masel, RI (2005). "Caracterización del rendimiento del nanocatalizador Pd/C para pilas de combustible de ácido fórmico directo". Journal of Power Sources . 144 (1): 28–34. Bibcode :2005JPS...144...28H. doi :10.1016/j.jpowsour.2004.12.031.
- ^ Jorn Madslien (27 de junio de 2017). "El poder de las hormigas: súbete a un autobús que funciona con ácido fórmico". BBC News . Consultado el 11 de julio de 2017 .
- ^ Yishai, Oren; Lindner, Steffen N; Gonzalez de la Cruz, Jorge; Tenenboim, Hezi; Bar-Even, Arren (diciembre de 2016). "La bioeconomía del formato". Current Opinion in Chemical Biology . 35 : 1–9. doi :10.1016/j.cbpa.2016.07.005. PMID 27459678.
- ^ Shmuel Gleizer; et al. (noviembre de 2019). "Conversión de Escherichia coli para generar todo el carbono de la biomasa a partir de CO2". Cell . 179 (6): 1255–1263.e12. doi : 10.1016/j.cell.2019.11.009 . PMC 6904909 . PMID 31778652.
- ^ Kim, Seohyoung; Lindner, Steffen N.; Aslan, Selçuk; Yishai, Oren; Wenk, Sebastian; Schann, Karin; Bar-Even, Arren (10 de febrero de 2020). "Crecimiento de E. coli en formato y metanol a través de la vía reductora de la glicina". Nature Chemical Biology . 16 (5): 538–545. doi :10.1038/s41589-020-0473-5. ISSN 1552-4469. PMID 32042198. S2CID 211074951.
- ^ Joó, Ferenc (2008). "Avances en el almacenamiento de hidrógeno: ácido fórmico como material de almacenamiento sostenible para hidrógeno". ChemSusChem . 1 (10): 805–8. doi :10.1002/cssc.200800133. PMID 18781551.
- ^ "Investigadores de la UCLA utilizan electricidad y CO2 para producir butanol". 30 de marzo de 2012.
- ^ Liao, James C.; Cho, Kwang Myung; Huo, Yi-Xin; Malati, Peter; Higashide, Wendy; Wu, Tung-Yun; Rogers, Steve; Wernick, David G.; Opgenorth, Paul H.; Li, Han (30 de marzo de 2012). "Conversión electromicrobiana integrada de CO2 en alcoholes superiores". Science . 335 (6076): 1596. Bibcode :2012Sci...335.1596L. doi :10.1126/science.1217643. PMID 22461604. S2CID 24328552.
- ^ "Copia archivada". Archivado desde el original el 7 de noviembre de 2017 . Consultado el 7 de noviembre de 2017 .
{{cite web}}: CS1 maint: copia archivada como título ( enlace )[ Se necesita cita completa ] - ^ Heukeshoven, Jochen; Dernick, Rudolf (1982). "Cromatografía líquida de alto rendimiento en fase inversa de proteínas virales y otras proteínas hidrofóbicas grandes en disolventes que contienen ácido fórmico". Journal of Chromatography A . 252 : 241–54. doi :10.1016/S0021-9673(01)88415-6. PMID 6304128.
- ^ Bhat, Ramesh M; Vidya, Krishna; Kamath, Ganesh (2001). "Técnica de punción tópica con ácido fórmico para el tratamiento de verrugas comunes". Revista Internacional de Dermatología . 40 (6): 415–9. doi :10.1046/j.1365-4362.2001.01242.x. PMID 11589750. S2CID 42351889.
- ^ Sadun, A. A (2002). "Neuropatías ópticas mitocondriales". Revista de neurología, neurocirugía y psiquiatría . 72 (4): 423–5. doi :10.1136/jnnp.72.4.423. PMC 1737836 . PMID 11909893.
- ^ ab "Directriz de seguridad y salud ocupacional para el ácido fórmico". OSHA. Archivado desde el original el 20 de septiembre de 2011. Consultado el 28 de mayo de 2011 .
- ^ Título 21 del Código de Reglamentos Federales 186.1316 , Título 21 del Código de Reglamentos Federales 172.515
Enlaces externos
- Tarjeta internacional de seguridad química 0485.
- Guía de bolsillo del NIOSH sobre peligros químicos.
- ChemSub Online (Ácido fórmico).







