Trihalometano
En química , los trihalometanos ( THM ) son compuestos químicos en los que tres de los cuatro átomos de hidrógeno del metano ( CH4 ) son reemplazados por átomos de halógeno . Los trihalometanos con todos los mismos átomos de halógeno se denominan haloformos . Muchos trihalometanos se utilizan en la industria como disolventes o refrigerantes . Algunos THM también son contaminantes ambientales y algunos se consideran cancerígenos .
Tabla de trihalometanos comunes
| Molecular fórmula | Nombre IUPAC | Número de registro CAS | Nombre común | Otros nombres | Molécula |
|---|---|---|---|---|---|
| 3 francos suizos | trifluorometano | 75-46-7 | fluoroform | Freón 23, R-23, HFC-23 |  |
| CHClF2 | clorodifluorometano | 75-45-6 | clorodifluorometano | R-22, HCFC-22 |  |
| CHCl3 | triclorometano | 67-66-3 | cloroformo | R-20, tricloruro de metilo |  |
| C1H2BrCl2 | bromodiclorometano | 75-27-4 | bromodiclorometano | diclorobromometano, BDCM | 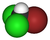 |
| CHBr2Cl | dibromoclorometano | 124-48-1 | dibromoclorometano | clorodibromometano, CDBM | 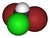 |
| Cbr3 | tribromometano | 75-25-2 | bromoform | tribromuro de metilo |  |
| CHI 3 | triyodometano | 75-47-8 | yodoformo | triyoduro de metilo | 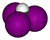 |
Usos industriales
El cloroformo es el único que tiene aplicaciones significativas de los haloformos. La aplicación predominante es el cloroformo, que se requiere para la producción de tetrafluoroetileno (TFE), precursor del teflón . [1] El cloroformo se fluora mediante la reacción con fluoruro de hidrógeno para producir clorodifluorometano (R-22). La pirólisis del clorodifluorometano (a 550-750 °C) produce TFE, con difluorocarbeno como intermediario.
Refrigerantes y disolventes
Los trihalometanos liberados al medio ambiente se descomponen más rápidamente que los clorofluorocarbonos (CFC), por lo que causan mucho menos daño a la capa de ozono . El trifluorometano y el clorodifluorometano se utilizan como refrigerantes . El clorodifluorometano es un refrigerante HCFC o hidroclorofluorocarbono , mientras que el fluoroformo es un HFC o hidrofluorocarbono . El fluoroformo no daña la capa de ozono.
El cloroformo es un disolvente común en la química orgánica.
Ocurrencia y producción
El flujo global total de cloroformo a través del medio ambiente es de aproximadamente660 000 toneladas por año [2] y aproximadamente el 90% de las emisiones son de origen natural. Muchos tipos de algas producen cloroformo y se cree que los hongos también lo producen en el suelo. [3]
La mayoría de los haloformos ( específicamente, cloroformo ( CHCl 3 ), bromoformo ( CHBr 3 ) y yodoformo ( CHI 3 ) ) son fáciles de preparar a través de la reacción del haloformo , aunque este método no se presta a síntesis en masa. ( El fluoroformo ( CHF 3 ) no se puede preparar de esta manera).
El cloroformo se produce calentando mezclas de metano o cloruro de metilo con cloro . El diclorometano es un subproducto. [4]
El bromoclorofluorometano es uno de los compuestos quirales estables más simples posibles y se utiliza para estudios.
Regulación
Los trihalometanos fueron objeto de las primeras regulaciones sobre agua potable emitidas después de la aprobación de la Ley de Agua Potable Segura de Estados Unidos en 1974. [5]
La EPA limita la concentración total de los cuatro componentes principales ( cloroformo , bromoformo , bromodiclorometano y dibromoclorometano ), denominados trihalometanos totales (TTHM), a 80 partes por mil millones en el agua tratada. [6]
En las piscinas se producen trazas de cloroformo . [7] [8] [9] [10]
Referencias
- ^ Dae Jin Sung; Dong Ju Moon; Yong Jun Lee; Suk-In Hong (2004). "Pirólisis catalítica de difluoroclorometano para producir tetrafluoroetileno". Revista internacional de ingeniería de reactores químicos . 2 : A6. doi :10.2202/1542-6580.1065. S2CID 97895482.
- ^ Gribble, Gordon W. (2004). "Organohalogenados naturales: ¿una nueva frontera para los agentes medicinales?". Journal of Chemical Education . 81 (10): 1441. Bibcode :2004JChEd..81.1441G. doi :10.1021/ed081p1441.
- ^ Cappelletti, M. (2012). "Degradación microbiana del cloroformo". Applied Microbiology and Biotechnology . 96 (6): 1395–409. doi :10.1007/s00253-012-4494-1. PMID 23093177. S2CID 12429523.
- ^ Rossberg, Manfred; Lendle, Wilhelm; Pfleiderer, Gerhard; Tögel, Adolf; Dreher, Eberhard-Ludwig; Langer, Ernst; Rassaerts, Heinz; Kleinschmidt, Peter; Strack, Heinz; Cocinero, Richard; Beck, Uwe; Lipper, Karl-August; Torkelson, Theodore R.; Löser, Eckhard; Beutel, Klaus K.; Mann, Trevor (2006). "Hidrocarburos clorados". Enciclopedia de química industrial de Ullmann . doi :10.1002/14356007.a06_233.pub2. ISBN 3527306730.
- ^ Asociación de Antiguos Alumnos de la EPA: Altos funcionarios de la EPA debaten la implementación temprana de la Ley de Agua Potable Segura de 1974, video, transcripción (ver páginas 12-13).
- ^ "EPA | Envirofacts | ICR | Regulations" (en inglés). archive.epa.gov . Consultado el 11 de octubre de 2021 .
- ^ Lindstrom, AB; Pleil, JD; Berkoff, DC (1997). "Muestreo y análisis del aliento alveolar para evaluar la exposición a trihalometanos durante el entrenamiento de natación competitiva". Environmental Health Perspectives . 105 (6): 636–642. doi :10.1289/ehp.97105636. ISSN 0091-6765. PMC 1470079 . PMID 9288498.
- ^ Drobnic, Franchek; Freixa, Assumpci??; Casan, Pere; Sanchis, Joaqu??N; Guardino, Xavier (1996). "Evaluación de la exposición al cloro en nadadores durante el entrenamiento". Medicina y ciencia en deportes y ejercicio . 28 (2): 271–274. doi : 10.1097/00005768-199602000-00018 . ISSN 0195-9131. PMID 8775165.
- ^ Aiking, Harry; van Ackert, Manila B.; Schölten, Rob JPM; Feenstra, Jan F.; Valkenburg, Hans A. (1994). "Cloración de piscinas: ¿un riesgo para la salud?". Toxicology Letters . 72 (1–3): 375–380. doi :10.1016/0378-4274(94)90051-5. ISSN 0378-4274. PMID 7911264.
- ^ Nickmilder, M.; Bernard, A. (2011). "Asociaciones entre las hormonas testiculares en la adolescencia y la asistencia a piscinas cloradas durante la infancia". Revista Internacional de Andrología . 34 (5pt2): e446–e458. doi :10.1111/j.1365-2605.2011.01174.x. ISSN 0105-6263. PMC 3229674 . PMID 21631527.
Enlaces externos
- Inventario Nacional de Contaminantes - Cloroformo y triclorometano
- Cómo la tecnología del ozono reduce los subproductos de la desinfección
- EPA - Trihalometanos en el agua potable: muestreo, análisis, control y cumplimiento (agosto de 1983)

