Fosfato de dihidrógeno
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Fosfato de dihidrogeno | |
| Nombre sistemático de la IUPAC Ácido fosfórico, ion(1-) | |
| Otros nombres Ácido fosfórico, ion(1-) Ácido deshidrofosfórico (1-) | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh |
|
| Araña química |
|
| Banco de medicamentos |
|
| 1999 | |
Identificador de centro de PubChem |
|
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| H2O4P − 1 | |
| Masa molar | 96,986 g·mol −1 |
| Ácido conjugado | Ácido fosfórico |
| Compuestos relacionados | |
Compuestos relacionados | Fosfato , Fosfato monohidrógeno |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
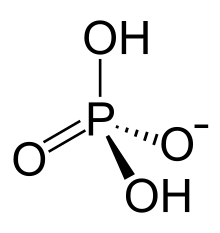
El fosfato de dihidrógeno es un ion inorgánico con la fórmula [H 2 PO 4 ] − . Los fosfatos se encuentran ampliamente presentes en los sistemas naturales . [1]
Estos fosfatos de sodio se utilizan artificialmente en el procesamiento y envasado de alimentos como agentes emulsionantes, agentes neutralizantes, agentes activadores de superficie y agentes leudantes, lo que aporta beneficios a los seres humanos. Los agentes emulsionantes evitan la separación de dos ingredientes en los alimentos procesados que se separarían en condiciones naturales, mientras que los agentes neutralizantes hacen que los alimentos procesados tengan un sabor más fresco durante más tiempo y conducen a una mayor vida útil de estos alimentos. [1] Los agentes activadores de superficie evitan la formación de tensión superficial en los alimentos procesados que contienen líquido y, por último, los agentes leudantes se utilizan en los alimentos procesados para ayudar a la expansión de la levadura en los productos horneados. [1]
El fosfato de dihidrógeno se emplea en la producción de productos farmacéuticos, lo que aumenta su importancia para los médicos gastroenterólogos y los seres humanos en general. En esta disciplina médica, los fosfatos de sodio se utilizan como laxantes naturales. [1] Otras aplicaciones médicas incluyen el uso de fosfatos de sodio y potasio junto con otros medicamentos para aumentar sus efectos terapéuticos. La inflamación, ciertos tipos de cáncer y las úlceras pueden beneficiarse del uso de una terapia combinada con fosfatos de sodio y potasio. [1]
El fosfato de potasio dihidrogenado, la sal de potasio, es útil para los seres humanos en forma de pesticidas. El fosfato de potasio dihidrogenado es un fungicida que se utiliza para prevenir el mildiú polvoroso en muchas frutas. [2] Las frutas que pueden beneficiarse de la adición de fosfato de potasio dihidrogenado incluyen frutas comunes, pimientos y rosas. [2]
Estructura
El anión dihidrogenofosfato consiste en un átomo central de fósforo rodeado por 2 átomos de oxígeno equivalentes y 2 grupos hidroxi en una disposición tetraédrica . [3] El dihidrogenofosfato puede identificarse como un anión, un ion con una carga negativa general, siendo los dihidrogenofosfatos una carga negativa 1. [3] El dihidrogenofosfato contiene 4 aceptores de enlaces H y 2 donadores de enlaces H, [3] y tiene 0 enlaces rotativos. [4]
Equilibrios ácido-base
El fosfato de dihidrógeno es un intermediario en la conversión de múltiples pasos del ácido fosfórico poliprótico en fosfato : [5]
Esta conversión de varios pasos ejemplifica que el ion fosfato de dihidrógeno es la base conjugada del ácido fosfórico, mientras que también actúa como ácido conjugado del ion fosfato. [3] Esto significa que el fosfato de dihidrógeno puede ser tanto un donante como un aceptor de hidrógeno.
| Equilibrio | Constante de disociación, p K a [6] |
|---|---|
| H3PO4⇌H 2correos− 4+H + | pK a1 = 2,14 [ a] |
| yo 2correos− 4⇌ HPO2− 4+H + | pKa2 = 7,20 |
| OHP2− 4⇌ PO3− 4+H + | pKa3 = 12,37 |
Ejemplos
- Fosfato dihidrógeno de amonio ((NH 4 )(H 2 PO 4 ))
- Fosfato monocálcico (Ca(H 2 PO 4 ) 2 )
Seguridad
Muchos alimentos, incluidos la leche, los huevos, las aves y los frutos secos, contienen estos fosfatos de sodio. [1]
Notas
- ^ Los valores corresponden a 25 °C y fuerza iónica 0.
Referencias
- ^ abcdef Tech, Noah. "Fosfatos de sodio: de los alimentos a la farmacología | Noah Technologies" . Consultado el 23 de marzo de 2021 .
- ^ ab "Visualización de documentos | NEPIS | US EPA". nepis.epa.gov . Consultado el 23 de marzo de 2021 .
- ^ abcd PubChem. «Dihidrógeno fosfato». pubchem.ncbi.nlm.nih.gov . Consultado el 23 de marzo de 2021 .
- ^ "fosfato de dihidrógeno | H2O4P | ChemSpider". chemspider.com . Consultado el 23 de marzo de 2021 .
- ^ "Ácido fosfórico H3PO4". aqion.de . Consultado el 23 de marzo de 2021 .
- ^ Powell, Kipton J.; Brown, Paul L.; Byrne, Robert H.; Gajda, Tamás; Hefter, Glenn; Sjöberg, Staffan; Wanner, Hans (2005). "Especiación química de metales pesados ambientalmente significativos con ligandos inorgánicos. Parte 1: Los sistemas acuosos Hg2+, Cl−, OH−, CO2−3, SO2−4 y PO3−4". Pure Appl. Chem . 77 (4): 739–800. doi : 10.1351/pac200577040739 .
