Bicapa lipídica


La bicapa lipídica (o bicapa fosfolipídica ) es una membrana polar delgada formada por dos capas de moléculas lipídicas . Estas membranas son láminas planas que forman una barrera continua alrededor de todas las células . Las membranas celulares de casi todos los organismos y muchos virus están hechas de una bicapa lipídica, al igual que la membrana nuclear que rodea el núcleo celular y las membranas de los orgánulos unidos a la membrana en la célula. La bicapa lipídica es la barrera que mantiene a los iones , proteínas y otras moléculas donde se necesitan y evita que se difundan a áreas donde no deberían estar. Las bicapas lipídicas son ideales para esta función, a pesar de que solo tienen unos pocos nanómetros de ancho, [1] porque son impermeables a la mayoría de las moléculas solubles en agua ( hidrófilas ). Las bicapas son particularmente impermeables a los iones, lo que permite a las células regular las concentraciones de sal y el pH transportando iones a través de sus membranas utilizando proteínas llamadas bombas de iones .
Las bicapas biológicas suelen estar compuestas de fosfolípidos anfifílicos que tienen una cabeza de fosfato hidrófila y una cola hidrófoba que consta de dos cadenas de ácidos grasos. Los fosfolípidos con ciertos grupos de cabeza pueden alterar la química de la superficie de una bicapa y pueden, por ejemplo, servir como señales y como "anclajes" para otras moléculas en las membranas de las células. [2] Al igual que las cabezas, las colas de los lípidos también pueden afectar las propiedades de la membrana, por ejemplo, determinando la fase de la bicapa. La bicapa puede adoptar un estado de fase de gel sólido a temperaturas más bajas, pero experimentar una transición de fase a un estado fluido a temperaturas más altas, y las propiedades químicas de las colas de los lípidos influyen en la temperatura a la que esto sucede. El empaquetamiento de los lípidos dentro de la bicapa también afecta a sus propiedades mecánicas, incluida su resistencia al estiramiento y la flexión. Muchas de estas propiedades se han estudiado con el uso de bicapas "modelo" artificiales producidas en un laboratorio. Las vesículas creadas por bicapas modelo también se han utilizado clínicamente para administrar medicamentos.
La estructura de las membranas biológicas incluye típicamente varios tipos de moléculas además de los fosfolípidos que componen la bicapa. Un ejemplo particularmente importante en las células animales es el colesterol , que ayuda a fortalecer la bicapa y disminuir su permeabilidad. El colesterol también ayuda a regular la actividad de ciertas proteínas integrales de membrana . Las proteínas integrales de membrana funcionan cuando se incorporan a una bicapa lipídica, y se mantienen firmemente a la bicapa lipídica con la ayuda de una cubierta lipídica anular . Debido a que las bicapas definen los límites de la célula y sus compartimentos, estas proteínas de membrana están involucradas en muchos procesos de señalización intra e intercelular. Ciertos tipos de proteínas de membrana están involucrados en el proceso de fusión de dos bicapas. Esta fusión permite la unión de dos estructuras distintas como en la reacción del acrosoma durante la fertilización de un óvulo por un espermatozoide , o la entrada de un virus en una célula. Debido a que las bicapas lipídicas son frágiles e invisibles en un microscopio tradicional, son un desafío para estudiar. Los experimentos en bicapas a menudo requieren técnicas avanzadas como la microscopía electrónica y la microscopía de fuerza atómica .
Estructura y organización
Cuando los fosfolípidos se exponen al agua, se autoensamblan en una lámina de dos capas con las colas hidrófobas apuntando hacia el centro de la lámina. Esta disposición da como resultado dos "folíolos" que son cada uno una sola capa molecular. El centro de esta bicapa casi no contiene agua y excluye moléculas como azúcares o sales que se disuelven en agua. El proceso de ensamblaje y mantenimiento son impulsados por la agregación de moléculas hidrófobas (también llamado efecto hidrófobo ). Este proceso complejo incluye interacciones no covalentes como fuerzas de van der Waals , enlaces electrostáticos y de hidrógeno .
Análisis de sección transversal

La bicapa lipídica es muy delgada en comparación con sus dimensiones laterales. Si una célula de mamífero típica (diámetro de ~10 micrómetros) se ampliara al tamaño de una sandía (~1 pie/30 cm), la bicapa lipídica que compone la membrana plasmática sería aproximadamente tan gruesa como una hoja de papel de oficina. A pesar de tener solo unos pocos nanómetros de espesor, la bicapa está compuesta por varias regiones químicas distintas a lo largo de su sección transversal. Estas regiones y sus interacciones con el agua circundante se han caracterizado durante las últimas décadas con reflectometría de rayos X , [4] dispersión de neutrones , [5] y técnicas de resonancia magnética nuclear .
La primera región a cada lado de la bicapa es el grupo de cabeza hidrofílico. Esta porción de la membrana está completamente hidratada y tiene un espesor típico de entre 0,8 y 0,9 nm. En las bicapas de fosfolípidos, el grupo fosfato se encuentra dentro de esta región hidratada, aproximadamente a 0,5 nm fuera del núcleo hidrofóbico. [6] En algunos casos, la región hidratada puede extenderse mucho más, por ejemplo, en lípidos con una proteína grande o una cadena larga de azúcar injertada en la cabeza. Un ejemplo común de tal modificación en la naturaleza es la capa de lipopolisacárido en una membrana externa bacteriana, [7] que ayuda a retener una capa de agua alrededor de la bacteria para evitar la deshidratación.

Junto a la región hidratada hay una región intermedia que está solo parcialmente hidratada. Esta capa límite tiene un espesor de aproximadamente 0,3 nm. Dentro de esta corta distancia, la concentración de agua cae de 2 M en el lado del grupo de cabeza a casi cero en el lado de la cola (núcleo). [8] [9] El núcleo hidrofóbico de la bicapa tiene típicamente un espesor de 3-4 nm, pero este valor varía con la longitud de la cadena y la química. [4] [10] El espesor del núcleo también varía significativamente con la temperatura, en particular cerca de una transición de fase. [11]
Asimetría
En muchas bicapas naturales, las composiciones de las láminas de membrana interna y externa son diferentes. En los glóbulos rojos humanos , la lámina interna (citoplasmática) está compuesta principalmente de fosfatidiletanolamina , fosfatidilserina y fosfatidilinositol y sus derivados fosforilados. Por el contrario, la lámina externa (extracelular) se basa en fosfatidilcolina , esfingomielina y una variedad de glicolípidos. [12] [13] [14] En algunos casos, esta asimetría se basa en dónde se fabrican los lípidos en la célula y refleja su orientación inicial. [15] Las funciones biológicas de la asimetría de lípidos se entienden imperfectamente, aunque está claro que se utiliza en varias situaciones diferentes. Por ejemplo, cuando una célula sufre apoptosis , la fosfatidilserina (normalmente localizada en el foliolo citoplasmático) se transfiere a la superficie exterior: allí es reconocida por un macrófago que luego recolecta activamente la célula moribunda.
La asimetría lipídica surge, al menos en parte, del hecho de que la mayoría de los fosfolípidos se sintetizan e insertan inicialmente en la monocapa interna: los que constituyen la monocapa externa son luego transportados desde la monocapa interna por una clase de enzimas llamadas flipasas . [16] [17] Otros lípidos, como la esfingomielina, parecen sintetizarse en la capa externa. Las flipasas son miembros de una familia más grande de moléculas de transporte de lípidos que también incluye flopasas, que transfieren lípidos en la dirección opuesta, y scramblasas, que aleatorizan la distribución de lípidos a través de las bicapas lipídicas (como en las células apoptóticas). En cualquier caso, una vez que se establece la asimetría lipídica, normalmente no se disipa rápidamente porque el cambio espontáneo de lípidos entre las capas es extremadamente lento. [18]
Es posible imitar esta asimetría en el laboratorio en sistemas de bicapa modelo. Ciertos tipos de vesículas artificiales muy pequeñas se volverán automáticamente ligeramente asimétricas, aunque el mecanismo por el cual se genera esta asimetría es muy diferente al de las células. [19] Al utilizar dos monocapas diferentes en la deposición de Langmuir-Blodgett [20] o una combinación de deposición de Langmuir-Blodgett y ruptura de vesículas [21] también es posible sintetizar una bicapa plana asimétrica. Esta asimetría puede perderse con el tiempo ya que los lípidos en las bicapas soportadas pueden ser propensos a cambiar de posición. [22] Sin embargo, se ha informado que el cambio de posición de los lípidos es lento en comparación con el colesterol y otras moléculas más pequeñas. [23] [24]
Se ha informado que la organización y la dinámica de las monocapas lipídicas en una bicapa están acopladas. [25] [26] Por ejemplo, la introducción de obstrucciones en una monocapa puede ralentizar la difusión lateral en ambas monocapas. [25] Además, la separación de fases en una monocapa también puede inducir la separación de fases en otra monocapa incluso cuando otra monocapa no puede separarse por sí misma. [26]
Fases y transiciones de fase
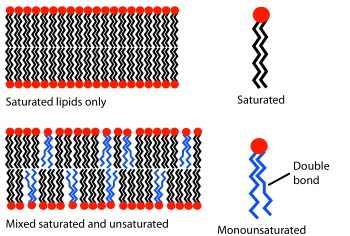
A una temperatura dada, una bicapa lipídica puede existir en fase líquida o en fase de gel (sólida). Todos los lípidos tienen una temperatura característica a la que pasan (se funden) de la fase de gel a la fase líquida. En ambas fases, las moléculas de lípidos no pueden cambiar de posición a través de la bicapa, pero en las bicapas en fase líquida un lípido determinado intercambiará posiciones con su vecino millones de veces por segundo. Este intercambio aleatorio permite que el lípido se difunda y, por lo tanto, deambule por la superficie de la membrana. [27] A diferencia de las bicapas en fase líquida, los lípidos en una bicapa en fase de gel tienen menos movilidad.
El comportamiento de fase de las bicapas lipídicas está determinado en gran medida por la fuerza de las interacciones atractivas de Van der Waals entre moléculas lipídicas adyacentes. Los lípidos de cola más larga tienen más área sobre la cual interactuar, aumentando la fuerza de esta interacción y, como consecuencia, disminuyendo la movilidad lipídica. Por lo tanto, a una temperatura dada, un lípido de cola corta será más fluido que un lípido de cola larga idéntico. [10] La temperatura de transición también puede verse afectada por el grado de insaturación de las colas lipídicas. Un doble enlace insaturado puede producir una torcedura en la cadena de alcanos , interrumpiendo el empaquetamiento lipídico. Esta interrupción crea espacio libre adicional dentro de la bicapa que permite una flexibilidad adicional en las cadenas adyacentes. [10] Un ejemplo de este efecto se puede observar en la vida cotidiana, ya que la mantequilla, que tiene un gran porcentaje de grasas saturadas, es sólida a temperatura ambiente, mientras que el aceite vegetal, que es mayoritariamente insaturado, es líquido.
La mayoría de las membranas naturales son una mezcla compleja de diferentes moléculas lipídicas. Si algunos de los componentes son líquidos a una temperatura dada mientras que otros están en la fase de gel, las dos fases pueden coexistir en regiones separadas espacialmente, como un iceberg flotando en el océano. Esta separación de fases desempeña un papel fundamental en los fenómenos bioquímicos porque los componentes de la membrana, como las proteínas, pueden dividirse en una u otra fase [28] y, por lo tanto, concentrarse o activarse localmente. Un componente particularmente importante de muchos sistemas de fase mixta es el colesterol , que modula la permeabilidad de la bicapa, la resistencia mecánica y las interacciones bioquímicas.
Química de superficies
Si bien las colas lipídicas modulan principalmente el comportamiento de la fase de bicapa, es el grupo de cabeza el que determina la química de la superficie de la bicapa. La mayoría de las bicapas naturales están compuestas principalmente de fosfolípidos , pero los esfingolípidos y los esteroles como el colesterol también son componentes importantes. [29] De los fosfolípidos, el grupo de cabeza más común es la fosfatidilcolina (PC), que representa aproximadamente la mitad de los fosfolípidos en la mayoría de las células de mamíferos. [30] La PC es un grupo de cabeza zwitteriónico , ya que tiene una carga negativa en el grupo fosfato y una carga positiva en la amina pero, debido a que estas cargas locales se equilibran, no hay carga neta.
Otros grupos de cabeza también están presentes en diversos grados y pueden incluir fosfatidilserina (PS) , fosfatidiletanolamina (PE) y fosfatidilglicerol (PG). Estos grupos de cabeza alternativos a menudo confieren una funcionalidad biológica específica que depende en gran medida del contexto. Por ejemplo, la presencia de PS en la cara de la membrana extracelular de los eritrocitos es un marcador de apoptosis celular , [31] mientras que la PS en las vesículas de la placa de crecimiento es necesaria para la nucleación de cristales de hidroxiapatita y la posterior mineralización ósea. [32] [33] A diferencia de PC, algunos de los otros grupos de cabeza llevan una carga neta, que puede alterar las interacciones electrostáticas de pequeñas moléculas con la bicapa. [34]
Roles biológicos
Contención y separación
La función principal de la bicapa lipídica en biología es separar los compartimentos acuosos de su entorno. Sin algún tipo de barrera que delimite lo “propio” de lo “ajeno”, es difícil incluso definir el concepto de un organismo o de vida. Esta barrera toma la forma de una bicapa lipídica en todas las formas de vida conocidas, excepto en unas pocas especies de arqueas que utilizan una monocapa lipídica especialmente adaptada. [7] Incluso se ha propuesto que la primera forma de vida puede haber sido una simple vesícula lipídica con prácticamente su única capacidad biosintética siendo la producción de más fosfolípidos . [35] La capacidad de partición de la bicapa lipídica se basa en el hecho de que las moléculas hidrófilas no pueden cruzar fácilmente el núcleo de la bicapa hidrófoba , como se analiza en Transporte a través de la bicapa a continuación. El núcleo, las mitocondrias y los cloroplastos tienen dos bicapas lipídicas, mientras que otras estructuras subcelulares están rodeadas por una sola bicapa lipídica (como la membrana plasmática, el retículo endoplasmático, el aparato de Golgi y los lisosomas). Véase Organelo . [36]
Los procariotas tienen una sola bicapa lipídica: la membrana celular (también conocida como membrana plasmática). Muchos procariotas también tienen una pared celular , pero la pared celular está compuesta de proteínas o carbohidratos de cadena larga , no lípidos. Por el contrario, los eucariotas tienen una variedad de orgánulos que incluyen el núcleo , las mitocondrias , los lisosomas y el retículo endoplasmático . Todos estos compartimentos subcelulares están rodeados por una o más bicapas lipídicas y, juntos, generalmente comprenden la mayoría del área de bicapa presente en la célula. En los hepatocitos del hígado , por ejemplo, la membrana plasmática representa solo el dos por ciento del área total de la bicapa de la célula, mientras que el retículo endoplasmático contiene más del cincuenta por ciento y las mitocondrias un treinta por ciento adicional. [37]

Señalización
La forma más conocida de señalización celular es probablemente la transmisión sináptica , mediante la cual un impulso nervioso que ha llegado al final de una neurona se transmite a una neurona adyacente mediante la liberación de neurotransmisores . Esta transmisión es posible gracias a la acción de vesículas sinápticas que, dentro de la célula, están cargadas con los neurotransmisores que se liberarán más tarde. Estas vesículas cargadas se fusionan con la membrana celular en la terminal presináptica y su contenido se libera al espacio exterior de la célula. Luego, el contenido se difunde a través de la sinapsis hasta la terminal postsináptica.
Las bicapas lipídicas también participan en la transducción de señales a través de su papel como hogar de las proteínas integrales de membrana . Se trata de una clase de biomolécula extremadamente amplia e importante. Se estima que hasta un tercio del proteoma humano son proteínas de membrana. [38] Algunas de estas proteínas están ligadas al exterior de la membrana celular. Un ejemplo de esto es la proteína CD59 , que identifica a las células como "propias" y, por lo tanto, inhibe su destrucción por el sistema inmunológico. El virus del VIH evade el sistema inmunológico en parte injertando estas proteínas de la membrana del huésped en su propia superficie. [37] Alternativamente, algunas proteínas de membrana penetran completamente a través de la bicapa y sirven para transmitir eventos de señal individuales desde el exterior al interior de la célula. La clase más común de este tipo de proteína es el receptor acoplado a proteína G (GPCR). Los GPCR son responsables de gran parte de la capacidad de la célula para percibir su entorno y, debido a esta importante función, aproximadamente el 40% de todos los medicamentos modernos están dirigidos a los GPCR. [39]
Además de los procesos mediados por proteínas y soluciones, también es posible que las bicapas lipídicas participen directamente en la señalización. Un ejemplo clásico de esto es la fagocitosis desencadenada por la fosfatidilserina . Normalmente, la fosfatidilserina se distribuye asimétricamente en la membrana celular y está presente solo en el lado interior. Durante la muerte celular programada, una proteína llamada scramblasa equilibra esta distribución, mostrando la fosfatidilserina en la cara de la bicapa extracelular. La presencia de fosfatidilserina desencadena entonces la fagocitosis para eliminar la célula muerta o moribunda.
Métodos de caracterización
La bicapa lipídica es una estructura muy difícil de estudiar debido a su delgadez y fragilidad. A pesar de estas limitaciones, en los últimos setenta años se han desarrollado decenas de técnicas que permiten investigar su estructura y función.
Medidas eléctricas
Las mediciones eléctricas son una forma sencilla de caracterizar una función importante de una bicapa: su capacidad para segregar y evitar el flujo de iones en solución. Aplicando un voltaje a través de la bicapa y midiendo la corriente resultante, se determina la resistencia de la bicapa. Esta resistencia suele ser bastante alta (10 8 Ohm-cm 2 o más) [40] ya que el núcleo hidrófobo es impermeable a las especies cargadas. La presencia de incluso unos pocos agujeros a escala nanométrica da como resultado un aumento drástico de la corriente. [41] La sensibilidad de este sistema es tal que incluso se puede resolver la actividad de canales iónicos individuales. [42]
Microscopía de fluorescencia

Una bicapa lipídica no se puede ver con un microscopio tradicional porque es demasiado delgada, por lo que los investigadores a menudo usan microscopía de fluorescencia . Se excita una muestra con una longitud de onda de luz y se observa en otra, de modo que solo se verán las moléculas fluorescentes con un perfil de excitación y emisión coincidente.
Una bicapa lipídica natural no es fluorescente, por lo que es necesario que se adhiera al menos un colorante fluorescente a algunas de las moléculas de la bicapa. La resolución suele estar limitada a unos pocos cientos de nanómetros, que, lamentablemente, es mucho mayor que el espesor de una bicapa lipídica.
Microscopía electrónica
La microscopía electrónica ofrece una imagen de mayor resolución. En un microscopio electrónico , un haz de electrones enfocados interactúa con la muestra en lugar de un haz de luz como en la microscopía tradicional. Junto con las técnicas de congelación rápida, la microscopía electrónica también se ha utilizado para estudiar los mecanismos de transporte intercelular e intracelular, por ejemplo, para demostrar que las vesículas exocitóticas son el medio de liberación química en las sinapsis . [43]
Espectroscopia de resonancia magnética nuclear
La espectroscopia de RMN de 31 P (resonancia magnética nuclear) se utiliza ampliamente para estudios de bicapas de fosfolípidos y membranas biológicas en condiciones nativas. El análisis [44] de los espectros de RMN de 31 P de lípidos podría proporcionar una amplia gama de información sobre el empaquetamiento de la bicapa lipídica, las transiciones de fase (fase de gel, fase de cristal líquido fisiológico, fases de ondulación, fases sin bicapa), la orientación/dinámica del grupo de cabezas lipídicas y las propiedades elásticas de la bicapa lipídica pura y como resultado de la unión de proteínas y otras biomoléculas.
Microscopía de fuerza atómica


Un nuevo método para estudiar las bicapas lipídicas es la microscopía de fuerza atómica (AFM). En lugar de utilizar un haz de luz o partículas, una punta muy pequeña y afilada escanea la superficie haciendo contacto físico con la bicapa y moviéndose a través de ella, como la aguja de un tocadiscos. La AFM es una técnica prometedora porque tiene el potencial de generar imágenes con resolución nanométrica a temperatura ambiente e incluso bajo agua o un tampón fisiológico, condiciones necesarias para el comportamiento natural de la bicapa. Utilizando esta capacidad, la AFM se ha utilizado para examinar el comportamiento dinámico de la bicapa, incluida la formación de poros transmembrana (agujeros) [45] y transiciones de fase en bicapas soportadas. [46] Otra ventaja es que la AFM no requiere un etiquetado fluorescente o isotópico de los lípidos, ya que la punta de la sonda interactúa mecánicamente con la superficie de la bicapa. Debido a esto, el mismo escaneo puede generar imágenes tanto de lípidos como de proteínas asociadas, a veces incluso con resolución de molécula única. [45] [47] La AFM también puede investigar la naturaleza mecánica de las bicapas lipídicas. [48]
Interferometría de polarización dual
Las bicapas lipídicas presentan altos niveles de birrefringencia , donde el índice de refracción en el plano de la bicapa difiere del perpendicular en hasta 0,1 unidades de índice de refracción . Esto se ha utilizado para caracterizar el grado de orden y disrupción en las bicapas mediante interferometría de polarización dual para comprender los mecanismos de interacción de proteínas.
Cálculos químicos cuánticos
Las bicapas lipídicas son sistemas moleculares complejos con muchos grados de libertad. Por lo tanto, la simulación atomística de la membrana y, en particular, los cálculos ab initio de sus propiedades son difíciles y computacionalmente costosos. Recientemente se han realizado con éxito cálculos químicos cuánticos para estimar los momentos dipolares y cuadrupolares de las membranas lipídicas. [49]
Transporte a través de la bicapa
Difusión pasiva
La mayoría de las moléculas polares tienen baja solubilidad en el núcleo de hidrocarburo de una bicapa lipídica y, como consecuencia, tienen coeficientes de permeabilidad bajos a través de la bicapa. Este efecto es particularmente pronunciado para las especies cargadas, que tienen coeficientes de permeabilidad incluso más bajos que las moléculas polares neutras. [50] Los aniones suelen tener una mayor tasa de difusión a través de las bicapas que los cationes . [51] [52] En comparación con los iones, las moléculas de agua en realidad tienen una permeabilidad relativamente grande a través de la bicapa, como lo demuestra la hinchazón osmótica . Cuando una célula o vesícula con una alta concentración de sal interior se coloca en una solución con una baja concentración de sal, se hinchará y eventualmente estallará. Tal resultado no se observaría a menos que el agua pudiera pasar a través de la bicapa con relativa facilidad. La permeabilidad anómalamente grande del agua a través de las bicapas aún no se entiende completamente y continúa siendo tema de debate activo. [53] Las pequeñas moléculas apolares sin carga se difunden a través de las bicapas lipídicas muchos órdenes de magnitud más rápido que los iones o el agua. Esto se aplica tanto a las grasas como a los disolventes orgánicos como el cloroformo y el éter . Independientemente de su carácter polar, las moléculas más grandes se difunden más lentamente a través de las bicapas lipídicas que las moléculas pequeñas. [54]
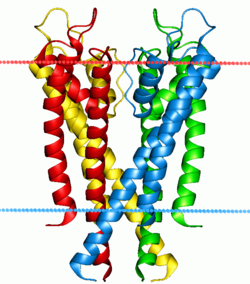
Bombas y canales de iones
Dos clases especiales de proteínas se ocupan de los gradientes iónicos que se encuentran a través de las membranas celulares y subcelulares en la naturaleza: los canales iónicos y las bombas iónicas . Tanto las bombas como los canales son proteínas integrales de membrana que pasan a través de la bicapa, pero sus funciones son bastante diferentes. Las bombas iónicas son las proteínas que construyen y mantienen los gradientes químicos utilizando una fuente de energía externa para mover iones contra el gradiente de concentración a un área de mayor potencial químico . La fuente de energía puede ser ATP , como es el caso de la Na + -K + ATPasa . Alternativamente, la fuente de energía puede ser otro gradiente químico ya existente, como en el antiportador Ca 2+ /Na + . Es a través de la acción de las bombas iónicas que las células pueden regular el pH mediante el bombeo de protones .
A diferencia de las bombas de iones, los canales iónicos no crean gradientes químicos, sino que los disipan para realizar un trabajo o enviar una señal. Probablemente el ejemplo más conocido y mejor estudiado es el canal de Na + dependiente de voltaje , que permite la conducción de un potencial de acción a lo largo de las neuronas . Todas las bombas de iones tienen algún tipo de mecanismo de activación o “activación”. En el ejemplo anterior era un sesgo eléctrico, pero otros canales pueden activarse mediante la unión de un agonista molecular o mediante un cambio conformacional en otra proteína cercana. [55]

Endocitosis y exocitosis
Algunas moléculas o partículas son demasiado grandes o demasiado hidrófilas para pasar a través de una bicapa lipídica. Otras moléculas podrían pasar a través de la bicapa, pero deben ser transportadas rápidamente en cantidades tan grandes que el transporte tipo canal es impráctico. En ambos casos, estos tipos de carga pueden moverse a través de la membrana celular a través de la fusión o gemación de vesículas . Cuando se produce una vesícula dentro de la célula y se fusiona con la membrana plasmática para liberar su contenido al espacio extracelular, este proceso se conoce como exocitosis. En el proceso inverso, una región de la membrana celular se hundirá hacia adentro y eventualmente se desprenderá, encerrando una porción del fluido extracelular para transportarlo a la célula. La endocitosis y la exocitosis dependen de maquinaria molecular muy diferente para funcionar, pero los dos procesos están íntimamente vinculados y no podrían funcionar uno sin el otro. El mecanismo principal de esta interdependencia es la gran cantidad de material lipídico involucrado. [56] En una célula típica, un área de bicapa equivalente a toda la membrana plasmática viajará a través del ciclo de endocitosis/exocitosis en aproximadamente media hora. [57] Si estos dos procesos no se equilibrasen entre sí, la célula se expandiría hasta alcanzar un tamaño inmanejable o agotaría completamente su membrana plasmática en poco tiempo.

Exocitosis en procariotas : La exocitosis vesicular de membrana , conocida popularmente como tráfico de vesículas de membrana , un proceso ganador del premio Nobel (año 2013), se considera tradicionalmente como una prerrogativa de las células eucariotas . [58] Sin embargo, este mito se rompió con la revelación de que las nanovesículas, conocidas popularmente como vesículas de membrana externa bacteriana , liberadas por microbios gramnegativos , translocan moléculas de señal bacterianas a células huésped o diana [59] para llevar a cabo múltiples procesos a favor del microbio secretor, por ejemplo, en la invasión de células huésped [60] y las interacciones microbio-ambiente, en general. [61]
Electroporación
La electroporación es el aumento rápido de la permeabilidad de la bicapa inducido por la aplicación de un gran campo eléctrico artificial a través de la membrana. Experimentalmente, la electroporación se utiliza para introducir moléculas hidrófilas en las células. Es una técnica particularmente útil para moléculas grandes altamente cargadas como el ADN , que nunca se difundirían pasivamente a través del núcleo de la bicapa hidrófoba. [62] Debido a esto, la electroporación es uno de los métodos clave de transfección , así como de transformación bacteriana . Incluso se ha propuesto que la electroporación resultante de la caída de rayos podría ser un mecanismo de transferencia horizontal natural de genes . [63]
Este aumento de la permeabilidad afecta principalmente al transporte de iones y otras especies hidratadas, lo que indica que el mecanismo es la creación de agujeros llenos de agua a escala nm en la membrana. Aunque la electroporación y la ruptura dieléctrica son resultado de la aplicación de un campo eléctrico, los mecanismos involucrados son fundamentalmente diferentes. En la ruptura dieléctrica, el material de barrera se ioniza, creando una vía conductora. La alteración del material es, por lo tanto, de naturaleza química. Por el contrario, durante la electroporación, las moléculas de lípidos no se alteran químicamente, sino que simplemente cambian de posición, abriendo un poro que actúa como vía conductora a través de la bicapa a medida que se llena de agua.
Mecánica

Las bicapas lipídicas son estructuras lo suficientemente grandes como para tener algunas de las propiedades mecánicas de los líquidos o sólidos. El módulo de compresión de área K a , el módulo de flexión K b y la energía de borde se pueden utilizar para describirlas. Las bicapas lipídicas sólidas también tienen un módulo de corte , pero como cualquier líquido, el módulo de corte es cero para las bicapas fluidas. Estas propiedades mecánicas afectan el funcionamiento de la membrana. K a y K b afectan la capacidad de las proteínas y las moléculas pequeñas para insertarse en la bicapa, [64] [65] y se ha demostrado que las propiedades mecánicas de la bicapa alteran la función de los canales iónicos activados mecánicamente. [66] Las propiedades mecánicas de la bicapa también determinan qué tipos de estrés puede soportar una célula sin desgarrarse. Aunque las bicapas lipídicas pueden doblarse fácilmente, la mayoría no pueden estirarse más de un pequeño porcentaje antes de romperse. [67]
Como se explicó en la sección Estructura y organización, la atracción hidrofóbica de las colas lipídicas en el agua es la fuerza principal que mantiene unidas las bicapas lipídicas. Por lo tanto, el módulo elástico de la bicapa está determinado principalmente por la cantidad de área adicional que se expone al agua cuando las moléculas lipídicas se estiran para separarlas. [68] No es sorprendente, dada esta comprensión de las fuerzas involucradas, que los estudios hayan demostrado que K a varía fuertemente con la presión osmótica [69], pero solo débilmente con la longitud de la cola y la insaturación. [10] Debido a que las fuerzas involucradas son tan pequeñas, es difícil determinar experimentalmente K a . La mayoría de las técnicas requieren microscopía sofisticada y equipo de medición muy sensible. [48] [70]
A diferencia de K a , que es una medida de cuánta energía se necesita para estirar la bicapa, K b es una medida de cuánta energía se necesita para doblar o flexionar la bicapa. Formalmente, el módulo de flexión se define como la energía requerida para deformar una membrana desde su curvatura intrínseca a alguna otra curvatura. La curvatura intrínseca se define por la relación entre el diámetro del grupo de la cabeza y el del grupo de la cola. Para los lípidos de PC de dos colas, esta relación es casi uno, por lo que la curvatura intrínseca es casi cero. Si un lípido en particular tiene una desviación demasiado grande de la curvatura intrínseca cero, no formará una bicapa y, en su lugar, formará otras fases, como micelas o micelas invertidas. La adición de pequeñas moléculas hidrófilas como la sacarosa en liposomas lamelares de lípidos mixtos hechos de membranas tilacoides ricas en galactolípidos desestabiliza las bicapas en la fase micelar . [71] Normalmente, K b no se mide experimentalmente, sino que se calcula a partir de mediciones de K a y el espesor de la bicapa, ya que los tres parámetros están relacionados.
es una medida de la cantidad de energía que se necesita para exponer un borde de bicapa al agua rasgándola o creando un agujero en ella. El origen de esta energía es el hecho de que la creación de dicha interfaz expone algunas de las colas lipídicas al agua, pero se desconoce la orientación exacta de estos lípidos del borde. Existe cierta evidencia de que pueden coexistir poros tanto hidrofóbicos (colas rectas) como hidrofílicos (cabezas curvadas alrededor). [72] [73]
Fusión

La fusión es el proceso por el cual dos bicapas lipídicas se fusionan, dando como resultado una estructura conectada. Si esta fusión se produce completamente a través de ambos foliolos de ambas bicapas, se forma un puente lleno de agua y las soluciones contenidas en las bicapas pueden mezclarse. Alternativamente, si solo un foliolo de cada bicapa está involucrado en el proceso de fusión, se dice que las bicapas están hemifusionadas. La fusión está involucrada en muchos procesos celulares, en particular en eucariotas , ya que la célula eucariota está ampliamente subdividida por membranas de bicapa lipídica. La exocitosis , la fertilización de un óvulo por activación del esperma y el transporte de productos de desecho al lisosoma son algunos de los muchos procesos eucariotas que dependen de alguna forma de fusión. Incluso la entrada de patógenos puede estar gobernada por la fusión, ya que muchos virus recubiertos de bicapa tienen proteínas de fusión dedicadas para ingresar a la célula huésped.
Hay cuatro pasos fundamentales en el proceso de fusión. [30] En primer lugar, las membranas involucradas deben agregarse, aproximándose entre sí a varios nanómetros. En segundo lugar, las dos bicapas deben entrar en contacto muy cercano (dentro de unos pocos angstroms). Para lograr este contacto cercano, las dos superficies deben deshidratarse al menos parcialmente, ya que el agua superficial unida normalmente presente hace que las bicapas se repelan fuertemente. La presencia de iones, en particular cationes divalentes como magnesio y calcio, afecta fuertemente a este paso. [74] [75] Una de las funciones críticas del calcio en el cuerpo es regular la fusión de membranas. En tercer lugar, debe formarse una desestabilización en un punto entre las dos bicapas, distorsionando localmente sus estructuras. La naturaleza exacta de esta distorsión no se conoce. Una teoría es que debe formarse un "tallo" muy curvado entre las dos bicapas. [76] Los defensores de esta teoría creen que explica por qué la fosfatidiletanolamina, un lípido muy curvado, promueve la fusión. [77] Finalmente, en el último paso de la fusión, este defecto puntual crece y los componentes de las dos bicapas se mezclan y se difunden lejos del sitio de contacto.


La situación se complica aún más cuando se considera la fusión in vivo, ya que la fusión biológica casi siempre está regulada por la acción de proteínas asociadas a la membrana . Las primeras de estas proteínas que se estudiaron fueron las proteínas de fusión viral, que permiten a un virus envuelto insertar su material genético en la célula huésped (los virus envueltos son aquellos rodeados por una bicapa lipídica; algunos otros solo tienen una cubierta proteica). Las células eucariotas también utilizan proteínas de fusión, las más estudiadas de las cuales son las SNARE . Las proteínas SNARE se utilizan para dirigir todo el tráfico intracelular vesicular . A pesar de años de estudio, todavía se desconoce mucho sobre la función de esta clase de proteínas. De hecho, todavía existe un debate activo sobre si las SNARE están vinculadas al acoplamiento temprano o participan más tarde en el proceso de fusión al facilitar la hemifusión. [79]
En los estudios de biología molecular y celular, a menudo es deseable inducir artificialmente la fusión. La adición de polietilenglicol (PEG) provoca la fusión sin agregación significativa ni alteración bioquímica. Este procedimiento se utiliza ahora ampliamente, por ejemplo, mediante la fusión de células B con células de mieloma . [80] El “ hibridoma ” resultante de esta combinación expresa un anticuerpo deseado según lo determinado por la célula B involucrada, pero se inmortaliza debido al componente de melanoma. La fusión también se puede inducir artificialmente a través de la electroporación en un proceso conocido como electrofusión. Se cree que este fenómeno es el resultado de los bordes energéticamente activos formados durante la electroporación, que pueden actuar como el punto de defecto local para nuclear el crecimiento del tallo entre dos bicapas. [81]
Sistemas modelo
Las bicapas lipídicas se pueden crear artificialmente en el laboratorio para permitir a los investigadores realizar experimentos que no se pueden hacer con bicapas naturales. También se pueden utilizar en el campo de la biología sintética para definir los límites de las células artificiales . Estos sistemas sintéticos se denominan bicapas lipídicas modelo. Hay muchos tipos diferentes de bicapas modelo, cada uno con ventajas y desventajas experimentales. Se pueden hacer con lípidos sintéticos o naturales. Entre los sistemas modelo más comunes se encuentran:
- Membranas lipídicas negras (BLM)
- Bicapas lipídicas soportadas (SLB)
- Membranas lipídicas bicapa unidas (t-BLM)
- Vesículas
- Bicapas de interfaz de gotitas (DIB)
Aplicaciones comerciales
Hasta la fecha, la aplicación comercial más exitosa de las bicapas lipídicas ha sido el uso de liposomas para la administración de fármacos, especialmente para el tratamiento del cáncer. (Nota: el término "liposoma" es en esencia sinónimo de " vesícula ", excepto que vesícula es un término general para la estructura, mientras que liposoma se refiere solo a vesículas artificiales, no naturales). La idea básica de la administración de fármacos liposomales es que el fármaco se encapsula en solución dentro del liposoma y luego se inyecta en el paciente. Estos liposomas cargados de fármaco viajan a través del sistema hasta que se unen en el sitio objetivo y se rompen, liberando el fármaco. En teoría, los liposomas deberían ser un sistema ideal de administración de fármacos, ya que pueden aislar casi cualquier fármaco hidrófilo, se pueden injertar con moléculas para dirigirse a tejidos específicos y pueden ser relativamente no tóxicos, ya que el cuerpo posee vías bioquímicas para degradar los lípidos. [82]
La primera generación de liposomas para administración de fármacos tenía una composición lipídica simple y adolecía de varias limitaciones. La circulación en el torrente sanguíneo era extremadamente limitada debido tanto a la depuración renal como a la fagocitosis . El refinamiento de la composición lipídica para ajustar la fluidez, la densidad de carga superficial y la hidratación superficial dio como resultado vesículas que adsorben menos proteínas del suero y, por lo tanto, son menos fácilmente reconocidas por el sistema inmunológico . [83] El avance más significativo en esta área fue el injerto de polietilenglicol (PEG) en la superficie del liposoma para producir vesículas "ocultas", que circulan durante largos períodos sin depuración renal o inmunológica. [84]
Los primeros liposomas furtivos se dirigían pasivamente a los tejidos tumorales . Debido a que los tumores inducen una angiogénesis rápida y descontrolada, son especialmente “permeables” y permiten que los liposomas salgan del torrente sanguíneo a una velocidad mucho mayor que la que lo haría el tejido normal. [85] Más recientemente [ ¿cuándo? ] se ha llevado a cabo un trabajo para injertar anticuerpos u otros marcadores moleculares en la superficie de los liposomas con la esperanza de unirlos activamente a una célula o tipo de tejido específico. [86] Algunos ejemplos de este enfoque ya se encuentran en ensayos clínicos. [87]
Otra posible aplicación de las bicapas lipídicas es el campo de los biosensores . Dado que la bicapa lipídica es la barrera entre el interior y el exterior de la célula, también es el sitio de una amplia transducción de señales. A lo largo de los años, los investigadores han intentado aprovechar este potencial para desarrollar un dispositivo basado en bicapas para el diagnóstico clínico o la detección del bioterrorismo. El progreso ha sido lento en esta área y, aunque unas pocas empresas han desarrollado sistemas automatizados de detección basados en lípidos, todavía están dirigidos a la comunidad de investigación. Estas incluyen Biacore (ahora GE Healthcare Life Sciences), que ofrece un chip desechable para utilizar bicapas lipídicas en estudios de cinética de unión [88] y Nanion Inc., que ha desarrollado un sistema automatizado de fijación de parches [89] . También se están buscando otras aplicaciones más exóticas, como el uso de poros de membrana de bicapa lipídica para la secuenciación de ADN por parte de Oxford Nanolabs. Hasta la fecha, esta tecnología no ha demostrado ser comercialmente viable.
Una bicapa lipídica soportada (SLB ) como la descrita anteriormente ha logrado un éxito comercial como técnica de detección para medir la permeabilidad de los fármacos. Esta técnica de ensayo de permeabilidad de membrana artificial paralela PAMPA mide la permeabilidad a través de cócteles de lípidos específicamente formulados que se han encontrado altamente correlacionados con cultivos de Caco-2 , [90] [91] el tracto gastrointestinal , [92] la barrera hematoencefálica [93] y la piel. [94]
Historia
A principios del siglo XX, los científicos habían llegado a creer que las células estaban rodeadas por una fina barrera similar al aceite, [95] pero no se conocía la naturaleza estructural de esta membrana. Dos experimentos realizados en 1925 sentaron las bases para llenar este vacío. Al medir la capacitancia de las soluciones de eritrocitos , Hugo Fricke determinó que la membrana celular tenía un espesor de 3,3 nm. [96]
Aunque los resultados de este experimento fueron precisos, Fricke interpretó erróneamente los datos para significar que la membrana celular es una sola capa molecular. El Prof. Dr. Evert Gorter [97] (1881-1954) y F. Grendel de la Universidad de Leiden abordaron el problema desde una perspectiva diferente, extendiendo los lípidos de los eritrocitos como una monocapa en una cubeta Langmuir-Blodgett . Cuando compararon el área de la monocapa con el área de superficie de las células, encontraron una relación de dos a uno. [98] Análisis posteriores mostraron varios errores y suposiciones incorrectas con este experimento pero, casualmente, estos errores se cancelaron y a partir de estos datos defectuosos Gorter y Grendel llegaron a la conclusión correcta: que la membrana celular es una bicapa lipídica. [30]
Esta teoría fue confirmada mediante el uso de la microscopía electrónica a finales de los años 1950. Aunque no publicó el primer estudio de microscopía electrónica de las bicapas lipídicas [99], J. David Robertson fue el primero en afirmar que las dos bandas oscuras densas en electrones eran los grupos de cabeza y las proteínas asociadas de dos monocapas lipídicas yuxtapuestas. [100] [101] En este trabajo, Robertson propuso el concepto de la "membrana unidad". Esta fue la primera vez que la estructura de bicapa se había asignado universalmente a todas las membranas celulares, así como a las membranas de los orgánulos .
Casi al mismo tiempo, el desarrollo de membranas modelo confirmó que la bicapa lipídica es una estructura estable que puede existir independientemente de las proteínas. Al “pintar” una solución de lípidos en un solvente orgánico a través de una abertura, Mueller y Rudin pudieron crear una bicapa artificial y determinar que ésta exhibía fluidez lateral, alta resistencia eléctrica y autocuración en respuesta a la punción, [102] todas las cuales son propiedades de una membrana celular natural. Unos años más tarde, Alec Bangham demostró que las bicapas, en forma de vesículas lipídicas, también podían formarse simplemente exponiendo una muestra de lípidos secos al agua. [103] Este fue un avance importante, ya que demostró que las bicapas lipídicas se forman espontáneamente a través del autoensamblaje y no requieren una estructura de soporte estampada.
En 1977, Kunitake y Okahata prepararon una membrana bicapa totalmente sintética a partir de un único compuesto orgánico, el bromuro de didodecildimetilamonio. [104] Esto demuestra claramente que la membrana bicapa se ensambló mediante fuerzas intermoleculares .
Véase también
Referencias
- ^ Andersen, Olaf S.; Koeppe, II, Roger E. (junio de 2007). "Espesor de la bicapa y función de la proteína de membrana: una perspectiva energética". Revisión anual de biofísica y estructura biomolecular . 36 (1): 107–130. doi :10.1146/annurev.biophys.36.040306.132643. PMID 17263662. S2CID 6521535.
- ^ Divecha, Nullin; Irvine, Robin F (27 de enero de 1995). "Señalización de fosfolípidos". Cell . 80 (2): 269–278. doi : 10.1016/0092-8674(95)90409-3 . PMID 7834746. S2CID 14120598.
- ^ Mashaghi et al. La hidratación afecta fuertemente la estructura molecular y electrónica de los fosfolípidos de membrana. 136, 114709 (2012) "The Journal of Chemical Physics". Archivado desde el original el 15 de mayo de 2016 . Consultado el 17 de mayo de 2012 .
- ^ ab Lewis BA, Engelman DM (mayo de 1983). "El espesor de la bicapa lipídica varía linealmente con la longitud de la cadena de acilo en vesículas de fosfatidilcolina fluida". J. Mol. Biol . 166 (2): 211–7. doi :10.1016/S0022-2836(83)80007-2. PMID 6854644.
- ^ Zaccai G, Blasie JK, Schoenborn BP (enero de 1975). "Estudios de difracción de neutrones sobre la ubicación del agua en membranas modelo de bicapa de lecitina". Proc. Natl. Sci. USA . 72 (1): 376–380. Bibcode :1975PNAS...72..376Z. doi : 10.1073/pnas.72.1.376 . PMC 432308 . PMID 16592215.
- ^ Nagle JF, Tristram-Nagle S (noviembre de 2000). "Estructura de las bicapas lipídicas". Biochim. Biophys. Acta . 1469 (3): 159–95. doi :10.1016/S0304-4157(00)00016-2. PMC 2747654. PMID 11063882 .
- ^ ab Parker J, Madigan MT, Brock TD, Martinko JM (2003). Biología de microorganismos de Brock (10.ª ed.). Englewood Cliffs, NJ: Prentice Hall. ISBN 978-0-13-049147-3.
- ^ Marsh D (julio de 2001). "Perfiles de polaridad y permeación en membranas lipídicas". Proc. Natl. Sci. USA . 98 (14): 7777–82. Bibcode :2001PNAS...98.7777M. doi : 10.1073/pnas.131023798 . PMC 35418 . PMID 11438731.
- ^ Marsh D (diciembre de 2002). "Perfiles de penetración de agua en membranas a partir de etiquetas de espín". Eur. Biophys. J. 31 ( 7): 559–62. doi :10.1007/s00249-002-0245-z. PMID 12602343. S2CID 36212541.
- ^ abcd Rawicz W, Olbrich KC, McIntosh T, Needham D, Evans E (julio de 2000). "Efecto de la longitud de la cadena y la insaturación en la elasticidad de las bicapas lipídicas". Biophys. J . 79 (1): 328–39. Bibcode :2000BpJ....79..328R. doi :10.1016/S0006-3495(00)76295-3. PMC 1300937 . PMID 10866959.
- ^ Trauble H, Haynes DH (1971). "El cambio de volumen en las láminas de la bicapa lipídica en la transición de fase cristalina a líquido cristalina". Química Física Lípidos . 7 (4): 324–35. doi :10.1016/0009-3084(71)90010-7.
- ^ Bretscher MS (1 de marzo de 1972). "Estructura de bicapa lipídica asimétrica para membranas biológicas". Nature New Biology . 236 (61): 11–12. doi :10.1038/newbio236011a0. PMID 4502419.
- ^ Verkleij AJ, Zwaal RF, Roelofsen B, Comfurius P, Kastelijn D, van Deenen LL (octubre de 1973). "La distribución asimétrica de los fosfolípidos en la membrana de los glóbulos rojos humanos. Un estudio combinado utilizando fosfolipasas y microscopía electrónica de grabado por congelación". Biochim. Biophys. Acta . 323 (2): 178–93. doi :10.1016/0005-2736(73)90143-0. PMID 4356540.
- ^ Coones, RT; Green, RJ; Frazier, RA (2021). "Investigación de la composición del grupo de cabezas lipídicas dentro de las membranas epiteliales: una revisión sistemática". Materia blanda . 17 (28): 6773–6786. Bibcode :2021SMat...17.6773C. doi : 10.1039/D1SM00703C . ISSN 1744-683X. PMID 34212942. S2CID 235708094.
- ^ Bell RM, Ballas LM, Coleman RA (1 de marzo de 1981). "Topogénesis lipídica". J. Lipid Res . 22 (3): 391–403. doi : 10.1016/S0022-2275(20)34952-X . PMID 7017050.
- ^ Bretscher MS (agosto de 1973). "Estructura de la membrana: algunos principios generales". Science . 181 (4100): 622–629. Bibcode :1973Sci...181..622B. doi :10.1126/science.181.4100.622. PMID 4724478. S2CID 34501546.
- ^ Rothman JE, Kennedy EP (mayo de 1977). "Movimiento transmembrana rápido de fosfolípidos recién sintetizados durante el ensamblaje de la membrana". Proc. Natl. Sci. USA . 74 (5): 1821–5. Bibcode :1977PNAS...74.1821R. doi : 10.1073/pnas.74.5.1821 . PMC 431015 . PMID 405668.
- ^ Kornberg RD, McConnell HM (marzo de 1971). "Transiciones de dentro a fuera de los fosfolípidos en las membranas de las vesículas". Bioquímica . 10 (7): 1111–20. doi :10.1021/bi00783a003. PMID 4324203.
- ^ Litman BJ (julio de 1974). "Determinación de la asimetría molecular en la distribución superficial de la fosfatidiletanolamina en vesículas de fosfolípidos mixtos". Bioquímica . 13 (14): 2844–8. doi :10.1021/bi00711a010. PMID 4407872.
- ^ Crane JM, Kiessling V, Tamm LK (febrero de 2005). "Medición de la asimetría lipídica en bicapas planas soportadas mediante microscopía de contraste de interferencia de fluorescencia". Langmuir . 21 (4): 1377–88. doi :10.1021/la047654w. PMID 15697284.
- ^ Kalb E, Frey S, Tamm LK (enero de 1992). "Formación de bicapas planas soportadas por fusión de vesículas a monocapas de fosfolípidos soportadas". Biochim. Biophys. Acta . 1103 (2): 307–16. doi :10.1016/0005-2736(92)90101-Q. PMID 1311950.
- ^ Lin WC, Blanchette CD, Ratto TV, Longo ML (enero de 2006). "Asimetría lipídica en bicapas lipídicas soportadas por DLPC/DSPC: un estudio combinado de microscopía de fluorescencia y AFM". Biophys. J . 90 (1): 228–37. Bibcode :2006BpJ....90..228L. doi :10.1529/biophysj.105.067066. PMC 1367021 . PMID 16214871.
- ^ Pérez-Salas, Ursula; Porcar, Lionel; Garg, Sumit; Ayee, Manuela AA; Levitan, Irena (octubre de 2022). "Parámetros efectivos que controlan la transferencia de esteroles: un estudio de dispersión de neutrones de ángulo pequeño resuelto en el tiempo". Revista de biología de membranas . 255 (4–5): 423–435. doi :10.1007/s00232-022-00231-3. ISSN 1432-1424. PMID 35467109. S2CID 248375027.
- ^ Garg, S.; Porcar, L.; Woodka, AC; Butler, PD; Perez-Salas, U. (20 de julio de 2011). "Medidas de dispersión de neutrones no invasivas revelan un transporte de colesterol más lento en membranas lipídicas modelo". Revista Biofísica . 101 (2): 370–377. Bibcode :2011BpJ...101..370G. doi :10.1016/j.bpj.2011.06.014. ISSN 1542-0086. PMC 3136766 . PMID 21767489.
- ^ ab Deverall, Miranda A.; Garg, Sumit; Lüdtke, Karin; Jordan, Rainer; Rühe, Jürgen; Naumann, Christoph A. (12 de agosto de 2008). "Acoplamiento transbicapa de la difusión lipídica obstruida en bicapas de fosfolípidos unidas a polímeros". Soft Matter . 4 (9): 1899–1908. Bibcode :2008SMat....4.1899D. doi :10.1039/B800801A. ISSN 1744-6848.
- ^ ab Garg, Sumit; Rühe, Jürgen; Lüdtke, Karin; Jordan, Rainer; Naumann, Christoph A. (15 de febrero de 2007). "Registro de dominios en mezclas lipídicas que imitan balsas estudiadas utilizando bicapas lipídicas unidas a polímeros". Revista biofísica . 92 (4): 1263–1270. Código Bibliográfico :2007BpJ....92.1263G. doi :10.1529/biophysj.106.091082. ISSN 0006-3495. PMC 1783876 . PMID 17114215.
- ^ Berg, Howard C. (1993). Paseos aleatorios en biología (edición de bolsillo ampliada). Princeton, NJ: Princeton University Press. ISBN 978-0-691-00064-0.
- ^ Dietrich C, Volovyk ZN, Levi M, Thompson NL, Jacobson K (septiembre de 2001). "Partición de Thy-1, GM1 y análogos de fosfolípidos reticulados en balsas lipídicas reconstituidas en monocapas de membrana modelo soportadas". Proc. Natl. Sci. USA . 98 (19): 10642–7. Bibcode :2001PNAS...9810642D. doi : 10.1073/pnas.191168698 . PMC 58519 . PMID 11535814.
- ^ Alberts, Bruce (2017). "Capítulo 10: Estructuras de membrana". Biología molecular de la célula . Garland Science. ISBN 9781317563747.
- ^ abc Yeagle, Philip (1993). Las membranas de las células (2.ª ed.). Boston: Academic Press. ISBN 978-0-12-769041-4.
- ^ Fadok VA, Bratton DL, Frasch SC, Warner ML, Henson PM (julio de 1998). "El papel de la fosfatidilserina en el reconocimiento de células apoptóticas por fagocitos". Cell Death Differ . 5 (7): 551–62. doi : 10.1038/sj.cdd.4400404 . PMID 10200509.
- ^ Anderson HC, Garimella R, Tague SE (enero de 2005). "El papel de las vesículas de la matriz en el desarrollo de la placa de crecimiento y la biomineralización". Portada. Biosci . 10 (1–3): 822–37. doi :10.2741/1576. PMID 15569622.
- ^ Eanes ED, Hailer AW (enero de 1987). "Precipitación de fosfato de calcio en suspensiones acuosas de liposomas aniónicos que contienen fosfatidilserina". Calcif. Tissue Int . 40 (1): 43–8. doi :10.1007/BF02555727. PMID 3103899. S2CID 26435152.
- ^ Kim J, Mosior M, Chung LA, Wu H, McLaughlin S (julio de 1991). "Unión de péptidos con residuos básicos a membranas que contienen fosfolípidos ácidos". Biophys. J . 60 (1): 135–48. Bibcode :1991BpJ....60..135K. doi :10.1016/S0006-3495(91)82037-9. PMC 1260045 . PMID 1883932.
- ^ Koch AL (1984). "Células primigenias: posibles mecanismos de generación de energía y división celular". J. Mol. Evol . 21 (3): 270–7. doi :10.1007/BF02102359. PMID 6242168. S2CID 21635206.
- ^ "5.1 Estructura de la membrana celular | Ciencias de la vida | Universidad de Tokio". Archivado desde el original el 22 de febrero de 2014 . Consultado el 10 de noviembre de 2012 .
- ^ ab Alberts, Bruce (2002). Biología molecular de la célula (4.ª ed.). Nueva York: Garland Science. ISBN 978-0-8153-4072-0.
- ^ Martelli PL, Fariselli P, Casadio R (2003). "Un enfoque de aprendizaje automático ENSEMBLE para la predicción de proteínas de membrana all-alpha". Bioinformática . 19 (Supl 1): i205–11. doi : 10.1093/bioinformatics/btg1027 . PMID 12855459.
- ^ Filmore D (2004). "Es un mundo GPCR". Descubrimiento moderno de fármacos . 11 : 24–9.
- ^ Montal M, Mueller P (diciembre de 1972). "Formación de membranas bimoleculares a partir de monocapas lipídicas y un estudio de sus propiedades eléctricas". Proc. Natl. Sci . 69 (12): 3561–6. Bibcode :1972PNAS...69.3561M. doi : 10.1073/pnas.69.12.3561 . PMC 389821 . PMID 4509315.
- ^ Melikov KC, Frolov VA, Shcherbakov A, Samsonov AV, Chizmadzhev YA, Chernomordik LV (abril de 2001). "Preporos no conductores inducidos por voltaje y poros individuales metaestables en la bicapa lipídica plana no modificada". Biophys. J . 80 (4): 1829–36. Bibcode :2001BpJ....80.1829M. doi :10.1016/S0006-3495(01)76153-X. PMC 1301372 . PMID 11259296.
- ^ Neher E, Sakmann B (abril de 1976). "Corrientes de un solo canal registradas a partir de la membrana de fibras musculares de rana desnervadas". Nature . 260 (5554): 799–802. Bibcode :1976Natur.260..799N. doi :10.1038/260799a0. PMID 1083489. S2CID 4204985.
- ^ Heuser JE, Reese TS, Dennis MJ, Jan Y, Jan L, Evans L (mayo de 1979). "Exocitosis de vesículas sinápticas capturada por congelación rápida y correlacionada con la liberación de transmisores cuánticos". J. Cell Biol . 81 (2): 275–300. doi :10.1083/jcb.81.2.275. PMC 2110310. PMID 38256 .
- ^ Dubinnyi MA, Lesovoy DM, Dubovskii PV, Chupin VV, Arseniev AS (junio de 2006). "Modelado de espectros de RMN de 31 P de liposomas de fosfolípidos orientados magnéticamente: una nueva solución analítica". Solid State Nucl Magn Reson . 29 (4): 305–311. doi :10.1016/j.ssnmr.2005.10.009. PMID 16298110.[ enlace muerto ]
- ^ abc Roiter, Yuri; Ornatska, Maryna; Rammohan, Aravind R.; Balakrishnan, Jitendra; Heine, David R.; Minko, Sergiy (2008). "Interacción de nanopartículas con membrana lipídica". Nano Letras . 8 (3): 941–944. Código Bib : 2008NanoL...8..941R. doi :10.1021/nl080080l. PMID 18254602.
- ^ Tokumasu F, Jin AJ, Dvorak JA (2002). "Comportamiento de la fase de la membrana lipídica dilucidado en tiempo real mediante microscopía de fuerza atómica en un entorno controlado". Journal of Electron Microscopy . 51 (1): 1–9. doi :10.1093/jmicro/51.1.1. PMID 12003236.
- ^ Richter RP, Brisson A (2003). "Caracterización de bicapas lipídicas y ensamblajes proteicos soportados en superficies rugosas mediante microscopía de fuerza atómica". Langmuir . 19 (5): 1632–40. doi :10.1021/la026427w. S2CID 56532332.
- ^ ab Steltenkamp S, Müller MM, Deserno M, Hennesthal C, Steinem C, Janshoff A (julio de 2006). "Propiedades mecánicas de las bicapas lipídicas que abarcan poros analizadas mediante microscopía de fuerza atómica". Biophys. J . 91 (1): 217–26. Bibcode :2006BpJ....91..217S. doi :10.1529/biophysj.106.081398. PMC 1479081 . PMID 16617084.
- ^ Alireza Mashaghi et al., La hidratación afecta fuertemente la estructura molecular y electrónica de los fosfolípidos de membrana. J. Chem. Phys. 136, 114709 (2012) "The Journal of Chemical Physics". Archivado desde el original el 15 de mayo de 2016 . Consultado el 17 de mayo de 2012 .
- ^ Chakrabarti AC (1994). "Permeabilidad de las membranas a los aminoácidos y a los aminoácidos modificados: mecanismos implicados en la translocación". Aminoácidos . 6 (3): 213–29. doi :10.1007/BF00813743. PMID 11543596. S2CID 24350029.
- ^ Hauser H, Phillips MC, Stubbs M (octubre de 1972). "Permeabilidad iónica de las bicapas de fosfolípidos". Nature . 239 (5371): 342–4. Código Bibliográfico :1972Natur.239..342H. doi :10.1038/239342a0. PMID 12635233. S2CID 4185197.
- ^ Papahadjopoulos D, Watkins JC (septiembre de 1967). "Membranas modelo de fosfolípidos. II. Propiedades de permeabilidad de cristales líquidos hidratados". Biochim. Biophys. Acta . 135 (4): 639–52. doi :10.1016/0005-2736(67)90095-8. PMID 6048247.
- ^ Paula S, Volkov AG, Van Hoek AN, Haines TH, Deamer DW (enero de 1996). "Permeación de protones, iones de potasio y pequeñas moléculas polares a través de bicapas de fosfolípidos en función del espesor de la membrana". Biophys. J . 70 (1): 339–48. Bibcode :1996BpJ....70..339P. doi :10.1016/S0006-3495(96)79575-9. PMC 1224932 . PMID 8770210.
- ^ Xiang TX, Anderson BD (junio de 1994). "La relación entre el tamaño del permeante y la permeabilidad en las membranas de bicapa lipídica". J. Membr. Biol . 140 (2): 111–22. doi :10.1007/bf00232899. PMID 7932645. S2CID 20394005.
- ^ Gouaux E, Mackinnon R (diciembre de 2005). "Principios del transporte selectivo de iones en canales y bombas". Science . 310 (5753): 1461–5. Bibcode :2005Sci...310.1461G. doi :10.1126/science.1113666. PMID 16322449. S2CID 16323721.
- ^ Gundelfinger ED, Kessels MM, Qualmann B (febrero de 2003). "Coordinación temporal y espacial de la exocitosis y la endocitosis". Nat. Rev. Mol. Cell Biol . 4 (2): 127–39. doi :10.1038/nrm1016. PMID 12563290. S2CID 14415959.
- ^ Steinman RM, Brodie SE, Cohn ZA (marzo de 1976). "Flujo de membrana durante la pinocitosis. Un análisis estereológico". J. Cell Biol . 68 (3): 665–87. doi :10.1083/jcb.68.3.665. PMC 2109655. PMID 1030706 .
- ^ YashRoy RC (1999) 'Exocitosis en procariotas' y su papel en la invasión de salmonela . ICAR NEWS - A Science and Technology Newsletter , (octubre-diciembre) vol. 5(4), página 18. https://www.researchgate.net/publication/230822402_'Exocitosis_en_procariotas'_y_su_papel_en_la_invasión_de_Salmonella?ev=prf_pub
- ^ YashRoy RC (1993) Estudios con microscopio electrónico de pili superficiales y vesículas de organismos Salmonella 3,10:r:-. Ind Jl of Anim Sci 63, 99-102. https://www.researchgate.net/publication/230817087_Electron_microscope_studies_of_surface_pilli_and_vesicles_of_Salmonella_310r-_organisms?ev=prf_pub
- ^ YashRoy RC (1998) Descubrimiento de la exocitosis vesicular en procariotas y su papel en la invasión de Salmonella . Current Science , vol. 75(10), págs. 1062-1066. https://www.researchgate.net/publication/230793568_Discovery_of_vesicular_exocytosis_in_prokaryotes_and_its_role_in_Salmonella_invasion?ev=prf_pub
- ^ YashRoy RC (1998). "Exocitosis de bacterias gramnegativas para la invasión de Salmonella del epitelio ileal del pollo". Indian Journal of Poultry Science . 33 (2): 119–123.
- ^ Neumann E, Schaefer-Ridder M, Wang Y, Hofschneider PH (1982). "Transferencia de genes a células de liomas de ratón mediante electroporación en campos eléctricos intensos". EMBO J . 1 (7): 841–5. doi :10.1002/j.1460-2075.1982.tb01257.x. PMC 553119 . PMID 6329708.
- ^ Demanèche S, Bertolla F, Buret F, et al. (agosto de 2001). "Evidencia a escala de laboratorio de transferencia de genes mediada por rayos en el suelo". Appl. Environ. Microbiol . 67 (8): 3440–4. Bibcode :2001ApEnM..67.3440D. doi :10.1128/AEM.67.8.3440-3444.2001. PMC 93040 . PMID 11472916.
- ^ Garcia ML (julio de 2004). "Canales iónicos: expectativas de compuertas". Nature . 430 (6996): 153–5. Bibcode :2004Natur.430..153G. doi :10.1038/430153a. PMID 15241399. S2CID 4427370.
- ^ McIntosh TJ, Simon SA (2006). "Funciones de las propiedades del material de la bicapa en la función y distribución de las proteínas de membrana". Annu. Rev. Biophys. Biomol. Struct . 35 (1): 177–98. doi :10.1146/annurev.biophys.35.040405.102022. PMID 16689633.
- ^ Suchyna TM, Tape SE, Koeppe RE, Andersen OS, Sachs F, Gottlieb PA (julio de 2004). "Inhibición dependiente de bicapa de canales mecanosensibles por enantiómeros de péptidos neuroactivos". Nature . 430 (6996): 235–40. Bibcode :2004Natur.430..235S. doi :10.1038/nature02743. PMID 15241420. S2CID 4401688.
- ^ Hallett FR, Marsh J, Nickel BG, Wood JM (febrero de 1993). "Propiedades mecánicas de las vesículas. II. Un modelo para la hinchazón y lisis osmóticas". Biophys. J . 64 (2): 435–42. Bibcode :1993BpJ....64..435H. doi :10.1016/S0006-3495(93)81384-5. PMC 1262346 . PMID 8457669.
- ^ Boal, David H. (2001). Mecánica de la célula . Cambridge, Reino Unido: Cambridge University Press. ISBN 978-0-521-79681-1.
- ^ Rutkowski CA, Williams LM, Haines TH, Cummins HZ (junio de 1991). "La elasticidad de vesículas de fosfolípidos sintéticos obtenidas por espectroscopia de correlación de fotones". Bioquímica . 30 (23): 5688–96. doi :10.1021/bi00237a008. PMID 2043611.
- ^ Evans E, Heinrich V, Ludwig F, Rawicz W (octubre de 2003). "Espectroscopia de tensión dinámica y resistencia de las biomembranas". Biophys. J . 85 (4): 2342–50. Bibcode :2003BpJ....85.2342E. doi :10.1016/S0006-3495(03)74658-X. PMC 1303459 . PMID 14507698.
- ^ YashRoy RC (1994) Desestabilización de la dispersión lamelar de los lípidos de la membrana tilacoidal por sacarosa. Biochimica et Biophysica Acta , vol. 1212, págs. 129-133. https://www.researchgate.net/publication/15042978_Destabilisation_of_lamellar_dispersion_of_thylakoid_membrane_lipids_by_sucrose?ev=prf_pub
- ^ Weaver JC, Chizmadzhev YA (1996). "Teoría de la electroporación: una revisión". Bioelectroquímica y bioenergética . 41 (2): 135–60. doi :10.1016/S0302-4598(96)05062-3.
- ^ Zeidi, Mahdi; Kim, Chun IL (2018). "Los efectos de la viscosidad intramembrana en la morfología de la membrana lipídica: solución analítica completa". Scientific Reports . 8 (1): 12845. Bibcode :2018NatSR...812845Z. doi : 10.1038/s41598-018-31251-6 . ISSN 2045-2322. PMC 6110749 . PMID 30150612.
- ^ Papahadjopoulos D, Nir S, Düzgünes N (abril de 1990). "Mecanismos moleculares de la fusión de membranas inducida por calcio". J. Bioenerg. Biomembr . 22 (2): 157–79. doi :10.1007/BF00762944. PMID 2139437. S2CID 1465571.
- ^ Leventis R, Gagné J, Fuller N, Rand RP, Silvius JR (noviembre de 1986). "Fusión inducida por cationes divalentes y segregación lateral de lípidos en vesículas de ácido fosfatidilcolina-fosfatídico". Bioquímica . 25 (22): 6978–87. doi :10.1021/bi00370a600. PMID 3801406.
- ^ Markin VS, Kozlov MM, Borovjagin VL (octubre de 1984). "Sobre la teoría de la fusión de membranas. El mecanismo del tallo". Gen. Physiol. Biophys . 3 (5): 361–77. PMID 6510702.
- ^ Chernomordik LV, Kozlov MM (2003). "Interacción proteína-lípido en la fusión y fisión de membranas biológicas". Annu. Rev. Biochem . 72 (1): 175–207. doi :10.1146/annurev.biochem.72.121801.161504. PMID 14527322.
- ^ Georgiev, Danko D.; Glazebrook, James F. (2007). "Procesamiento subneuronal de información mediante ondas solitarias y procesos estocásticos". En Lyshevski, Sergey Edward (ed.). Manual de nanoelectrónica y electrónica molecular . Serie de nanoingeniería y microingeniería. CRC Press. págs. 17–1–17–41. doi :10.1201/9781315221670-17. ISBN 978-0-8493-8528-5.S2CID 199021983 .
- ^ Chen YA, Scheller RH (febrero de 2001). "Fusión de membrana mediada por SNARE". Nat. Rev. Mol. Cell Biol . 2 (2): 98–106. doi :10.1038/35052017. PMID 11252968. S2CID 205012830.
- ^ Köhler G, Milstein C (agosto de 1975). "Cultivos continuos de células fusionadas que secretan anticuerpos de especificidad predefinida". Nature . 256 (5517): 495–7. Bibcode :1975Natur.256..495K. doi :10.1038/256495a0. PMID 1172191. S2CID 4161444.
- ^ Jordan, Carol A.; Neumann, Eberhard; Sowershi Mason, Arthur E. (1989). Electroporación y electrofusión en biología celular . Nueva York: Plenum Press. ISBN 978-0-306-43043-5.
- ^ Immordino ML, Dosio F, Cattel L (2006). "Liposomas invisibles: revisión de la ciencia básica, fundamentos y aplicaciones clínicas, existentes y potenciales". Int J Nanomed . 1 (3): 297–315. doi :10.2217/17435889.1.3.297. PMC 2426795 . PMID 17717971.
- ^ Chonn A, Semple SC, Cullis PR (15 de septiembre de 1992). "Asociación de proteínas sanguíneas con liposomas unilamelares grandes in vivo. Relación con la vida útil en circulación". J. Biol. Chem . 267 (26): 18759–65. doi : 10.1016/S0021-9258(19)37026-7 . PMID 1527006.
- ^ Boris EH, Winterhalter M, Frederik PM, Vallner JJ, Lasic DD (1997). "Liposomas invisibles: de la teoría al producto". Advanced Drug Delivery Reviews . 24 (2–3): 165–77. doi :10.1016/S0169-409X(96)00456-5.
- ^ Maeda H, Sawa T, Konno T (julio de 2001). "Mecanismo de administración dirigida a tumores de fármacos macromoleculares, incluido el efecto EPR en tumores sólidos y descripción clínica del fármaco polimérico prototipo SMANCS". J Control Release . 74 (1–3): 47–61. doi :10.1016/S0168-3659(01)00309-1. PMID 11489482.
- ^ Lopes DE, Menezes DE, Kirchmeier MJ, Gagne JF (1999). "Tráfico celular y citotoxicidad de la doxorrubicina liposomal dirigida a CD19 en células de linfoma B". Journal of Liposome Research . 9 (2): 199–228. doi :10.3109/08982109909024786.
- ^ Matsumura Y, Gotoh M, Muro K, et al. (marzo de 2004). "Estudio de fase I y farmacocinético de MCC-465, una doxorrubicina (DXR) encapsulada en inmunoliposoma de PEG, en pacientes con cáncer de estómago metastásico". Ann. Oncol . 15 (3): 517–25. doi : 10.1093/annonc/mdh092 . PMID: 14998859.
- ^ [1] [ enlace muerto permanente ] . Biacore Inc. Recuperado el 12 de febrero de 2009.
- ^ Nanion Technologies. Automated Patch Clamp Archivado el 31 de marzo de 2010 en Wayback Machine . Consultado el 28 de febrero de 2010. (PDF)
- ^ Bermejo, M.; Avdeef, A.; Ruíz, A.; Nalda, R.; Ruell, JA; Tsinman, O.; González, I.; Fernández, C.; Sánchez, G.; Garrigues, TM; Merino, V. (2004). "PAMPA - un modelo 7 de absorción de fármacos in vitro. Comparación de la permeabilidad de las fluoroquinolonas in situ, Caco-2 y PAMPA en ratas". Revista Europea de Ciencias Farmacéuticas . 21 (4): 429–41. doi :10.1016/j.ejps.2003.10.009. PMID 14998573.
- ^ Avdeef, A.; Artursson, P.; Neuhoff, S.; Lazorova, L.; Gråsjö, J.; Tavelin, S. (2005). "Permeabilidad Caco-2 de fármacos débilmente básicos predicha con el método de pKa(flux) PAMPA de doble sumidero". Revista Europea de Ciencias Farmacéuticas . 24 (4): 333–49. doi :10.1016/j.ejps.2004.11.011. PMID 15734300.
- ^ Avdeef, A.; Nielsen, PE; Tsinman, O. (2004). "PAMPA: un modelo in vitro de absorción de fármacos 11. Igualación del espesor de la capa de agua no agitada in vivo mediante agitación de pocillos individuales en placas de microtitulación". Revista Europea de Ciencias Farmacéuticas . 22 (5): 365–74. doi :10.1016/j.ejps.2004.04.009. PMID 15265506.
- ^ Dagenais, C.; Avdeef, A.; Tsinman, O.; Dudley, A.; Beliveau, R. (2009). "Permeabilidad in situ de la barrera hematoencefálica en ratones deficientes en P-glicoproteína y su predicción utilizando un modelo PAMPA en combo". Revista Europea de Ciencias Farmacéuticas . 38 (2): 121–37. doi :10.1016/j.ejps.2009.06.009. PMC 2747801 . PMID 19591928.
- ^ Sinkó, B.; Kökösi, J.; Avdeef, A.; Takács-Novák, K. (2009). "Un estudio PAMPA sobre el efecto de mejora de la permeabilidad de nuevos análogos de ceramida". Química y Biodiversidad . 6 (11): 1867–74. doi :10.1002/cbdv.200900149. PMID 19937821. S2CID 27395246.
- ^ Loeb J (diciembre de 1904). "El desarrollo reciente de la biología". Science . 20 (519): 777–786. Bibcode :1904Sci....20..777L. doi :10.1126/science.20.519.777. PMID 17730464.
- ^ Fricke H (1925). "La capacidad eléctrica de las suspensiones con especial referencia a la sangre". Revista de fisiología general . 9 (2): 137–52. doi :10.1085/jgp.9.2.137. PMC 2140799 . PMID 19872238.
- ^ Dooren LJ, Wiedemann LR (1986). "Sobre las capas bimoleculares de lípidos en los cromocitos de la sangre". Revista Europea de Pediatría . 145 (5): 329. doi :10.1007/BF00439232. PMID 3539619. S2CID 36842138.
- ^ Gorter E, Grendel F (1925). "Sobre las capas bimoleculares de lípidos en los cromocitos de la sangre". Journal of Experimental Medicine . 41 (4): 439–43. doi :10.1084/jem.41.4.439. PMC 2130960 . PMID 19868999.
- ^ Sjöstrand FS, Andersson-Cedergren E, Dewey MM (abril de 1958). "La ultraestructura de los discos intercalados del músculo cardíaco de rana, ratón y cobaya". J. Ultrastruct. Res . 1 (3): 271–87. doi :10.1016/S0022-5320(58)80008-8. PMID 13550367.
- ^ Robertson JD (1960). "La estructura molecular y las relaciones de contacto de las membranas celulares". Prog. Biophys. Mol. Biol . 10 : 343–418. PMID 13742209.
- ^ Robertson JD (1959). "La ultraestructura de las membranas celulares y sus derivados". Biochem. Soc. Symp . 16 : 3–43. PMID 13651159.
- ^ Mueller P, Rudin DO, Tien HT, Wescott WC (junio de 1962). "Reconstitución de la estructura de la membrana celular in vitro y su transformación en un sistema excitable". Nature . 194 (4832): 979–80. Bibcode :1962Natur.194..979M. doi :10.1038/194979a0. PMID 14476933. S2CID 2110051.
- ^ Bangham, AD ; Horne, RW (1964). "Tinción negativa de fosfolípidos y su modificación estructural por agentes tensioactivos observada en el microscopio electrónico". Journal of Molecular Biology . 8 (5): 660–668. doi :10.1016/S0022-2836(64)80115-7. PMID 14187392.
- ^ Kunitake T (1977). "Una membrana bicapa totalmente sintética". J. Am. Chem. Soc . 99 (11): 3860–3861. doi :10.1021/ja00453a066.
Enlaces externos
- LIPIDAT Una extensa base de datos de propiedades físicas de lípidos
- Estructura de las bicapas lipídicas fluidas Archivado el 11 de abril de 2011 en Wayback Machine Simulaciones y enlaces a publicaciones relacionados con la estructura transversal de las bicapas lipídicas.

