Fertilización

La fecundación o fertilización (ver diferencias ortográficas ), también conocida como fecundación generativa , singamia e impregnación , [1] es la fusión de gametos para dar lugar a un cigoto e iniciar su desarrollo en un nuevo organismo individual o descendencia. [2] Si bien procesos como la inseminación o la polinización , que ocurren antes de la fusión de gametos, también se denominan a veces informalmente fecundación, [3] estos son procesos técnicamente separados. El ciclo de fecundación y desarrollo de nuevos individuos se llama reproducción sexual . Durante la doble fecundación en las angiospermas , el gameto masculino haploide se combina con dos núcleos polares haploides para formar un núcleo de endospermo primario triploide mediante el proceso de fecundación vegetativa.
Historia
En la antigüedad, Aristóteles concibió la formación de nuevos individuos a través de la fusión de fluidos masculinos y femeninos, surgiendo la forma y la función gradualmente, en un modo llamado por él como epigenético . [4]
En 1784, Spallanzani estableció la necesidad de la interacción entre el óvulo de la hembra y el espermatozoide del macho para formar un cigoto en las ranas. [5] En 1827, Karl Ernst von Baer observó por primera vez un óvulo de mamífero terio . [4] Oscar Hertwig (1876), en Alemania, describió la fusión de núcleos de espermatozoides y de óvulos de erizo de mar . [5]
Evolución
La evolución de la fecundación está relacionada con el origen de la meiosis , pues ambas forman parte de la reproducción sexual , originada en eucariotas . Una hipótesis plantea que la meiosis se originó a partir de la mitosis. [6]
Fertilización en las plantas

Los gametos que participan en la fertilización de las plantas son el espermatozoide (masculino) y el óvulo (femenino). Varios grupos de plantas tienen diferentes métodos por los cuales los gametos producidos por los gametofitos masculino y femenino se unen y son fertilizados. En las briofitas y plantas terrestres pteridofíticas , la fertilización del espermatozoide y el óvulo tiene lugar dentro del arquegonio . En las plantas con semillas , el gametofito masculino se forma dentro de un grano de polen . Después de la polinización , el grano de polen germina y un tubo polínico crece y penetra en el óvulo a través de un pequeño poro llamado micrópilo . Los espermatozoides se transfieren desde el polen a través del tubo polínico hasta el óvulo donde se fertiliza el óvulo. En las plantas con flores , dos espermatozoides se liberan del tubo polínico y ocurre un segundo evento de fertilización que involucra al segundo espermatozoide y la célula central del óvulo, que es un segundo gameto femenino. [7]
Crecimiento del tubo polínico
A diferencia de los espermatozoides animales, que son móviles, los espermatozoides de la mayoría de las plantas con semillas son inmóviles y dependen del tubo polínico para llevarlos al óvulo, donde se liberan. [8] El tubo polínico penetra el estigma y se alarga a través de la matriz extracelular del estilo antes de llegar al ovario. Luego, cerca del receptáculo, atraviesa el óvulo a través del micrópilo (una abertura en la pared del óvulo) y el tubo polínico "estalla" en el saco embrionario, liberando el esperma. [9] Se ha creído que el crecimiento del tubo polínico depende de señales químicas del pistilo, sin embargo, estos mecanismos fueron poco comprendidos hasta 1995. El trabajo realizado en plantas de tabaco reveló una familia de glicoproteínas llamadas proteínas TTS que mejoran el crecimiento de los tubos polínicos. [9] Los tubos polínicos en un medio de germinación de polen sin azúcar y un medio con proteínas TTS purificadas crecieron. Sin embargo, en el medio TTS, los tubos crecieron a una velocidad tres veces mayor que en el medio sin azúcar. [9] También se colocaron proteínas TTS en varias ubicaciones de pistilos polinizados semi in vivo , y se observó que los tubos polínicos se extendían inmediatamente hacia las proteínas. Las plantas transgénicas que carecían de la capacidad de producir proteínas TTS tuvieron un crecimiento más lento del tubo polínico y una fertilidad reducida. [9]
Ruptura del tubo polínico
Se ha demostrado que la ruptura del tubo polínico para liberar el esperma en Arabidopsis depende de una señal del gametofito femenino. Unas proteínas específicas llamadas quinasas de proteína FER presentes en el óvulo controlan la producción de derivados altamente reactivos del oxígeno llamados especies reactivas de oxígeno (ROS). Se ha demostrado que los niveles de ROS a través de GFP son más altos durante las etapas florales cuando el óvulo es más receptivo a los tubos polínicos, y más bajos durante los momentos de desarrollo y después de la fertilización. [8] Las altas cantidades de ROS activan los canales de iones de calcio en el tubo polínico, lo que hace que estos canales absorban iones de calcio en grandes cantidades. Este aumento de la absorción de calcio hace que el tubo polínico se rompa y libere su esperma en el óvulo. [8] Los ensayos de alimentación del pistilo en los que las plantas fueron alimentadas con cloruro de difenil yodonio (DPI) suprimieron las concentraciones de ROS en Arabidopsis , lo que a su vez impidió la ruptura del tubo polínico. [8]
Plantas con flores
Después de ser fertilizado, el ovario comienza a hincharse y desarrollarse hasta convertirse en el fruto . [10] En los frutos con múltiples semillas, se necesitan múltiples granos de polen para la singamia con cada óvulo. El crecimiento del tubo polínico está controlado por el citoplasma vegetativo (o del tubo). El tubo polínico secreta enzimas hidrolíticas que digieren el tejido femenino a medida que el tubo crece por el estigma y el estilo; el tejido digerido se utiliza como fuente de nutrientes para el tubo polínico a medida que crece. Durante el crecimiento del tubo polínico hacia el ovario, el núcleo generativo se divide para producir dos núcleos de espermatozoides separados (número haploide de cromosomas) [11] ; por lo tanto, un tubo polínico en crecimiento contiene tres núcleos separados, dos espermatozoides y un tubo. [12] Los espermatozoides están interconectados y son dimórficos; el grande, en varias plantas, también está vinculado al núcleo del tubo y el espermatozoide interconectado y el núcleo del tubo forman la "unidad germinal masculina". [13]
La doble fecundación es el proceso en las angiospermas (plantas con flores) en el que dos espermatozoides de cada tubo polínico fecundan dos células en un gametofito femenino (a veces llamado saco embrionario) que está dentro de un óvulo. Después de que el tubo polínico entra en el gametofito, el núcleo del tubo polínico se desintegra y los dos espermatozoides se liberan; uno de los dos espermatozoides fecunda el óvulo (en la parte inferior del gametofito cerca del micrópilo), formando un cigoto diploide (2n) . Este es el punto en el que realmente ocurre la fecundación; la polinización y la fecundación son dos procesos separados. El núcleo del otro espermatozoide se fusiona con dos núcleos polares haploides (contenidos en la célula central) en el centro del gametofito. La célula resultante es triploide (3n). Esta célula triploide se divide a través de la mitosis y forma el endospermo , un tejido rico en nutrientes , dentro de la semilla . [7] Los dos núcleos maternos de las células centrales (núcleos polares) que contribuyen a la formación del endospermo surgen por mitosis a partir del único producto meiótico que también dio origen al óvulo. Por lo tanto, la contribución materna a la constitución genética del endospermo triploide es el doble de la del embrión.
Una especie primitiva de planta con flores, Nuphar polysepala , tiene un endospermo diploide, resultado de la fusión de un espermatozoide con un núcleo materno en lugar de dos. Se cree que en las primeras etapas del desarrollo de los linajes de angiospermas se produjo una duplicación de este modo de reproducción, lo que produjo gametofitos femeninos de siete células y ocho núcleos, y endospermas triploides con una proporción de genoma materno a paterno de 2:1. [14]
En muchas plantas, el desarrollo de la pulpa del fruto es proporcional al porcentaje de óvulos fecundados. Por ejemplo, en el caso de la sandía , se deben depositar unos mil granos de polen y distribuirlos uniformemente sobre los tres lóbulos del estigma para obtener un fruto de tamaño y forma normales. [ cita requerida ]
Autopolinización y polinización cruzada
La polinización cruzada y la autopolinización representan estrategias diferentes con diferentes beneficios y costos. Se estima que el 48,7% de las especies de plantas son dioicas o polinizadoras obligadas autoincompatibles. [15] También se estima que alrededor del 42% de las plantas con flores presentan un sistema de apareamiento mixto en la naturaleza. [16]
En el tipo más común de sistema de apareamiento mixto, las plantas individuales producen un solo tipo de flor y los frutos pueden contener progenies autofecundadas, exogamia o una mezcla de tipos de progenie. La transición de la fecundación cruzada a la autofecundación es la transición evolutiva más común en las plantas y ha ocurrido repetidamente en muchos linajes independientes. [17] Alrededor del 10-15% de las plantas con flores son predominantemente autofecundantes. [17]
En circunstancias en las que los polinizadores o las parejas son raros, la autofecundación ofrece la ventaja de asegurar la reproducción . [17] Por lo tanto, la autofecundación puede dar como resultado una mejor capacidad de colonización. En algunas especies, la autofecundación ha persistido durante muchas generaciones. Capsella rubella es una especie autofecundante que se volvió autocompatible hace 50.000 a 100.000 años. [18] Arabidopsis thaliana es una planta predominantemente autofecundante con una tasa de cruzamiento externo en la naturaleza de menos del 0,3%; [19] un estudio sugirió que la autofecundación evolucionó hace aproximadamente un millón de años o más en A. thaliana . [20] En plantas autofecundantes establecidas desde hace mucho tiempo, el enmascaramiento de mutaciones deletéreas y la producción de variabilidad genética son poco frecuentes y, por lo tanto, es poco probable que proporcionen un beneficio suficiente durante muchas generaciones para mantener el aparato meiótico. En consecuencia, se podría esperar que la autofecundación fuera reemplazada en la naturaleza por una forma de reproducción asexual amiósica que sería menos costosa. Sin embargo, la persistencia real de la meiosis y la autofecundación como forma de reproducción en plantas autofecundantes establecidas desde hace mucho tiempo puede estar relacionada con el beneficio inmediato de la reparación recombinatoria eficiente del daño del ADN durante la formación de células germinales proporcionada por la meiosis en cada generación. [ cita requerida ]
La fecundación en los animales
La mecánica de la fecundación se ha estudiado ampliamente en erizos de mar y ratones. Esta investigación aborda la cuestión de cómo el espermatozoide y el óvulo correspondiente se encuentran y la cuestión de cómo un solo espermatozoide llega al óvulo y libera su contenido. Hay tres pasos en la fecundación que garantizan la especificidad de la especie:
- Quimiotaxis
- Activación de los espermatozoides/reacción acrosómica
- Adhesión espermatozoide/óvulo
Interno vs. externo
La consideración de si un animal (más específicamente un vertebrado) utiliza la fertilización interna o externa a menudo depende del método de nacimiento. Los animales ovíparos que ponen huevos con cáscaras gruesas de calcio, como las gallinas , o cáscaras gruesas y correosas generalmente se reproducen mediante fertilización interna, de modo que el esperma fecunda el óvulo sin tener que atravesar la gruesa capa terciaria protectora del óvulo. Los animales ovovivíparos y vivíparos también utilizan la fertilización interna. Aunque algunos organismos se reproducen mediante amplexo , aún pueden utilizar la fertilización interna, como ocurre con algunas salamandras. Las ventajas de la fertilización interna incluyen un desperdicio mínimo de gametos, una mayor probabilidad de fertilización de óvulos individuales, un período más largo de protección del óvulo y una fertilización selectiva. Muchas hembras tienen la capacidad de almacenar esperma durante períodos prolongados de tiempo y pueden fertilizar sus óvulos a su propio deseo. [ cita requerida ]
Por otra parte, los animales ovíparos que producen huevos con membranas terciarias delgadas o sin membranas utilizan métodos de fertilización externa. Estos animales pueden denominarse con mayor precisión ovulíparos. [21] La fertilización externa es ventajosa porque minimiza el contacto (lo que disminuye el riesgo de transmisión de enfermedades) y aumenta la variación genética.
Erizos de mar
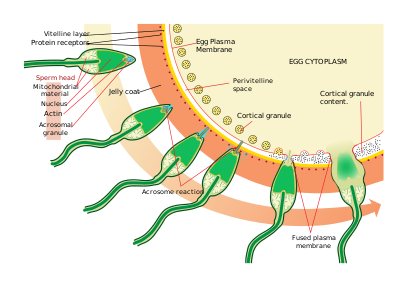
Los espermatozoides encuentran los óvulos mediante quimiotaxis , un tipo de interacción ligando/receptor. Resact es un péptido de 14 aminoácidos purificado a partir de la capa gelatinosa de A. punctulata que atrae la migración de los espermatozoides.
Después de encontrar el óvulo, el espermatozoide penetra la capa gelatinosa a través de un proceso llamado activación espermática. En otra interacción ligando/receptor, un componente oligosacárido del óvulo se une y activa un receptor en el espermatozoide y causa la reacción acrosómica . Las vesículas acrosómicas del espermatozoide se fusionan con la membrana plasmática y se liberan. En este proceso, las moléculas unidas a la membrana de la vesícula acrosómica, como la bindina, quedan expuestas en la superficie del espermatozoide. Estos contenidos digieren la capa gelatinosa y, finalmente, la membrana vitelina. Además de la liberación de vesículas acrosómicas, se produce una polimerización explosiva de actina para formar una punta delgada en la cabeza del espermatozoide llamada proceso acrosómico .
El espermatozoide se une al óvulo a través de otra reacción de ligando entre receptores de la membrana vitelina . La proteína de superficie del espermatozoide, bindin, se une a un receptor de la membrana vitelina identificado como EBR1.
La fusión de las membranas plasmáticas del espermatozoide y el óvulo probablemente esté mediada por la bindina. En el lugar de contacto, la fusión provoca la formación de un cono de fecundación.
Mamíferos
Los mamíferos se fertilizan internamente a través de la cópula . [22] Después de que un macho eyacula , muchos espermatozoides se desplazan hacia la parte superior de la vagina (a través de contracciones de la vagina) a través del cuello uterino y a lo largo del útero para encontrarse con el óvulo. En los casos en que se produce la fecundación, la hembra suele ovular durante un período que se extiende desde horas antes de la cópula hasta unos días después; por lo tanto, en la mayoría de los mamíferos, es más común que la eyaculación preceda a la ovulación que viceversa. [ cita requerida ]
Cuando los espermatozoides se depositan en la vagina anterior, no son capaces de fertilización (es decir, no están capacitados) [ aclaración necesaria ] y se caracterizan por patrones de motilidad lineal lenta. Esta motilidad, combinada con contracciones musculares, permite el transporte de los espermatozoides hacia el útero y los oviductos . [23] Existe un gradiente de pH dentro del microambiente del tracto reproductivo femenino, de modo que el pH cerca de la abertura vaginal es menor (aproximadamente 5) que el de los oviductos (aproximadamente 8). [24] La proteína de transporte de calcio sensible al pH específica de los espermatozoides, llamada CatSper, aumenta la permeabilidad de los espermatozoides al calcio a medida que avanzan hacia el tracto reproductivo. El influjo de calcio intracelular contribuye a la capacitación e hiperactivación de los espermatozoides, lo que provoca un patrón de motilidad no lineal más violento y rápido a medida que los espermatozoides se acercan al ovocito. El espermatozoide capacitado y el ovocito se encuentran e interactúan en la ampolla de la trompa de Falopio . La reotaxis, la termotaxis y la quimiotaxis son mecanismos conocidos que guían a los espermatozoides hacia el óvulo durante la etapa final de la migración de los espermatozoides. [25] Los espermatozoides responden (ver Termotaxis de los espermatozoides ) al gradiente de temperatura de ~2 °C entre el oviducto y la ampolla, [26] y se ha confirmado que los gradientes quimiotácticos de progesterona son la señal que emana de las células del cúmulo oóforo que rodean a los ovocitos de conejo y humanos. [27] Los espermatozoides capacitados e hiperactivados responden a estos gradientes modificando su comportamiento y moviéndose hacia el complejo cúmulo-ovocito. Otras señales quimiotácticas como la formil Met-Leu-Phe (fMLF) también pueden guiar a los espermatozoides. [28]
La zona pelúcida , una gruesa capa de matriz extracelular que rodea al óvulo y que tiene una función similar a la de la membrana vitelina en los erizos de mar, une al espermatozoide. A diferencia de los erizos de mar, el espermatozoide se une al óvulo antes de la reacción acrosómica. La ZP3 , una glicoproteína de la zona pelúcida, es responsable de la adhesión óvulo/espermatozoide en los seres humanos. El receptor galactosiltransferasa (GalT) se une a los residuos de N-acetilglucosamina en la ZP3 y es importante para la unión con el espermatozoide y la activación de la reacción acrosómica. La ZP3 es suficiente, aunque innecesaria, para la unión del espermatozoide/óvulo. Existen dos receptores de espermatozoides adicionales: una proteína de 250 kD que se une a una proteína secretada por el oviducto, y la SED1, que se une de forma independiente a la zona. Después de la reacción acrosómica, se cree que el espermatozoide permanece unido a la zona pelúcida a través de los receptores ZP2 expuestos. Estos receptores son desconocidos en ratones, pero se han identificado en cobayas. [ cita requerida ]
En los mamíferos, la unión del espermatozoide al GalT inicia la reacción del acrosoma . Este proceso libera la hialuronidasa que digiere la matriz de ácido hialurónico en las vestiduras alrededor del ovocito. Además, cerca del ovocito se liberan glicosaminoglicanos similares a la heparina (GAG) que promueven la reacción del acrosoma. [29] A continuación, se produce la fusión entre las membranas plasmáticas del ovocito y el espermatozoide y permite que el núcleo del espermatozoide , el centríolo típico y el centríolo atípico que está unido al flagelo , pero no a las mitocondrias , entren en el ovocito. [30] La proteína CD9 probablemente media esta fusión en ratones (el homólogo de unión). El óvulo se " activa " a sí mismo al fusionarse con un solo espermatozoide y, por lo tanto, cambia su membrana celular para evitar la fusión con otros espermatozoides. Durante esta activación se liberan átomos de zinc . [ cita requerida ]
Este proceso finalmente conduce a la formación de una célula diploide llamada cigoto . El cigoto se divide para formar un blastocisto y, al ingresar al útero, se implanta en el endometrio, dando inicio al embarazo . La implantación embrionaria fuera de la pared uterina da como resultado un embarazo ectópico que puede matar a la madre.
En animales como los conejos, el coito induce la ovulación al estimular la liberación de la hormona pituitaria gonadotropina; esta liberación aumenta enormemente la probabilidad de embarazo.
Humanos

La fecundación en humanos es la unión de un óvulo y un espermatozoide humanos , que ocurre generalmente en la ampolla de la trompa de Falopio , produciendo un cigoto unicelular , la primera etapa de la vida en el desarrollo de un organismo genéticamente único, [31] e iniciando el desarrollo embrionario . Los científicos descubrieron la dinámica de la fecundación humana en el siglo XIX.
El término concepción se refiere comúnmente al "proceso de quedar embarazada que implica la fertilización o la implantación o ambas". [32] Su uso lo convierte en un tema de discusiones semánticas sobre el comienzo del embarazo , típicamente en el contexto del debate sobre el aborto . Tras la gastrulación , que ocurre alrededor de 16 días después de la fertilización, el blastocisto implantado desarrolla tres capas germinales, el endodermo, el ectodermo y el mesodermo, y el código genético del padre se involucra completamente en el desarrollo del embrión; la gemelación posterior es imposible. Además, los híbridos interespecies sobreviven solo hasta la gastrulación y no pueden desarrollarse más. Sin embargo, alguna literatura de biología del desarrollo humano se refiere al concepto y dicha literatura médica se refiere a los "productos de la concepción" como el embrión post-implantación y sus membranas circundantes. [33] El término "concepción" no se utiliza habitualmente en la literatura científica debido a su definición y connotación variables.
Insectos

![[icono]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1c/Wiki_letter_w_cropped.svg/20px-Wiki_letter_w_cropped.svg.png) | Esta sección necesita ser ampliada . Puedes ayudar agregándole algo. ( Febrero 2015 ) |
Los insectos de diferentes grupos, incluidos los odonatos ( libélulas y caballitos del diablo ) y los himenópteros ( hormigas , abejas y avispas ) practican la fertilización retardada. Entre los odonatos, las hembras pueden aparearse con varios machos y almacenar esperma hasta que se ponen los huevos. El macho puede flotar sobre la hembra durante la puesta de huevos (oviposición) para evitar que se aparee con otros machos y reemplace su esperma; en algunos grupos, como los darteres, el macho continúa agarrando a la hembra con sus pinzas durante la puesta de huevos, y la pareja vuela en tándem. [34] Entre los himenópteros sociales, las reinas de las abejas melíferas se aparean solo en vuelos de apareamiento, en un corto período que dura algunos días; una reina puede aparearse con ocho o más zánganos . Luego almacena el esperma por el resto de su vida, quizás durante cinco años o más. [35] [36]
Fertilización en hongos
En muchos hongos (excepto los quitridios ), al igual que en algunos protistos, la fecundación es un proceso de dos pasos. En primer lugar, los citoplasmas de las dos células gametocelulares se fusionan (lo que se denomina plasmogamia ), lo que produce una célula dicariótica o heterocariota con múltiples núcleos. Esta célula puede luego dividirse para producir hifas dicarióticas o heterocariotas . El segundo paso de la fecundación es la cariogamia , la fusión de los núcleos para formar un cigoto diploide.
En los hongos quitridios , la fecundación se produce en un solo paso con la fusión de gametos, como en animales y plantas.
Fecundación en protistos
Fecundación en protozoos
Existen tres tipos de procesos de fertilización en los protozoos: [37]
- gametogamia;
- autogamia; [38] [39]
- gamontogamia.
Fertilización en algas
Las algas, al igual que algunas plantas terrestres, sufren una alternancia de generaciones . Algunas algas son isomorfas, en las que tanto el esporofito (2n) como el gameteofito (n) son morfológicamente iguales. Cuando la reproducción de las algas se describe como oógama, los gametos masculinos y femeninos son diferentes morfológicamente, en el caso de los gametos femeninos hay un gran óvulo inmóvil y los gametos masculinos son uniflagelados (móviles). A través del proceso de singamia, estos formarán un nuevo cigoto, regenerando nuevamente la generación de esporofitos.
Fecundación y recombinación genética
La meiosis resulta en una segregación aleatoria de los genes que cada progenitor aporta. Cada organismo progenitor suele ser idéntico salvo por una fracción de sus genes; por tanto, cada gameto es genéticamente único. En la fecundación, los cromosomas parentales se combinan. En los seres humanos , (2²²)² = 17,6x10 12 cigotos cromosómicamente diferentes son posibles para los cromosomas no sexuales, incluso suponiendo que no haya cruce cromosómico . Si el cruce ocurre una vez, entonces, en promedio, (4²²)² = 309x10 24 cigotos genéticamente diferentes son posibles para cada pareja, sin considerar que los eventos de cruce pueden tener lugar en la mayoría de los puntos a lo largo de cada cromosoma. Los cromosomas X e Y no experimentan eventos de cruce [ cita requerida ] y, por lo tanto, se excluyen del cálculo. El ADN mitocondrial solo se hereda del progenitor materno.
Los centrosomas del áster del espermatozoide y del cigoto
Poco después de que el espermatozoide se fusione con el óvulo, los dos centriolos del espermatozoide forman el primer centrosoma y el áster de microtúbulos del embrión . [40] El centriolo del espermatozoide, que se encuentra cerca del pronúcleo masculino, recluta proteínas del material pericentriolar del óvulo formando el primer centrosoma del cigoto. [41] Este centrosoma nuclea microtúbulos en forma de estrellas llamados microtúbulos astrales. Los microtúbulos abarcan todo el valium del óvulo, lo que permite que el pronúcleo del óvulo use los cables para llegar al pronúcleo masculino. A medida que los pronúcleos masculino y femenino se acercan entre sí, el centrosoma único se divide en dos centrosomas ubicados en la interfase entre los pronúcleos. Luego, el centrosoma a través de los microtúbulos astrales polariza el genoma dentro de los pronúcleos. [42]
Partenogénesis
Los organismos que normalmente se reproducen sexualmente también pueden hacerlo mediante partenogénesis , en la que un gameto femenino no fertilizado produce descendencia viable. Estas crías pueden ser clones de la madre o, en algunos casos, pueden diferir genéticamente de ella pero heredar solo una parte de su ADN. La partenogénesis se produce en muchas plantas y animales y puede ser inducida en otros mediante un estímulo químico o eléctrico al óvulo. En 2004, investigadores japoneses dirigidos por Tomohiro Kono lograron, después de 457 intentos, fusionar los óvulos de dos ratones bloqueando ciertas proteínas que normalmente impedirían esa posibilidad; el embrión resultante se desarrolló normalmente hasta convertirse en un ratón. [43]
Alogamia y autogamia
La alogamia , también conocida como fertilización cruzada, se refiere a la fertilización de un óvulo de un individuo con el gameto masculino de otro.
La autogamia, también conocida como autofecundación, ocurre en organismos hermafroditas como plantas y platelmintos; en ella, dos gametos de un individuo se fusionan.
Otras variantes de reproducción bisexual
Algunas formas de reproducción relativamente inusuales son: [44] [45]
Ginogénesis : un espermatozoide estimula el desarrollo del óvulo sin fecundación ni singamia. El espermatozoide puede entrar en el óvulo.
Hibridogénesis : se elimina un genoma para producir óvulos haploides.
Meiosis canina : (a veces llamada "poliploidía impar permanente") un genoma se transmite al estilo mendeliano, otros se transmiten clonalmente.
Beneficios de la fertilización cruzada
En general, se cree que el principal beneficio de la fecundación cruzada es la prevención de la depresión endogámica . Charles Darwin , en su libro de 1876 Los efectos de la fecundación cruzada y la autofecundación en el reino vegetal (páginas 466-467), resumió sus hallazgos de la siguiente manera. [46]
"En el presente volumen se ha demostrado que los hijos de la unión de dos individuos distintos, especialmente si sus progenitores han estado sometidos a condiciones muy diferentes, tienen una inmensa ventaja en altura, peso, vigor constitucional y fertilidad sobre los hijos autofecundados de uno de los mismos progenitores. Y este hecho es más que suficiente para explicar el desarrollo de los elementos sexuales, es decir, la génesis de los dos sexos."
Además, algunos piensan [47] que una ventaja a largo plazo del cruzamiento en la naturaleza es una mayor variabilidad genética que promueve la adaptación o la evitación de la extinción (ver Variabilidad genética ).
Véase también
- Fusión celular
- Gorra de concepción
- Dispositivo de concepción
- esperma femenino
- Desarrollo fetal
- Fecundación in vitro
- Kaguya (ratón)
- Partenogénesis , un tipo de reproducción que no implica fertilización.
- Polinización
- Preembrión
- Pronúcleo
- Superfecundación
- Superfetación
- Ruptura de simetría y rotación cortical
- Reacción cortical
- Polispermia
Referencias
- ^ "impregnación". Diccionario Oxford para estudiantes avanzados .
- ^ Siu, Karen K.; Serrão, Vitor Hugo B.; Ziyyat, Ahmed; Lee, Jeffrey E. (2021). "La biología celular de la fertilización: unión y fusión de gametos". Revista de biología celular . 220 (10). doi :10.1083/jcb.202102146. PMC 8406655 . PMID 34459848 . Consultado el 14 de enero de 2023 .
- ^ "Fertilización". Merriam-Webster . Consultado el 10 de julio de 2018 .
- ^ ab Maienschein, Jane (2017). "El primer siglo de la teoría celular: de las unidades estructurales a los sistemas vivos complejos". Historia integrada y filosofía de la ciencia . Anuario del Instituto Círculo de Viena. Vol. 20. págs. 43–54. doi :10.1007/978-3-319-53258-5_4. ISBN 978-3-319-53257-8. Número de identificación del sujeto 89731001.
- ^ ab Birkhead, Tim R.; Montgomerie, Robert (2009). "Tres siglos de investigación sobre el esperma". Biología del esperma . págs. 1–42. doi :10.1016/B978-0-12-372568-4.00001-X. ISBN 978-0-12-372568-4.
- ^ Wilkins AS, Holliday R (enero de 2009). "La evolución de la meiosis a partir de la mitosis". Genética . 181 (1): 3–12. doi :10.1534/genetics.108.099762. PMC 2621177 . PMID 19139151.
- ^ ab Faure, JE (1999). "Doble fertilización en plantas con flores: origen, mecanismos y nueva información a partir de la fertilización in vitro". En Cresti, M.; Cai, G.; Moscatelli, A. (eds.). Fertilización en plantas superiores . Berlín, Heidelberg.: Springer. págs. 79–89. ISBN 978-3-642-59969-9.
- ^ abcd Duan, Qiaohong; Kita, Daniel; Johnson, Eric A; Aggarwal, Mini; Gates, Laura; Wu, Hen-Ming; Cheung, Alice Y (2014). "Las especies reactivas de oxígeno median la ruptura del tubo polínico para liberar esperma para la fertilización en Arabidopsis". Nature Communications . 5 : 3129. Bibcode :2014NatCo...5.3129D. doi : 10.1038/ncomms4129 . PMID 24451849.
- ^ abcd Cheung, Alice Y ; Wang, Hong; Wu, Hen-Ming (1995). "Una glicoproteína específica de tejido transmisora floral atrae tubos polínicos y estimula su crecimiento". Cell . 82 (3): 383–93. doi : 10.1016/0092-8674(95)90427-1 . PMID 7634328.
- ^ Johnstone, Adam (2001). Biología: hechos y práctica para el nivel A. Oxford University Press. pág. 95. ISBN 0-19-914766-3.
- ^ Manual de ciencias vegetales . Chichester, West Sussex, Inglaterra: John Wiley. 2007. pág. 466. ISBN 978-0-470-05723-0.
- ^ Kirk, David; Starr, Cecie (1975). Biología hoy . Del Mar, California: CRM. p. 93. ISBN 978-0-394-31093-0.
- ^ Raghavan, Valayamghat (2006). Doble fertilización: desarrollo del embrión y el endospermo en plantas con flores . Berlín: Springer-Verlag. p. 12. ISBN 978-3-540-27791-0.
- ^ Friedman, William E; Williams, Joseph H (2003). "Modularidad del gametofito femenino de las angiospermas y su relación con la evolución temprana del endospermo en plantas con flores". Evolution . 57 (2): 216–30. doi : 10.1111/j.0014-3820.2003.tb00257.x . PMID 12683519.
- ^ Igic B, Kohn JR (2006). "La distribución de los sistemas de apareamiento de las plantas: sesgo de estudio contra las especies de cruzamiento obligado". Evolution . 60 (5): 1098–103. doi :10.1554/05-383.1. PMID 16817548. S2CID 40964.
- ^ Goodwillie C, Kalisz S, Eckert CG (2005). "El enigma evolutivo de los sistemas de apareamiento mixtos en plantas: ocurrencia, explicaciones teóricas y evidencia empírica". Annu. Rev. Ecol. Evol. Syst . 36 : 47–79. doi :10.1146/annurev.ecolsys.36.091704.175539. S2CID 3755371.
- ^ abc Wright, S. I; Kalisz, S; Slotte, T (2013). "Consecuencias evolutivas de la autofecundación en plantas". Actas de la Royal Society B: Biological Sciences . 280 (1760): 20130133. doi :10.1098/rspb.2013.0133. PMC 3652455 . PMID 23595268.
- ^ Brandvain, Yaniv; Slotte, Tanja; Hazzouri, Khaled M; Wright, Stephen I; Coop, Graham (2013). "La identificación genómica de los haplotipos fundadores revela la historia de la especie autofecundada Capsella rubella". PLOS Genetics . 9 (9): e1003754. arXiv : 1307.4118 . Bibcode :2013arXiv1307.4118B. doi : 10.1371/journal.pgen.1003754 . PMC 3772084 . PMID 24068948.
- ^ Abbott, RJ; Gomes, MF (1989). "Estructura genética poblacional y tasa de cruzamiento de Arabidopsis thaliana (L.) Heynh". Heredity . 62 (3): 411–418. doi : 10.1038/hdy.1989.56 .
- ^ Tang C, Toomajian C, Sherman-Broyles S, Plagnol V, Guo YL, Hu TT, Clark RM, Nasrallah JB, Weigel D, Nordborg M (2007). "La evolución de la autofecundación en Arabidopsis thaliana". Ciencia . 317 (5841): 1070–2. Código Bib : 2007 Ciencia... 317.1070T. doi : 10.1126/ciencia.1143153. PMID 17656687. S2CID 45853624.
- ^ Lodé, Thierry (2001). Les stratégies de reproduction des animaux [ Estrategias de reproducción en el reino animal ] (en francés). Dunod. ISBN 978-2-10-005739-9.[ página necesaria ]
- ^ Naguib, Marc (19 de abril de 2020). Avances en el estudio del comportamiento. Academic Press. ISBN 978-0-12-820726-0.
- ^ Suarez, SS; Pacey, AA (2006). "Transporte de espermatozoides en el tracto reproductivo femenino". Human Reproduction Update . 12 (1): 23–37. doi : 10.1093/humupd/dmi047 . PMID 16272225.
- ^ Ng, Ka Ying Bonnie; Mingels, Roel; Morgan, Hywel; Macklon, Nick; Cheong, Ying (1 de enero de 2018). "Dinámica del oxígeno, la temperatura y el pH in vivo en el tracto reproductivo femenino y su importancia en la concepción humana: una revisión sistemática". Actualización de la reproducción humana . 24 (1): 15–34. doi : 10.1093/humupd/dmx028 . PMID 29077897.
- ^ Li, Shuai; Winuthayanon, Wipawee (2016). "Oviducto: funciones en la fertilización y el desarrollo embrionario temprano". Revista de endocrinología . 232 (1): R1–R26. doi : 10.1530/JOE-16-0302 . PMID 27875265.
- ^ Bahat, Anat; Eisenbach, Michael (2006). "Termotaxis de los espermatozoides". Endocrinología molecular y celular . 252 (1–2): 115–9. doi :10.1016/j.mce.2006.03.027. PMID 16672171. S2CID 22094855.
- ^ Teves, Maria E; Guidobaldi, Hector A; Uñates, Diego R; Sanchez, Raul; Miska, Werner; Publicover, Stephen J; Morales Garcia, Aduén A; Giojalas, Laura C (2009). "Mecanismo molecular de la quimiotaxis del esperma humano mediada por progesterona". PLOS ONE . 4 (12): e8211. Bibcode :2009PLoSO...4.8211T. doi : 10.1371/journal.pone.0008211 . PMC 2782141 . PMID 19997608.
- ^ Gnessi L, Fabbri A, Silvestroni L, Moretti C, Fraioli F, Pert CB, Isidori A (1986). "Evidencia de la presencia de receptores específicos para péptidos quimiotácticos N-formilo en espermatozoides humanos". J Clin Endocrinol Metab . 63 (4): 841–846. doi :10.1210/jcem-63-4-841. PMID 3018025.
- ^ Lee, CN; Clayton, MK; Bushmeyer, SM; First, NL; Ax, RL (1 de septiembre de 1986). "Glicosaminoglicanos en los tractos reproductivos de las ovejas y su influencia en las reacciones del acrosoma en los espermatozoides bovinos in vitro". Journal of Animal Science . 63 (3): 861–867. doi :10.2527/jas1986.633861x. PMID 3759713. S2CID 853558.
- ^ Fishman, Emily L; Jo, Kyoung; Nguyen, Quynh P. H; Kong, Dong; Royfman, Rachel; Cekic, Anthony R; Khanal, Sushil; Miller, Ann L; Simerly, Calvin; Schatten, Gerald; Loncarek, Jadranka; Mennella, Vito; Avidor-Reiss, Tomer (2018). "Un nuevo centríolo atípico del espermatozoide es funcional durante la fertilización humana". Nature Communications . 9 (1): 2210. Bibcode :2018NatCo...9.2210F. doi :10.1038/s41467-018-04678-8. PMC 5992222 . PMID 29880810.
- ^ "Zigoto | Definición, desarrollo, ejemplo y hechos | Britannica". www.britannica.com . Consultado el 14 de enero de 2023 .
- ^ "Concepción". Merriam-Webster . Consultado el 27 de enero de 2019 .
- ^ Moore, KL; TVM Persaud (2003). El ser humano en desarrollo: embriología con orientación clínica. WB Saunders Company. ISBN 0-7216-6974-3.[ página necesaria ]
- ^ Dijkstra, Klaas-Douwe B. (2006). Guía de campo de las libélulas de Gran Bretaña y Europa . Publicación británica de vida silvestre. págs. 8–9. ISBN 0-9531399-4-8.
- ^ Waldbauer, Gilbert (1998). El libro de insectos del observador de aves . Harvard University Press.
- ^ Agricultura y protección del consumidor. "La apicultura en África: vida en colonias y organización social". FAO.
- ^ Tarin, Juan J.; Cano, Antonio (2000). Fertilización en animales protozoarios y metazoarios: aspectos celulares y moleculares . Springer Science & Business Media. ISBN 978-3-540-67093-3.[ página necesaria ]
- ^ Reproducción#Autogamia
- ^ "Autogamia | biología".
- ^ Avidor-Reiss, Tomer; Mazur, Matthew; Fishman, Emily L.; Sindhwani, Puneet (1 de octubre de 2019). "El papel de los centriolos de los espermatozoides en la reproducción humana: lo conocido y lo desconocido". Frontiers in Cell and Developmental Biology . 7 : 188. doi : 10.3389/fcell.2019.00188 . PMC 6781795 . PMID 31632960.
- ^ Fishman, Emily L.; Jo, Kyoung; Nguyen, Quynh PH; Kong, Dong; Royfman, Rachel; Cekic, Anthony R.; Khanal, Sushil; Miller, Ann L.; Simerly, Calvin; Schatten, Gerald; Loncarek, Jadranka; Mennella, Vito; Avidor-Reiss, Tomer (diciembre de 2018). "Un nuevo centríolo atípico del espermatozoide es funcional durante la fertilización humana". Nature Communications . 9 (1): 2210. Bibcode :2018NatCo...9.2210F. doi :10.1038/s41467-018-04678-8. PMC 5992222 . PMID 29880810.
- ^ Cavazza, Tommaso; Takeda, Yuko; Politi, Antonio Z.; Aushev, Magomet; Aldag, Patrick; panadero, Clara; Choudhary, Meenakshi; Bucevičius, Jonas; Lukinavičius, Gražvydas; Mayor, Kay; Blayney, Martyn; Lucas-Hahn, Andrea; Niemann, Heiner; Herberto, María; Schuh, Melina (mayo de 2021). "La unificación del genoma parental es muy propensa a errores en embriones de mamíferos". Celúla . 184 (11): 2860–2877.e22. doi : 10.1016/j.cell.2021.04.013. PMC 8162515 . PMID 33964210.
- ^ Kono, Tomohiro; Obata, Yayoi; Wu, Quiong; Niwa, Katsutoshi; Ono, Yukiko; Yamamoto, Yuji; Park, Eun Sung; Seo, Jeong-Sun; Ogawa, Hidehiko (2004). "Nacimiento de ratones partenogenéticos que pueden desarrollarse hasta la edad adulta". Nature . 428 (6985): 860–4. Bibcode :2004Natur.428..860K. doi :10.1038/nature02402. PMID 15103378. S2CID 4353479.
- Bijal P. Trivedi (21 de abril de 2004). "¿El fin de los machos? Un ratón creado para reproducirse sin esperma". National Geographic . Archivado desde el original el 23 de abril de 2004.
- ^ Stenberg, P; Saura, A (2013). "Meiosis y sus desviaciones en animales poliploides". Investigación citogenética y genómica . 140 (2–4): 185–203. doi :10.1159/000351731. PMID 23796636. S2CID 19955975.
- ^ Stock, M; Ustinova, J; Betto-Colliard, C; Schartl, M; Moritz, C; Perrin, N (2011). "Transmisión mendeliana y clonal simultánea del genoma en un vertebrado totalmente triploide con reproducción sexual". Actas de la Royal Society B: Biological Sciences . 279 (1732): 1293–1299. doi :10.1098/rspb.2011.1738. PMC 3282369 . PMID 21993502.
- ^ Darwin, Charles (1876). Los efectos de la fecundación cruzada y autofecundada en el reino vegetal. J. Murray. págs. 466–467. OCLC 57556547.
- ^ Otto, SP; Gerstein, AC (2006). "¿Por qué tener sexo? La genética poblacional del sexo y la recombinación". Biochemical Society Transactions . 34 (4): 519–22. doi :10.1042/BST0340519. PMID 16856849. S2CID 14542950.
Enlaces externos
- Vídeo sobre la fecundación (concepción)
