ADN polimerasa
| ADN polimerasa dirigida por ADN | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estructura 3D de los motivos hélice-giro-hélice de unión al ADN en la ADN polimerasa beta humana (basada en el archivo PDB 7ICG) | |||||||||
| Identificadores | |||||||||
| N.º CE | 2.7.7.7 | ||||||||
| N.º CAS | 9012-90-2 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista de IntEnz | ||||||||
| BRENDA | Entrada de BRENDA | ||||||||
| Expasí | Vista de NiceZyme | ||||||||
| BARRIL | Entrada de KEGG | ||||||||
| MetaCiclo | vía metabólica | ||||||||
| PRIAMO | perfil | ||||||||
| Estructuras del PDB | RCSB AP APBE APSUMA | ||||||||
| Ontología genética | AmiGO / QuickGO | ||||||||
| |||||||||
Una ADN polimerasa es un miembro de una familia de enzimas que catalizan la síntesis de moléculas de ADN a partir de trifosfatos de nucleósidos , los precursores moleculares del ADN. Estas enzimas son esenciales para la replicación del ADN y, por lo general, trabajan en grupos para crear dos dúplex de ADN idénticos a partir de un único dúplex de ADN original. Durante este proceso, la ADN polimerasa "lee" las cadenas de ADN existentes para crear dos nuevas cadenas que coincidan con las existentes. [1] [2] [3] [4] [5] [6] Estas enzimas catalizan la reacción química
- desoxinucleósido trifosfato + ADN n ⇌ pirofosfato + ADN n+1 .
La ADN polimerasa añade nucleótidos a los tres extremos principales (3') de una cadena de ADN, un nucleótido a la vez. Cada vez que una célula se divide , las ADN polimerasas deben duplicar el ADN de la célula, de modo que se pueda pasar una copia de la molécula de ADN original a cada célula hija. De esta manera, la información genética se transmite de generación en generación.
Antes de que pueda producirse la replicación, una enzima llamada helicasa desenrolla la molécula de ADN de su forma estrechamente entrelazada, rompiendo en el proceso los enlaces de hidrógeno entre las bases de los nucleótidos . Esto abre o "descomprime" el ADN bicatenario para dar lugar a dos cadenas simples de ADN que pueden utilizarse como plantillas para la replicación en la reacción anterior.
Historia
En 1956, Arthur Kornberg y sus colegas descubrieron la ADN polimerasa I (Pol I), en Escherichia coli . Describieron el proceso de replicación del ADN por el cual la ADN polimerasa copia la secuencia de bases de una cadena de ADN molde. Kornberg fue posteriormente galardonado con el Premio Nobel de Fisiología o Medicina en 1959 por este trabajo. [7] La ADN polimerasa II fue descubierta por Thomas Kornberg (el hijo de Arthur Kornberg ) y Malcolm E. Gefter en 1970 mientras elucidaban aún más el papel de la Pol I en la replicación del ADN de E. coli . [8] Se han encontrado tres ADN polimerasas más en E. coli , incluyendo la ADN polimerasa III (descubierta en la década de 1970) y las ADN polimerasas IV y V (descubiertas en 1999). [9] A partir de 1983 se empezaron a utilizar ADN polimerasas en la reacción en cadena de la polimerasa (PCR) y a partir de 1988 se empezaron a utilizar ADN polimerasas termoestables , ya que no es necesario añadirlas en cada ciclo de una PCR.
Función
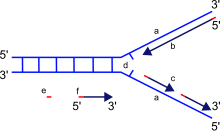

La función principal de la ADN polimerasa es sintetizar ADN a partir de desoxirribonucleótidos , los componentes básicos del ADN. Las copias de ADN se crean mediante el apareamiento de nucleótidos con bases presentes en cada hebra de la molécula de ADN original. Este apareamiento siempre se produce en combinaciones específicas, con citosina junto con guanina y timina junto con adenina , formando dos pares separados, respectivamente. Por el contrario, las ARN polimerasas sintetizan ARN a partir de ribonucleótidos, ya sea de ARN o de ADN. [ cita requerida ]
Al sintetizar ADN nuevo, la ADN polimerasa puede agregar nucleótidos libres solo al extremo 3' de la cadena que se está formando. Esto da como resultado una elongación de la cadena que se está formando en una dirección 5'–3'. [ cita requerida ]
Es importante señalar que la direccionalidad de la nueva hebra que se forma (la hebra hija) es opuesta a la dirección en la que la ADN polimerasa se mueve a lo largo de la hebra molde. Dado que la ADN polimerasa requiere un grupo OH 3' libre para iniciar la síntesis, puede sintetizar en una sola dirección al extender el extremo 3' de la cadena de nucleótidos preexistente. Por lo tanto, la ADN polimerasa se mueve a lo largo de la hebra molde en una dirección 3'–5', y la hebra hija se forma en una dirección 5'–3'. Esta diferencia permite que el ADN de doble hebra resultante formado esté compuesto de dos hebras de ADN que son antiparalelas entre sí. [ cita requerida ]
La función de la ADN polimerasa no es del todo perfecta, ya que la enzima comete aproximadamente un error por cada mil millones de pares de bases copiados. La corrección de errores es una propiedad de algunas, pero no de todas las ADN polimerasas. Este proceso corrige errores en el ADN recién sintetizado. Cuando se reconoce un par de bases incorrecto, la ADN polimerasa retrocede un par de bases de ADN. La actividad exonucleasa 3'–5' de la enzima permite extirpar el par de bases incorrecto (esta actividad se conoce como corrección de pruebas ). Después de la excisión de bases, la polimerasa puede volver a insertar la base correcta y la replicación puede continuar hacia adelante. Esto preserva la integridad de la cadena de ADN original que se transmite a las células hijas.
La fidelidad es muy importante en la replicación del ADN. Los desajustes en el apareamiento de bases del ADN pueden dar lugar a proteínas disfuncionales y provocar cáncer. Muchas polimerasas de ADN contienen un dominio de exonucleasa, que actúa detectando desajustes de pares de bases y, además, eliminando el nucleótido incorrecto para reemplazarlo por el correcto. [10] La forma y las interacciones que acomodan el par de bases de Watson y Crick son las que contribuyen principalmente a la detección o al error. Los enlaces de hidrógeno desempeñan un papel clave en la unión y la interacción de pares de bases. Se dice que la pérdida de una interacción, que se produce en un desajuste, desencadena un cambio en el equilibrio, para la unión del molde-cebador, de la polimerasa al dominio de la exonucleasa. Además, la incorporación de un nucleótido incorrecto provoca un retraso en la polimerización del ADN. Este retraso da tiempo para que el ADN se cambie del sitio de la polimerasa al sitio de la exonucleasa. Se producen diferentes cambios conformacionales y pérdida de interacción en diferentes desajustes. En un desajuste purina:pirimidina hay un desplazamiento de la pirimidina hacia el surco mayor y de la purina hacia el surco menor. En relación con la forma del bolsillo de unión de la ADN polimerasa, se producen choques estéricos entre la purina y los residuos en el surco menor, y la pirimidina pierde importantes interacciones de van der Waals y electrostáticas. [11] Los desajustes pirimidina:pirimidina y purina:purina presentan cambios menos notables ya que las bases se desplazan hacia el surco mayor y se experimenta menos impedimento estérico. Sin embargo, aunque los diferentes desajustes dan como resultado diferentes propiedades estéricas, la ADN polimerasa aún puede detectarlos y diferenciarlos de manera uniforme y mantener la fidelidad en la replicación del ADN. [12] La polimerización del ADN también es fundamental para muchos procesos de mutagénesis y se emplea ampliamente en biotecnologías.
Estructura
Las polimerasas de ADN conocidas tienen una estructura altamente conservada, lo que significa que sus subunidades catalíticas generales varían muy poco de una especie a otra, independientemente de las estructuras de sus dominios. Las estructuras conservadas suelen indicar funciones importantes e irreemplazables de la célula, cuyo mantenimiento proporciona ventajas evolutivas. La forma puede describirse como parecida a una mano derecha con dominios para el pulgar, los dedos y la palma. El dominio de la palma parece funcionar para catalizar la transferencia de grupos fosforilo en la reacción de transferencia de fosforilo. El ADN se une a la palma cuando la enzima está activa. Se cree que esta reacción está catalizada por un mecanismo de dos iones metálicos. El dominio del dedo funciona para unir los trifosfatos de nucleósidos con la base de la plantilla. El dominio del pulgar desempeña un papel potencial en la procesividad, la translocación y el posicionamiento del ADN. [13]
Procesividad
La rápida catálisis de la ADN polimerasa se debe a su naturaleza procesiva. La procesividad es una característica de las enzimas que funcionan en sustratos poliméricos. En el caso de la ADN polimerasa, el grado de procesividad se refiere al número promedio de nucleótidos añadidos cada vez que la enzima se une a una plantilla. La ADN polimerasa promedio requiere aproximadamente un segundo para localizar y unir una unión cebador/plantilla. Una vez que se une, una ADN polimerasa no procesiva añade nucleótidos a una velocidad de un nucleótido por segundo. [14] : 207–208 Sin embargo, las ADN polimerasas procesivas añaden múltiples nucleótidos por segundo, lo que aumenta drásticamente la velocidad de síntesis de ADN. El grado de procesividad es directamente proporcional a la velocidad de síntesis de ADN. La velocidad de síntesis de ADN en una célula viva se determinó por primera vez como la velocidad de elongación del ADN del fago T4 en E. coli infectada con fagos . Durante el período de aumento exponencial del ADN a 37 °C, la velocidad fue de 749 nucleótidos por segundo. [15]
La capacidad de la ADN polimerasa de deslizarse a lo largo de la plantilla de ADN permite una mayor procesividad. Hay un aumento dramático de la procesividad en la horquilla de replicación . Este aumento se ve facilitado por la asociación de la ADN polimerasa con proteínas conocidas como abrazadera deslizante de ADN . Las abrazaderas son múltiples subunidades proteicas asociadas en forma de anillo. Usando la hidrólisis de ATP, una clase de proteínas conocidas como proteínas de carga de abrazadera deslizante abren la estructura de anillo de las abrazaderas deslizantes de ADN permitiendo la unión y liberación de la cadena de ADN. La interacción proteína-proteína con la abrazadera evita que la ADN polimerasa se difunda desde la plantilla de ADN, asegurando así que la enzima se una a la misma unión cebador/plantilla y continúe la replicación. [14] : 207–208 La ADN polimerasa cambia la conformación, aumentando la afinidad con la abrazadera cuando se asocia con ella y disminuyendo la afinidad cuando completa la replicación de un tramo de ADN para permitir la liberación de la abrazadera. [ cita requerida ]
La procesividad de la ADN polimerasa se ha estudiado con experimentos in vitro de moléculas individuales (es decir, pinzas ópticas y pinzas magnéticas ) que han revelado las sinergias entre las ADN polimerasas y otras moléculas del replisoma ( helicasas y SSB ) y con la horquilla de replicación del ADN. [16] Estos resultados han llevado al desarrollo de modelos cinéticos sinérgicos para la replicación del ADN que describen el aumento resultante de la procesividad de la ADN polimerasa. [16]
Variación entre especies
| Familia A de la ADN polimerasa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Par c:o6-metil-guanina en la posición del par de bases de la polimerasa-2 | |||||||||
| Identificadores | |||||||||
| Símbolo | ADN_pol_A | ||||||||
| Pfam | PF00476 | ||||||||
| Interprofesional | IPR001098 | ||||||||
| ELEGANTE | - | ||||||||
| PROSITIO | PDOC00412 | ||||||||
| SCOP2 | 1dpi / ALCANCE / SUPFAM | ||||||||
| |||||||||
| Familia B de la ADN polimerasa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estructura cristalina de rb69 gp43 en complejo con ADN que contiene timina glicol | |||||||||
| Identificadores | |||||||||
| Símbolo | ADN_pol_B | ||||||||
| Pfam | PF00136 | ||||||||
| Clan Pfam | CL0194 | ||||||||
| Interprofesional | IPR006134 | ||||||||
| PROSITIO | PDOC00107 | ||||||||
| SCOP2 | 1noy / ALCANCE / SUPFAM | ||||||||
| |||||||||
| ADN polimerasa tipo B, organelar y viral | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 ADN polimerasa phi29, forma cristalina ortorrómbica, complejo ssdna | |||||||||
| Identificadores | |||||||||
| Símbolo | ADN_pol_B_2 | ||||||||
| Pfam | PF03175 | ||||||||
| Clan Pfam | CL0194 | ||||||||
| Interprofesional | IPR004868 | ||||||||
| |||||||||
Según la homología de secuencia, las ADN polimerasas se pueden subdividir en siete familias diferentes: A, B, C, D, X, Y y RT.
Algunos virus también codifican ADN polimerasas especiales, como la ADN polimerasa del virus de la hepatitis B. Estas pueden replicar selectivamente el ADN viral a través de una variedad de mecanismos. Los retrovirus codifican una ADN polimerasa inusual llamada transcriptasa inversa , que es una ADN polimerasa dependiente de ARN (RdDp). Polimeriza el ADN a partir de una plantilla de ARN .
| Familia [17] | Tipos de ADN polimerasa | Taxones | Ejemplos | Característica |
|---|---|---|---|---|
| A | Polimerasas replicativas y reparadoras | Eucariota y procariota | ADN polimerasa T7, Pol I, Pol γ, θ y ν | Dos dominios de exonucleasa (3'-5' y 5'-3') |
| B | Polimerasas replicativas y reparadoras | Eucariota y procariota | Pol II, Pol B, Pol ζ, Pol α, δ y ε | Exonucleasa 3'-5 (corrección de pruebas); algunas polimerasas virales utilizan cebadores de proteínas |
| do | Polimerasas replicativas | Procariota | Política III | Exonucleasa 3'-5 (corrección de pruebas) |
| D | Polimerasas replicativas | Euryarchaeota | PolD (heterodímero DP1/DP2) [18] | Sin característica de "mano", de doble barril, similar a la ARN polimerasa ; exonucleasa 3'-5 (corrección de pruebas) |
| incógnita | Polimerasas replicativas y reparadoras | Eucariota | Pol β, Pol σ, Pol λ, Pol μ y desoxinucleotidil transferasa terminal | plantilla opcional; fosfatasa 5' (solo Pol β); característica de "mano" débil |
| Y | Polimerasas replicativas y reparadoras | Eucariota y procariota | Pol ι, Pol κ, Pol η, [19] Pol IV y Pol V | Síntesis de translesión [20] |
| R.O. | Polimerasas replicativas y reparadoras | Virus, retrovirus y eucariotas | Telomerasa , virus de la hepatitis B | Dependiente de ARN |
Polimerasa procariota
Las polimerasas procariotas existen en dos formas: la polimerasa central y la holoenzima. La polimerasa central sintetiza ADN a partir de la plantilla de ADN, pero no puede iniciar la síntesis sola o con precisión. La holoenzima inicia la síntesis con precisión.
Policía I
Las polimerasas de la familia A de los procariotas incluyen la enzima ADN polimerasa I (Pol I), que está codificada por el gen polA y es ubicua entre los procariotas . Esta polimerasa reparadora está involucrada en la reparación por escisión con actividad exonucleasa 3'–5' y 5'–3' y en el procesamiento de fragmentos de Okazaki generados durante la síntesis de la cadena rezagada. [21] La Pol I es la polimerasa más abundante, y representa >95% de la actividad polimerasa en E. coli ; sin embargo, se han encontrado células que carecen de Pol I, lo que sugiere que la actividad de Pol I puede ser reemplazada por las otras cuatro polimerasas. La Pol I agrega ~15-20 nucleótidos por segundo, lo que muestra una procesividad deficiente. En cambio, la Pol I comienza a agregar nucleótidos en la unión del cebador:molde del ARN conocida como el origen de replicación (ori). Aproximadamente 400 pb aguas abajo del origen, la holoenzima Pol III se ensambla y se hace cargo de la replicación a una velocidad y naturaleza altamente procesivas. [22]
La polimerasa Taq es una enzima termoestable de esta familia que carece de capacidad de corrección. [23]
Política II
La ADN polimerasa II es una polimerasa de la familia B codificada por el gen polB. La pol II tiene actividad exonucleasa 3'–5' y participa en la reparación del ADN , el reinicio de la replicación para evitar lesiones, y su presencia celular puede aumentar de ~30-50 copias por célula a ~200–300 durante la inducción de SOS. También se cree que la pol II es un respaldo de la pol III, ya que puede interactuar con proteínas holoenzimáticas y asumir un alto nivel de procesividad. Se cree que el papel principal de la pol II es la capacidad de dirigir la actividad de la polimerasa en la horquilla de replicación y ayudar a la pol III estancada a evitar los desajustes terminales. [24]
La ADN polimerasa Pfu es una enzima termoestable de esta familia que se encuentra en la arquea hipertermófila Pyrococcus furiosus . [25] La clasificación detallada divide a la familia B en arqueas en B1, B2, B3, en la que B2 es un grupo de pseudoenzimas . Pfu pertenece a la familia B3. Otras PolB que se encuentran en arqueas son parte de los "Casposones", transposones dependientes de Cas1 . [26] Algunos virus (incluida la ADN polimerasa Φ29 ) y plásmidos mitocondriales también portan polB. [27]
Política III
La holoenzima ADN polimerasa III es la enzima principal implicada en la replicación del ADN en E. coli y pertenece a la familia C de las polimerasas. Consta de tres conjuntos: el núcleo de la pol III, el factor de procesividad de la abrazadera deslizante beta y el complejo de carga de la abrazadera. El núcleo consta de tres subunidades: α, el centro de actividad de la polimerasa, ɛ, corrector exonucleolítico, y θ, que puede actuar como estabilizador para ɛ. El factor de procesividad de la abrazadera deslizante beta también está presente por duplicado, uno para cada núcleo, para crear una abrazadera que encierra el ADN, lo que permite una alta procesividad. [28] El tercer conjunto es un complejo de carga de abrazadera de siete subunidades (τ2γδδ ′ χψ).
El viejo libro de texto "modelo de trombón" describe un complejo de elongación con dos equivalentes de la enzima central en cada horquilla de replicación (RF), uno para cada cadena, la rezagada y la líder. [24] Sin embargo, evidencia reciente de estudios de moléculas individuales indica un promedio de tres equivalentes estequiométricos de enzima central en cada RF tanto para Pol III como para su contraparte en B. subtilis, PolC. [29] La microscopía fluorescente en células ha revelado que la síntesis de la cadena líder puede no ser completamente continua, y Pol III* (es decir, las subunidades α, ε, τ, δ y χ de la holoenzima sin la abrazadera deslizante ß2) tiene una alta frecuencia de disociación de las RF activas. [30] En estos estudios, la tasa de recambio de la horquilla de replicación fue de aproximadamente 10 s para Pol III*, 47 s para la abrazadera deslizante ß2 y 15 m para la helicasa DnaB. Esto sugiere que la helicasa DnaB puede permanecer asociada de manera estable a los RF y servir como punto de nucleación para la holoenzima competente. Estudios in vitro de moléculas individuales han demostrado que Pol III* tiene una alta tasa de recambio de RF cuando está en exceso, pero permanece asociada de manera estable con las horquillas de replicación cuando la concentración es limitante. [30] Otro estudio de moléculas individuales mostró que la actividad de la helicasa DnaB y la elongación de la cadena pueden proceder con una cinética estocástica desacoplada. [30]
Política IV
En E. coli , la ADN polimerasa IV (Pol IV) es una ADN polimerasa propensa a errores que participa en la mutagénesis no dirigida. [31] La Pol IV es una polimerasa de la Familia Y expresada por el gen dinB que se activa mediante la inducción de SOS causada por polimerasas estancadas en la horquilla de replicación. Durante la inducción de SOS, la producción de Pol IV se incrementa diez veces y una de las funciones durante este tiempo es interferir con la procesividad de la holoenzima Pol III. Esto crea un punto de control, detiene la replicación y da tiempo para reparar las lesiones del ADN a través de la vía de reparación adecuada. [32] Otra función de la Pol IV es realizar la síntesis de translesión en la horquilla de replicación estancada como, por ejemplo, eludiendo los aductos de N2-desoxiguanina a un ritmo más rápido que atravesando el ADN no dañado. Las células que carecen del gen dinB tienen una mayor tasa de mutagénesis causada por agentes que dañan el ADN. [33]
Pol V
La ADN polimerasa V (Pol V) es una ADN polimerasa de la familia Y que está involucrada en la respuesta SOS y en los mecanismos de reparación del ADN de síntesis translesión . [34] La transcripción de Pol V a través de los genes umuDC está altamente regulada para producir solo Pol V cuando hay ADN dañado presente en la célula que genera una respuesta SOS. Las polimerasas estancadas hacen que RecA se una al ssDNA, lo que hace que la proteína LexA se autodigiera. LexA luego pierde su capacidad de reprimir la transcripción del operón umuDC. La misma nucleoproteína RecA-ssDNA modifica postraduccionalmente la proteína UmuD en la proteína UmuD'. UmuD y UmuD' forman un heterodímero que interactúa con UmuC, que a su vez activa la actividad catalítica de la polimerasa de umuC en el ADN dañado. [35] En E. coli , se ha propuesto un modelo de "cinturón de herramientas" de polimerasa para cambiar la pol III por la pol IV en una horquilla de replicación bloqueada, donde ambas polimerasas se unen simultáneamente a la pinza β. [36] Sin embargo, la participación de más de una polimerasa TLS trabajando en sucesión para evitar una lesión aún no se ha demostrado en E. coli . Además, la Pol IV puede catalizar tanto la inserción como la extensión con alta eficiencia, mientras que la pol V se considera la principal polimerasa SOS TLS. Un ejemplo es la omisión del enlace cruzado intracatenario de guanina-timina, donde se demostró sobre la base de la diferencia en las firmas mutacionales de las dos polimerasas, que la pol IV y la pol V compiten por TLS del enlace cruzado intracatenario. [36]
Familia D

En 1998, la familia D de la ADN polimerasa fue descubierta en Pyrococcus furiosus y Methanococcus jannaschii . [38] El complejo PolD es un heterodímero de dos cadenas, cada una codificada por DP1 (corrección de pruebas pequeña) y DP2 (catalítica grande). A diferencia de otras ADN polimerasas, la estructura y el mecanismo del núcleo catalítico DP2 se asemejan a los de las ARN polimerasas de múltiples subunidades . La interfaz DP1-DP2 se asemeja a la del dedo de zinc de la polimerasa de clase B eucariota y su subunidad pequeña. [18] DP1, una exonucleasa similar a Mre11 , [39] es probablemente el precursor de la subunidad pequeña de Pol α y ε , proporcionando capacidades de corrección de pruebas ahora perdidas en eucariotas. [26] Su dominio HSH N-terminal es similar a las proteínas AAA , especialmente la subunidad δ de Pol III y RuvB , en estructura. [40] DP2 tiene un dominio KH de clase II . [18] La polD de Pyrococcus abyssi es más estable al calor y más precisa que la polimerasa Taq , pero aún no se ha comercializado. [41] Se ha propuesto que la ADN polimerasa de la familia D fue la primera en evolucionar en organismos celulares y que la polimerasa replicativa del Último Ancestro Celular Universal (LUCA) pertenecía a la familia D. [42]
ADN polimerasa eucariota
Polimerasas β, λ, σ, μ (beta, lambda, sigma, mu) y TdT
Las polimerasas de la familia X contienen la conocida polimerasa eucariota pol β (beta) , así como otras polimerasas eucariotas como Pol σ (sigma), Pol λ (lambda) , Pol μ (mu) , y la desoxinucleotidil transferasa terminal (TdT) . Las polimerasas de la familia X se encuentran principalmente en vertebrados, y unas pocas se encuentran en plantas y hongos. Estas polimerasas tienen regiones altamente conservadas que incluyen dos motivos hélice-horquilla-hélice que son imperativos en las interacciones ADN-polimerasa. Un motivo se encuentra en el dominio de 8 kDa que interactúa con el ADN corriente abajo y un motivo se encuentra en el dominio pulgar que interactúa con la cadena del cebador. Pol β, codificada por el gen POLB, es necesaria para la reparación por escisión de bases de parche corto , una vía de reparación del ADN que es esencial para reparar bases alquiladas u oxidadas, así como sitios abásicos . Pol λ y Pol μ, codificadas por los genes POLL y POLM respectivamente, están involucradas en la unión de extremos no homólogos , un mecanismo para volver a unir las roturas de doble cadena de ADN debido al peróxido de hidrógeno y la radiación ionizante, respectivamente. TdT se expresa solo en el tejido linfoide y agrega "n nucleótidos" a las roturas de doble cadena formadas durante la recombinación V(D)J para promover la diversidad inmunológica. [43]
Polimerasas α, δ y ε (alfa, delta y épsilon)
Pol α (alfa) , Pol δ (delta) y Pol ε (épsilon) son miembros de la Familia B de las Polimerasas y son las principales polimerasas involucradas en la replicación nuclear del ADN. El complejo Pol α (complejo pol α-ADN primasa) consta de cuatro subunidades: la subunidad catalítica POLA1 , la subunidad reguladora POLA2 y las subunidades primasa pequeña y grande PRIM1 y PRIM2 respectivamente. Una vez que la primasa ha creado el cebador de ARN, Pol α comienza la replicación alargando el cebador con ~20 nucleótidos. [44] Debido a su alta procesividad, Pol δ se hace cargo de la síntesis de la cadena líder y rezagada de Pol α. [14] : 218–219 Pol δ es expresada por los genes POLD1 , creando la subunidad catalítica, POLD2 , POLD3 y POLD4 creando las otras subunidades que interactúan con el Antígeno Nuclear de Células Proliferativas (PCNA), que es una abrazadera de ADN que permite que Pol δ posea procesividad. [45] Pol ε es codificada por el gen POLE1 , la subunidad catalítica, POLE2 y POLE3 . Se ha informado que la función de Pol ε es extender la cadena líder durante la replicación, [46] [47] mientras que Pol δ replica principalmente la cadena rezagada; sin embargo, evidencia reciente sugirió que Pol δ también podría tener un papel en la replicación de la cadena líder de ADN. [48] Se cree que la región "reliquia de polimerasa" del extremo C de Pol ε, a pesar de ser innecesaria para la actividad de la polimerasa, [49] es esencial para la vitalidad celular. Se cree que la región C-terminal proporciona un punto de control antes de entrar en anafase, proporciona estabilidad a la holoenzima y agrega proteínas a la holoenzima necesarias para el inicio de la replicación. [50] Pol ε tiene un dominio de "palma" más grande que proporciona alta procesividad independientemente de PCNA. [49]
En comparación con otras polimerasas de la familia B, la familia de exonucleasas DEDD responsable de la corrección de pruebas está inactivada en Pol α. [26] Pol ε es única porque tiene dos dominios de dedos de zinc y una copia inactiva de otra polimerasa de la familia B en su C-terminal. La presencia de este dedo de zinc tiene implicaciones en los orígenes de Eukaryota, que en este caso se coloca en el grupo Asgard con la polimerasa B3 arqueal. [51]
Polimerasas η, ι y κ (eta, iota y kappa)
Pol η (eta) , Pol ι (iota) y Pol κ (kappa) son ADN polimerasas de la Familia Y implicadas en la reparación del ADN por síntesis de traducción y codificadas por los genes POLH, POLI y POLK respectivamente. Los miembros de la Familia Y tienen cinco motivos comunes para ayudar a unir el sustrato y el extremo del cebador y todos incluyen los dominios típicos del pulgar, la palma y los dedos de la mano derecha con dominios agregados como el dedo meñique (LF), el dominio asociado a la polimerasa (PAD) o la muñeca. Sin embargo, el sitio activo difiere entre los miembros de la familia debido a las diferentes lesiones que se reparan. Las polimerasas de la Familia Y son polimerasas de baja fidelidad, pero se ha demostrado que hacen más bien que mal, ya que las mutaciones que afectan a la polimerasa pueden causar varias enfermedades, como el cáncer de piel y la variante del xeroderma pigmentoso (XPS). La importancia de estas polimerasas se evidencia por el hecho de que el gen que codifica la ADN polimerasa η se conoce como XPV, porque la pérdida de este gen resulta en la enfermedad Xeroderma Pigmentosum Variant. Pol η es particularmente importante para permitir la síntesis translesional precisa del daño del ADN resultante de la radiación ultravioleta . La funcionalidad de Pol κ no se entiende completamente, pero los investigadores han encontrado dos funciones probables. Se cree que Pol κ actúa como un extensor o un insertador de una base específica en ciertas lesiones del ADN. Las tres polimerasas de síntesis translesional, junto con Rev1, son reclutadas a las lesiones dañadas a través de ADN polimerasas replicativas estancadas. Hay dos vías de reparación del daño que llevan a los investigadores a concluir que la vía elegida depende de qué cadena contiene el daño, la cadena líder o la rezagada. [52]
Polimerasas Rev1 y ζ (zeta)
Pol ζ otra polimerasa de la familia B, está formada por dos subunidades Rev3 , la subunidad catalítica, y Rev7 ( MAD2L2 ), que aumenta la función catalítica de la polimerasa, y está implicada en la síntesis translesión. Pol ζ carece de actividad exonucleasa 3' a 5', es única en el sentido de que puede extender cebadores con desajustes terminales. Rev1 tiene tres regiones de interés en el dominio BRCT , el dominio de unión a la ubiquitina y el dominio C-terminal y tiene capacidad de transferasa dCMP, que añade desoxicitidina a las lesiones opuestas que detendrían las polimerasas replicativas Pol δ y Pol ε. Estas polimerasas detenidas activan los complejos de ubiquitina que a su vez disocian las polimerasas de replicación y reclutan a Pol ζ y Rev1. Juntos, Pol ζ y Rev1 añaden desoxicitidina y Pol ζ se extiende más allá de la lesión. A través de un proceso aún no determinado, la Pol ζ se disocia y las polimerasas de replicación se vuelven a asociar y continúan la replicación. La Pol ζ y Rev1 no son necesarias para la replicación, pero la pérdida del gen REV3 en la levadura en ciernes puede causar una mayor sensibilidad a los agentes que dañan el ADN debido al colapso de las horquillas de replicación donde las polimerasas de replicación se han estancado. [53]
Telomerasa
La telomerasa es una ribonucleoproteína que funciona para replicar los extremos de los cromosomas lineales, ya que la ADN polimerasa normal no puede replicar los extremos o telómeros . El saliente 3' de cadena simple del cromosoma de doble cadena con la secuencia 5'-TTAGGG-3' recluta a la telomerasa. La telomerasa actúa como otras ADN polimerasas al extender el extremo 3', pero, a diferencia de otras ADN polimerasas, la telomerasa no requiere una plantilla. La subunidad TERT, un ejemplo de una transcriptasa inversa , utiliza la subunidad de ARN para formar la unión cebador-plantilla que permite a la telomerasa extender el extremo 3' de los extremos de los cromosomas. Se cree que la disminución gradual del tamaño de los telómeros como resultado de muchas replicaciones a lo largo de la vida está asociada con los efectos del envejecimiento. [14] : 248–249
Polimerasas γ, θ y ν (gamma, theta y nu)
Pol γ (gamma), Pol θ (theta) y Pol ν (nu) son polimerasas de la Familia A. Durante mucho tiempo se pensó que Pol γ, codificada por el gen POLG , era la única polimerasa mitocondrial . Sin embargo, investigaciones recientes muestran que al menos Pol β (beta) , una polimerasa de la Familia X, también está presente en las mitocondrias. [54] [55] Cualquier mutación que conduzca a una Pol γ limitada o no funcional tiene un efecto significativo en el ADNmt y es la causa más común de trastornos mitocondriales hereditarios autosómicos. [56] Pol γ contiene un dominio de polimerasa C-terminal y un dominio de exonucleasa 3'–5' N-terminal que están conectados a través de la región de enlace, que se une a la subunidad accesoria. La subunidad accesoria se une al ADN y es necesaria para la procesividad de Pol γ. La mutación puntual A467T en la región de enlace es responsable de más de un tercio de todos los trastornos mitocondriales asociados a Pol γ. [57] Si bien muchos homólogos de Pol θ, codificados por el gen POLQ , se encuentran en eucariotas, su función no se entiende claramente. La secuencia de aminoácidos en el extremo C es lo que clasifica a Pol θ como polimerasa de la Familia A, aunque la tasa de error para Pol θ está más relacionada con las polimerasas de la Familia Y. Pol θ extiende los extremos de cebadores no coincidentes y puede eludir los sitios abásicos agregando un nucleótido. También tiene actividad de desoxirribofosfodiesterasa (dRPasa) en el dominio de la polimerasa y puede mostrar actividad ATPasa en estrecha proximidad al ssDNA. [58] Pol ν (nu) se considera la menos efectiva de las enzimas polimerasas. [59] Sin embargo, la ADN polimerasa nu juega un papel activo en la reparación de la homología durante las respuestas celulares a los enlaces cruzados, cumpliendo su función en un complejo con la helicasa . [59]
Las plantas utilizan dos polimerasas de la Familia A para copiar los genomas mitocondriales y plastídicos. Son más similares a la Pol I bacteriana que a la Pol γ de los mamíferos. [60]
Transcriptasa inversa
Los retrovirus codifican una ADN polimerasa inusual llamada transcriptasa inversa , que es una ADN polimerasa dependiente de ARN (RdDp) que sintetiza ADN a partir de una plantilla de ARN. La familia de la transcriptasa inversa contiene tanto la funcionalidad de la ADN polimerasa como la funcionalidad de la ARNasa H, que degrada el ARN apareado en bases a ADN. Un ejemplo de un retrovirus es el VIH . [14] La transcriptasa inversa se emplea comúnmente en la amplificación de ARN con fines de investigación. Usando una plantilla de ARN, la PCR puede utilizar la transcriptasa inversa, creando una plantilla de ADN. Esta nueva plantilla de ADN puede luego usarse para la amplificación típica de PCR. Los productos de dicho experimento son, por lo tanto, productos de PCR amplificados a partir del ARN. [9]
Cada partícula del retrovirus del VIH contiene dos genomas de ARN , pero, después de una infección, cada virus genera solo un provirus . [61] Después de la infección, la transcripción inversa se acompaña de un cambio de plantilla entre las dos copias del genoma (recombinación por elección de copia). [61] En cada ciclo de replicación ocurren de 5 a 14 eventos de recombinación por genoma. [62] El cambio de plantilla (recombinación) parece ser necesario para mantener la integridad del genoma y como mecanismo de reparación para salvar genomas dañados. [63] [61]
ADN polimerasa del bacteriófago T4
El bacteriófago (fago) T4 codifica una ADN polimerasa que cataliza la síntesis de ADN en una dirección de 5' a 3'. [64] La polimerasa del fago también tiene una actividad de exonucleasa que actúa en una dirección de 3' a 5', [65] y esta actividad se emplea en la corrección y edición de bases recién insertadas. [66] Se observó que un mutante de fago con una ADN polimerasa sensible a la temperatura , cuando se cultiva a temperaturas permisivas, experimenta recombinación a frecuencias que son aproximadamente dos veces más altas que las del fago de tipo salvaje. [67]
Se propuso que una alteración mutacional en la ADN polimerasa del fago puede estimular el cambio de cadena molde (recombinación de elección de copia) durante la replicación . [67]
Véase también
- Máquinas biológicas
- Secuenciación de ADN
- Catálisis enzimática
- Recombinación genética
- Clonación molecular
- Reacción en cadena de la polimerasa
- Dinámica de dominios proteicos
- Transcripción inversa
- ARN polimerasa
- Taq ADN polimerasa
Referencias
- ^ Bollum FJ (agosto de 1960). "Polimerasa del timo de ternera". Revista de química biológica . 235 (8): 2399–2403. doi : 10.1016/S0021-9258(18)64634-4 . PMID 13802334.
- ^ Falaschi A, Kornberg A (abril de 1966). "Estudios bioquímicos de la esporulación bacteriana. II. Ácido desoxirribonucleico polimerasa en esporas de Bacillus subtilis". The Journal of Biological Chemistry . 241 (7): 1478–1482. doi : 10.1016/S0021-9258(18)96736-0 . PMID 4957767.
- ^ Lehman IR, Bessman MJ, Simms ES, Kornberg A (julio de 1958). "Síntesis enzimática del ácido desoxirribonucleico. I. Preparación de sustratos y purificación parcial de una enzima de Escherichia coli". Revista de química biológica . 233 (1): 163–170. doi : 10.1016/S0021-9258(19)68048-8 . PMID 13563462.
- ^ Richardson CC, Schildkraut CL, Aposhian HV, Kornberg A (enero de 1964). "Síntesis enzimática del ácido desoxirribonucleico. XIV. Purificación adicional y propiedades de la polimerasa del ácido desoxirribonucleico de Escherichia coli". The Journal of Biological Chemistry . 239 : 222–232. doi : 10.1016/S0021-9258(18)51772-5 . PMID 14114848.
- ^ Schachman HK, Adler J, Radding CM, Lehman IR, Kornberg A (noviembre de 1960). "Síntesis enzimática del ácido desoxirribonucleico. VII. Síntesis de un polímero de desoxiadenilato y desoxitimidilato". The Journal of Biological Chemistry . 235 (11): 3242–3249. doi : 10.1016/S0021-9258(20)81345-3 . PMID 13747134.
- ^ Zimmerman BK (mayo de 1966). "Purificación y propiedades de la polimerasa del ácido desoxirribonucleico de Micrococcus lysodeikticus". Revista de química biológica . 241 (9): 2035–2041. doi : 10.1016/S0021-9258(18)96662-7 . PMID 5946628.
- ^ "El Premio Nobel de Fisiología o Medicina 1959". Fundación Nobel . Consultado el 1 de diciembre de 2012 .
- ^ Tessman I, Kennedy MA (febrero de 1994). "ADN polimerasa II de Escherichia coli en la omisión de sitios abásicos in vivo". Genética . 136 (2): 439–448. doi :10.1093/genetics/136.2.439. PMC 1205799 . PMID 7908652.
- ^ ab Lehninger AL, Cox MM, Nelson DL (2013). Principios de bioquímica de Lehninger (6.ª ed.). Nueva York: WH Freeman and Company. ISBN 978-1-4292-3414-6.OCLC 824794893 .
- ^ Garrett G (2013). Bioquímica . Mary Finch.
- ^ Hunter WN, Brown T, Anand NN, Kennard O (1986). "Estructura de un par de bases adenina-citosina en el ADN y sus implicaciones para la reparación de errores de emparejamiento". Nature . 320 (6062): 552–555. Bibcode :1986Natur.320..552H. doi :10.1038/320552a0. PMID 3960137. S2CID 4319887.
- ^ Swan MK, Johnson RE, Prakash L, Prakash S, Aggarwal AK (septiembre de 2009). "Base estructural de la síntesis de ADN de alta fidelidad por la ADN polimerasa delta de levadura". Nature Structural & Molecular Biology . 16 (9): 979–986. doi :10.1038/nsmb.1663. PMC 3055789 . PMID 19718023.
- ^ Steitz TA (junio de 1999). "ADN polimerasas: diversidad estructural y mecanismos comunes". The Journal of Biological Chemistry . 274 (25): 17395–17398. doi : 10.1074/jbc.274.25.17395 . PMID 10364165.
- ^ abcde Losick R, Watson JD, Baker TA, Bell S, Gann A, Levine MW (2008). Biología molecular del gen (6ª ed.). San Francisco: Pearson/Benjamin Cummings. ISBN 978-0-8053-9592-1.
- ^ McCarthy D, Minner C, Bernstein H, Bernstein C (octubre de 1976). "Tasas de elongación del ADN y distribuciones de puntos de crecimiento del fago T4 de tipo salvaje y un mutante ámbar con retraso del ADN". Journal of Molecular Biology . 106 (4): 963–981. doi :10.1016/0022-2836(76)90346-6. PMID 789903.
- ^ ab Jarillo J, Ibarra B, Cao-García FJ (2021). "Replicación de ADN: análisis de datos y modelos de manipulación de moléculas individuales in vitro". Revista de biotecnología estructural y computacional . 19 : 3765–3778. doi :10.1016/j.csbj.2021.06.032. PMC 8267548 . PMID 34285777.
- ^ Filée J, Forterre P, Sen-Lin T, Laurent J (junio de 2002). "Evolución de las familias de polimerasas de ADN: evidencias de intercambio múltiple de genes entre proteínas celulares y virales" (PDF) . Journal of Molecular Evolution . 54 (6): 763–773. Bibcode :2002JMolE..54..763F. CiteSeerX 10.1.1.327.4738 . doi :10.1007/s00239-001-0078-x. PMID 12029358. S2CID 15852365. Archivado desde el original (PDF) el 29 de julio de 2020 . Consultado el 23 de septiembre de 2019 .
- ^ abc Raia P, Carroni M, Henry E, Pehau-Arnaudet G, Brûlé S, Béguin P, et al. (enero de 2019). "Estructura del complejo DP1-DP2 PolD unido al ADN y sus implicaciones para la historia evolutiva de las polimerasas de ADN y ARN". PLOS Biology . 17 (1): e3000122. doi : 10.1371/journal.pbio.3000122 . PMC 6355029 . PMID 30657780.
- ^ Boehm EM, Powers KT, Kondratick CM, Spies M, Houtman JC, Washington MT (abril de 2016). "El motivo de la proteína que interactúa con el antígeno nuclear de células proliferantes (PCNA) de la ADN polimerasa η media su interacción con el dominio C-terminal de Rev1". The Journal of Biological Chemistry . 291 (16): 8735–8744. doi : 10.1074/jbc.M115.697938 . PMC 4861442 . PMID 26903512.
- ^ Yang W (mayo de 2014). "Una descripción general de las ADN polimerasas de la familia Y y un estudio de caso de la ADN polimerasa humana η". Bioquímica . 53 (17): 2793–2803. doi :10.1021/bi500019s. PMC 4018060 . PMID 24716551.
- ^ Maga G, Hubscher U, Spadari S, Villani G (2010). ADN polimerasas: descubrimiento, funciones de caracterización en transacciones de ADN celular . World Scientific Publishing Company. ISBN 978-981-4299-16-9.
- ^ Choi CH, Burton ZF, Usheva A (febrero de 2004). "Autoacetilación de factores de transcripción como mecanismo de control en la expresión génica". Ciclo celular . 3 (2): 114–115. doi : 10.4161/cc.3.2.651 . PMID 14712067.
- ^ Chien A, Edgar DB, Trela JM (septiembre de 1976). "Polimerasa del ácido desoxirribonucleico del termófilo extremo Thermus aquaticus". Journal of Bacteriology . 127 (3): 1550–1557. doi :10.1128/JB.127.3.1550-1557.1976. PMC 232952 . PMID 8432.
- ^ ab Banach-Orlowska M, Fijalkowska IJ, Schaaper RM, Jonczyk P (octubre de 2005). "ADN polimerasa II como factor de fidelidad en la síntesis de ADN cromosómico en Escherichia coli". Microbiología Molecular . 58 (1): 61–70. doi : 10.1111/j.1365-2958.2005.04805.x . PMID 16164549. S2CID 12002486.
- ^ Vista de proteína InterPro: P61875
- ^ abc Makarova KS, Krupovic M, Koonin EV (2014). "Evolución de las polimerasas de ADN replicativas en arqueas y sus contribuciones a la maquinaria de replicación eucariota". Frontiers in Microbiology . 5 : 354. doi : 10.3389/fmicb.2014.00354 . PMC 4104785 . PMID 25101062.
- ^ Rohe M, Schrage K, Meinhardt F (diciembre de 1991). "El plásmido lineal pMC3-2 de Morchella conica está estructuralmente relacionado con los adenovirus". Current Genetics . 20 (6): 527–533. doi :10.1007/BF00334782. PMID 1782679. S2CID 35072924.
- ^ Olson MW, Dallmann HG, McHenry CS (diciembre de 1995). "Complejo DnaX de la holoenzima de la ADN polimerasa III de Escherichia coli. El complejo chi psi funciona aumentando la afinidad de tau y gamma por delta.delta' hasta un rango fisiológicamente relevante". The Journal of Biological Chemistry . 270 (49): 29570–29577. doi : 10.1074/jbc.270.49.29570 . PMID 7494000.
- ^ Liao Y, Li Y, Schroeder JW, Simmons LA, Biteen JS (diciembre de 2016). "Dinámica de la ADN polimerasa de una sola molécula en un replicasoma bacteriano en células vivas". Revista Biofísica . 111 (12): 2562–2569. Código Bib : 2016BpJ...111.2562L. doi :10.1016/j.bpj.2016.11.006. PMC 5192695 . PMID 28002733.
- ^ abc Xu ZQ, Dixon NE (diciembre de 2018). "Replisomas bacterianos". Current Opinion in Structural Biology . 53 : 159–168. doi : 10.1016/j.sbi.2018.09.006 . PMID 30292863.
- ^ Goodman MF (2002). "ADN polimerasas de reparación propensas a errores en procariotas y eucariotas". Revisión anual de bioquímica . 71 : 17–50. doi :10.1146/annurev.biochem.71.083101.124707. PMID 12045089. S2CID 1979429.
- ^ Mori T, Nakamura T, Okazaki N, Furukohri A, Maki H, Akiyama MT (2012). "Escherichia coli DinB inhibe la progresión de la horquilla de replicación sin inducir significativamente la respuesta SOS". Genes & Genetic Systems . 87 (2): 75–87. doi : 10.1266/ggs.87.75 . PMID 22820381.
- ^ Jarosz DF, Godoy VG, Walker GC (abril de 2007). "Evitación eficiente y precisa de lesiones persistentes del ADN por las polimerasas de ADN DinB". Cell Cycle . 6 (7): 817–822. doi : 10.4161/cc.6.7.4065 . PMID 17377496.
- ^ Patel M, Jiang Q, Woodgate R, Cox MM, Goodman MF (junio de 2010). "Un nuevo modelo para la mutagénesis inducida por SOS: cómo la proteína RecA activa la ADN polimerasa V". Critical Reviews in Biochemistry and Molecular Biology . 45 (3): 171–184. doi :10.3109/10409238.2010.480968. PMC 2874081 . PMID 20441441.
- ^ Sutton MD, Walker GC (julio de 2001). "Manejo de las polimerasas de ADN: coordinación de la replicación, reparación y recombinación del ADN". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 98 (15): 8342–8349. Bibcode :2001PNAS...98.8342S. doi : 10.1073/pnas.111036998 . PMC 37441 . PMID 11459973.
- ^ ab Raychaudhury P, Basu AK (marzo de 2011). "Requisito genético para la mutagénesis del enlace cruzado G[8,5-Me]T en Escherichia coli: las ADN polimerasas IV y V compiten por la derivación propensa a errores". Bioquímica . 50 (12): 2330–2338. doi :10.1021/bi102064z. PMC 3062377 . PMID 21302943.
- ^ Madru C, Henneke G, Raia P, Hugonneau-Beaufet I, Pehau-Arnaudet G, England P, et al. (marzo de 2020). "Base estructural para la mayor procesividad de las ADN polimerasas de la familia D en complejos con PCNA". Nature Communications . 11 (1): 1591. Bibcode :2020NatCo..11.1591M. doi : 10.1038/s41467-020-15392-9 . PMC 7101311 . PMID 32221299.
- ^ Ishino Y, Komori K, Cann IK, Koga Y (abril de 1998). "Una nueva familia de polimerasas de ADN encontrada en Archaea". Journal of Bacteriology . 180 (8): 2232–2236. doi :10.1128/JB.180.8.2232-2236.1998. PMC 107154 . PMID 9555910.
- ^ Sauguet L, Raia P, Henneke G, Delarue M (2016). "Arquitectura de sitio activo compartido entre PolD arqueal y polimerasas de ARN multisubunitarias revelada por cristalografía de rayos X". Nature Communications . 7 : 12227. Bibcode :2016NatCo...712227S. doi :10.1038/ncomms12227. PMC 4996933 . PMID 27548043.
- ^ Yamasaki K, Urushibata Y, Yamasaki T, Arisaka F, Matsui I (agosto de 2010). "La estructura de la solución del dominio N-terminal de la subunidad pequeña de la ADN polimerasa de la familia D de las arqueas revela una relación evolutiva con las polimerasas de la familia B de las eucariotas". FEBS Letters . 584 (15): 3370–3375. doi : 10.1016/j.febslet.2010.06.026 . PMID 20598295. S2CID 11229530.
- ^ Ishino S, Ishino Y (2014). "Las polimerasas de ADN como reactivos útiles para la biotecnología: la historia de la investigación de desarrollo en el campo". Frontiers in Microbiology . 5 : 465. doi : 10.3389/fmicb.2014.00465 . PMC 4148896 . PMID 25221550.
- ^ Koonin EV, Krupovic M, Ishino S, Ishino Y (junio de 2020). "La maquinaria de replicación de LUCA: origen común de la replicación y transcripción del ADN". BMC Biology . 18 (1): 61. doi : 10.1186/s12915-020-00800-9 . PMC 7281927 . PMID 32517760.
- ^ Yamtich J, Sweasy JB (mayo de 2010). "Familia X de la ADN polimerasa: función, estructura y roles celulares". Biochimica et Biophysica Acta (BBA) - Proteínas y proteómica . 1804 (5): 1136–1150. doi :10.1016/j.bbapap.2009.07.008. PMC 2846199. PMID 19631767 .
- ^ Chansky ML, Marks A, Peet A (2012). Marks' Basic Medical Biochemistry: a clinical approach (4.ª ed.). Filadelfia: Wolter Kluwer Health/Lippincott Williams & Wilkins. pág. capítulo 13. ISBN 978-1608315727.
- ^ Chung DW, Zhang JA, Tan CK, Davie EW, So AG, Downey KM (diciembre de 1991). "Estructura primaria de la subunidad catalítica de la ADN polimerasa delta humana y localización cromosómica del gen". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 88 (24): 11197–11201. Bibcode :1991PNAS...8811197C. doi : 10.1073/pnas.88.24.11197 . PMC 53101 . PMID 1722322.
- ^ Pursell ZF, Isoz I, Lundström EB, Johansson E, Kunkel TA (julio de 2007). "La ADN polimerasa épsilon de la levadura participa en la replicación de la cadena principal del ADN". Science . 317 (5834): 127–130. Bibcode :2007Sci...317..127P. doi :10.1126/science.1144067. PMC 2233713 . PMID 17615360.
- ^ Lujan SA, Williams JS, Kunkel TA (septiembre de 2016). "Las polimerasas de ADN dividen el trabajo de replicación del genoma". Tendencias en biología celular . 26 (9): 640–654. doi :10.1016/j.tcb.2016.04.012. PMC 4993630 . PMID 27262731.
- ^ Johnson RE, Klassen R, Prakash L, Prakash S (julio de 2015). "Un papel importante de la ADN polimerasa δ en la replicación de las cadenas de ADN líder y rezagada". Molecular Cell . 59 (2): 163–175. doi :10.1016/j.molcel.2015.05.038. PMC 4517859 . PMID 26145172.
- ^ ab Doublié S, Zahn KE (2014). "Información estructural sobre la replicación del ADN eucariota". Frontiers in Microbiology . 5 : 444. doi : 10.3389/fmicb.2014.00444 . PMC 4142720 . PMID 25202305.
- ^ Edwards S, Li CM, Levy DL, Brown J, Snow PM, Campbell JL (abril de 2003). "La ADN polimerasa épsilon y la polimerasa sigma de Saccharomyces cerevisiae interactúan física y funcionalmente, lo que sugiere un papel para la polimerasa épsilon en la cohesión de las cromátidas hermanas". Biología molecular y celular . 23 (8): 2733–2748. doi :10.1128/mcb.23.8.2733-2748.2003. PMC 152548 . PMID 12665575.
- ^ Zaremba-Niedzwiedzka K, Caceres EF, Saw JH, Bäckström D, Juzokaite L, Vancaester E, et al. (Enero de 2017). "Asgard archaea iluminan el origen de la complejidad celular eucariota". Naturaleza . 541 (7637): 353–358. Código Bib :2017Natur.541..353Z. doi : 10.1038/naturaleza21031. OSTI 1580084. PMID 28077874. S2CID 4458094.
- ^ Ohmori H, Hanafusa T, Ohashi E, Vaziri C (2009). Funciones separadas de las regiones estructuradas y no estructuradas de las ADN polimerasas de la familia Y. Avances en química de proteínas y biología estructural. Vol. 78. págs. 99–146. doi :10.1016/S1876-1623(08)78004-0. ISBN 9780123748270. PMC 3103052 . PMID 20663485.
- ^ Gan GN, Wittschieben JP, Wittschieben BØ, Wood RD (enero de 2008). "ADN polimerasa zeta (pol zeta) en eucariotas superiores". Cell Research . 18 (1): 174–183. doi : 10.1038/cr.2007.117 . PMID 18157155.
- ^ Bienstock RJ, Beard WA, Wilson SH (octubre de 2014). "Análisis filogenético y orígenes evolutivos de los miembros de la familia X de la ADN polimerasa". Reparación del ADN . 22 : 77–88. doi :10.1016/j.dnarep.2014.07.003. PMC 4260717 . PMID 25112931.
- ^ Prasad R, Çağlayan M, Dai DP, Nadalutti CA, Zhao ML, Gassman NR, et al. (Diciembre de 2017). "ADN polimerasa β: un eslabón perdido de la maquinaria de reparación por escisión de bases en las mitocondrias de los mamíferos". Reparación del ADN . 60 : 77–88. doi :10.1016/j.dnarep.2017.10.011. PMC 5919216 . PMID 29100041.
- ^ Zhang L, Chan SS, Wolff DJ (julio de 2011). "Trastornos mitocondriales de la disfunción de la ADN polimerasa γ: del diagnóstico de patología anatómica al molecular". Archivos de patología y medicina de laboratorio . 135 (7): 925–934. doi :10.5858/2010-0356-RAR.1. PMC 3158670. PMID 21732785 .
- ^ Stumpf JD, Copeland WC (enero de 2011). "Replicación del ADN mitocondrial y enfermedad: perspectivas a partir de las mutaciones de la ADN polimerasa γ". Ciencias de la vida celular y molecular . 68 (2): 219–233. doi :10.1007/s00018-010-0530-4. PMC 3046768 . PMID 20927567.
- ^ Hogg M, Sauer-Eriksson AE, Johansson E (marzo de 2012). "Síntesis promiscua de ADN por la ADN polimerasa humana θ". Nucleic Acids Research . 40 (6): 2611–2622. doi :10.1093/nar/gkr1102. PMC 3315306 . PMID 22135286.
- ^ ab "UniProtKB - Q7Z5Q5 (DPOLN_HUMAN)". Uniprot . Consultado el 5 de julio de 2018 .
- ^ Cupp JD, Nielsen BL (noviembre de 2014). "Minirevisión: replicación del ADN en mitocondrias de plantas". Mitocondria . 19 (Pt B): 231–237. doi :10.1016/j.mito.2014.03.008. PMC 417701 . PMID 24681310.
- ^ abc Rawson JM, Nikolaitchik OA, Keele BF, Pathak VK, Hu WS (noviembre de 2018). "La recombinación es necesaria para la replicación eficiente del VIH-1 y el mantenimiento de la integridad del genoma viral". Nucleic Acids Research . 46 (20): 10535–10545. doi :10.1093/nar/gky910. PMC 6237782 . PMID 30307534.
- ^ Cromer D, Grimm AJ, Schlub TE, Mak J, Davenport MP (enero de 2016). "Estimación de la tasa de recombinación y cambio de plantilla del VIH in vivo". SIDA . 30 (2): 185–192. doi : 10.1097/QAD.0000000000000936 . PMID 26691546. S2CID 20086739.
- ^ Hu WS, Temin HM (noviembre de 1990). "Recombinación retroviral y transcripción inversa". Science . 250 (4985): 1227–1233. Bibcode :1990Sci...250.1227H. doi :10.1126/science.1700865. PMID 1700865.
- ^ Goulian M, Lucas ZJ, Kornberg A (febrero de 1968). "Síntesis enzimática del ácido desoxirribonucleico. XXV. Purificación y propiedades de la polimerasa del ácido desoxirribonucleico inducida por infección con el fago T4". The Journal of Biological Chemistry . 243 (3): 627–638. doi : 10.1016/S0021-9258(18)93650-1 . PMID 4866523.
- ^ Huang WM, Lehman IR (mayo de 1972). "Sobre la actividad exonucleasa de la polimerasa del ácido desoxirribonucleico del fago T4". The Journal of Biological Chemistry . 247 (10): 3139–3146. doi : 10.1016/S0021-9258(19)45224-1 . PMID 4554914.
- ^ Gillin FD, Nossal NG (septiembre de 1976). "Control de la frecuencia de mutación por la ADN polimerasa del bacteriófago T4. I. La ADN polimerasa antimutadora CB120 es defectuosa en el desplazamiento de la cadena". The Journal of Biological Chemistry . 251 (17): 5219–5224. doi : 10.1016/S0021-9258(17)33149-6 . PMID 956182.
- ^ ab Bernstein H (agosto de 1967). "El efecto sobre la recombinación de los defectos mutacionales en la ADN-polimerasa y la desoxicitidilato hidroximetilasa del fago T4D". Genética . 56 (4): 755–769. doi :10.1093/genetics/56.4.755. PMC 1211652 . PMID 6061665.
Lectura adicional
Enlaces externos
- Polimerasas de ADN+ en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Molécula del mes de PDB ADN polimerasa
- Mecanismo de reparación inusual en la ADN polimerasa lambda, Universidad Estatal de Ohio , 25 de julio de 2006.
- Una gran animación de la ADN polimerasa de WEHI a las 1:45 minutos en Archivado el 5 de diciembre de 2014 en Wayback Machine.
- Estructuras macromoleculares tridimensionales de la ADN polimerasa del EM Data Bank (EMDB)

