Familia de proteínas ERM
| Familia de ezrin/radixin/moesin | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
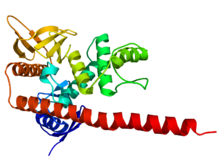 Estructura cristalográfica del dominio N-terminal de la moesina . [1] | |||||||||||
| Identificadores | |||||||||||
| Símbolo | Gestión de riesgos institucionales | ||||||||||
| Pfam | PF00769 | ||||||||||
| Interprofesional | IPR011259 | ||||||||||
| SCOP2 | 1ef1 / ALCANCE / SUPFAM | ||||||||||
| |||||||||||
La familia de proteínas ERM consta de tres proteínas estrechamente relacionadas , ezrina , [2] radixina [3] y moesina . [4] [5] Los tres parálogos , ezrina, radixina y moesina, están presentes en vertebrados, mientras que otras especies tienen solo un gen ERM. Por lo tanto, en los vertebrados, estos parálogos probablemente surgieron por duplicación de genes. [6]
Las proteínas ERM se han conservado en gran medida a lo largo de la evolución. Se observa más del 75 % de identidad en el extremo N-terminal y el extremo C-terminal de los homólogos de vertebrados (ezrina, radixina, moesina), Drosophila (dmoesina) y C. elegans (ERM-1). [7]
Estructura
Las moléculas ERM contienen los siguientes tres dominios : [5]
- Dominio globular N-terminal , también llamado dominio FERM ( Band 4.1 , ezrin , radixin , moesin ). El dominio FERM permite que las proteínas ERM interactúen con proteínas integrales de la membrana plasmática, o proteínas de andamiaje localizadas debajo de la membrana plasmática. [6] El dominio FERM está compuesto por tres subdominios (F1, F2, F3) que están dispuestos como una hoja de trébol.
- dominio alfa-helicoidal extendido .
- Dominio C-terminal cargado . Este dominio media la interacción con F-actina.
La ezrina, la radixina y la moesina también contienen una región de poliprolina entre los dominios helicoidales centrales y C-terminal.
Función
Las proteínas ERM unen los filamentos de actina con las membranas plasmáticas . Se co-localizan con CD44 en los sitios de interacción entre los filamentos de actina y la membrana plasmática, asociándose con CD44 a través de sus dominios N-terminales y con los filamentos de actina a través de sus dominios C-terminales. [5] [8]
La proteína ERM moesina se une directamente a los microtúbulos a través de su dominio FERM N-terminal in vitro y estabiliza los microtúbulos en la corteza celular in vivo . Esta interacción es necesaria para funciones específicas dependientes de ERM en la mitosis. [9]
Activación
Las proteínas ERM son proteínas altamente reguladas. Existen en dos formas: [6] [7]
- El dominio FERM puede interactuar con el sitio de unión de F-actina y esta interacción de cabeza a cola mantiene a las proteínas ERM en una forma plegada; en este estado, las proteínas ERM están inactivas porque el plegamiento impide la unión de proteínas integrales o la unión de actina.
- Si se interrumpe esta interacción cabeza-cola, las proteínas ERM se despliegan, dando lugar a una conformación abierta y activa .
En células de cultivo, las proteínas ERM exhiben principalmente la conformación plegada (aproximadamente 80-85% [10] ).
El modelo actual para la activación de la proteína ERM es un mecanismo de dos pasos: [11]
- En primer lugar, la interacción del fosfatidilinositol 4,5-bisfosfato en la membrana plasmática induce una preapertura de la molécula ERM.
- Luego, una quinasa aún no identificada fosforila una treonina localizada en una región altamente conservada del dominio C-terminal. El fosfato estabilizará la apertura de la molécula.
Referencias
- ^ PDB : 1E5W ; Edwards SD, Keep NH (junio de 2001). "La estructura cristalina de 2,7 Å del dominio FERM activado de la moesina: un análisis de los cambios estructurales en la activación". Bioquímica . 40 (24): 7061–8. doi :10.1021/bi010419h. PMID 11401550.
- ^ Bretscher A (agosto de 1983). "Purificación de una proteína de 80.000 dalton que es un componente del citoesqueleto de microvellosidades aislado y su localización en células no musculares". J. Cell Biol . 97 (2): 425–32. doi :10.1083/jcb.97.2.425. PMC 2112519. PMID 6885906 .
- ^ Tsukita S, Hieda Y, Tsukita S (junio de 1989). "Una nueva proteína de 82 kD con extremos con púas (radixin) localizada en la unión adherente entre células: purificación y caracterización". J. Cell Biol . 108 (6): 2369–82. doi :10.1083/jcb.108.6.2369. PMC 2115614. PMID 2500445 .
- ^ Lankes W, Griesmacher A, Grünwald J, Schwartz-Albiez R, Keller R (mayo de 1988). "Una proteína de unión a heparina implicada en la inhibición de la proliferación de células de músculo liso". Biochem. J. 251 ( 3): 831–42. doi :10.1042/bj2510831. PMC 1149078. PMID 3046603 .
- ^ abc Tsukita S, Yonemura S, Tsukita S (febrero de 1997). "Proteínas ERM: regulación de la interacción entre la actina y la membrana plasmática de la cabeza a la cola". Trends Biochem. Sci . 22 (2): 53–8. doi :10.1016/S0968-0004(96)10071-2. PMID 9048483.
- ^ abc Bretscher A, Edwards K, Fehon RG (agosto de 2002). "Proteínas ERM y merlin: integradores en la corteza celular". Nat Rev Mol Cell Biol . 3 (8): 586–99. doi :10.1038/nrm882. PMID 12154370. S2CID 26970178.
- ^ ab Fiévet B, Louvard D, Arpin M (mayo de 2007). "Proteínas ERM en la organización y funciones de las células epiteliales". Biochim Biophys Acta . 1773 (5): 653–60. doi : 10.1016/j.bbamcr.2006.06.013 . PMID 16904765.
- ^ Yonemura S, Hirao M, Doi Y, Takahashi N, Kondo T, Tsukita S, Tsukita S (febrero de 1998). "Las proteínas Ezrin/Radixin/Moesin (ERM) se unen a un grupo de aminoácidos con carga positiva en el dominio citoplasmático yuxtamembrana de CD44, CD43 e ICAM-2". J. Cell Biol . 140 (4): 885–95. doi : 10.1083 /jcb.140.4.885. PMC 2141743. PMID 9472040.
- ^ Solinet S, Mahmud K, Stewman SF, Ben El Kadhi K, Decelle B, Talje L, Ma A, Kwok BH, Carreno S (julio de 2013). "La proteína ERM de unión a actina, Moesin, se une a los microtúbulos de la corteza celular y los estabiliza". J. Cell Biol . 202 (2): 251–60. doi :10.1083/jcb.201304052. PMC 3718980. PMID 23857773 .
- ^ Gautreau A, Louvard D, Arpin M (julio de 2000). "Los efectos morfogénicos de la ezrina requieren una transición inducida por fosforilación de oligómeros a monómeros en la membrana plasmática". J. Cell Biol . 150 (1): 193–203. doi :10.1083/jcb.150.1.193. PMC 2185562. PMID 10893267 .
- ^ Fievet BT, Gautreau A, Roy C, Del Maestro L, Mangeat P, Louvard D, Arpin M (marzo de 2004). "La unión y la fosforilación de fosfoinosítidos actúan secuencialmente en el mecanismo de activación de la ezrina". J. Cell Biol . 164 (5): 653–9. doi :10.1083/jcb.200307032. PMC 2172172. PMID 14993232 .